Общая характеристика неметаллов
На этой странице вы узнаете
- Из каких неметаллов состоит Вселенная?
- Кто главный в семье неметаллов и почему лучше с ним лично не знакомиться?
- Многоликие элементы: как одни и те же неметаллы могут иметь разные физические свойства?
Многие предметы в мире имеют свою пару: день и ночь, правый и левый носок, котлетка и пюрешка, и металлы не исключение. Их второй половинкой являются неметаллы: сильные, энергичные, а порой и агрессивные. Сегодня мы получше познакомимся с важнейшей частью неорганической химии — свойствами неметаллов.
Характеристика неметаллов
Все в мире можно поделить на группы, так и таблицу Менделеева мы делим на два основных больших класса: металлы и неметаллы. С металлами мы впервые встретились в статье «Металлы IA группы», теперь настало время изучить вторую половину таблицы — неметаллы и их свойства.
Неметаллы — вещества, обладающие особыми химическими свойствами, отличными от металлических.
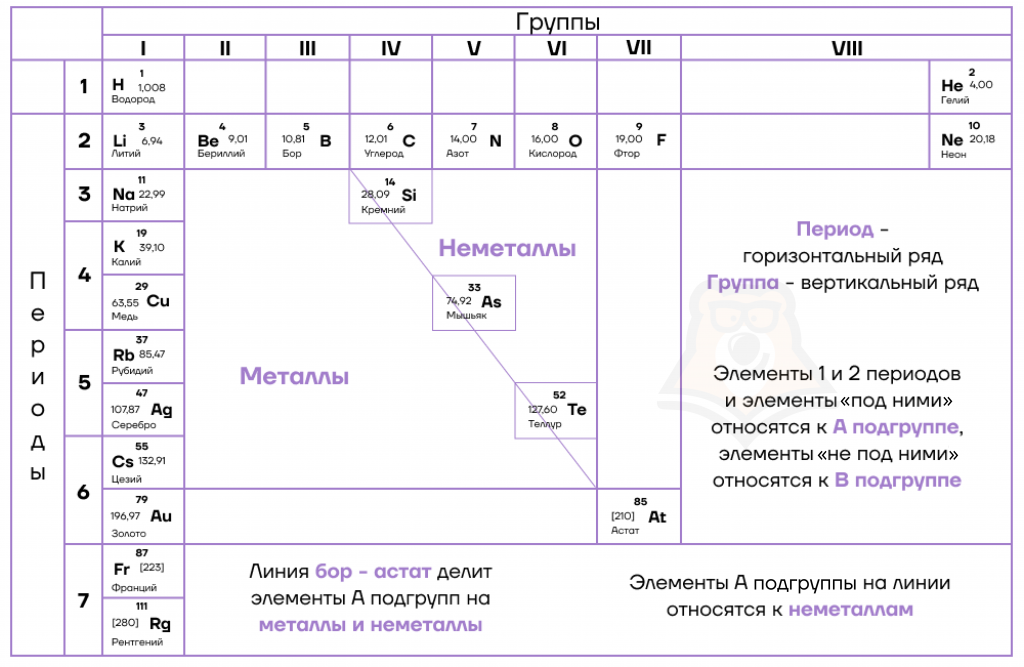
Для того чтобы найти в таблице неметаллы, проведем диагональ из левого верхнего угла от бериллия (Be) в правый нижний угол к астату (At).
Элементы главных (А) подгрупп выше и правее полученной условной диагонали и сам астат будут относиться к неметаллам.

Но есть другой лайфхак для запоминания: чем ближе атом к фтору, тем сильнее его неметаллические свойства. Если от фтора отсчитать вниз 4 элемента и влево тоже 4 элемента, то получим треугольник неметаллов. Важно помнить, что мы учитываем только элементы главных подгрупп.
Определив, какие элементы относятся к неметаллам, можем углубиться в классификацию выделенных элементов.
Неметаллы, которые встречаются на экзамене, по их свойствам можно разделить на несколько групп:
- Водород (H).
- Подгруппа углерода: углерод и кремний (C и S).
- Пниктогены – неметаллы VA группы: азот и фосфор (N и P).
- Халькогены – неметаллы VIA группы: кислород, сера и селен (О, S и Se).
- Галогены – неметаллы VIIA группы: фтор, хлор, бром, йод и астат (F, Cl, Br, I, At).
В некоторых классификациях к неметаллам относят также благородные газы.
Благородные газы — элементы, расположенные в VIIIA группе, имеющие на внешнем энергетическом уровне максимально возможное число электронов — 8.

Благородные газы невероятно богаты, почти как знаменитый Скрудж Макдак (почти, потому что никто не может быть богат как он). Вот только богатство их измеряется не в деньгах, а в электронах. Данные элементы живут в своем роскошном поместье (VIIIA группе), и в жизни их всегда царит благополучие. Они уже достигли всего, о чем другие элементы могут мечтать (заполненный электронный уровень), поэтому они отдыхают и не хотят лишний раз работать (реагировать с кем-то).
Когда мы знакомимся с человеком, мы обязательно узнаем его имя. Настало время узнать «имена» неметаллов.
Названия неметаллов
Большинство названий неметаллов можно «подглядеть» в таблице Менделеева, а произношение элементов в соединениях практически всегда совпадает с названием неметалла, за исключением нескольких элементов.
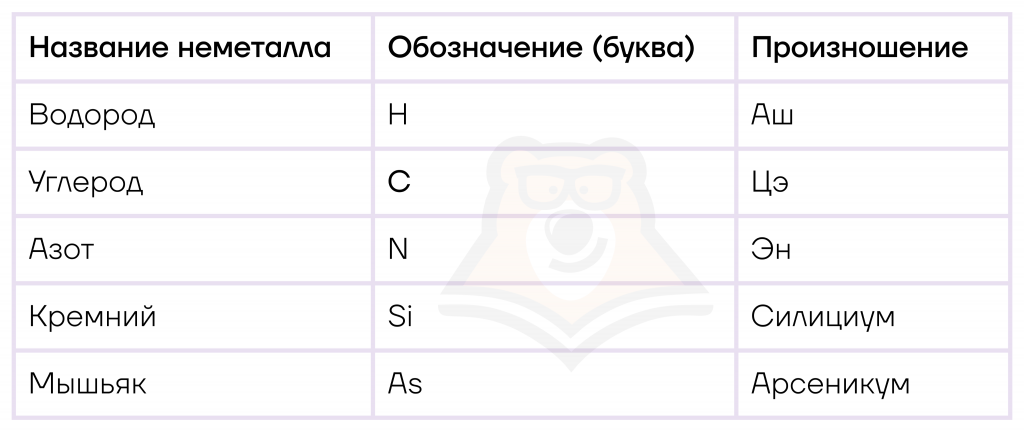
Однако есть и иные, распространенные в обиходе тривиальные названия. Так, углерод мы можем назвать коксом, фуллереном, карбидом, графитом и алмазом. Углерод — очень интересный неметалл, более полную информацию о нем можно прочитать в статье «Элементы IVА группы. Углерод».

Все эти названия отражают различные аллотропные модификации углерода. Встретиться также могут модификации кислорода: кислород О2 и озон О3. А подробнее об аллотропии мы поговорим позже.
Соединения кислорода встречаются повсеместно, для лучшего изучения их свойств рекомендуем ознакомиться со статьей «Элементы VIА группы. Кислород».
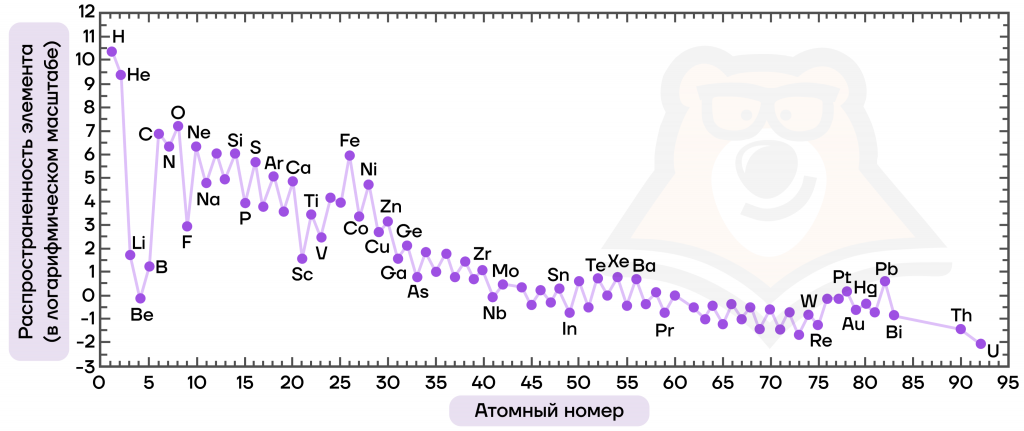
| Из каких неметаллов состоит Вселенная? Самые распространенные элементы во Вселенной — это неметаллы: водород и гелий вместе составляют около 98% Вселенной. Далее следуют кислород, углерод, азот, кремний, сера и т.д. Объясняется такое соотношение тем, что в ходе развития Вселенной изначально появились наиболее легкие атомы (водород и гелий), а затем из них уже рождались все более и более тяжелые элементы. Также элементы с четным атомным номером являются более распространенными, чем элементы с нечетным атомным номером, данный феномен не имеет точного объяснения. Углерод и его способность создавать цепочки и кратные связи, кислород с его окислительными способностями, азот и многие другие элементы средней атомной массы, относящиеся к неметаллам, породили жизнь. Более тяжелые элементы (например, металлы вроде железа) образуют ядра планет, а совсем тяжелые элементы неустойчивы и радиоактивны, то есть спонтанно распадаются на более легкие атомы и частицы. То есть все неметаллы участвуют в образовании Вселенной: звезд, планет и жизни на этих планетах. |
Исходя из их положения в таблице, неметаллы:
- Имеют меньший, чем у металлов, радиус атома.
- Более электроотрицательны, поэтому чаще всего выступают окислителями, то есть отнимают у более слабых металлов их электроны и принимают отрицательное значение степени окисления.
- Имеют большую энергию ионизации (энергию отрыва одного электрона от атома) и энергию сродства к электрону (энергию, выделяющуюся при присоединения одного электрона к атому).
| Кто главный в семье неметаллов и почему лучше с ним лично не знакомиться ? Он имеет наибольшую электроотрицательность, энергии сродства к электрону и ионизации, является сильнейшим окислителем — фтор буквально первый во всем, его можно назвать главным во всем семействе неметаллов. Данное знание может нам пригодиться при сравнении свойств двух элементов: кто находится ближе к «отцу», тот и сильнее. С фтором лучше лично не встречаться, так как это очень химически агрессивный и опасный элемент. Из-за сильнейших окислительных свойств при реакции с другими веществами возможен взрыв, многие соединения фтора также взрыво- и пожароопасны. Кроме того, фтор и его соединения очень токсичны, при вдыхании вызывают отравления, а при контакте с кожей — ожоги. |

При взаимодействии с более электроотрицательными элементами (в реакции неметалл + неметалл), становится возможна отдача неметаллом своих электронов, повышение степени окисления и проявление свойств восстановителей.
Электронные конфигурации и свойства неметаллов в общем виде можно обозначить таким образом:
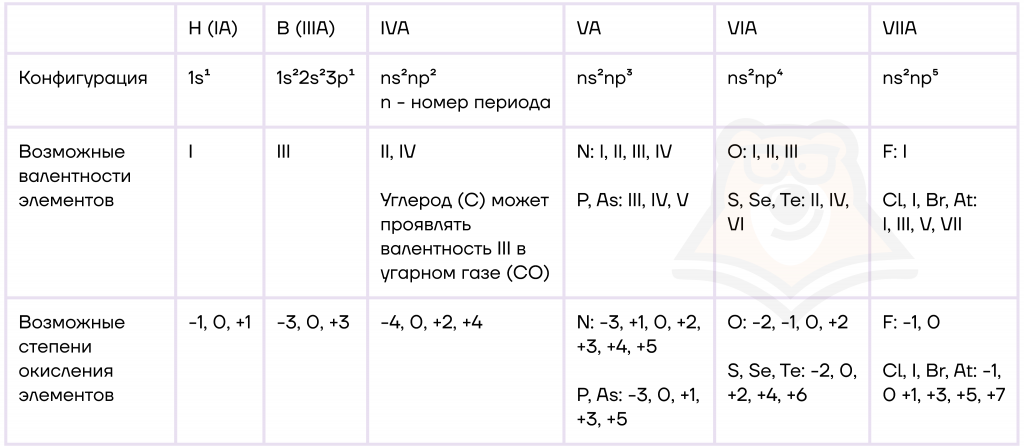
Мы изучили общую характеристику неметаллов, поэтому можем перейти к более детальному изучению элементов. Начнем с физических свойств.
Физические свойства
Вспомним, что к основным характеристикам физических свойств веществ относят агрегатное состояние (газообразное, твердое или жидкое), цвет и запах. Все неметаллы разделим по их агрегатному состоянию и рассмотрим каждую группу подробнее.
Бром является красно-бурой зловонной ядовитой жидкостью.

К газам относятся водород (Н2), азот (N2), кислород (O2) и озон (O3), и некоторые галогены: фтор (F2) и хлор (Cl2). Для подробного изучения свойств галогенов рекомендуем прочитать статью «Элементы VIIА группы. Галогены».
Некоторые из газообразных веществ ядовиты, такие газы мы можем заметить невооруженным глазом.

Остальные газы: кислород, азот и водород, — не ядовиты, бесцветны и не имеют запаха.
Закрепим материал на примере задания №1 ОГЭ по химии. При его решении может пригодиться информация о физических и химических свойствах неметаллов.
Задание. Выберите два высказывания, в которых говорится о кислороде как об атоме.
1) Воздух состоит из кислорода на 21%.
2) Кислород может образовывать озон.
3) Кислород ー бесцветный газ.
4) Кислород не реагирует с галогенами.
5) Кислород содержится в составе воды.
Решение.
Проанализируем предложения:
1) Воздух состоит на 21% из молекул кислорода О2, то есть в данном предложении речь о кислороде как о простом веществе.
2) Если речь идет об аллотропных модификациях (а озон как раз к ним относится), то речь об атоме кислорода.
3) Бесцветным газом у нас будет кислород О2, то есть дана информация о веществе.
4) Речь идет о химических свойствах, а они присущи веществам, а не атомам.
5) В органических и неорганических веществах содержатся атомы химических элементов, поэтому высказывание нам подойдет.
Ответ: 25
В виде простых веществ большинство неметаллов имеют твердое агрегатное состояние. Но если у нас в ходе лабораторной работы выпадает осадок неметалла, то как мы можем понять, «кто» именно образовался? Для того чтобы различать между собой все твердые неметаллы, лучше всего запомнить их внешние характеристики. Визуально проще всего нам различить цвета веществ, поэтому остановимся на них.
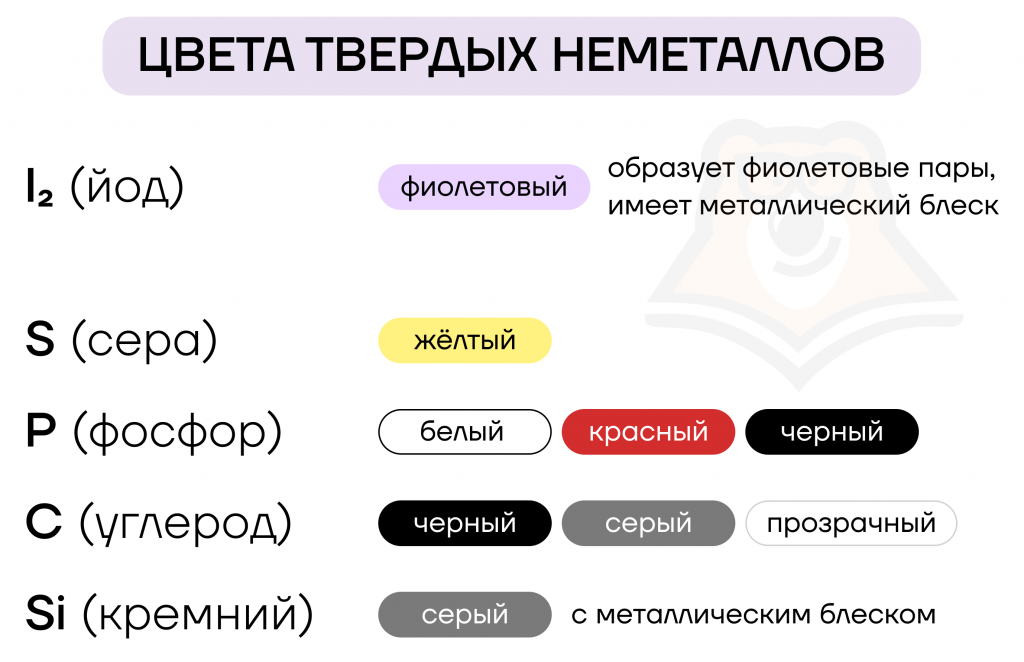
Если мы внимательнее посмотрим на таблицу цветов твердых неметаллов, то заметим, что одни и те же элементы могут иметь по два или даже три цвета. Чем объясняется то, что один неметалл имеет различные физические свойства?
| Многоликие элементы: как одни и те же неметаллы могут иметь разные физические свойства? Как уже было сказано, некоторые элементы способны образовывать аллотропные модификации, то есть один и тот же элемент способен образовывать несколько простых веществ. Сера может быть моноклинная (желтые игольчатые кристаллы), пластическая (резиноподобное коричневое вещество) и ромбическая. Последняя является наиболее устойчивой, именно ее мы чаще всего видим как желтый осадок в химических реакциях.О том, в каких химических реакциях образуется и в какие химические реакции вступает сера, можно прочитать в статье «Халькогены. Сера, сероводород и сульфиды» Фосфор способен существовать в различных формах, наиболее распространенные из них 一 красный, белый и черный фосфор: — Белый фосфор ядовит, самовоспламеняется, светится в темноте, оставляет ожоги; — Красный фосфор не ядовит, загорается при поджигании, входит в состав спичек; — Черный фосфор — это самая редкая форма, образуется из белого фосфора под давлением.Подробнее о фосфоре можно прочитать в статье «Элементы VА группы. Фосфор» Углерод имеет больше всего аллотропных модификаций: — Графит, который входит в состав карандашей, темно-серый; — Кокс, который может иметь цвет от серого до черного; — Карбин и фуллерен черные; — Алмаз — прозрачный минерал. |

Когда мы изучили химические и физические характеристики неметаллов, можем перейти к тому, как же все эти удивительные элементы можно получить.
Способы получения неметаллов
Некоторые неметаллы мы можем получить напрямую из природных ресурсов: азот, кислород и водород содержатся в воздухе, алмазы добываются в шахтах, а сера встречается в вулканах и может быть добыта оттуда. Но не будем же мы каждый раз залезать в кратер или бурить скважину, чтобы провести реакцию с тем или иным неметаллом. Давайте подробнее изучим лабораторные методы получения неметаллов.
Все способы получения неметаллов можно разделить на несколько больших групп.
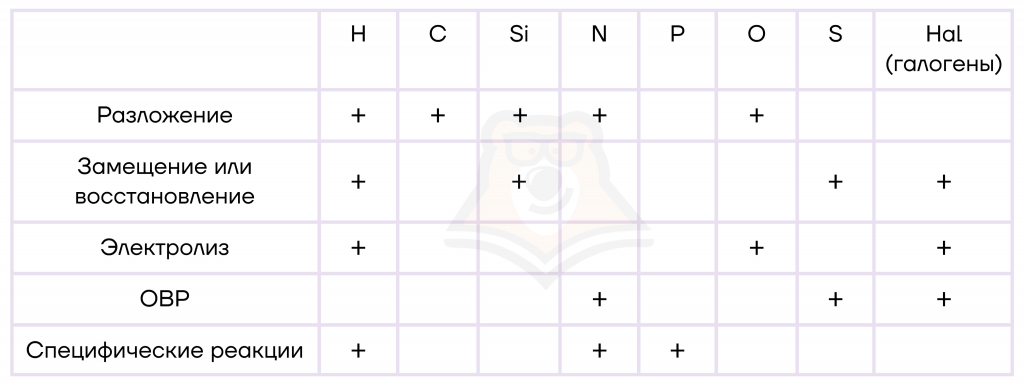
О типах химических реакций (которые указаны в первом столбике нашей таблицы) можно прочитать в статье «Химическая реакция».
- Реакции разложения
Углерод и водород получают в ходе пиролиза углеводородов.
Пиролиз — нагревание вещества без доступа кислорода.
Запишем реакцию пиролиза метана (СН4) с образованием углерода (С) и водорода (H2).
СН4 (t > 10000C) = C + 2H2
Аналогично протекает разложение силана, образуются водород и кремний (Si).
SiH4 = Si + 2H2
Азот может быть получен в ходе разложения дихромата аммония.
(NH4)2Cr2O7 (t) = N2 + Cr2O3 + 4H2O
Кислород также может быть получен в реакциях разложения различных солей.
2KClO3 = 2KCl + 3O2, разложение перхлората калия
2KNO3 = 2KNO2 + O2, разложение нитрата калия
- Реакции замещения или восстановления
Мы можем получить водород при взаимодействии металлов с водой, кислотами и щелочами, если протекает реакция замещения.
Например, при взаимодействии воды с металлическим натрием образуется гидроксид натрия (NaOH) и водород.
2H2O + 2Na = 2NaOH + H2 ↑
Для галогенов возможно замещение более активным галогеном менее активного.
2KBr + Cl2 = 2KCl + Br2
2KI + Cl2 = 2KCl + I2
Кремний получают восстановлением из диоксида кремния (SiO2) сильными восстановителями, например, углеродом.
SiO2 + 2С = 2СO + Si
Более подробно изучить свойства кремния и его соединений можно в статье «Элементы IVА группы. Кремний».
Аналогично получают серу:
SO2 + C = S + CO2
- Электролиз
Электролиз — это окислительно-восстановительная реакция (ОВР), протекающая при прохождении электрического тока через раствор или расплав вещества.
Подробнее об этом процессе написано в статье «Электролиз расплавов и растворов (солей, щелочей, кислот)».
Электролизом воды мы можем получить водород и кислород.
2H2O (эл.ток) = 2H2 + O2
Электролизом растворов и расплавов галогенидов (солей галогенов) мы можем получить галогены.
Исключение — фтор, он может быть получен только из расплава!
расплав: 2KF (эл.ток) = 2K + F2
раствор: 2NaCl + 2H2O (эл.ток) = 2NaOH + H2 + Cl2
- Окислительно-восстановительные реакции (ОВР)
Подробнее об этом ОВР можно прочитать в статье «Окислительно-восстановительные реакции».
Азот можно получить в ходе ОВР с оксидом меди(II).
2NH3 + 3CuO (t) = 3Cu + N2 + 3H2O
Сера также может быть получена в ходе различных ОВР.
SO2 + C = S + CO2
2H2S + O2 = 2S + 2H2O
Получение в ходе ОВР возможно также и для галогенов, обычно реакция протекает между галогеноводородными кислотами и окислителем.
MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O
4HCl + Ca(ClO)2 = 2Cl2 + CaCl2 + 2H2O
- Специфические реакции
Конверсия (преобразование) метана или углерода при взаимодействии с водой является способом получения водорода:
СН4 + Н2O = СО + 3Н2
C + H2O = СO + H2
Фосфор получают из солей, нагревая их в электрической печи без доступа воздуха в присутствии диоксида кремния и угля (С):
Сa3(РO₄)₂ + 5С + 3SiO₂ (t) = 3CaSiO₃ + 2P + 5CO, взаимодействие фосфата кальция с углеродом и оксидом кремния (IV)
Азот можно получить в ходе специфической реакции самопроизвольного разложения нитрита аммония (NH4NO2):
NH4NO2 = N2 + 2H2O,
Важно отметить, что в ходе реакции между солью аммония и нитритом должен образоваться нитрит аммония, однако данная соль в свободном виде не встречается, она будет самопроизвольно разлагаться на азот ( N2) и воду (H2O). В результате взаимодействия получим следующую реакцию:
NH4Cl + NaNO2 = NaCl + N2 + 2H2O
О соединениях азота можно прочитать в статье «Элементы VА группы. Азот».
Наше приключение по миру неметаллов продолжается, прямо по курсу самое интересное — химические свойства.
Химические свойства
Неметаллы уникальны по своим свойствам: они могут реагировать практически со всеми классами неорганических веществ, и, в отличие от металлов, взаимодействуют даже с другими элементами-неметаллами. Но и тут не обошлось без исключений. Какие именно неметаллы реагируют с оксидами, все ли из них способны взаимодействовать с щелочами и какие продукты возможны в реакции с азотной кислотой? Давайте разбираться.
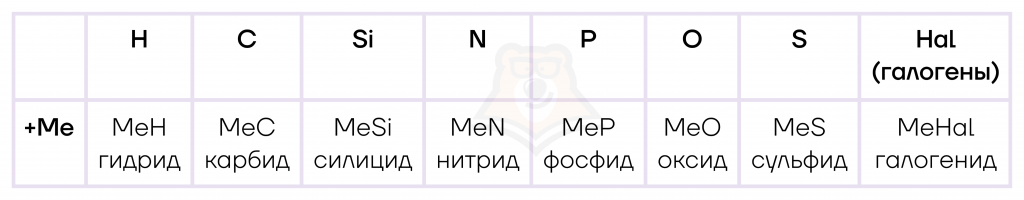
- Взаимодействие с металлами
При взаимодействии с металлами элементы-неметаллы образуют бинарные соединения при этом степень окисления неметалла понижается.
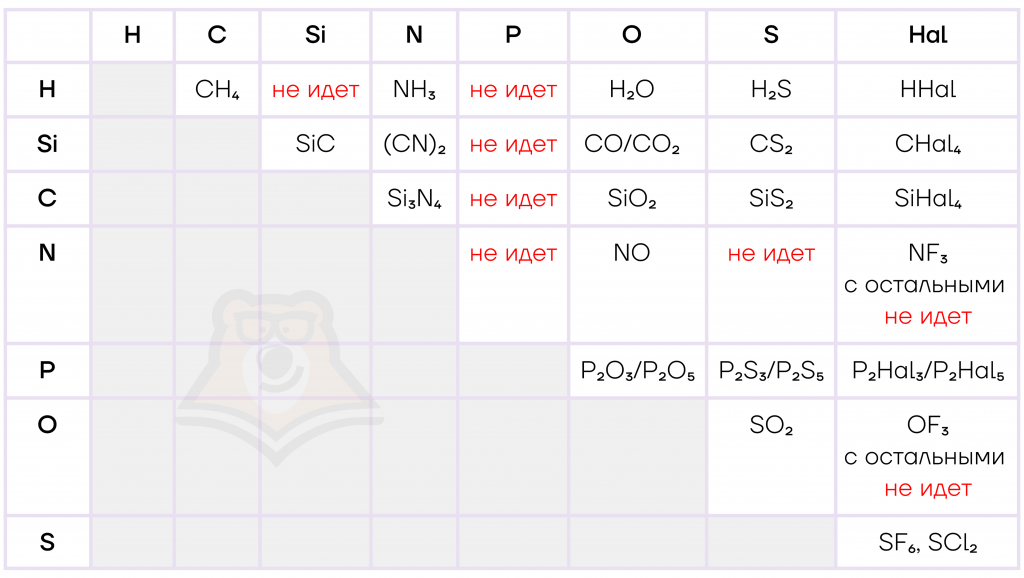
- Взаимодействие с неметаллами
При взаимодействии с другими неметаллами элементы-неметаллы также образуют бинарные соединения. Более электроотрицательный элемент понижает степень окисления, а менее электроотрицательный — повышает.
- Взаимодействие с оксидами
Неметаллы способны вступать в ОВР и реакции замещения с оксидами.
Для понимания данных реакций нам потребуется ряд активности металлов.
Ряд активности металлов — это ряд, использующийся на практике для относительной оценки химической активности металлов в реакциях с водными растворами солей и кислот.

- Реакции замещения с металлами средней активности и неактивными металлами (правее алюминия в ряду активности):
CuO + H2 = Cu + H2O (аналогично с С)
- Замещение активных металлов (левее алюминия в ряду активности и сам алюминий):
2Al2O3 + 9C = Al4C3 + 6CO
- ОВР с оксидами других неметаллов:
H2 + CO2 = CO + H2O
SiO2 + 2F2 = SiF4 + O2
- ОВР с оксидом того же неметалла:
SiO2 + Si = 2SiO (аналогично для С)
- Взаимодействие с водой
С водой реагируют только углерод и галогены:
С + H2O (пар) = CO + H2
2F2 + 2H2O = 4HF + O2
Cl2 + H2O = HCl + HClO (обратима)
- Взаимодействие с щелочами и кислотами-окислителями

Таким образом, при взаимодействии с кислотами-окислителями идет ОВР с повышением степени окисления, а в реакциях со щелочами идет диспропорционирование, то есть неметалл и повышает, и понижает степень окисления.
Для запоминания химических свойств неметаллов решим вариант задания №7 ОГЭ, попрактикуемся в знании свойств серы.
Задание. Из предложенного перечня выберите два вещества, с которыми реагирует сера.
1) NaOH
2) O2
3) N2
4) HCl
5) H2O
Решение.
Сера как типичный неметалл способна реагировать с щелочами (NaOH) и кислотами-окислителями, соляная кислота (HCl) к кислотам-окислителям не относится, поэтому подойдет вариант ответа 1.
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Из неметаллов сера реагирует с кислородом (O2), с азотом (N2) реакция не идет, подойдет также вариант ответа 2.
S + O2 = SO2
С водой (H2O) сера не реагирует, в ответ возьмем только 1 и 2.
Ответ: 12
- Взаимодействие с солями
Возможны реакции вытеснения менее электроотрицательных элементов из солей и ОВР:
S + 2KI = I2 + K2S
S + KClO3 = KCl + SO2 (аналогично с фосфором)
4FeS + 7O2 = 2Fe2O3 + 4SO2, обжиг сульфида железа (II)
2P + 5NaNO3 = 5NaNO2 + P2O5
Наше сегодняшнее знакомство с неметаллами подходит к концу. Мы изучили основные свойства данного класса элементов, благодаря чему можем решать задания из обеих частей экзамена. Но изучение неорганической химии не подходит к концу. Для более глубокого изучения этой обширной темы предлагаем прочитать статьи по свойствам отдельных элементов-неметаллов, а начать рекомендуем со статьи «Водород».

Термины
Бинарные соединения — соединения, которые состоят из двух элементов: металла и неметалла или двух неметаллов.
Восстановители — соединения, отдающие электроны в окислительно-восстановительных реакциях, при этом повышающие свою степень окисления.
Металлы — вещества, обладающие металлическими свойствами, такими как высокие электро- и теплопроводность, высокая пластичность, ковкость и характерный металлический блеск. Они способны взаимодействовать с неметаллами, водой и некоторыми кислотами, а также могут вступать в окислительно-восстановительные реакции.
Окислители — это соединения, охотно принимающие электроны в окислительно-восстановительных реакциях, при этом сами они понижают свою степень окисления.
Степень окисления — это условный заряд атома элемента, вычисленный на основе предположения, что все связи в данном соединении являются ионными (показывает, сколько электронов атом «притянул» или, наоборот, «отдал» при образовании химической связи).
Фактчек
- Периодическая система химических элементов Д. И. Менделеева состоит из металлов и неметаллов, к последним также относят благородные газы.
- Неметаллы имеют различные физические свойства: большая часть является твердыми веществами, 5 неметаллов находятся в газообразном агрегатном состоянии, встречается одна жидкость.
- Неметаллы могут образовывать аллотропные модификации, чаще всего встречаются модификации кислорода — сам кислород О2 и озон О3.
- Все способы получения неметаллов можно разделить на 5 групп: реакции разложения, замещения и восстановления, окислительно-восстановительные реакции, электролиз и некоторые специфические реакции.
- Неметаллы способны реагировать с металлами, другими неметаллами, щелочами и кислотами. Некоторые неметаллы растворяются в воде и реагируют с оксидами и солями.
Проверь себя
Задание 1.
Какой валентности нет у азота?
- IV
- I
- III
- V
Задание 2.
Каким способом получают углерод?
- гидролиз
- пиролиз
- электролиз
- конверсия метана
Задание 3.
Какое вещество нельзя получить электролизом?
- кислород
- хлор
- фтор
- водород
Задание 4.
Что образуется при взаимодействии хлора с кислородом?
- Cl2O7
- Cl2О
- зависит от условий реакции
- реакция не протекает
Задание 5.
Какой неметалл не реагирует с щелочью?
- азот
- хлор
- сера
- бром
Ответы: 1. — 4; 2. — 2; 3. — 3; 4. — 4; 5. — 1.


 к списку статей
к списку статей




