Окислительно-восстановительные реакции
На этой странице вы узнаете
- Окислитель — «вор электронов», а восстановитель — «жертва»: почему так?
- Что роднит нас с бактериями и растениями?
- Как спасти свою любимую садовую металлическую мебель?
Внимание! В химических реакциях на постоянной основе начали проходить ограбления. Давайте выясним: кто является грабителем, а кто — жертвой? Будем вести расследование в статье.

Окислительно-восстановительные реакции
Опрос свидетелей ограбления не дал большого результата, единственное, что мы заметили, — все говорят о каких-то окислительно-восстановительных реакциях. Нам необходимо разобраться, что это такое.
Все химические реакции делят на два типа: окислительно-восстановительные и не окислительно-восстановительные. Нас сегодня особенно будет интересовать первый тип.
Окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степеней окисления атомов.
Но как можно определить, какая реакция является ОВР, а какая — нет? Разберем на примерах:
- Na+12O-2 + C+4O-22 = Na+12C+4O-23 — степени окисления атомов остались теми же, что и были → реакция не окислительно-восстановительная;
- Fe0 + 2H+1Cl-1 = Fe+2Cl-12 + H02 — степени окисления атомов поменялись → реакция окислительно-восстановительная.
Теперь, когда мы узнали, о чем все говорят, можем приступить к допросу участников преступления.
Окислительно-восстановительные свойства веществ
А почему, собственно, степень окисления меняется? Вспомним, что такое степень окисления.
Степень окисления (СО) — это условный заряд атома элемента, вычисленный на основе предположения, что все связи в данном соединении являются ионными (показывает, сколько электронов атом «притянул» или, наоборот, «отдал» при образовании химической связи).
Именно благодаря степени окисления мы можем понять, на сколько электронов «обеднел» или «обогатился» какой-либо атом, насколько огромен масштаб грабежа.
Посмотрим в качестве примера на молекулу воды. Здесь кислород — атом наиболее электроотрицательного элемента. Именно он стягивает на себя электронную плотность с двух атомов водорода, из-за чего приобретает степень окисления -2.
А что с атомами водорода? Они оказываются со степенями окисления +1, потому что отрицательно заряженные частицы (электроны) с них, наоборот, стягивает кислород.
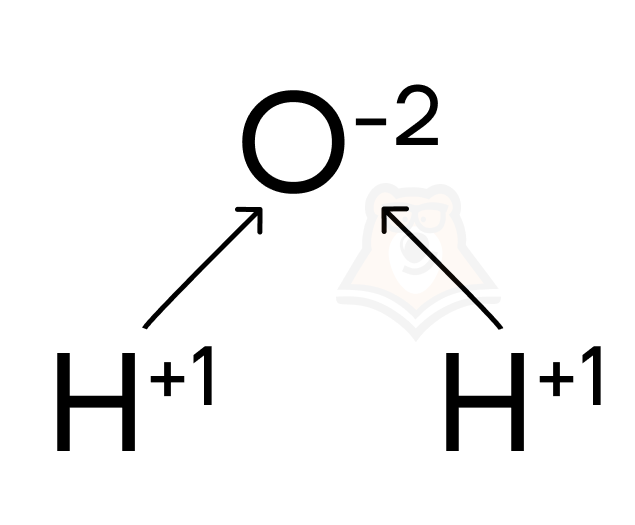
Так как в ОВР изменяются степени окисления атомов, в процессе их протекания происходит нечто подобное, но в более агрессивном виде: атомы одного элемента буквально отбирают электроны у атомов другого, то есть в процессе окислительно-восстановительных реакций происходит передача электронов от одних атомов к другим.
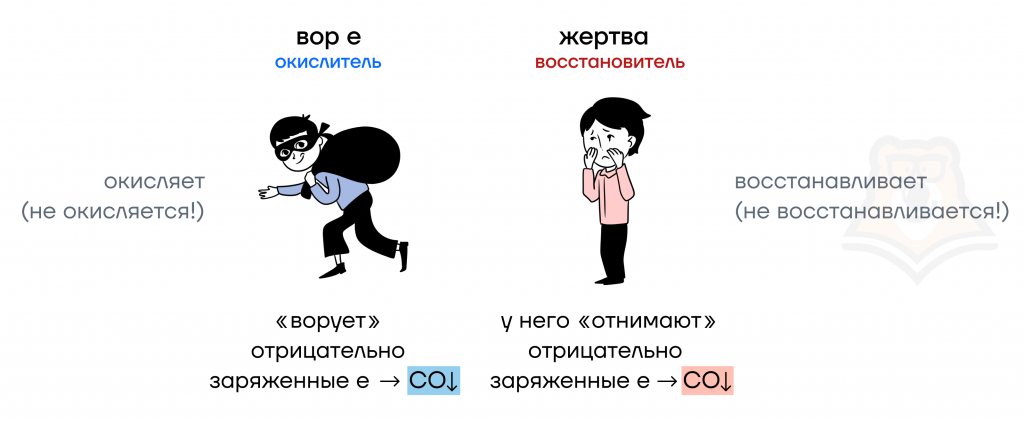
Какое-то прямо химическое ограбление… О, так и запомним! Так же, как и в обычном ограблении, в нем присутствует два лица — тот, кто берет, и тот, кто отдает.
| Окислитель — «вор электронов», а восстановитель — «жертва»: почему так? Окислитель («вор электронов») — тот, кто принимает электроны, которые, будучи заряженными отрицательно, понижают его степень окисления. Восстановитель («жертва») — тот, кто отдает электроны. И так как восстановитель отдает свои отрицательно заряженные частицы, его степень окисления повышается. Что следует из всего вышесказанного? — Если друг с другом встретятся только два «вора», например, KMnO4 и HNO3, то никакого ограбления не произойдет (не у кого «воровать электроны»). — Если встретятся две «жертвы», например, H2S и HI, то некому будет воровать эти самые электроны, и «ограбление» точно так же не случится. |
А что тогда такое «окисление» и «восстановление»? Обычно с этими процессами возникает путаница, но мы сейчас разберемся.
- Окисление — отдача электронов. Так как отдает электроны в реакции восстановитель (жертва), то окисление — это процесс, происходящий именно с ним:
восстановитель окисляется (= отдает электроны)
- Восстановление — взятие электронов. Так как берет (а точнее, крадет) электроны окислитель, то восстановление — это процесс, протекающий с ним:
окислитель восстанавливается (= принимает электроны)
Вор и жертва определены, теперь можем подробнее изучить, что же было украдено.
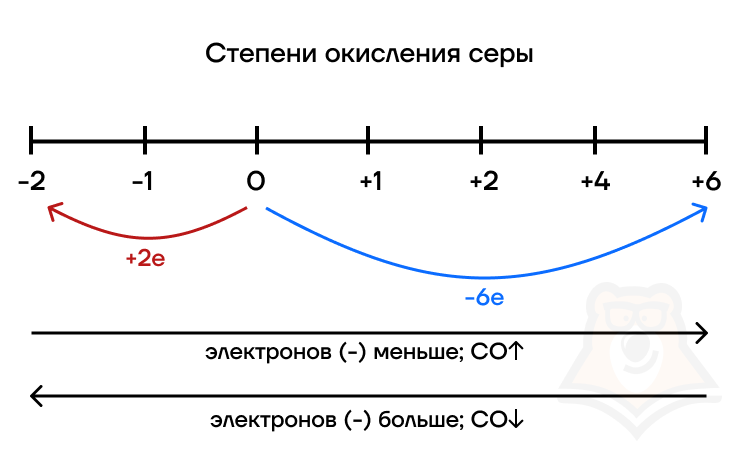
В ходе ОВР происходит передача электронов, которые заряжены отрицательно (–), поэтому:
| S0 + 2e = S-2 Если атом элемента их принимает, то свою степень окисления он понижает, так как у него становится больше «минусов». В данном случае происходит процесс восстановления (присоединения электронов), а сама сера выступает в роли окислителя (вора электронов). S-2 — это сера, которая приняла 2e (украла 2e). | S0 – 6e = S+6 Если атом элемента их отдает, то свою степень окисления он повышает. «Минусов» становится меньше, а «плюсов» — больше. В данном случае происходит процесс окисления (отдачи электронов), а сама сера выступает в роли восстановителя (жертвы). S+2 — это сера, которая отдала 2e (у которой украли 2e). |
Разберемся на практике.
После изучения основ окислительно-восстановительных свойств, можем закрепить полученные знания, решив задание №19 ЕГЭ.
Задание. Установите соответствие между схемой реакции и свойством серы, которое она проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой..
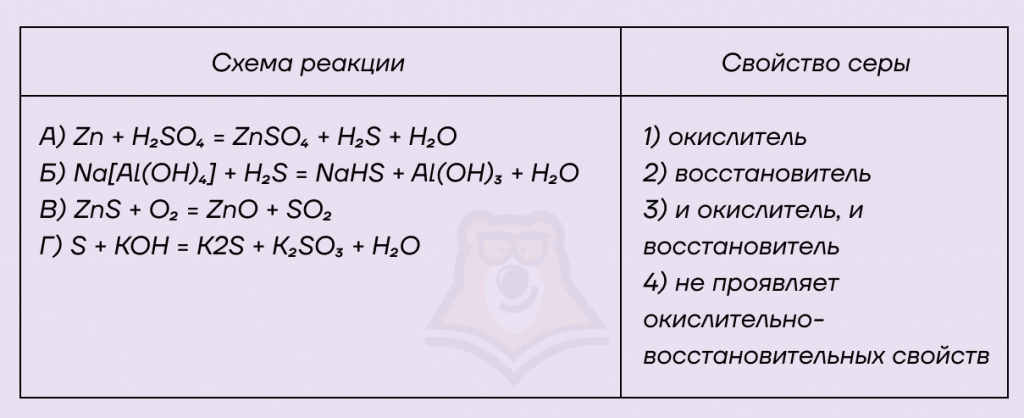
Решение.
А) В правой части уравнения сера находится в степени окисления +6, а в левой части присутствуют два атома серы: один находится в степени окисления +6, а другой — в степени окисления -2. В левой и правой частях есть атомы серы, степени окисления которых отличаются, следовательно, это ОВР. Запишем схему изменения степени окисления серы:
S+6 + 8e = S-2
Сера в данном случае «ворует» электроны, следовательно, она является окислителем.
Б) В левой части реакции степень окисления серы равна -2, в правой части тоже, следовательно, сера в данном случае не проявляет окислительно-восстановительные свойства.
В) В левой части уравнения сера находится в степени окисления -2, а в правой — в степени окисления +4, происходит ОВР. Запишем схему изменения степени окисления для атома серы:
S-2 — 6e = S+4
Сера отдает электроны, она «жертва», следовательно, проявляются ее восстановительные свойства.
Г) В левой части степень окисления серы 0, а в правой — -2 и +4. Степень окисления изменяется, это ОВР, поэтому запишем схемы изменения степени окисления для серы:
S0 + 2e = S-2
S0 — 6e = S+6
Сера и отдает, и принимает электроны, следовательно, она и окислитель, и восстановитель.
Ответ: 1423
Итак, ОВР — это своеобразное «химическое ограбление». Мы разобрались, кто такие «окислитель» и «восстановитель».
Следствие в разгаре, жертвы появляются все чаще и чаще, поэтому нам просто необходимо предугадать дальнейшие действия преступников. Разберемся, какие атомы могут стать следующими жертвами, а какие — ворами.
Как по частице определить, в роли кого она может выступать в окислительно-восстановительной реакции? Для этого нужно уметь четко интерпретировать степени окисления, чему мы сейчас и будем учиться.
Окислитель понижает степень окисления (у воров карма ухудшается), а восстановитель — повышает (карма очищается и становится лучше).
В кислородсодержащих ионах, как правило, смотрим на центральный атом (не на кислород).
| Атом или ион | Может повысить степень окисления? (быть восстановителем) | Может понизить степень окисления? (быть окислителем) | Вердикт |
| N–3 | + | – | Только восстановитель |
| P+5 | – | + | Только окислитель |
| S+6 в составе иона SO42– | – | + | Только окислитель |
| N+3 в составе иона NO2– | + | + | И окислитель, и восстановитель |
| Cl+2 в составе иона ClO– | + | + | И окислитель, и восстановитель |
Из всего этого делаем выводы:
- если атом элемента находится в высшей степени окисления (может только понизить ее) — в ОВР он может являться только окислителем;
- если атом элемента находится в низшей степени окисления (может только повысить ее) — в ОВР он может являться только восстановителем;
- если атом элемента находится в промежуточной степени окисления (то есть может ее как повысить, так и понизить) — в ОВР он может быть как окислителем, так и восстановителем.
Явление, при котором атом элемента за счет нахождения в промежуточной степени окисления может проявлять как окислительные, так и восстановительные свойства, называется окислительно-восстановительной двойственностью.
При этом важно понимать: если частица может проявлять только окислительные свойства, это еще не значит, что она — сильный окислитель.
Например, высшая степень окисления +5 для фосфора — наиболее устойчивая, и он «не собирается из нее никуда уходить», поэтому понижать степень окисления он не намерен и окислителем является крайне редко.
Аналогично с восстановительными свойствами: если частица может проявлять только восстановительные свойства — это не делает ее сильным восстановителем.
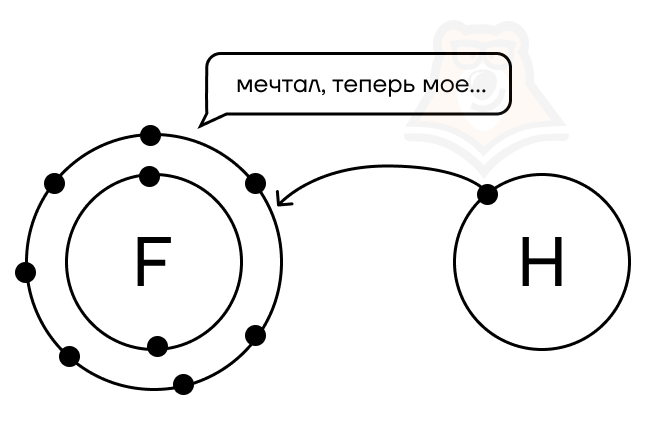
Например, F⁻ может только повышать степень окисления, а следовательно, может быть только восстановителем. Но «отобрать» у него электроны крайне затруднительно из-за высокой электроотрицательности, поэтому в ОВР в качестве восстановителя он почти никогда не выступает.
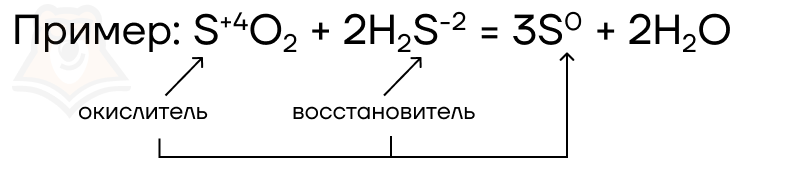
Рассмотрим еще один важный момент. В некоторых ОВР атомы-окислители и атомы-восстановители находятся в одном веществе, а в других — в разных. Давайте разберем, какие ОВР в принципе бывают.
- Межмолекулярные ОВР — атом-окислитель и атом-восстановитель находятся в разных соединениях.
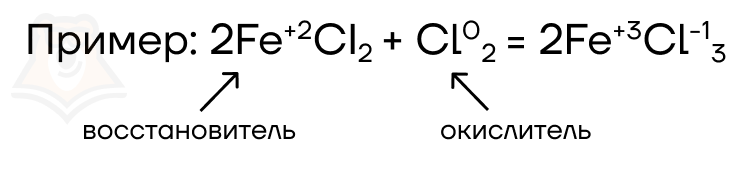
- Внутримолекулярные ОВР — атом-окислитель и атом-восстановитель находятся в одном соединении.
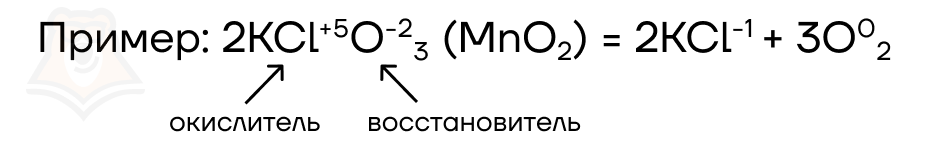
- Реакции диспропорционирования (самоокисления-самовосстановления) — окислителем и восстановителем являются атомы одного и того же элемента в одной степени окисления. В процессе реакции эта степень окисления как бы «раздваивается».
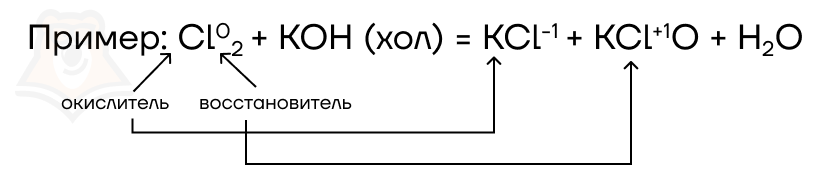

- Реакции сопропорционирования (конпропорционирования, усреднения) — окислителем и восстановителем являются атомы одного и того же элемента в разных степенях окисления. В процессе реакции эти степени окисления как бы «сходятся в одну» («усредняются»).
Основные моменты в расследовании ясны, наша следственная группа подготовила типичный портрет преступника и жертвы.
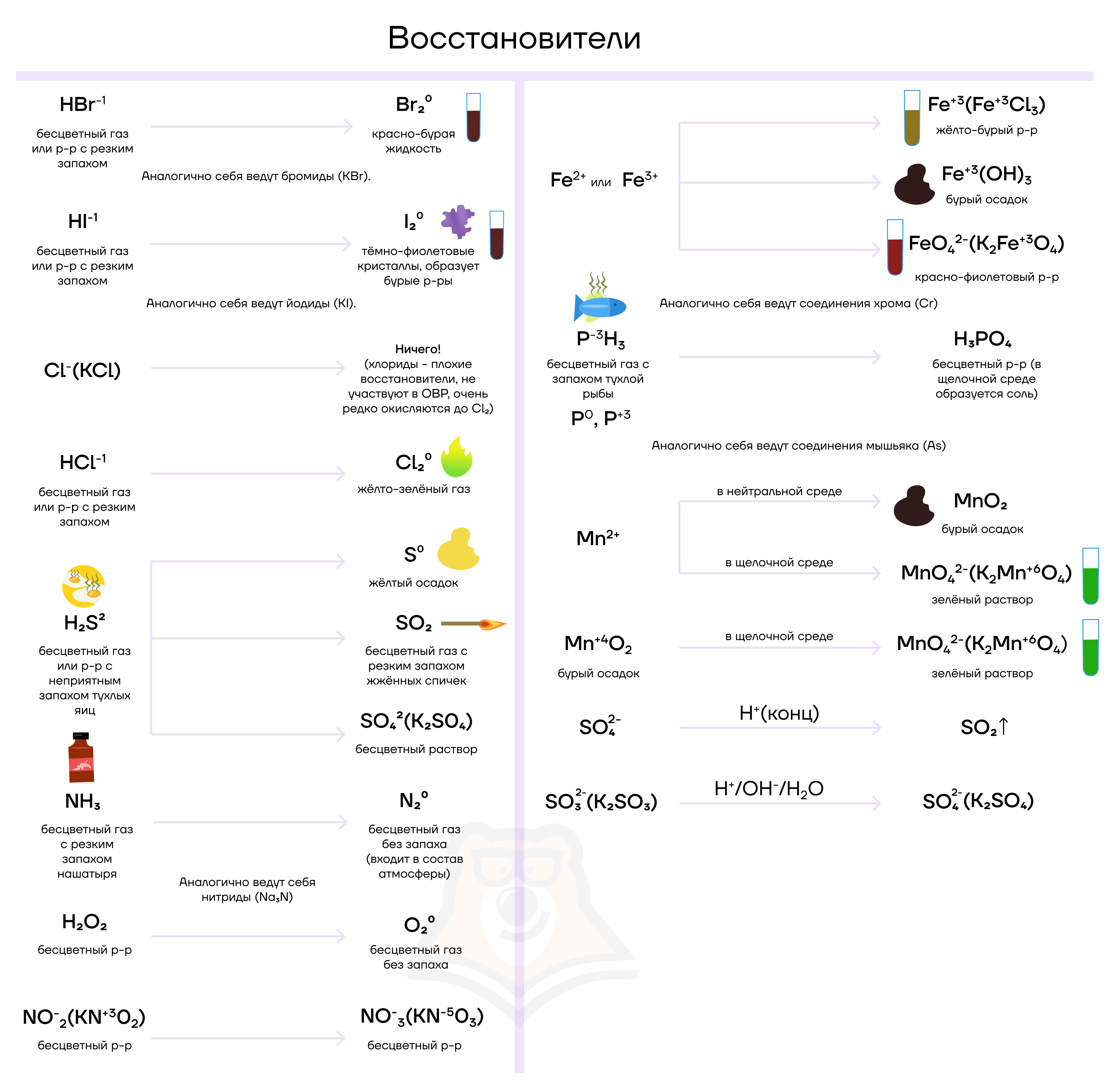
| Типичные окислители (кто грабит?) | Типичные восстановители (кого грабят?) |
| Атомы элементов, которых обидели, украв у них электроны. Атомы элементов в высших/высоких степенях окисления: KMn+7O4, K2Mn+6O4, Mn+4O2K2Cr+6O4, K2Cr+62O7, Cr3+K2Fe+6O4, Fe3+Ag+, Cu2+H2S+6O4(конц), S+6O3HN+5O3 и ее соли, N+12O, N+2O, N+4O2, N+52O5HCl+7O4, HCl+5O3, HCl+3O2, HCl+1O и их солиH2O–12 и другие пероксиды | Богатые атомы элементов с большим числом электронов («мажоры»). Атомы элементов в низших/низких степенях окисления: Cl–, Br–, I–S–2N–3H3P0, P+32O3, P–3H3, P+3Cl3S+4O2, S+4O32–N+3O2–C+2OH2O–12 и другие пероксиды |
| Воры по природе. Атомы элементов с высокими значениями электроотрицательности: F2, O2, O3, Cl2, Br2, I2 | Жертвы по природе. Атомы элементов с низкими значениями электроотрицательности: Металлы (Al, Ca, Mg, K…), H2, C, Р |
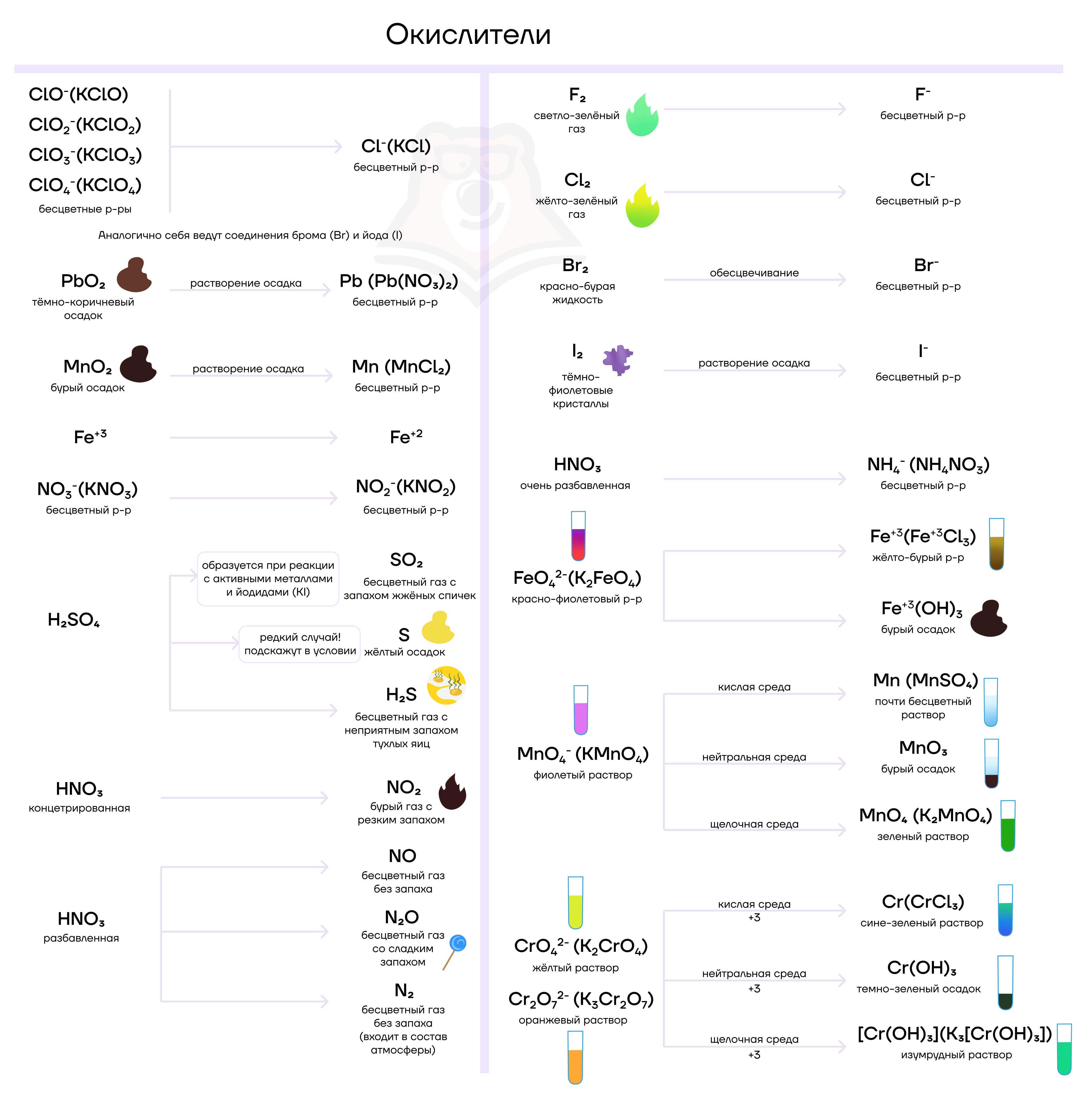
Все улики собраны, теперь нам для полноценного понимания картины преступления остается только поставить следственный эксперимент.
Составление электронного баланса реакции
В записи уравнения ОВР важно не только понимать, как изменяется степень окисления, но и уметь уравнивать полученную реакцию.
В ЕГЭ обычно расставляют коэффициенты в ОВР методом электронного баланса.
Изучим последовательность составления электронного баланса
1. Необходимо написать схемы изменения степеней окисления окислителя и восстановителя.
2. Для значений отданных и принятых электронов найти наименьшее общее кратное, разделить его на каждое из этих чисел.
3. Полученные значения записать в качестве коэффициентов перед окислителем и восстановителем.
4. Остальные вещества уравнять «вручную».
5. Если в задании просят указать окислитель и восстановитель, то нужно отдельной строкой прописать, кто в реакции и за счет каких атомов является окислителем, а кто — восстановителем.
Проще всего понять этот процесс на примере.
Запишем реакцию: HI + H2SO4 = I2 + H2S + H2O
- Определим, как изменяются степени окисления восстановителя и окислителя и запишем схемы для каждого элемента.
В данной реакции степени окисления меняются у иода (с -1 в HI до 0 в I2) и у серы (с +6 в H2SO4 до -2 в H2S), для этих двух элементов мы и составим схемы.Важно помнить, что количество атомов в левой и правой части должно быть равным: так как в правой части молекула иода I20 состоит из двух атомов иода, то и в левой части должно быть два атома.
А чтобы этого добиться, мы добавляем коэффициент 2 перед ионом I—. Количество отдаваемых электронов тогда тоже удваивается: один атом йода I— отдает 1 электрон (1e) , 2 атома йода I— отдают 2 электрона (1×2e).
Итого получим:
2I-1 — 2e = I20
S+6 + 8e = S-2
- Наименьшее общее кратное равно 8, поделим его на количество отданных или принятых электронов:
Для иода: 8 : 2 = 4
Для серы: 8 : 8 = 1
Подставим полученные значения в баланс.
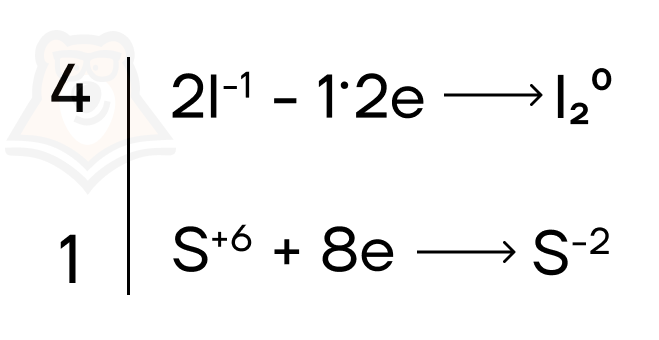
- Перенесем полученные коэффициенты в уравнение: перед иодом I2 поставим 4, тогда перед HI будет стоять 8. Перед серой коэффициенты не добавляем.
Получим: 8HI + H2SO4 = 4I2 + H2S + ?H2O
- Остается уравнять воду: слева 10 атомов водорода, справа 2 в H2S, неуравненными остаются 8 атомов водорода.
Так как в одной молекуле воды 2 атома водорода, то коэффициент будет равен
8 : 2 = 4
Итого: 8HI + H2SO4 = 4I2 + H2S + 4H2O
- Укажем окислитель и восстановитель.
Так как в ходе реакции иод I— в составе HI повышает степень окисления, то он будет восстановителем, а сера S+6 в составе H2SO4 степень окисления понижает, поэтому будет окислителем.

Важные детали по оформлению ОВР!
- Не путайте степень окисления (+2, -3…) с зарядом иона (2+, 3-…). За это снижают баллы.
- Окислитель и восстановитель необходимо прописывать отдельной строкой, при записи в правой части баланса могут снизить балл.
- Простые вещества (двухатомные молекулы) в баланс переносятся с индексом, при этом обязательно нужно уравнять количество атомов в левой и правой частях реакции, расставив коэффициенты (как это было в нашем примере с иодом).
- В случае, когда в составе вещества присутствует несколько атомов элемента-окислителя или восстановителя, мы также можем поставить коэффициент (не индекс!) перед атомом элемента, тогда нам будет проще уравнять реакцию.
Например, в составе K2Cr2O7 присутствуют 2 атома элемента-окислителя Cr+6. Предположим, что степень окисления изменяется с +6 до +3, тогда электронный баланс можно записать как
2Cr+6 — 2×3e = 2Cr+3
или
2Cr+6 — 6e = 2Cr+3
- Вручную мы уравниваем сначала все оставшиеся атомы металлов и неметаллов, последним всегда уравнивается водород, а по кислороду мы проверяем правильность расстановки коэффициентов.
Попрактикуемся над составлением электронного баланса, для этого решим задание №29 второй части ЕГЭ.
Задание. Для выполнения задания используйте следующий перечень веществ: перманганат натрия, гидрокарбонат калия, сульфат натрия, иодид натрия, гидроксид калия, оксид углерода(IV). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с обесцвечиванием раствора и выпадением осадка темного цвета. В ответ запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение. Окислителем может выступать перманганат натрия, обесцвечивание раствора происходит либо при окислении в кислой среде (соли марганца(II) имеют почти бесцветный раствор), либо при окислении в нейтральной среде (марганец восстановится до оксида марганца(IV) и выпадет в темный осадок).
Восстановителем может быть иодид натрия. Кислая среда в данном случае невозможна, так как среди предложенных веществ кислоты нет, значит, в качестве среды берем воду.
Запишем уравнение:
NaMnO4 + NaI + H2O = MnO2 + I2 + NaOH
Окислитель — марганец в NaMnO4, восстановитель — иод в NaI.
Приступим к составлению баланса, для этого запишем схемы изменения степеней окисления восстановителя и окислителя.
Mn+7 + 3ē = Mn+4
2I— — 2ē = I20
Наименьшее общее кратное равно 6, разделим его на число электронов:
Для марганца: 6 : 3 = 2
Для иода: 6 : 2 = 3
Добавим коэффициенты в электронный баланс:
Mn+7 + 3ē = Mn+4 | 2
2I— — 2ē = I20 | 3
Перенесем полученные коэффициенты в уравнение.
2NaMnO4 + 6NaI + H2O = 2MnO2 + 3I2 + NaOH
В левой части 8 атомов натрия, в правой части должно быть столько же, поставим восьмерку перед NaOH.
2NaMnO4 + 6NaI + H2O = 2MnO2 + 3I2 + 8NaOH
Остается уравнять воду: в правой части 8 атомов водорода, тогда перед водой ставим 4.
2NaMnO4 + 6NaI + 4H2O = 2MnO2 + 3I2 + 8NaOH
Проверяем по кислороду: справа 12 атомов, слева тоже 12, реакция уравнена верно.
В ответ записываем уравненную реакцию, баланс и в отдельной строке указываем окислитель и восстановитель.
Ответ:
2NaMnO4 + 6NaI + 4H2O = 2MnO2 + 3I2 + 8NaOH
Mn+7 + 3ē = Mn+4 | 2
2I— — 2ē = I20 | 3
NaMnO4 (за счет Mn+7) — окислитель;
NaI (за счет I—) — восстановитель.
К экзамену мы готовы, но в нашем расследовании обнаружена новая жертва. И это… садовая мебель! Давайте разберемся, как ОВР испортили ее жизнь.
Коррозия металлов: виды коррозии, способы защиты металлов от коррозии
Вероятно, вы видели какие-нибудь металлические предметы, которые были подвержены коррозии. Но что это такое?

Коррозия — это процесс разрушения металлов под воздействием различных внешних факторов, обычно кислорода или влаги.
Различают два типа коррозии.
- Химическая коррозия сопровождается химическими реакциями (обычно при реакциях с кислородом).
К химической коррозии относится окисление железа кислородом до Fe3O4. - Электрохимическая коррозия сопровождается электрохимическими реакциями (обычно протекает в присутствии воды или в растворах электролитов).
К электрохимической коррозии будет относится образование ржавчины: окисление железа на воздухе (кислородом в присутствии воды) до Fe(OH)2.
| Как спасти свою любимую садовую металлическую мебель? Дачный сезон снова открыт, весеннее солнышко приятно греет, снег оттаял, а первые цветы уже расцвели! Казалось бы, ничто не способно разрушить эту идиллию. Но вдруг мы с горечью замечаем, что любимая скамейка на веранде немного разрушилась, бочка с водой покрылась какой-то непонятной корочкой, — одним словом, коррозия. Не стоит отчаиваться, есть решение этой проблемы! Существуют специальные покрытия, которые будут препятствовать разрушению металла, входящего в конструкцию. Это могут быть различные краски, лаки, менее активные металлы. Принцип таких покрытий основывается на создании прослойки, препятствующей контакту металла с воздухом и влагой. |

Преступление раскрыто! Мы узнали, что окислительно-восстановительные реакции являются основой многих химических превращений, именно они делают нашу жизнь такой, какая она есть. Но на ОВР все не заканчивается. Для дальнейшего изучения химических реакций рекомендуем прочитать статью «Реакции ионного обмена».
Термины
Электронная плотность — вероятность нахождения электрона в данной области пространства: вокруг атомного ядра или в «окрестностях» внутри молекулярных структур.
Фактчек
- Окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степеней окисления атомов.
- В ОВР всегда есть и окислитель, и восстановитель.
- Типичными окислителями являются вещества, в составе которых есть атом в высоких степенях окисления.
- Типичным восстановителем являются вещества, в составе которых есть атом в низких степенях окисления.
- Для уравнивания ОВР необходимо записать электронный баланс.
- Металлы могут разрушаться под действием воздуха или влаги. Это явление называется коррозией.
Проверь себя
Задание 1.
Какая из перечисленных реакций является окислительно-восстановительной?
- Реакция между карбонатом натрия и HCl
- Реакция между алюминием и HCl
- Реакция между угарным газом и гидроксидом натрия
- Реакция между фосфидом кальция и водой
Задание 2.
Какое из перечисленных веществ может быть только восстановителем?
- NH3
- KMnO4
- H2SO4
- O2
Задание 3.
Какое из перечисленных веществ может быть только окислителем?
- H2O
- Li
- K2Cr2O7
- H2
Задание 4.
В реакции с каким веществом хлор будет самоокисляться-самовосстанавливаться?
- Хлорид железа(II)
- Алюминий
- Сера
- Гидроксид калия
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 4.


 к списку статей
к списку статей





