Элементы IVА группы. Кремний
На этой странице вы узнаете:
- Физические и химические свойства кремния;
- Песок тоже с кремнием: разберем соединения кремния — силаны, оксиды, силикаты;
- Единственная и неповторимая — поговорим о свойствах кремниевой кислоты.
В чайном сервизе твоей бабушки обязательно найдется кремний, так как диоксид кремния входит в состав стекла. Ну а загорать на пляже без песочка (SiO2) ну просто невозможно (песок встречается на каждом шагу).
Кремний
Кремний встречается во многих веществах и предметах, которые нас окружают. Достаточно вспомнить только солнечные батареи, которые служат альтернативным источником энергии!
Так что же из себя представляет кремний? Он, как и углерод, находится в IVA-группе и имеет конфигурацию внешнего электронного слоя 3s23p2.
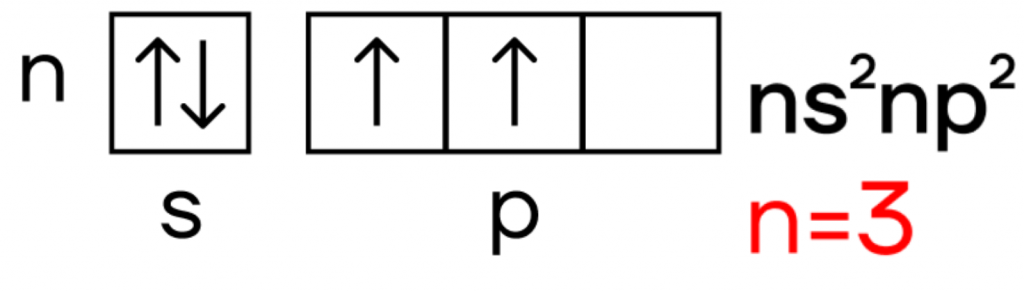
В возбужденном состоянии электроны на s-орбитали распариваются, и один из них переселяется на p-орбиталь. В результате, атом приобретает конфигурацию ns1np3.
В возбужденном состоянии число неспаренных атомов кремния возрастает до четырех, и кремний приобретает валентность IV:

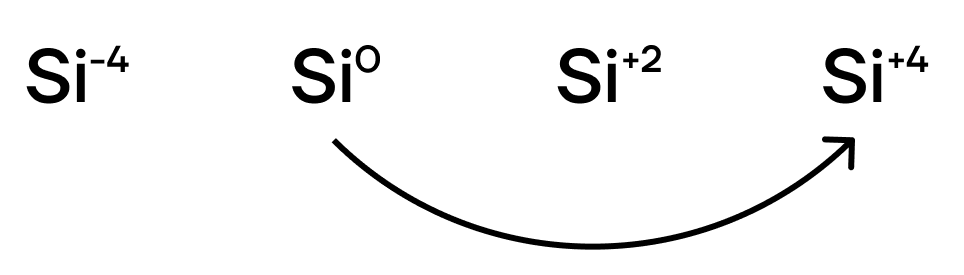
У кремния возможны следующие степени окисления: -4, +2, +4.
Физические свойства
| Кремний — второй по распространенности элемент на Земле (после кислорода). Кремний встречается только в виде сложных веществ, таких как горный хрусталь, кварц, кремнезем. |

Кристаллическая решётка простого вещества кремния — атомная, сам кремний представляет собой вещество темно-серого цвета с металлическим блеском. Является полупроводником.
Химические свойства кремния
У кремния относительно низкая электроотрицательность. А что это значит? Это значит, что он будет яро проявлять восстановительные свойства, даже ещё более выраженные чем у углерода! Поэтому из неметаллов будет вступать в реакции с типичными окислителями, повышая свою степень окисления до +4:
- Реакции с неметаллами
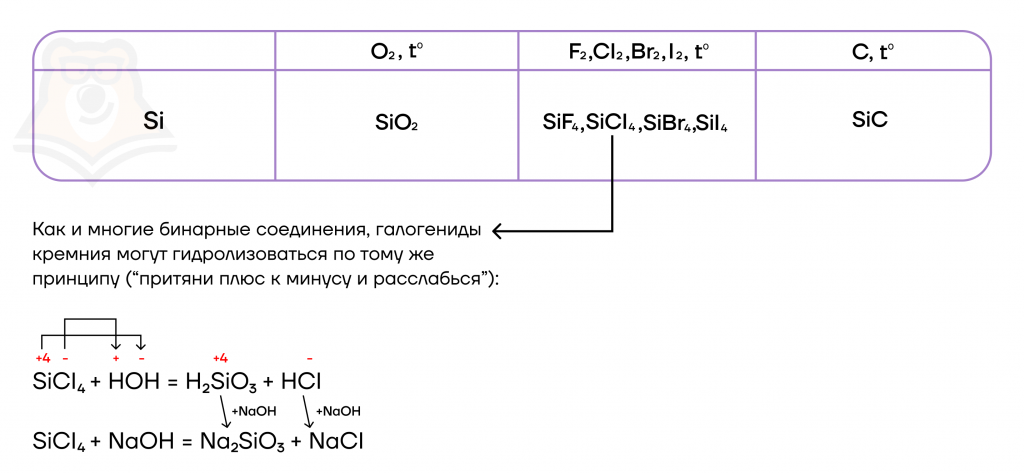
| Кремний не реагирует с водородом и фосфором в силу близких значений электроотрицательностей! |
- Реакция со щелочами
В отличие от других неметаллов, реагирующих со щелочами, кремний является в этих реакциях только восстановителем, повышая степень окисления до +4:
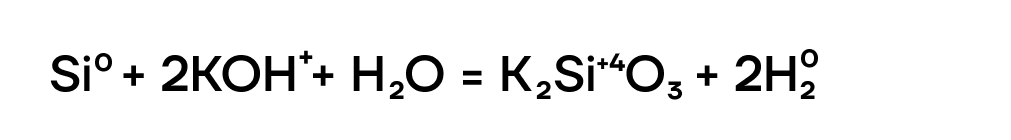
- А с окислителями реакция идет?
Конечно! Но не со всеми. Отобрать электроны «слабенький» кремний способен только у самых слабых — у металлов. Как и углерод, кремний реагирует в основном с металлами активными и средней активности, образуя силициды:
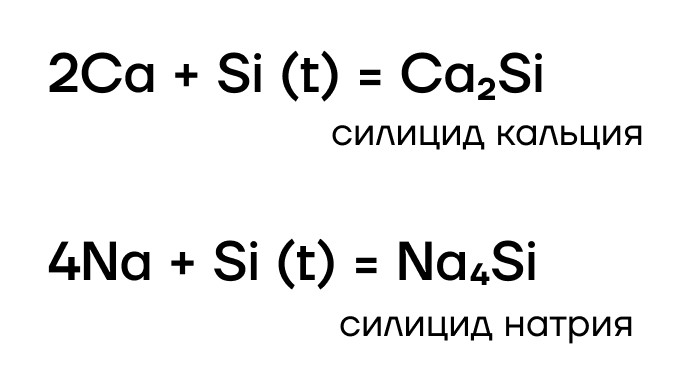
Как и многие другие бинарные соединения, силициды металлов могут гидролизоваться:
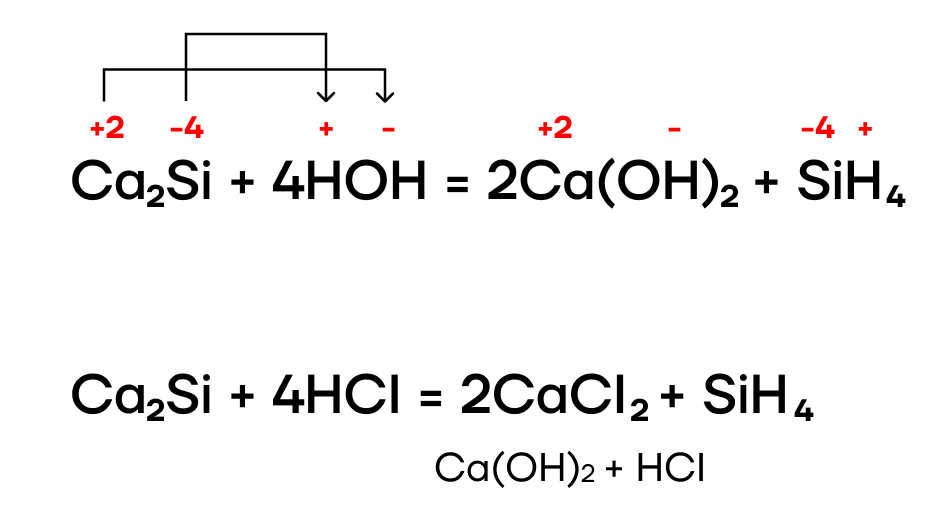
Образующийся бесцветный газ с неприятным запахом — силан — за счёт степени окисления кремния -4 проявляет восстановительные свойства и способен реагировать с окислителями (например, с кислородом):
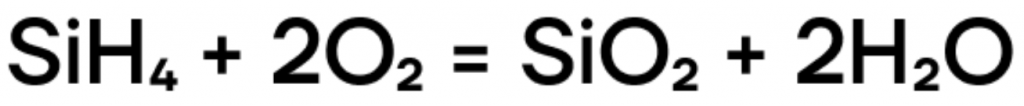
(оксид кремния(IV) входит в состав песка, который мы видим на улице)
Получение кремния
Кремний в основном получают восстановлением из диоксида кремния SiO2 сильными восстановителями: углеродом, металлами:
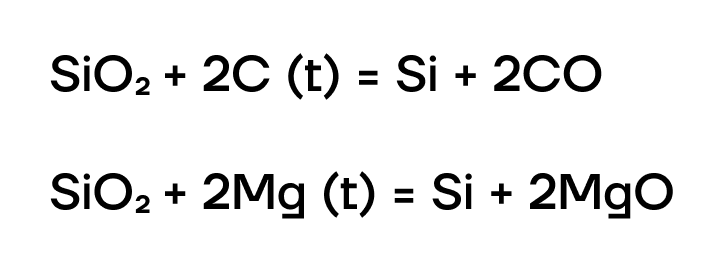
Оксид кремния (IV) — кремнезём SiO2
Диоксид кремния — кислотный оксид, главный компонент почти всех земных горных пород. Из кремнезема и силикатов состоит почти 90 % массы литосферы.
- Реакция с водой
Почему же диоксид кремния такой исключительный? Да все потому, что это — единственный кислотный оксид, который не реагирует с водой! Как следствие, ему соответствует нерастворимая кремниевая кислота H2SiO3.
- Основно-кислотное взаимодействие
Как кислотный оксид, SiO2 проявляет кислотные свойства, а значит, способен взаимодействовать с веществами, проявляющими основные свойства, с образованием солей — силикатов:
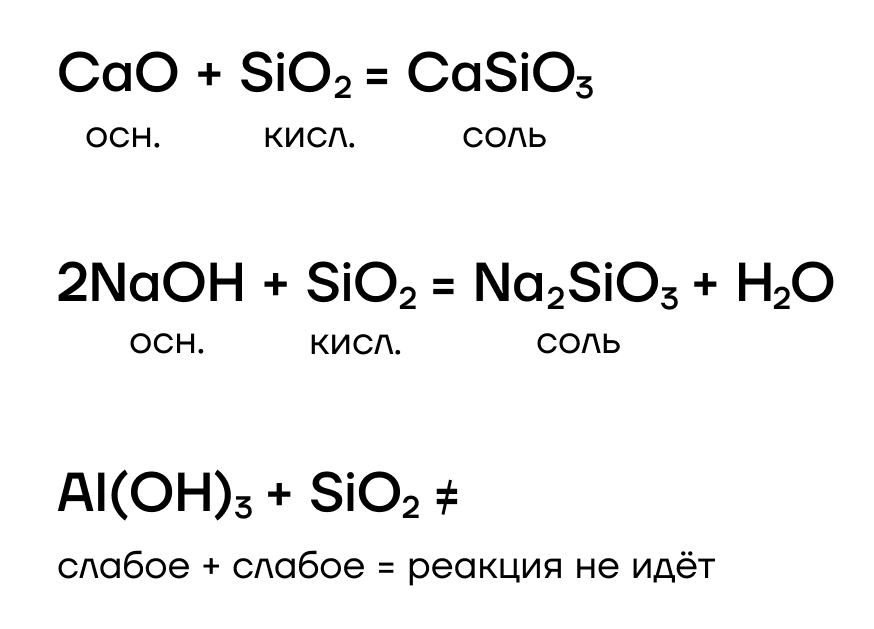
- А в реакции вытеснения вступает?
Да! SiO2 в реакциях вытеснения — условно «сильный» оксид, способный вытеснять условно «слабые» (CO2, SO2) из их солей при сплавлении (t):
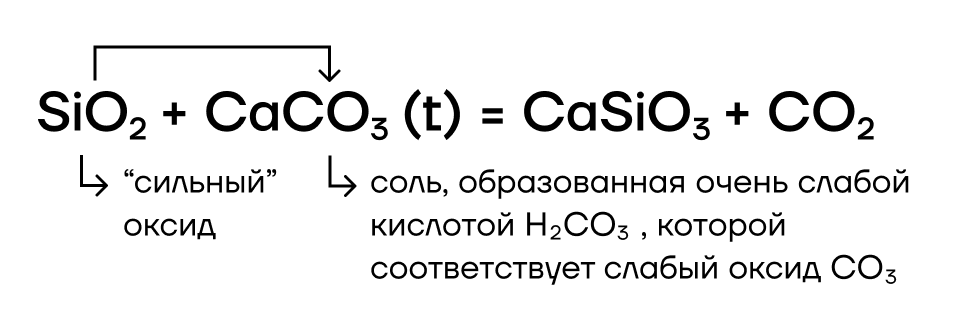
- Реакции с окислителями
За счёт высокой степени окисления кремния +4 SiO2 проявляет слабо выраженные окислительные свойства и может вступать в ОВР, как правило, только с очень сильными восстановителями (например, углеродом или металлами):
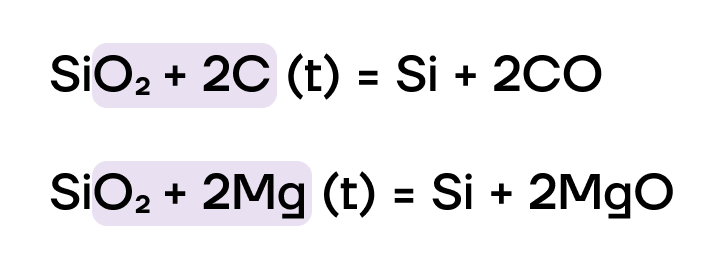
Единственная и неповторимая — кремниевая кислота и силикаты

Кремниевая кислота, хоть и нерастворима, но всё-таки проявляет кислотные свойства, взаимодействуя с сильными основаниями (щелочами):
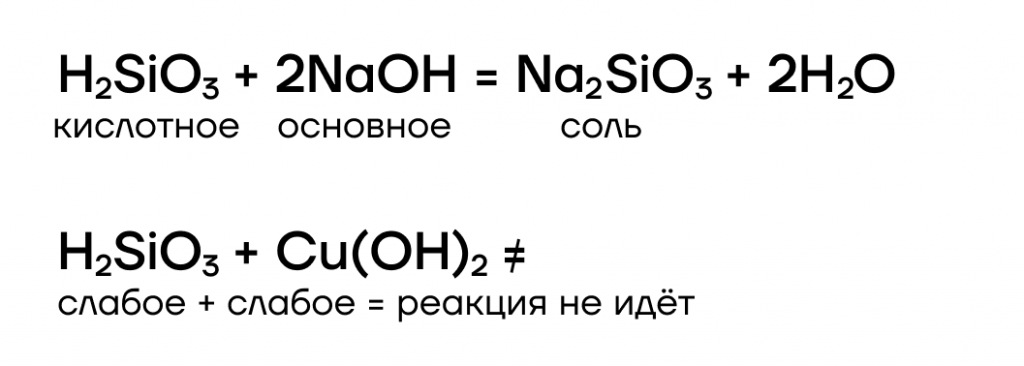
| А ещё силикаты различных металлов образуют красивые нитевидные кристаллы, которые используются в эксперименте « силикатный сад»! |
Её соли — силикаты, как и другие соли, являются электролитами, а значит, способны вступать в РИО с другими электролитами: солями, основаниями, кислотами:
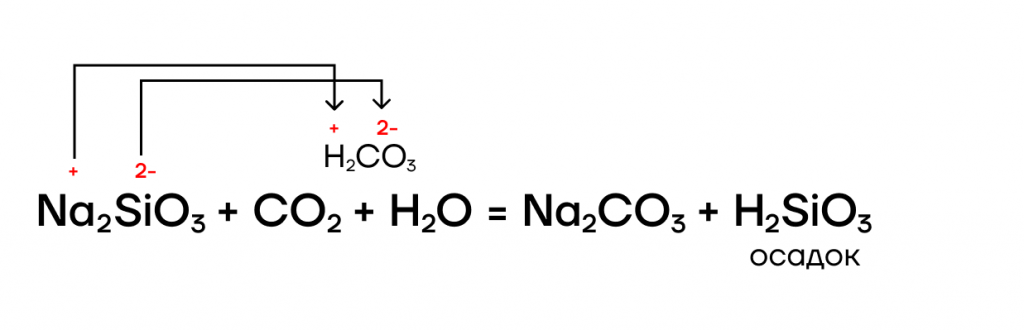
Как нерастворимый гидроксид, кремниевая кислота способна разлагаться при нагревании на воду и соответствующий оксид:
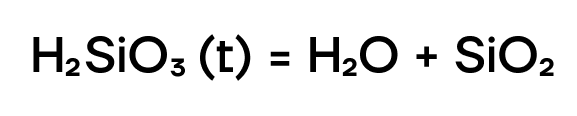
Фактчек
- Кремний — химический элемент IVA группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14.
- Возможные степени окисления кремния: -4, +2, +4.
- Электронная конфигурация атома кремния: 1s22s22p63s13p3.
- Кремний за счёт низкой электроотрицательности ярко проявляет восстановительные свойства.
- Кремний образует множество соединений, в том числе оксид кремния SiO2 — кислотный оксид, который соответствует кремниевой кислоте H2SiO3. Соли кремниевой кислоты называются силикатами.
Проверь себя
Задание 1.
Сколько неспаренных электронов содержит атом кремния в возбужденном электронном состоянии?
- 1 электрон;
- 2 электрона;
- 3 электрона;
- 4 электрона.
Задание 2.
С каким из следующих простых веществ не реагирует кремний?
- Углерод;
- Бром;
- Фосфор;
- Кислород.
Задание 3.
С каким из перечисленных веществ будет реагировать диоксид кремния?
- Карбонат натрия;
- Сульфат калия;
- Хлорид рубидия;
- Ортофосфат кальция.
Задание 4.
Какое свойство отличает кремниевую кислоту от других кислот?
- Она содержит атомы кислорода;
- При комнатной температуре кремниевая кислота — жидкость;
- Она нерастворима в воде;
- Она проявляет амфотерные свойства.
Задание 5.
Как называются бинарные соединения кремния и металлов?
- Силаны;
- Силициды;
- Силикаты;
- Силоксаны.
Ответы: 1. — 4; 2. — 3; 3. — 1; 4. — 3; 5. — 2.


 к списку статей
к списку статей





