Электролиз расплавов и растворов (солей, щелочей, кислот)
На этой странице вы узнаете
- Сила Тора — как с помощью электричества разлагаются вещества?
- Могут ли химические элементы «летать»?
- Как электролиз связывает между собой самолеты и ложки?
Электрический ток — основа современной жизни. Без него у нас элементарно бы не было света в доме, не работали бы наши гаджеты, не ездил бы транспорт. А как электричество участвует в химических реакциях? Узнаем в этой статье.
Принцип электролиза
Электролиз основан на пропускании электрического тока через раствор или расплав вещества-электролита.
| Сила Тора — как с помощью электричества разлагаются вещества? Бог грома и молний Тор не мог себе и представить, что электричество играет важную роль в химии. Вещества способны «разрушаться» под воздействием электрического тока. Такой процесс называют электролизом. |
Реакции электролиза протекают в приборе, называемом электролизёром или электролитической ванной. Посмотрим на него детальнее.
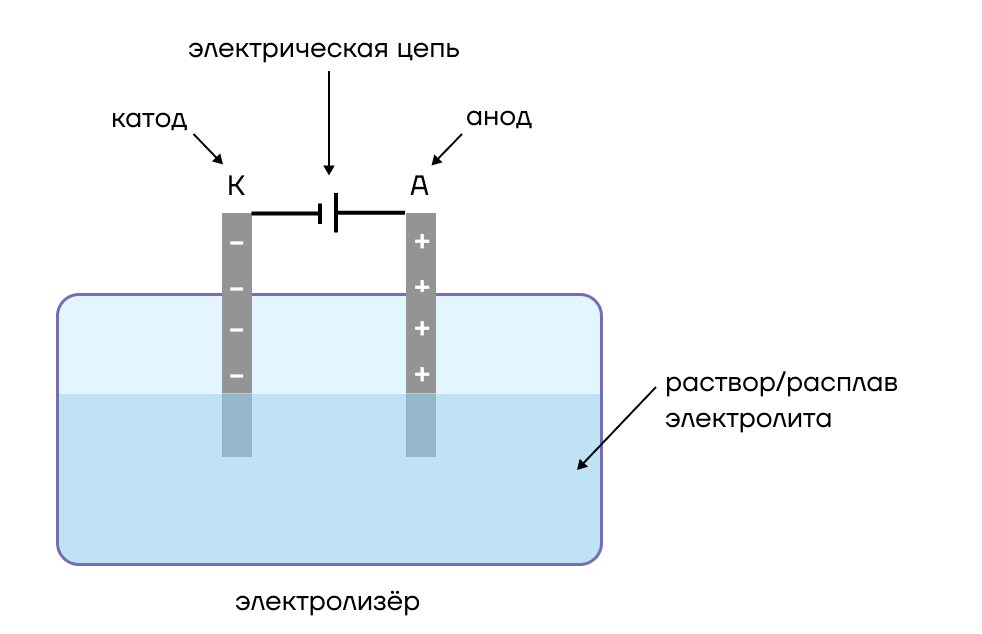
Электролизер представляет собой определенную емкость, в которую для протекания реакции заливают раствор или расплав электролита и в которую опущены электроды — катод и анод. Это, как правило, металлические пластинки или графитовые стержни, на поверхности которых будут протекать реакции электролиза.
Электроды — это пластинки или стержни, которые служат местом протекания реакций.
| Могут ли химические элементы «летать»? Можно сказать, что да, ведь ионы электролитов притягиваются к электродам, опущенным в раствор или расплав вещества. Различают два типа электродов: катод и анод. — Катод — электрод, имеющий отрицательный заряд (–), к поверхности которого, исходя из принципа «+» притягивается к «–», будут притягиваться катионы (+). — Анод — электрод, имеющий положительный заряд (+), исходя из чего к нему притягиваются анионы (–). |
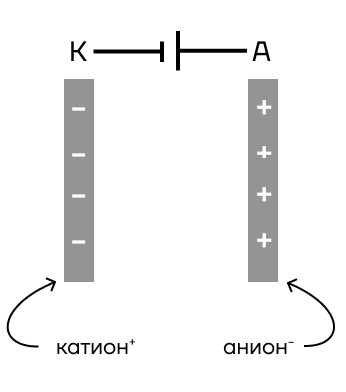
За счет того, что между электродами натянута электрическая цепь, электроны (–) от анода могут передаваться к катоду, благодаря чему и происходит передача электронов от аниона к катиону, а значит, окислительно-восстановительная реакция (ОВР).
Какой вывод можно из этого сделать?
Электролиз — это окислительно-восстановительная реакция (ОВР), протекающая на электродах при прохождении электрического тока через раствор или расплав электролита.
Особенность электролиза состоит в том, что процессы окисления и восстановления в этой ОВР пространственно разделены: окисление протекает на одном электроде, а восстановление на другом.
Возможны два варианта развития событий: когда проводят электролиз раствора и электролиз расплава. Начнем по порядку.
Электролиз растворов веществ
Словосочетание «водный раствор» предполагает, что, помимо ионов электролита, в электролизере также будут находиться молекулы воды, которые являются растворителем.
Давайте вспомним строение аш-два-о:
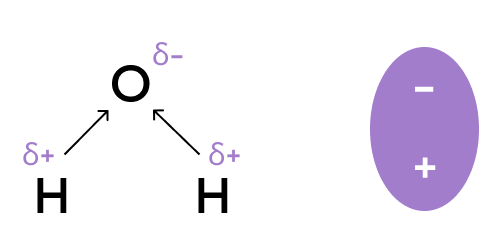
Вода — это полярная молекула: наиболее электроотрицательный атом кислорода перетягивает на себя электронную плотность в молекуле, создавая отрицательно заряженный полюс (δ-), на водородах же создается положительно заряженный полюс (δ+).
Таким образом, молекула воды представляет собой диполь («ди» — два, «поль» — полюс) и имеет положительно и отрицательно заряженные полюса.
А что это значит? Это значит, что отрицательно заряженным полюсом (–) вода способна притягиваться к аноду (+), а положительно заряженным (+) — к катоду (–).
Так, если реакция электролиза вещества протекает в водном растворе, то на катоде и на аноде, помимо ионов электролита, будут находиться также молекулы воды, как бы конкурирующие с ними за право вступить в реакцию электролиза.
Поэтому сейчас мы будем разбираться, что в каждом конкретном случае будет подвергаться электролизу: вода или ион электролита.
Катодные процессы
На катоде происходит процесс восстановления (взятия электронов катионом).
При этом продукт электролиза на катоде зависит от активности металла, находящегося в составе электролита.
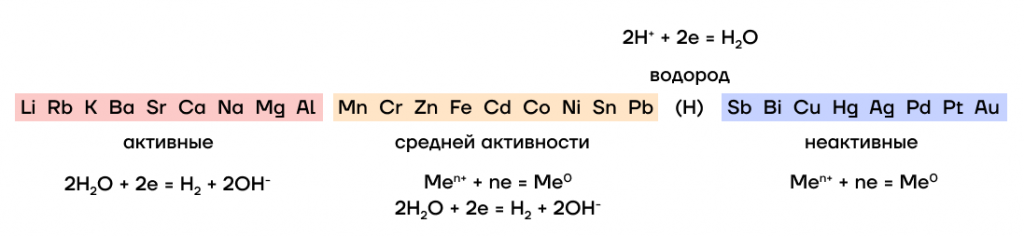
Металлы, стоящие в ряду активности металлов до алюминия (включительно!), считаются активными; металлы после водорода — неактивными; металлы, находящиеся в промежутке между активными и неактивными, — средней активности.
Продукты электролиза довольно логичны, если построить нужную ассоциацию:
- «Крутые» активные металлы даже не собираются принимать участие в электролизе (могут себе это позволить). Поэтому они «толкают» на катод молекулы воды и заставляют их делать всю работу за них, а сами остаются в прикатодном пространстве, то есть просто рядом с ним. Таким образом, электролизу подвергается вода, исходя из чего на катоде выделяется водород:
2H2O + 2ē = H2 + 2OH⁻
- «Некрутые» неактивные металлы не имеют таких привилегий, поэтому им приходится выполнять всю работу и принимать участие в электролизе самим, в результате чего на катоде выделяется сам металл:
Меⁿ⁺ + nē = Me⁰
- Металлы средней активности «не определились в этой жизни», поэтому какая-то часть катионов этих металлов «толкает» на катод и заставляет участвовать в электролизе воду, а другая часть — электролизуется сама. Таким образом, при нахождении на катоде катионов металла средней активности, на катоде выделяются и водород, и металл:
2H2O + 2ē = H2 + 2OH⁻;
Meⁿ⁺ + nē = Me⁰
- При нахождении на катоде ионов H⁺ вместо катионов металла — например, при электролизе раствора кислоты, — логично, что на катоде будет выделяться водород:
2H⁺ + 2ē = H2⁰
Анодные процессы
На аноде происходит процесс отдачи электронов — окисление аниона. Сам же продукт электролиза на аноде зависит от типа аниона.
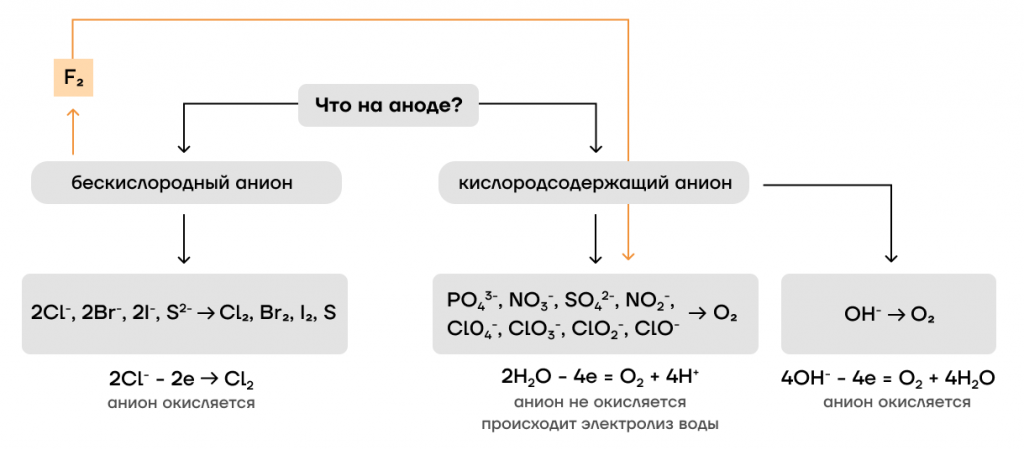
- Если на аноде оказывается кислородсодержащий анион неорганической кислоты (или фторид-ион!), ситуация обстоит так же, как с активными металлами. То есть «крутой» кислородсодержащий анион самостоятельно не принимает участия в процессе электролиза, а «толкает» на анод воду, «заставляя ее выполнять свои обязанности» и электролизоваться: при этом на аноде выделяется кислород.
Легко запомнить: при нахождении на аноде кислородсодержащего аниона, на аноде происходит окисление воды и выделяется кислород:
2H2O – 4ē = O2 + 4H⁺
- Если на аноде бескислородный анион — например, Cl –, Br –, I –, S² – — ему, как и катионам неактивных металлов, приходится участвовать в электролизе самому. В результате на аноде выделяется сам неметалл:
неМеⁿ⁻ – nē = неМе
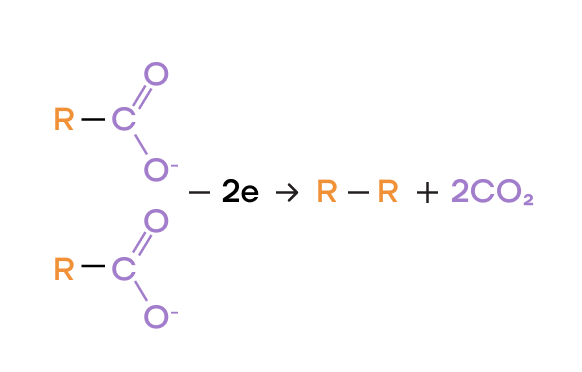
- В случае анионов органических кислот, оказавшихся на аноде, происходит другой процесс. Радикал удваивается R–R и выделяется углекислый газ CO2.
P.S. Именно поэтому для понимания продукта электролиза на аноде в этом случае анион органической кислоты берут в удвоенном количестве.
Почему в случае фторидов на аноде не выделяется сам неметалл (фтор), как в ситуации с другими бескислородными анионами?
Мы знаем, что на аноде происходит окисление (отдача электронов). А разве фтор, самый электроотрицательный на планете Земля? Он когда-то кому-нибудь отдавал свои или даже «украденные» электроны? Ни за что!

Именно поэтому он не ведет себя как типичные бескислородные анионы, отдавая электроны. Он «примыкает к банде кислородсодержащих анионов» и «толкает» на анод воду, в результате чего электролизу подвергается именно она и выделяется кислород.
Рассмотрим все эти процессы на конкретных примерах.
- Электролиз раствора NaCl.
Процесс на катоде: Na — активный металл, поэтому его катион подвергаться электролизу не будет, он остается в прикатодном пространстве (не притягивается к катоду, а находится рядом с ним). Вместо этого электролизоваться будет вода.
2H2O + 2e = H2 + OH–
Процесс на аноде: 2Cl – – 2e = Cl2
Теперь объединим оба процесса в одно уравнение реакции. Выделившийся на катоде анион OH– и незадействованный в электролизе катион Na+ дадут нам NaOH. К нему дописываем выделившиеся на электродах простые вещества — водород и хлор, получаем :
2NaCl + 2H2O = H2 + Cl2 + NaOH
- Электролиз раствора NaOH.
Процесс на катоде: 2H2O +2e = H2 + 2OH–
Процесс на аноде: 4OH– – 4e = O2 + 2H2O
Уравняем электроны методом электронного баланса (как при обычных ОВР), для этого домножим коэффициенты первого процесса на 2. Получим : 4H2O +4e = 2H2 + 4OH–
Запишем суммарно: 4H2O + 4OH– = 2H2 + 4OH– + O2 + 2H2O. Сократим H2O и OH–, которые есть у нас и в левой, и в правой частях. Получим итоговое уравнение:
2H2O = 2H2 + O2
- Электролиз раствора FeCl3
Процессы на катоде:
- Восстановление водорода 2H2O + 2e = H2 + 2OH–
- Восстановление железа: Fe+3 + 3e = Fe
Процесс на аноде: 2Cl – – 2e = Cl2
В ходе восстановления водорода образовались ОН–-ионы, которые с радостью присоединятся к катиону железа Fe3+, образуется гидроксид железа(III). Дальше остается составить итоговое уравнение, но не одно, а целых два! Запись в одно уравнение на экзамене считается неверной, так как не отражает все катодные процессы.
Первое уравнение отражает восстановление железа и анодный процесс:
2FeCl3 = 3Cl2 + 2Fe
Второе отражает восстановление водорода:
2FeCl3 + 6H2O = 3Cl2 + 2Fe(OH)3 + 3H2
- Электролиз раствора Cr2(SO4)3
Процессы на катоде:
- Восстановление водорода 2H2O + 2e = H2 + 2OH–
- Восстановление хрома: Cr+3 + 3e = Cr
Процесс на аноде: Так как сульфат-ион является кислородсодержащим ионом, то протекает электролиз воды: 4OH– – 4e = O2 + 2H2O
В ходе восстановления водорода образовались ОН–-ионы, которые с радостью присоединятся к катиону хрома Cr3+, образуется гидроксид хрома(III). В ходе анодного процесса образуются катионы водорода Н+, которые идут к сульфат-иону с образованием серной кислоты. Дальше остается составить уравнение электролиза, но не одно, а целых два!
Первое уравнение отражает восстановление хрома и анодный процесс:
4Cr2(SO4)3 + 6H2O = 3О2 + 4Cr + 6H2SO4
Второе отражает восстановление водорода:
2H2O = 2Н2 + О2
Электролиз расплавов веществ
Чем электролиз в расплаве будет отличаться от электролиза в растворе? Тем, что в расплаве НЕТ ВОДЫ: расплав представляет собой нагретое до температуры плавления и, таким образом, расплавленное вещество.
А если нет воды, значит, на аноде и катоде не будет конкуренции за вступление в реакцию между водой и ионами электролита. То есть в данном случае за счет отсутствия в электролизере воды складывается простое и логичное правило: что оказывается на электроде, то и подвергается электролизу.
Именно поэтому продукты электролиза расплавов веществ интуитивно просто определяются. Разберем конкретный пример и рассмотрим электролиз расплава хлорида натрия NaCl.
Погрузим в электролизер расплав NaCl. Как сильный электролит, хлорид натрия сразу же распадается на ионы:
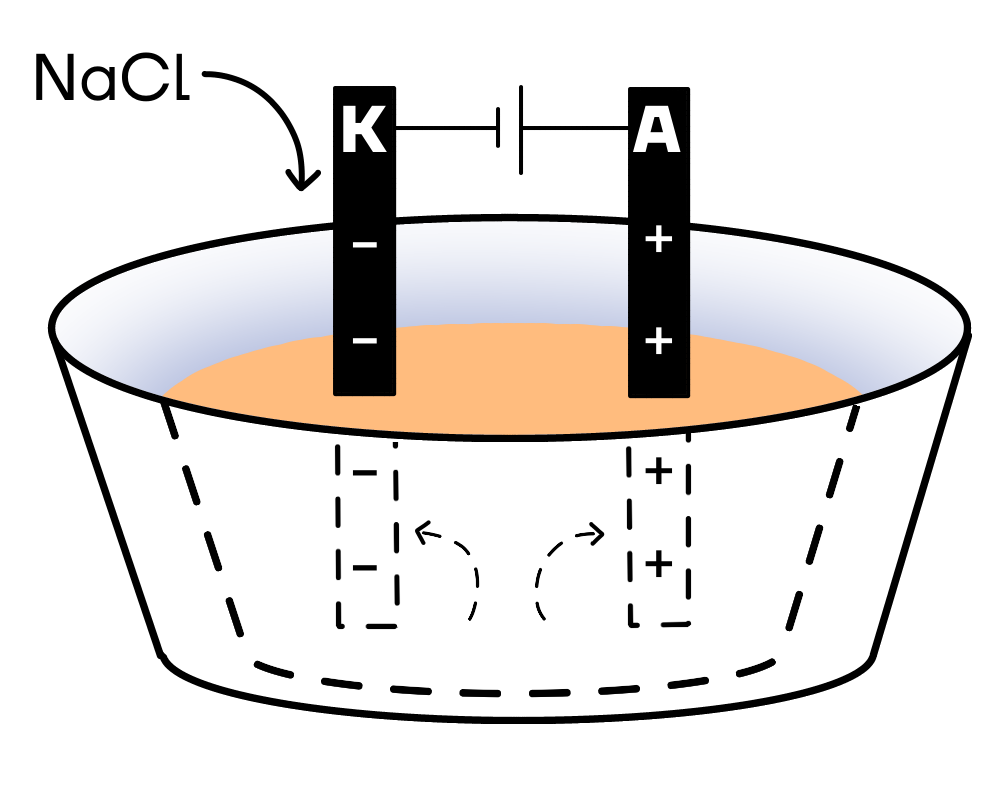
NaCl → Na⁺ + Cl⁻
Образовавшиеся после диссоциации катионы Na⁺ притягиваются к катоду (–), анионы Cl⁻ — к аноду (+).
Положительно заряженная поверхность анода (+) притягивает к себе и, таким образом, «отбирает» отрицательно заряженный электрон хлора, делая его электронейтральным:
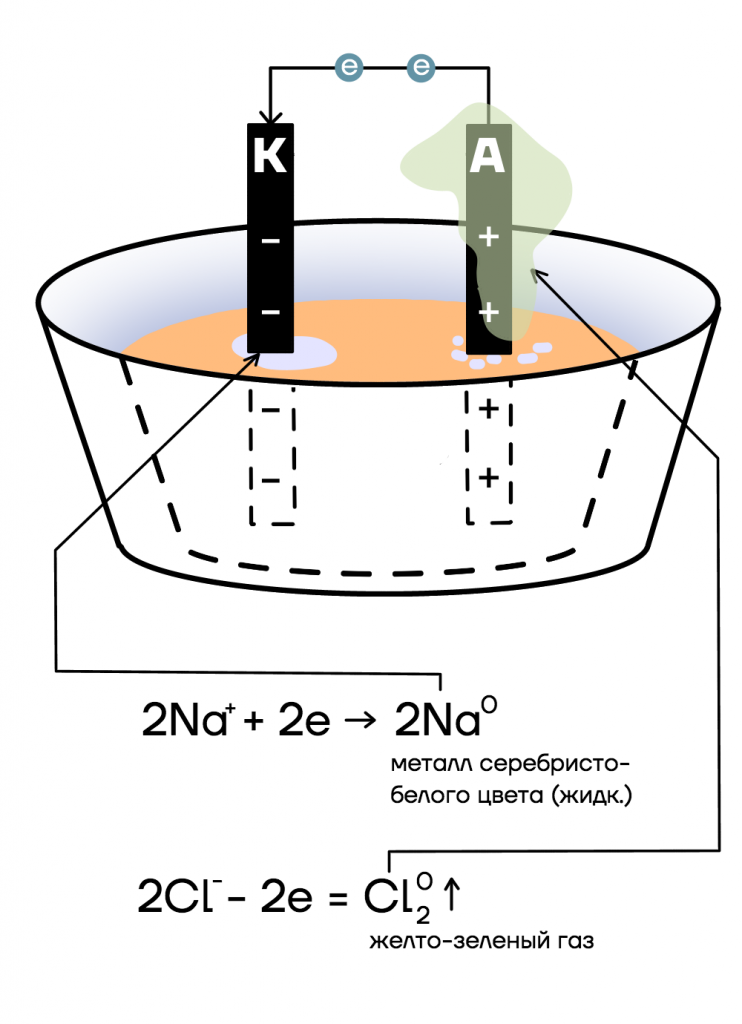
Cl⁻ – 1ē = Cl0
Так как хлор как простое вещество существует только в виде двухатомной молекулы (Cl2), для ее образования потребуется два аниона хлора. Электронно-ионное уравнение реакции, протекающей на аноде, будет выглядеть следующим образом:
2Cl⁻ – 2ē = Cl2⁰
По электрической цепи, натянутой между анодом и катодом, два «оторванных» на аноде у хлора электрона направляются к катоду, где их «ждет» катион натрия Na⁺. Чтобы принять два электрона, понадобится два Na⁺, в результате чего электронно-ионное уравнение реакции, протекающей на катоде, будет выглядеть следующим образом:
2Na⁺ + 2ē → 2Na
Так, при электролизе расплава NaCl на аноде выделяется хлор, а на катоде — натрий. То есть что оказалось на электроде, то электролизу и подверглось.
Итоговое уравнение реакции:
2NaCl (расплав, эл. ток) = 2Na + Cl2
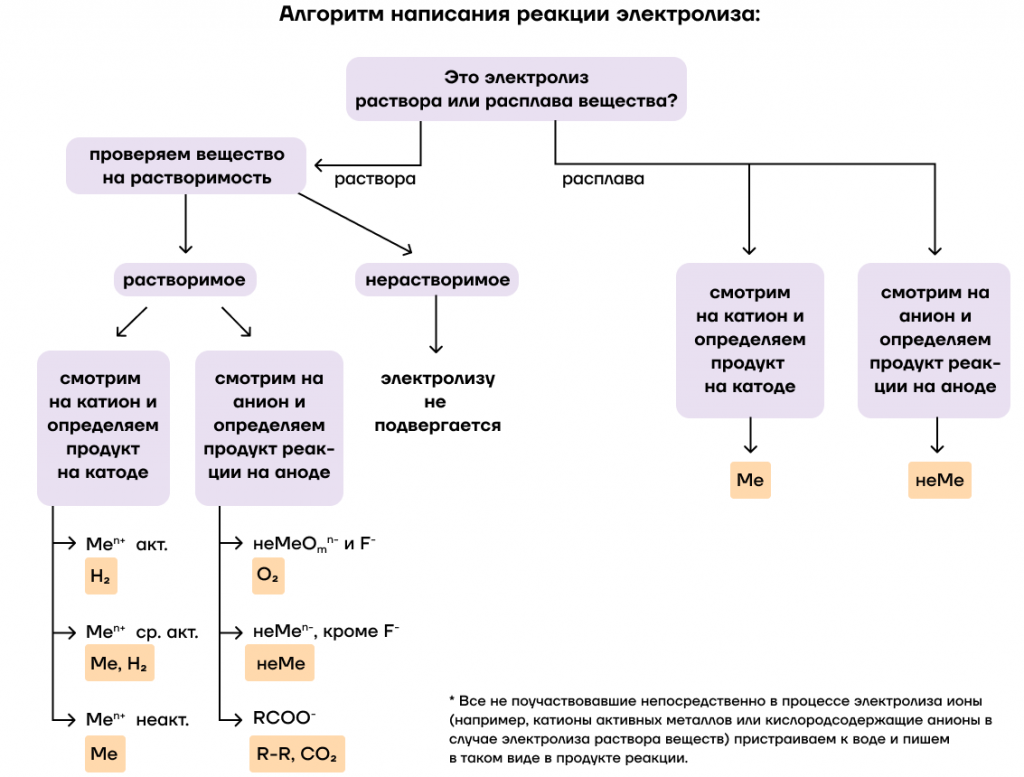
Какой общий алгоритм написания таких реакций? Чтобы не запутаться, мы можем пользоваться схемой.
| Как электролиз связывает между собой самолеты и ложки? Электролиз активно используют в промышленности для получения многих металлов. Например, натрий, магний и алюминий, из которого изготавливается множество изделий, начиная от ложек и заканчивая деталями для самолетов, получают только электролизом расплавов солей. Металлы, полученные электролизом очень чистые за счет отсутствия примесей. Также этот метод используют для рафинирования металлов (то есть их очистки) и защиты от коррозии. |
Фактчек
- Электролиз — это окислительно-восстановительная реакция, протекающая на электродах при прохождении электрического тока.
- Его проводят в специальном приборе — электролизере, в который помещают раствор или расплав вещества. В них опускаются специальные стержни — электроды.
- Особенность электролиза растворов заключается в том, что в реакции могут участвовать молекулы воды — это зависит от состава вещества.
- Особенность электролиза расплавов заключается в том, что там нет никакого растворителя, то есть вещество раскладывается на то, из чего состоит.
Проверь себя
Задание 1.
Сколько электродов используется в реакциях электролиза?
- 1
- 2
- 3
- 4
Задание 2.
Какое вещество выделяется на катоде при электролизе раствора хлорида меди?
- медь
- водород
- хлор
- кислород
Задание 3.
Какое вещество выделяется на аноде при электролизе раствора фторида калия?
- калий
- водород
- фтор
- кислород
Задание 4.
Электролиз расплава бромида калия приводит к образованию:
- водорода и галогена
- металла и галогена
- металла и кислорода
- водорода и кислорода
Ответы: 1. — 2; 2. — 1; 3. — 4; 4. — 2.


 к списку статей
к списку статей




