Элементы VIА группы. Кислород
На этой странице вы узнаете
- Почему без кислорода невозможна жизнь?
- Зачем нашей планете нужен озоновый слой?
- Чем полезна перекись водорода?
В каждом механизме есть незаменимая деталь, без которой ничего работать не будет. Кислород является такой деталью во многих сложных биохимических реакциях. В этой статье мы узнаем, кто может ограбить кислород, чем знаменит озон и под кого подстраивается перекись водорода.
Кислород как химический элемент
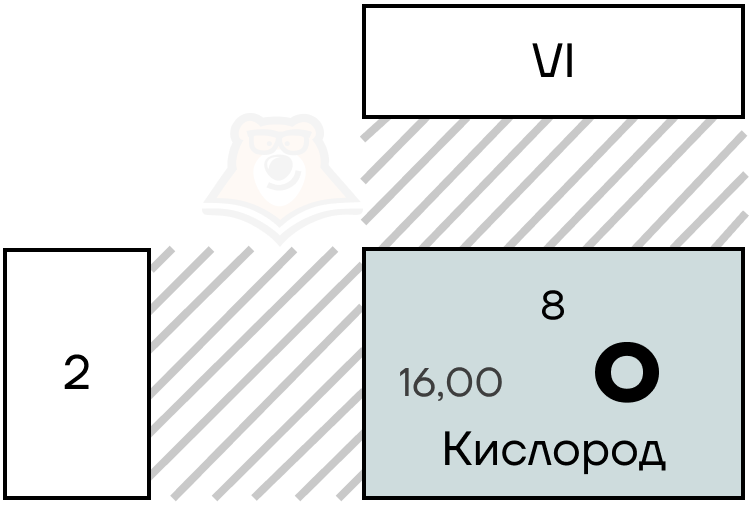
Кислород — элемент VIA-группы 2-ого периода таблицы Менделеева.
Кислород расположен в VIA-группе. При этом на его внешнем слое находятся шесть электронов, два из которых неспаренные.
За счет этих неспаренных электронов кислород обычно образует в соединениях две химические связи, то есть имеет валентность II.
Благодаря спаренным электронам на p-подуровне, он также может образовывать третью химическую связь в соединениях по донорно-акцепторному механизму, о чем подробнее можно прочитать в статье «Химическая связь».
Такое происходит, например, в молекуле угарного газа CO.
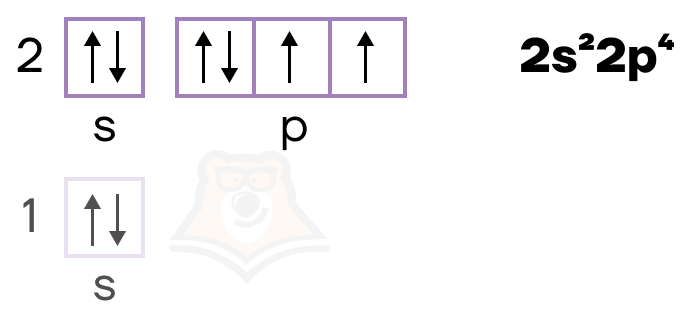
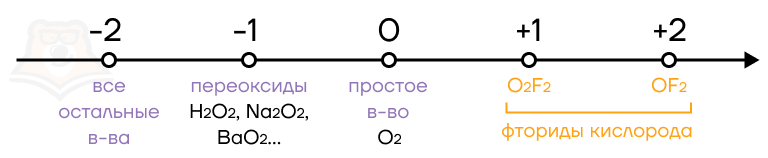
Кислород является вторым по электроотрицательности элементом после фтора. Следовательно, положительные степени окисления (+1, +2) для кислорода характерны только в соединениях с фтором — только фтор способен его “ограбить”.
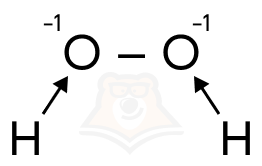
Степень окисления -1 он проявляет в пероксидах, за счет наличия ковалентной неполярной связи (кислородного мостика) между атомами кислорода. А наиболее характерной для него является низшая степень окисления -2, так как он постоянно кого-то “грабит”, отнимая при этом отрицательно заряженные электроны. Для него она условно постоянная.
Итоговый набор степеней окисления кислорода: -2,-1, 0,+1,+2.
| Почему без кислорода невозможна жизнь? Главная биологическая роль кислорода — поддержка дыхания живых организмов. Он принимает участие в обменных процессах, в разложении и усвояемости различных питательных веществ. Кислород является самым распространенным элементом на Земле. |
Все его химические свойства кислорода основаны на том, что благодаря высокой электроотрицательности, он является сильнейшим окислителем.
Химические свойства кислорода
- Реакция с неметаллами.
Кислород не взаимодействует с галогенами, кроме фтора, ввиду близких значений электроотрицательности. Условно говоря, они не могут решить, кто в реакции будет окислителем, а кто — восстановителем.
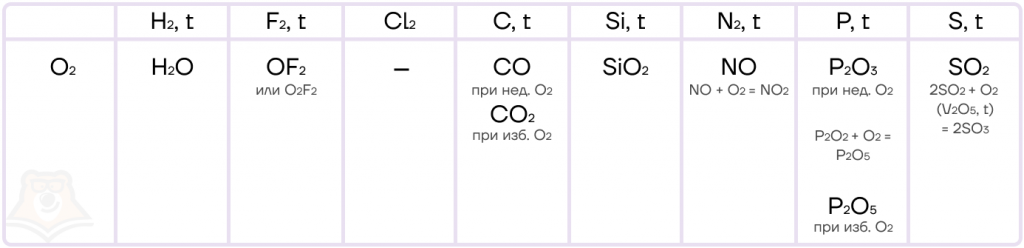
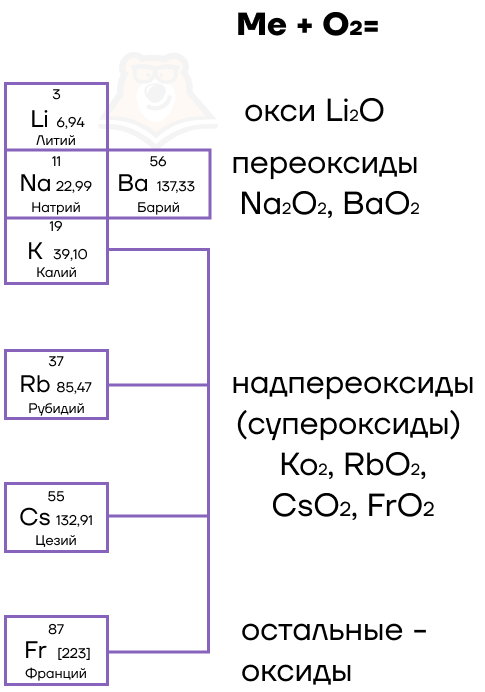
- Как кислород реагирует с металлами?
В реакциях с металлами кислород обычно образует оксиды, исключениями здесь являются щелочные металлы и щелочно-земельный барий:
- литий, как и подавляющее большинство металлов, образует оксид Li2O;
- натрий и барий образуют пероксиды Na2O2, BaO2;
- калий и все нижестоящие металлы — надпероксиды/супероксиды (KO2).
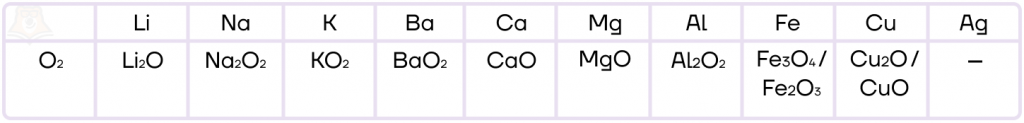
Кислород неспособен окислить неактивные металлы (начиная с серебра в ряду активности).
- Реакции со сложными веществами.
Кислород окисляет многие сложные вещества:
- некоторые оксиды;
- другие бинарные соединения — карбиды, силициды, гидриды и проч.;
- некоторые соли — нитриты, сульфиты и проч.
Эти реакции не нужно заучивать, необходимо просто понять принцип протекания каждой из них: кислород как окислитель будет понижать степень окисления до своей условно-постоянной -2, а восстановитель — повышать.
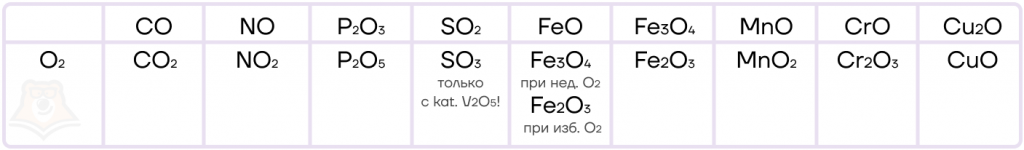
Как видно из таблицы ниже, восстановитель обычно повышает степень окисления в ближайшую возможную для него:

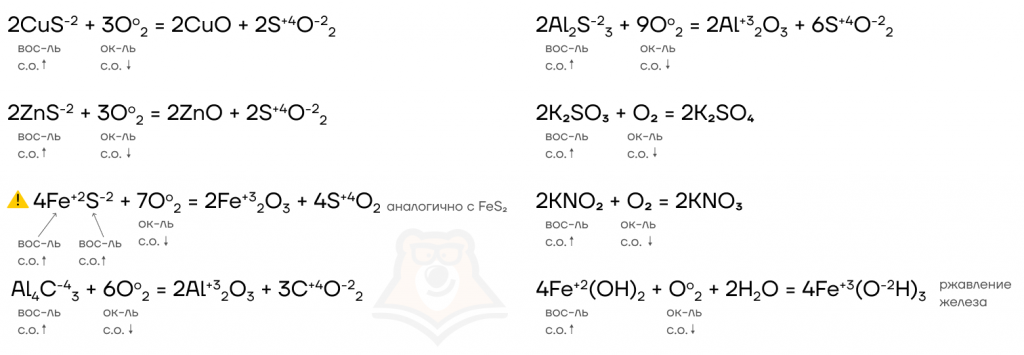
В органической химии мы постоянно будем встречаться с такими реакциями, как реакции горения веществ в кислороде. Они представляют собой окислительно-восстановительную реакцию (ОВР), где окислителем является кислород, а восстановителем — органическое вещество.
Кислород, как сильный окислитель, окисляет углерод в составе органических веществ, сразу до +4, поэтому в таких реакциях выделяется CO2:
Озон
В атмосфере есть озоновый слой, который образован аллотропной модификацией кислорода — озоном. По физическим свойствам озон O3 представляет собой ядовитый голубой газ с резким специфическим запахом свежести после грозы.
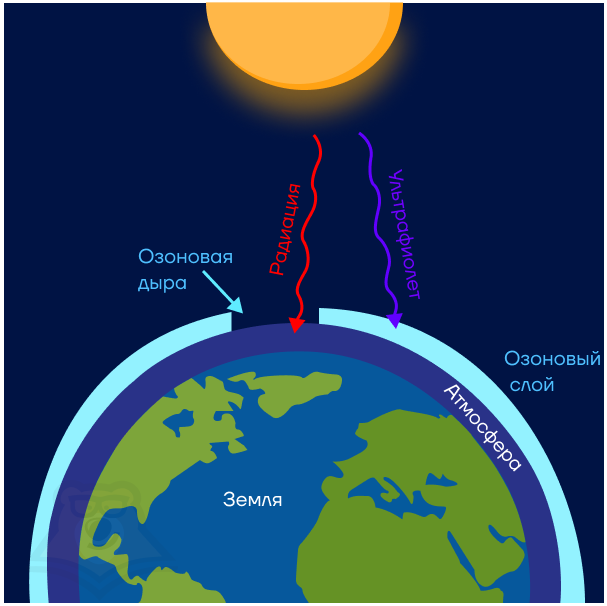
| Зачем нашей планете нужен озоновый слой? Именно озоновый слой защищает Землю от опасного ультрафиолетового излучения. Его разрушение способно причинить ощутимый ущерб для жизни на нашей планете. |
Озон образуется во время разрядов молнии, то есть под действием электрического тока, из молекул кислорода. Реакция выглядит следующим образом:

Как и кислород, благодаря высокой электроотрицательности, озон проявляет сильные окислительные свойства — еще более сильные, чем у кислорода — а значит, он способен вступать в ОВР с восстановителями. В ОВР он всегда превращается в кислород O2:

Перекись водорода и пероксиды
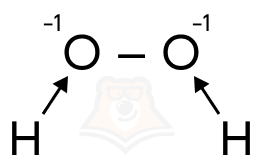
Возможно, в вашей домашней аптечке есть флакончик с раствором перекиси водорода, который используется при обработке ран. Что она из себя представляет?
В целом, пероксиды — соединения с кислородным мостиком, в которых кислород проявляет степень окисления -1. Примеры: H2O2, Na2O2, BaO2 и проч.
Пероксид водорода (или перекись водорода) — бесцветная жидкость с металлическим вкусом, концентрированные растворы которой безопасны.
| Чем полезна перекись водорода? Разбавленные растворы перекиси водорода широко применяются в медицине для очищения и обеззараживания ран. При нагревании и на свету перекись водорода способна разлагаться на воду и кислород, поэтому на ее упаковке всегда написано «хранить в холодном, темном, защищенном от детей месте». |

За счет промежуточной степени окисления кислорода в пероксидах (-1) в ОВР они могут проявлять:
- роль окислителей — кислород при этом понижает степень окисления до -2;
- роль восстановителей — в этом случае кислород повышает степень окисления до нуля.
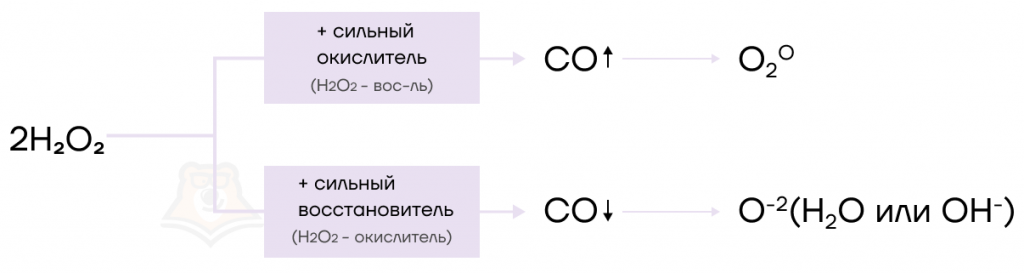
Понять, в роли кого в реакции выступает пероксид, можно по реагентам, с которыми он взаимодействует — пероксид всегда “подстраивается” под того, с кем реагирует:
- если в реакцию с пероксидом вступает типичный восстановитель, пероксид выступает в роли окислителя;
- если в реакцию с пероксидом вступает типичный восстановитель, пероксид выступает в роли окислителя.
| Чаще всего пероксиды являются в ОВР окислителями. |

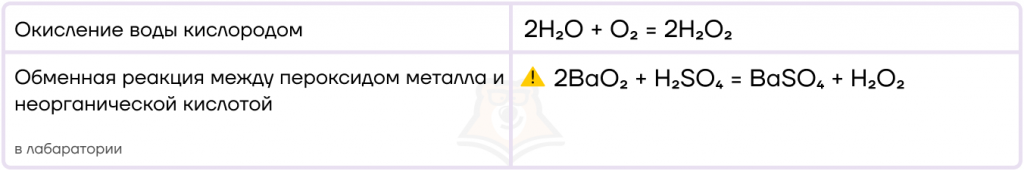
Получение перекиси водорода
Существует два основных способа получения перекиси водорода: окисление воды кислородом и реакция между пероксидом металла и какой-нибудь неорганической кислотой.
Фактчек
- Кислород — “элемент жизни”, элемент VIA-группы 2-ого периода, образует двухатомную молекулу O2.
- Степени окисления кислорода: -2,-1, 0,+1,+2.
- Кислород — сильный окислитель, реагирует с большинством металлов и неметаллов, также с некоторыми сложными соединениями.
- Аллотропная модификация кислорода — озон — образует озоновый слой, является более сильным окислителем, чем кислород.
- Пероксиды — соединения с кислородным мостиком, в которых кислород проявляет степень окисления -1; проявляют окислительно-восстановительную двойственность.
Проверь себя
Задание 1.
Сколько неспаренных электронов находится у атома кислорода в основном электронном состоянии?
- 1 электрон
- 2 электрона
- 3 электрона
- 6 электронов
Задание 2.
С каким веществом не реагирует кислород?
- углерод
- фтор
- хлор
- азот
Задание 3.
При реакции лития с кислородом образуется:
- оксид лития
- пероксид лития
- супероксид лития
- озонид лития
Задание 4.
Перекись водорода в реакции с аммиаком проявляет:
- окислительные свойства
- восстановительные свойства
- амфотерные свойства
- реакция не идет
Ответы: 1. — 2; 2. — 3; 3. — 1; 4. — 1.


 к списку статей
к списку статей





