Химическая реакция
На этой странице вы узнаете
- Что общего у философов, алхимиков и химиков?
- Если у человека противоположные реакции — злость и радость, то что же тогда будет у химических веществ?
- Кто открыл катализаторы?
У человека насчитывается огромное количество различных реакций — радость, гнев, тоска и так далее. Некоторые из них похожи друг на друга, некоторые полностью противоположны. Точно так же и в химии. От «характера» веществ, между прочим, зависит тип реакции.
Гомогенные и гетерогенные химические реакции
Большинство процессов, протекающих в окружающем нас мире, можно разделить на физические и химические явления, и очень важно уметь отличать их друг от друга.
Физическое явление — изменение свойств физических тел.
К физическим явлениям будут относиться изменения:
- агрегатного состояния;
- размера или формы тела;
- объема;
- положения тел относительно друг друга и т.д.
Химические явления включают в себя химические реакции. Давайте узнаем, что это такое.
Химическая реакция — процесс, в течение которого одни вещества превращаются в другие.
В отличие от физических явлений, в которых происходит изменение свойств одного и того же вещества, химические явления характеризуются превращением одних веществ в другие, при этом образовавшиеся соединения обладают новыми свойствами.
Например, плавление свечи будет физическим явлением, а горение фитиля свечи — химическим. Также закипание воды будет физическим явлением, а образование воды — химическим явлением, а именно химической реакцией.
2Н2 + О2 = 2Н2О

Перед непосредственным изучением химических реакций разберем необходимый для понимания темы закон — Закон сохранения массы.
Закон сохранения массы гласит, что масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
Можно копнуть чуть глубже и перейти на атомы.
Например, если в реакции есть водород, то можно сказать, что масса атомов водорода в левой части реакции (слева от знака равно) равна массе атомов водорода в правой части (справа от равно).
Знание этого закона помогает нам составлять уравнения реакций, но этот момент разберем чуть позже.
| Что общего у философов, алхимиков и химиков? На первый взгляд, у древних философов, средневековых алхимиков и современных химиков не так много общего. Однако все эти люди внесли свой вклад в открытие Закона сохранения массы. Впервые закон сформулировал древнегреческий философ Эмпедокл: «Ничто не может произойти из ничего, и никак не может то, что есть, уничтожиться». По мере развития алхимии, а затем и химии, данный закон только подтверждался на практике. А современная формулировка закона была создана Михаилом Васильевичем Ломоносовым. |

А сейчас мы разберем, какие реакции вообще бывают в химии. Химия делится на органическую (химия углерода) и неорганическую (химия всех химических элементов и их соединений). Вот и реакции в химии решили делить тоже на две большие группы.
Какие реакции бывают в неорганике? Давайте разбираться.
Реакции в неорганике
I. Типы реакций по числу и составу исходных веществ и продуктов реакции
| Если у человека противоположные реакции — злость и радость, то что же тогда будет у химических веществ? Реакции в химическом мире тоже противоположны. Когда в коллективе между людьми дружба, все испытывают радость и удовлетворенность, что приводит к объединению людей — как реакции соединения в химии. А когда в коллективе разлад, то у всех членов этого коллектива плохое настроение, все испытывают злость, что ведет к распаду коллектива — как реакции разложения в химии. |

- Реакции соединения
А + В = С
Суть реакции хорошо описывается своим названием — изначально было несколько веществ, их сложили и получилось одно.

Можем провести ассоциацию с пазлами. То есть мы соединяем пазлы и получаем одно «вещество».
Пример: 4Na + O2 = 2Na2O
Давайте разберемся, как мы получили это уравнение.
Опираясь на знание химических свойств элементов, мы можем сказать, что при взаимодействии металла (натрия) с неметаллом (кислородом) образуется оксид Na2O.
Теперь на сцену выходит Закон сохранения массы.
Если мы запишем реакцию как Na + O2 = Na2O, то у нас массы атомов до и после реакции будут неравные: слева один натрий и два кислорода, а справа будет два натрия и один кислород. Нам нужно уравнять реакцию так, чтобы количество каждого элемента справа и слева было равным, а для этого используем коэффициенты — цифры, отражающие, сколько частиц вещества вступило в реакцию.
Слева два кислорода, справа тоже должно быть два — перед оксидом появляется коэффициент 2.
Na + O2 = 2Na2O
Теперь у нас справа 4 натрия, а слева 1, перед металлом возникает 4.
4Na + O2 = 2Na2O
Проверяем: справа и слева 4 натрия и 2 кислорода, все верно!
- Реакции разложения
АВ = А + В
Данная реакция противоположна предыдущей — было одно вещество, из которого образовалось несколько веществ. Причем в продуктах могут быть как простые вещества, так и сложные.

Это как в случае с матрешкой. Внутри одной матрешки много маленьких. То есть, когда мы разбираем одну большую матрешку, мы получаем много маленьких.
Пример: Сa(OH)2 = CaO + H2O
- Реакции замещения
АВ + С = АС + В
До реакции было одно простое вещество и одно сложное, после реакции мы получаем другое простое вещество и другое сложное.
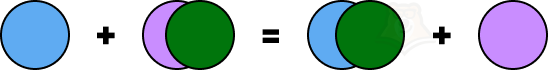
Так и в жизни людей иногда происходят замещения. Например, в любом рабочем коллективе есть директор (B). У директора самая большая зарплата (А). У директора есть помощник — заместитель директора (С), который тоже хочет получать столько денег. И иногда так случается, что заместитель (С) вытесняет директора (В), становится самым главным в компании и получает свою заветную огромную зарплату (А).
Пример: CuSO4 + Fe = FeSO4 + Cu
- Реакции обмена
АВ + CD = AD + CB
Данная реакция похожа на предыдущую, но немного сложнее: до реакции было два сложных вещества, после реакции стало два других сложных вещества.

В человеческой жизни может произойти следующая ситуация. Теперь у нас два директора (А и С), которые имеют два разных бизнеса (B и D соответственно). Так случилось, что обоим владельцам надоел их бизнес, поэтому они решили заключить сделку и обменяться своими бизнесами. Теперь директор А владеет бизнесом D, а директор С владеет бизнесом B.
Пример: AgF + NaCl = AgCl + NaF
II. Типы реакций по обратимости
По обратимости мы можем разделить все реакции на обратимые и необратимые.
- Обратимые
По названию можно догадаться, что такие реакции протекают в двух направлениях: прямом и обратном. То есть из реагентов мы можем получить продукты, а из продуктов — реагенты. Тот самый наш пазл можно собрать, разобрать, и заново собрать.
Пример: N2 + 3H2 ⇆ 2NH3
- Необратимые
По названию можно догадаться, что такие реакции протекают только в одном направлении — прямом. То есть из реагентов мы можем получить продукты, а из продуктов реагенты мы получить не сможем. Если разбить фарфоровую чашку, обратно уже не соберешь.
Как не путать и верно определять обратима реакция или нет?
Если в продуктах есть слабый электролит, осадок, газ или выделяется очень много тепла, то чаще всего в таких случаях реакция будет необратима.
Пример: NaOH + HCl = NaCl + H2O
III. Типы реакций по количеству фаз
Все реакции можно разделить по количеству фаз на гомогенные и гетерогенные. Изучим данные группы по-отдельности.
Вспомним, что такое фаза.
Фаза — совокупность всех частей системы, обладающих одинаковыми физическими и химическими свойствами во всех точках, и отделенная от других частей системы поверхностью (границей) раздела.

- Гомогенные реакции
Реагенты чаще всего находятся в одном и том же агрегатном состоянии, при этом граница раздела фаз отсутствует.
Пример: NaOH (р-р) + CH3COOH (р-р) = CH3COONa (р-р) + H2O (р-р), то есть в данном случае жидкость + жидкость.
- Гетерогенные реакции
Реагенты чаще всего находятся в разных агрегатных состояниях или друг с другом взаимодействуют две плохо смешивающиеся жидкости, реакция проходит на границе раздела фаз.
Примеры: Zn (тв.) + 2HCl (р-р) = ZnCl2 (р-р) + H2 (газ), то есть в данном случае твердое вещество + жидкость.
IV. Типы реакций по тепловому эффекту
- Экзотермические реакции
В результате такой реакции выделяется тепло (Q), поэтому также встречается обозначение экзотермических реакций через +Q. Сюда относят большую часть реакций соединения, замещения и обмена, а также горение.

Экзотермические реакции можно сравнить с экстравертами — они активны и им хочется всем делиться с миром
Пример: 2Mg + O2 = 2MgO + Q
Реакция N2 + O2 ⇄ 2NO – Q является исключением. Несмотря на то, что это реакция соединения, тепло выделяться не будет.

Также исключениями будут:
C + CO2 = 2CO — Q
H2 + I2 = 2HI — Q
3O2 = 2O3 — Q
- Эндотермические
Такие реакции протекают с поглощением тепла (–Q), сюда относится большая часть реакций разложения.

Эндотермические реакции можно сравнить с интровертами — они сконцентрированы на своем внутреннем мире и не особо стремятся делиться им с окружающим миром.
Пример: CaCO3 = CaO + CO2 – Q

Здесь тоже важно запомнить парочку исключений:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O + Q
2HI = Н2 + I2 + Q
2NO = N2 +O2 +Q
V. Типы реакций по наличию катализатора
- Каталитические
По названию можно догадаться, что такие реакции протекают при катализаторе — веществе, которое увеличивает скорость реакции.

Список каталитических реакций, встречающихся на экзамене:
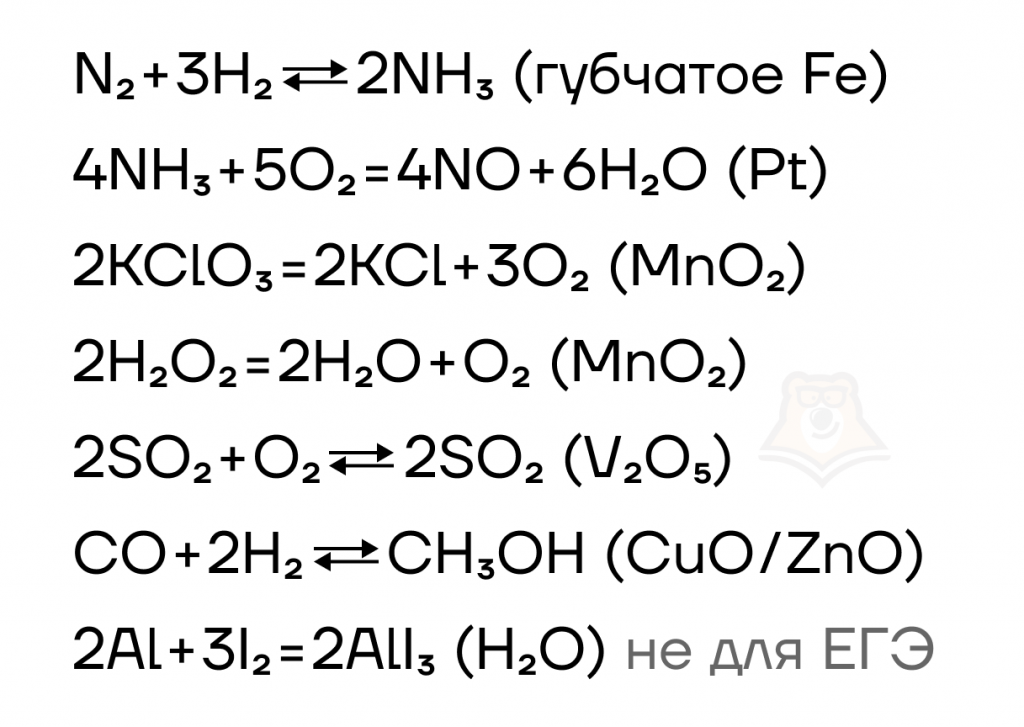
| Кто открыл катализаторы? Большинство широко известных катализаторов были открыты случайно, предсказывать их теоретически мы до сих пор не можем. Однако впервые термин «катализатор» ввел Берцелиус. В 1835 шведский химик установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает. |
Все каталитические реакции можно поделить на реакции гетерогенного и гомогенного катализа, также можно выделить ферментативный катализ.
Тип катализа
| Гомогенный | Гетерогенный | Ферментативный |
| Реагенты и катализатор находятся в одной фазе. | Реагенты и катализатор находятся в разных фазах. Реакция происходит на поверхности катализатора. | Роль катализатора играет белок. |
| SO2 + O2 = SO3, реагенты газообразные,катализатор V2O5 — твердое вещество | Гидролиз дисахаридов в присутствии кислот | Реакции, протекающие внутри человеческого организма |
- Автокатализ
Реакция автокатализа похожа на обычную каталитическую, однако имеет и свои тонкости. Для начала определимся, что же представляет из себя автокатализ.
Автокатализ — ускорение химической реакции одним из ее продуктов, являющимся катализатором превращения исходных веществ.
В отличие от обычной каталитической реакции, в рамках которой изменение количества катализатора не происходит, в автокаталитической реакции количество катализатора изменяется в ходе протекания реакции и образования продукта.
Примером автокатализа является окисление щавелевой кислоты перманганатом. Катализирующим действием тут обладает продукт реакции — ион двухвалентного марганца.
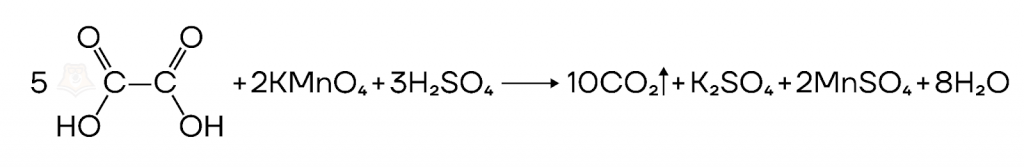
- Некаталитические
Это реакции, которые протекают без использования катализатора.
Пример: 2KOH + MgCl2 = Mg(OH)2 + 2KCl
VI. Типы реакций по изменению степеней окисления
- Окислительно-восстановительные (ОВР)
Это реакции, протекающие с изменением степеней окисления атомов элементов, входящих в состав реагирующих веществ. Также об этих реакциях можно почитать в статье «Окислительно-восстановительные реакции».
Пример: KMn+7O4 + HCl— = KCl + Mn+2Cl2 + Cl02 + H2O
- Не окислительно-восстановительные (не ОВР)
Это реакции, протекающие без изменения степени окисления.
Пример: BaCl2 + H2SO4 = BaSO4 + 2HCl
Лайфхак по определению ОВР: если в реакции есть простое вещество в реагентах или в продуктах, значит, это точно ОВР.
Закрепим знания о типах реакции в неорганике, решив задачу, которая может встретиться в №17 ЕГЭ по химии.
Из предложенного перечня выберите все схемы каталитических реакций.
Zn + KOH + H₂O = K₂[Zn(OH)₄] + H₂KOH + HCl = KCl + H2OСu2O + 2HCl = H2O + 2CuClCu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2OKMnO4 + (NH4)2SO3 = MnO2 + (NH4)2SO4 + K2SO4 + NH3 + H2O
Запишите номера выбранных ответов в порядке возрастания.
Решение. Посчитаем степени окисления для всех элементов во всех реакциях.
1) Zn0 + K+O-2H+ + H+₂O-2 = K+₂[Zn+2(O-2H+)₄] + H0₂
Степени окисления цинка и водорода меняются, это ОВР.
2) K+O-2H+ + H+Cl— = K+Cl— + H+₂O-2
Степени окисления не меняются, не ОВР.
3) Сu+2O-2 + 2H+Cl = H+₂O-2 + 2Cu+Cl—
Степени окисления не меняются, не ОВР.
4) Сu+2O-2 + 3H+2S+6O-24 = 2Cu+2S+6O-24 + S+4O-22 + 3H+₂O-2
Степени окисления меди и серы меняются, это ОВР.
5) K+Mn+7O-24 + (N-3H+4)2S+4O-23 = Mn+4O-22 + (N-3H+4)2S+6O-24 +
K+2S+6O-24 + N-3H+3 + H+₂O-2
Степени окисления марганца и серы меняются, это ОВР.
Ответ: 145
С реакциями в неорганической химии разобрались, теперь рассмотрим реакции в органической химии.
Реакции в органике
- Типы реакций по числу и составу исходных веществ и продуктов реакции
Здесь все похоже на неорганику, однако есть несколько различий. О них мы сейчас и поговорим.
- Реакции присоединения (в неорганике было соединение)
В данной реакции происходит присоединение одного вещества к другому.
А + В = С
Несмотря на то, что название видоизменилось, суть осталась та же. То есть изначально было несколько веществ, их сложили и получилось одно.
Представьте, что в парке гуляли два одиноких человека. Они случайно познакомились, подружились и теперь ни на шаг друг от друга не отходят — произошло присоединение одного человека к другому.
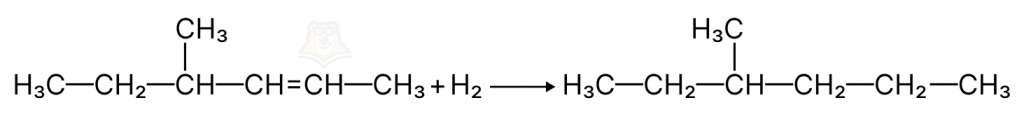
- Реакции отщепления (в неорганике было разложение)
В данной реакции происходит разделение одного вещества на несколько составляющих.
АВ = А + В
Опять суть реакции та же. То есть было одно вещество, из которого образовалось несколько веществ (причем в продуктах могут быть как простые вещества, так и сложные).
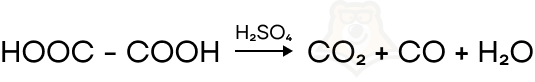
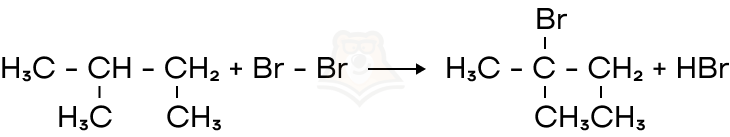
- Реакции замещения
В ходе реакции замещения один из радикалов замещается присоединяемым веществом.
АВ + С = АС + В
Название и суть остаются прежними. То есть до реакции было одно простое вещество и одно сложное, после реакции мы получаем тоже одно простое вещество и одно сложное.
- Реакции перегруппировки (изомеризация)
Что нужно знать про этот тип реакции? Здесь всегда один продукт и один реагент, причем состав вещества не меняется, а строение меняется.
Все как в жизни. Мы можем надеть на себя рубашку и застегнуть все пуговицы, а потом расстегнуть нижние пуговицы и завязать низ рубашки в узел. Рубашка осталась та же, но ее вид (строение) изменился.
- Реакции окисления
Это реакции, в которых количество связей С–Н уменьшается, но увеличивается количество связей С–О.
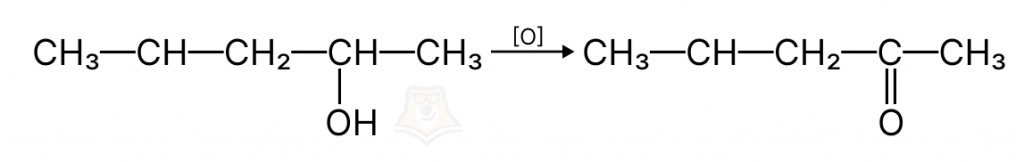
- Реакции полимеризации и поликонденсации
Происходит образование полимера из мономеров.
Полимеры — соединения, состоящие из множества повторяющихся одинаковых элементов.
Такие повторяющиеся элементы называются мономерами.
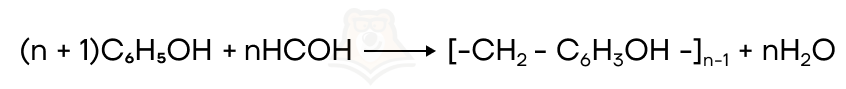
II. Типы реакций по механизму разрыва связей
Подробнее механизмы реакций в органической химии разбирались в статье «Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии».
В сегодняшней статье мы лишь кратко обобщим информацию.
- С гомолитическим (радикальным) механизмом
Это реакции, в которых разрыв связи происходит с образованием радикалов.
Радикалы — это частицы, которые содержат один или несколько неспаренных электронов во внешнем электронном слое.
К радикальным реакциям относятся реакции галогенирования, нитрования и сульфирования алканов, галогенирование гомологов бензола на свету, реакции полимеризации, а также реакция присоединения против правила Марковникова, где участвует перекись.

В неорганической химии также возможен данный тип реакций:
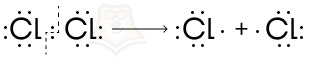
Попрактикуемся над определением типов реакций в органике, решив аналог №17 ЕГЭ по химии.
Задание. Из предложенного перечня выберите все схемы реакций, протекающих по радикальному механизму.
Запишите номера выбранных ответов в порядке возрастания.
Решение. Вспомним, что к радикальному механизму относятся реакции галогенирования, нитрования и сульфирования алканов, галогенирования гомологов бензола на свету.
Реакции с самим бензолом (3 и 5), а также с алкенами (1) нам не подойдут, остаются варианты 2 и 4.
Действительно, под 2 дано галогенирование (хлорирование) гомолога бензола, а под 4 галогенирование (хлорирование) алкана.
Ответ: 24
- С гетеролитическим (ионным) механизмом
В случае реализации ионного механизма в химической реакции происходит образование ионов в ходе гетеролитического разрыва связи: один из атомов забирает электронную пару себе, оставляя другой атом «ни с чем».
К ионным реакциям относятся гидрирование, галогенирование, гидратация, гидрогалогенирование алкенов, галогенирование, нитрование, сульфирование бензола и его гомологов в присутствии катализаторов, присоединение HCN или спирта к альдегидам или кетонам, а также реакция замещение на OH-группу в галогенпроизводном.
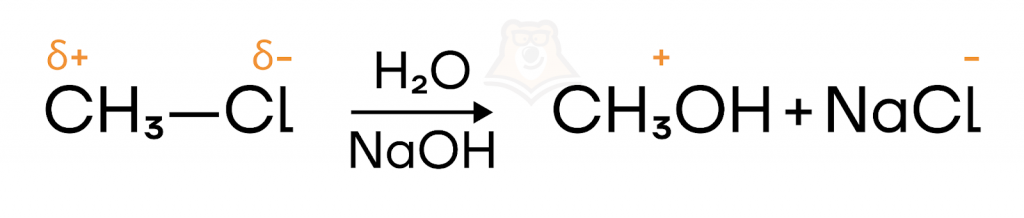
Подобные реакции встречаются также и в неорганической химии, например, диссоциация (распад) хлороводорода. Реакция происходит с образованием заряженных частиц — ионов.

Разобрав типы химических реакций, подведем итог и разберемся, каким же способом составлять уравнения реакций.
Общие принципы составления уравнения реакции
Для составления уравнения реакции следуем проверенному плану.
- Первым делом, исходя из свойств данных нам веществ, записываем продукты реакции.
- Смотрим, может быть, реакция не нуждается в уравнивании и массы атомов справа и слева равны.
Если нам повезло и массы одинаковые, то наша работа заканчивается здесь. - Если нам не повезло и есть различия между правой и левой частями, определяем, реакция какого типа нам дана: окислительно-восстановительная реакция (ОВР) или нет.
- Если дана ОВР, пытаемся прикинуть, сможем ли мы ее уравнять интуитивно. Пример того, как это делается, есть выше. Если уравнять таким методом не получится (много веществ и/или атомов), то составляем электронный баланс. О том, как это делается, подробно рассказано в статье «Окислительно-восстановительные реакции».
- Если дана не-ОВР, то уравниваем интуитивно, подстановкой. При уравнивании реакций любого типа водород уравниваем в конце, а по кислороду делаем проверку.
- Перепроверяем, все ли элементы имеют равные массы. Мы изучили важнейшую часть как органической, так и неорганической химии — типы реакций, а также получили навык составления уравнения химической реакции. Данная тема не ограничивается только типами реакций, важным параметром является также скорость химической реакции, о ней можно прочитать в статье «Скорость химической реакции».
Фактчек
- Существуют физические и химические явления, химические явления выражаются химическими реакциями.
- В неорганической химии выделяют следующие типы реакций: соединение, разложение, замещение и обмен.
- Также существует деление на обратимые и необратимые реакции; гомогенные и гетерогенные реакции; экзотермические и эндотермические реакции; каталитические и некаталитические; ОВР и не ОВР.
- В органической химии некоторые типы реакций отличаются от неорганических: вместо соединения — присоединение, вместо разложения — отщепление, отсутствуют реакции обмена, зато есть реакции изомеризации и поликонденсации. Также в органической химии можно разделить реакции на те, которые протекают по гомо- или гетеролитическим механизмам.
- Для составления уравнения реакции важно помнить определенный план.
Проверь себя
Задание 1.
К какому типу химической реакции относится следующая реакция?
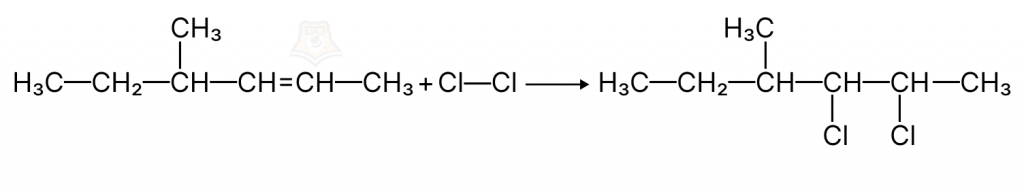
- Присоединение
- Соединение
- Замещение
- Обмен
Задание 2.
К какому типу химической реакции относится следующая реакция?
K2O + H2SO4 = K2SO4 + H2O
- ОВР
- Замещение
- Обмен
- Соединение
Задание 3.
К какому типу химической реакции относится следующая реакция?
2HgO (t) = 2Hg + O2
- Замещение
- Соединение
- Обмен
- Разложение
Задание 4.
К какому типу химической реакции относится следующая реакция?
2Na + 2H2O = 2NaOH + H2
- ОВР
- Соединение
- Обмен
- Разложение
Ответы: 1. — 1; 2. — 3; 3. — 4; 4. — 1.


 к списку статей
к списку статей





