Элементы VIIА группы. Галогены
На этой странице вы узнаете
- Есть ли галогены внутри нас?
- «Разрушительный» фтор: почему он такой особенный?
- «Йод» или «Иод»?
- Может ли вода гореть?
Фторированная паста, хлорные отбеливатели, медицинский иод — эти названия у всех на слуху. Галогены входят в состав многих довольно распространенных веществ, которые встречаются в повседневной жизни постоянно. Об этой группе химических элементов мы и поговорим в статье.
Общая характеристика VIIA группы
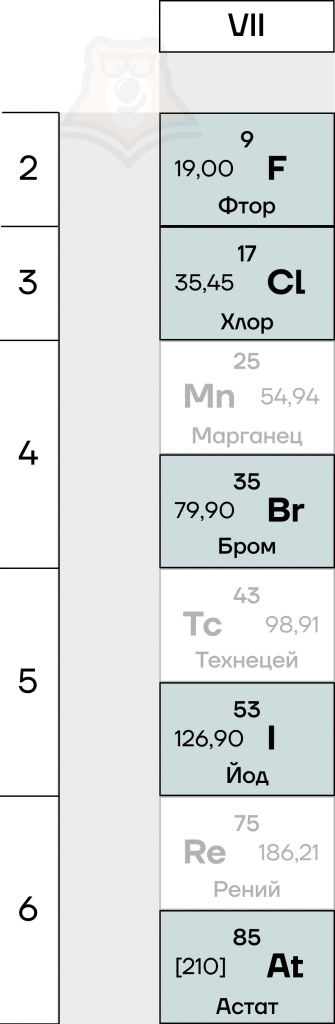
Сейчас мы разберемся, какие химические элементы относят к этой группе и каковы их особенности.
Галогены — это элементы VIIA-группы таблицы Менделеева:
- фтор F,
- хлор Cl,
- бром Br,
- иод I,
- астат At.
| Есть ли галогены внутри нас? В нашем организме содержится, например, иод. При массе тела человека 70 кг, в организме содержится около 12—20 мг иода. Он является важным микроэлементом для правильной работы щитовидной железы и поддержания других важных функций человеческого организма. На пузырьке с иодом в вашей домашней аптечке написано: «Для наружного применения». Это важно, и стоит строго соблюдать рекомендации! Но есть еще иод в таблетках для приема внутрь. Среднестатистическому человеку необходимо ежедневно потреблять до 0,15 мг иода, иначе он рискует заболеть гипотиреозом и другими болезнями. Не является рекомендацией, перед приемом проконсультируйтесь с врачом. |

Галогены образуют простые вещества в виде двухатомных молекул: F2, Cl2, Br2, I2. Выделяется в этом ряду астат — это радиоактивный элемент, который может быть получен только искусственным путем. Интересно, что астат — это наиболее редкий элемент среди всех, встречающихся на планете. Его суммарное содержание в земной коре в любой момент времени не может превышать одного грамма.
Запомним: все галогены — сильные окислители, относятся к неметаллам.
Рассмотрим свойства атомов галогенов снизу вверх в периодической системе, от астата к фтору.
| Уменьшаются: | Увеличиваются: |
| атомный радиус | электроотрицательность |
| металлические свойства | энергия ионизации |
| основные свойства | сродство к электрону |
| восстановительные свойства |
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns2np5. Для атомов галогенов в возбужденном электронном состоянии (кроме фтора) возможно распаривание одной или двух электронных пар и перенос неспаренных электронов на d-орбиталь.
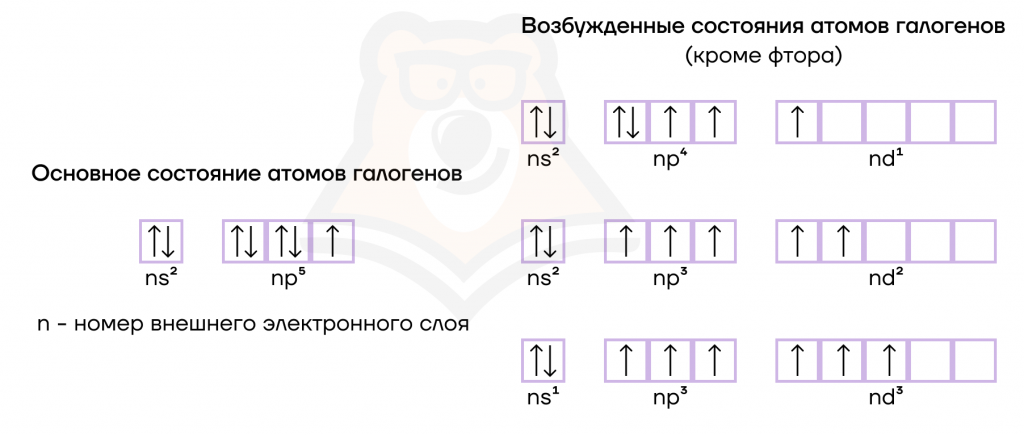
| «Разрушительный» фтор: почему он такой особенный? Фтор — уникальный элемент: его атом обладает самой высокой электроотрицательностью, из-за чего невероятно сильно притягивает к себе электроны, а значит, «отнять» их у фтора никто не может. Из этого вытекает то, что фтор не проявляет положительных степеней окисления, только отрицательную -1. |
А что с другими галогенами? У хлора, брома и иода все более прозаично:
- Высшая степень окисления равна номеру группы: +7.
- Низшая степень окисления определяется по формуле «номер группы − 8»: −1 .
- Наиболее характерные промежуточные степени окисления нечетные, как и номер группы, в которой они находятся.
Тогда вырисовывается следующий набор степеней окисления для галогенов:
- F: -1, 0;
- Cl, Br, I: -1, 0, +1, +3, +5, +7.
Галогены сильно различаются по физическим свойствам:
| Фтор | Желтоватый ядовитый газ с резким запахом. |  |
| Хлор | Желто-зеленый ядовитый газ с резким удушливым запахом. |  |
| Бром | Бурая зловонная жидкость. |  |
| Иод | Черно-серые кристаллы с фиолетовым металлическим блеском. При нагревании способен возгоняться (сублимироваться) с образованием паров иода фиолетового цвета. |  |
| «Йод» или «Иод»? Возможно, этот вопрос интересовал и вас. Можно использовать и первое, и второе название. В середине XX века Международным союзом теоретической и прикладной химии было принято название «Иод» и символ обозначения — I. Однако, в быту, биологии и медицине остается уместным использование старого названия «Йод». Интересно, что впервые получил иод в 1811 году Бернар Куртуа, а название ему дал в 1814 году Гей-Люссак. Это название происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с фиолетовым цветом пара, который наблюдал французский химик Бернар Куртуа при получении иода нагреванием золы морских водорослей с концентрированной серной кислотой. |


Химические свойства галогенов
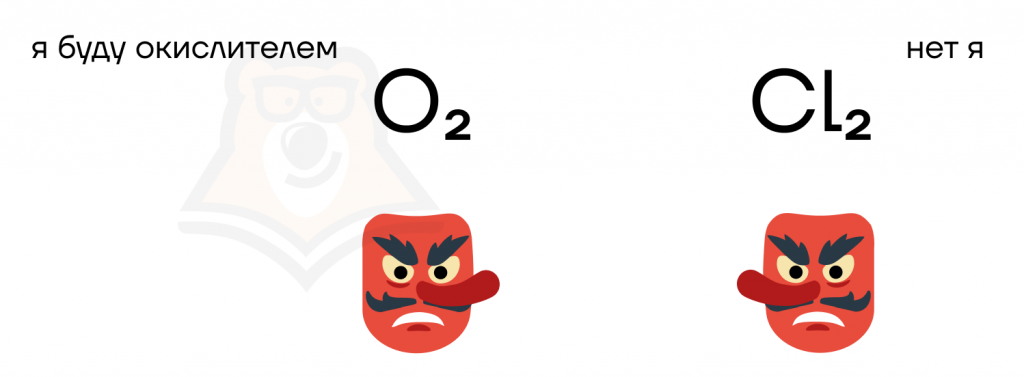
У всех галогенов достаточно высокие значения электроотрицательности (ЭО) на фоне других элементов. К чему это ведет? К тому, что все галогены являются крайне активными веществами, при этом их активность растет к фтору:

В реакциях из-за высоких ЭО они обычно играют роль окислителей («воров электронов»). Фтор при этом является самым сильным окислителем из них, а иод — самым слабым.
- Реакция с металлами.
Галогены — неметаллы, поэтому по «закону противоположностей» они будут взаимодействовать с металлами, причем из-за своей активности практически со всеми. Название «галогены» можно перевести как «рождающие соли». Это объясняется тем, что в реакциях с металлами галогены образуют соли.
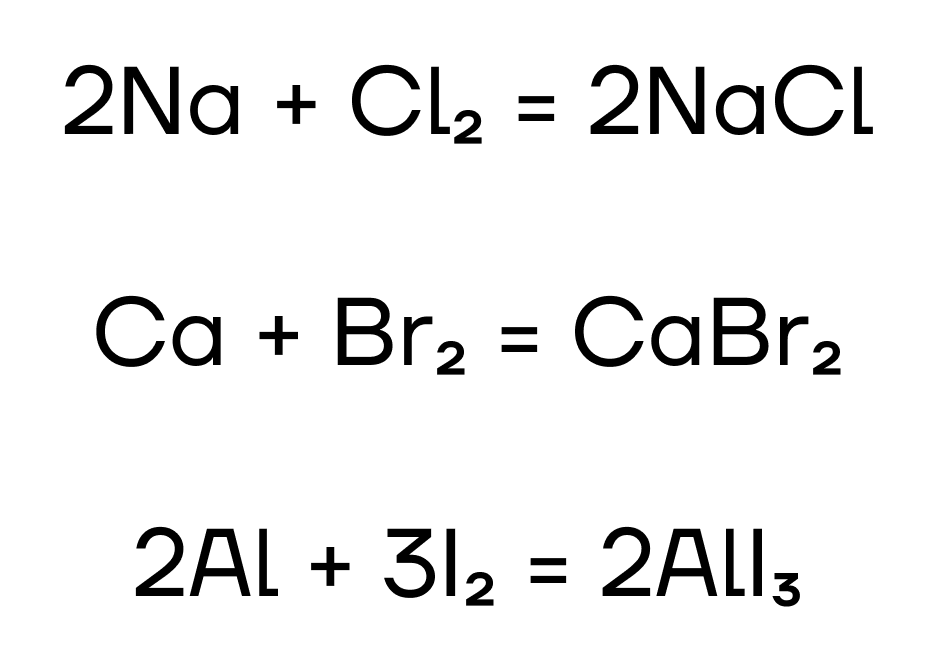

- Реакции с неметаллами.
Из-за своей бешеной активности фтор реагирует практически со всеми неметаллами, в том числе с другими галогенами, тоже имеющими очень высокую химическую активность.
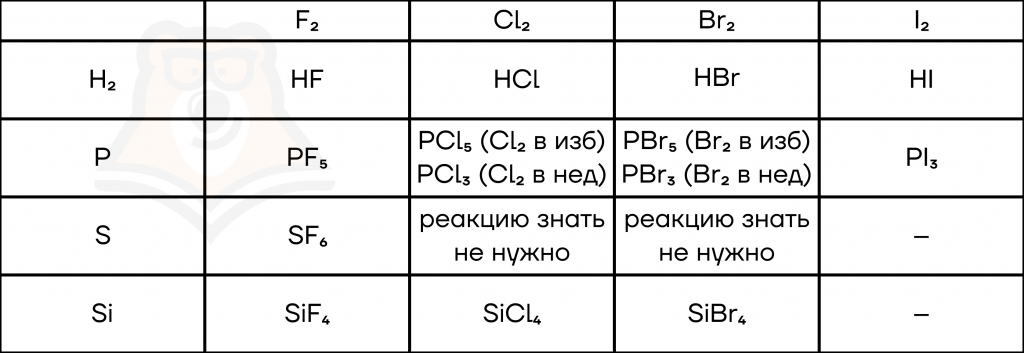
Обратим внимание на реакции галогенов с фосфором. Фосфор энергично взаимодействует с галогенами, при этом может соединяться как с тремя, так и с пятью атомами галогена. Это зависит от следующих факторов:
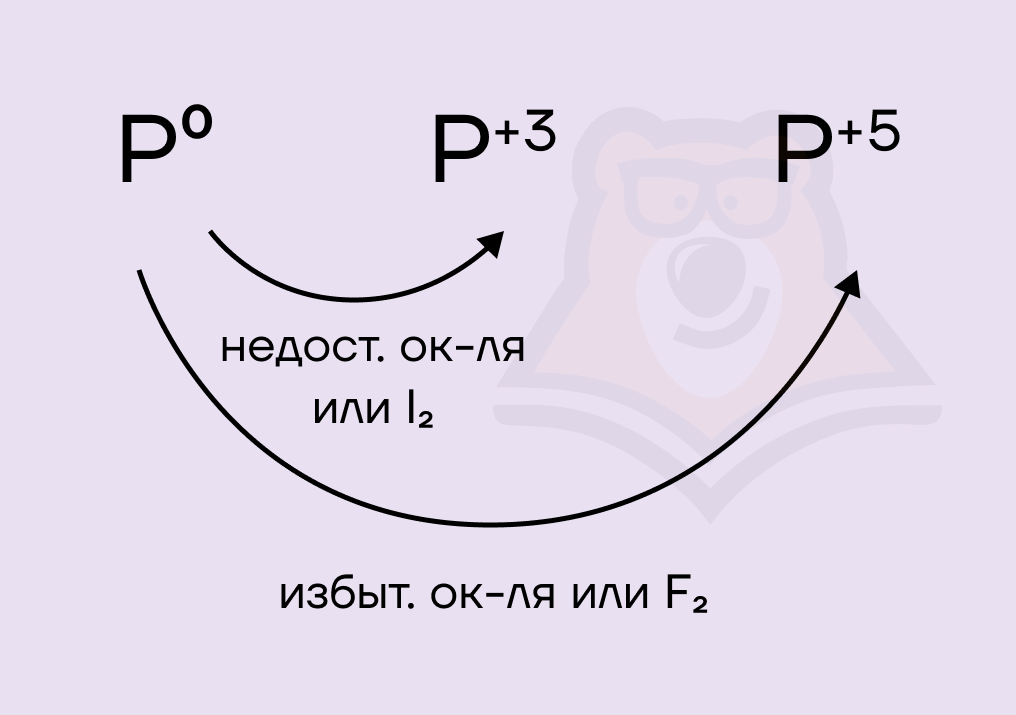
- При избытке окислителя или воздействии такого сильного окислителя, как F2, фосфор окисляется по максимуму до +5.
- При недостатке окислителя или при воздействии такого слабого окислителя, как I2, фосфор окисляется только до +3.
Иод из-за своей меньшей, по сравнению с другими галогенами, активности не взаимодействует с кремнием и серой.
Все галогены (кроме фтора) не взаимодействуют напрямую с кислородом и азотом ввиду близких значений электроотрицательности (то есть «не могут решить», кто в реакции будет окислителем, а кто — восстановителем). По этой же причине они не реагируют с углеродом.
- Реакции с водой.
Малоактивный иод с водой не взаимодействует в принципе. А как себя ведут хлор с бромом?
У них проявляется интересное свойство: они в воде диспропорционируют: так как вода не обладает выраженными окислительными или восстановительными свойствами, роли и окислителя, и восстановителя приходится брать на себя хлору и брому, поэтому они и повышают, и понижают степень окисления самостоятельно:
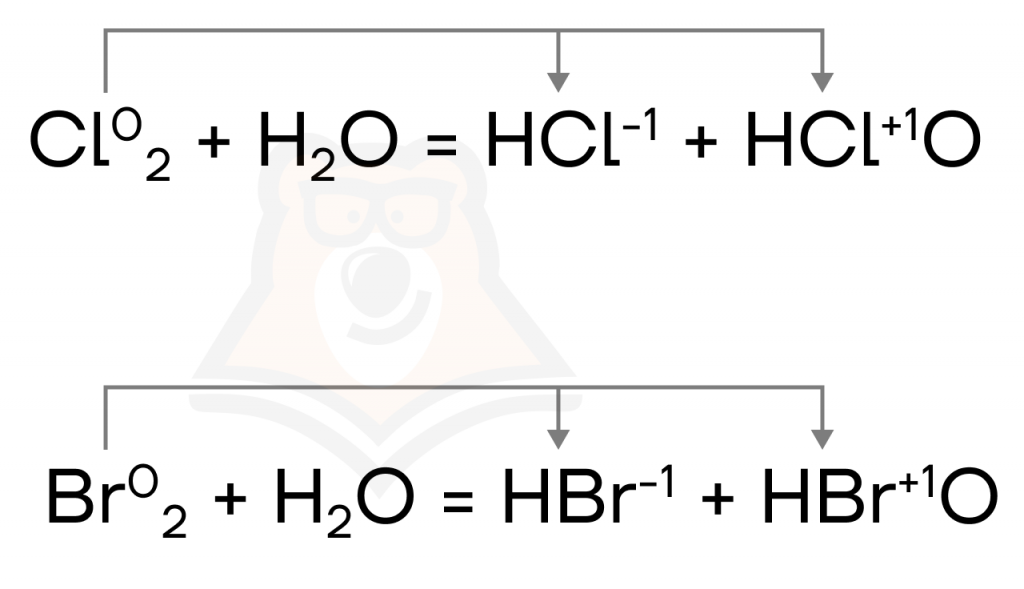
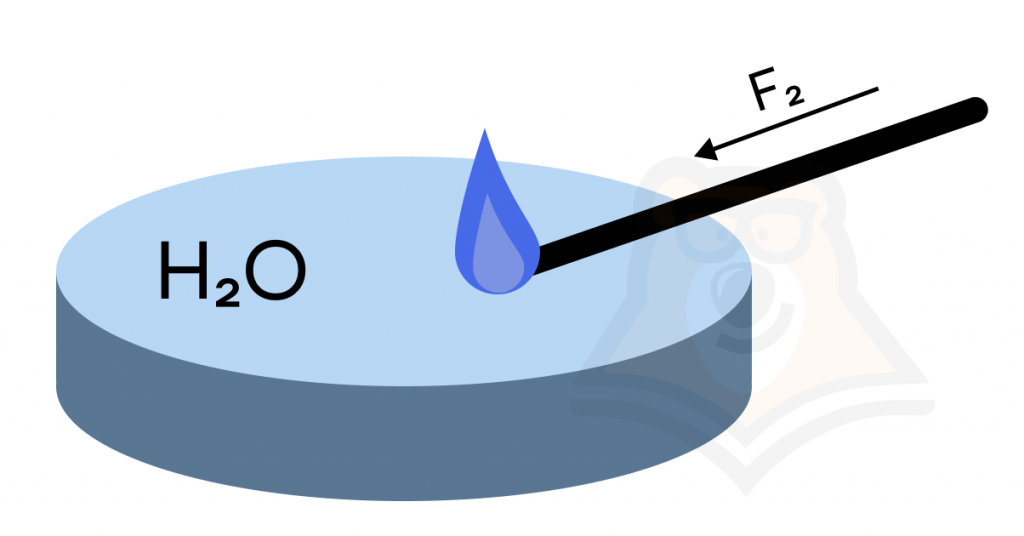
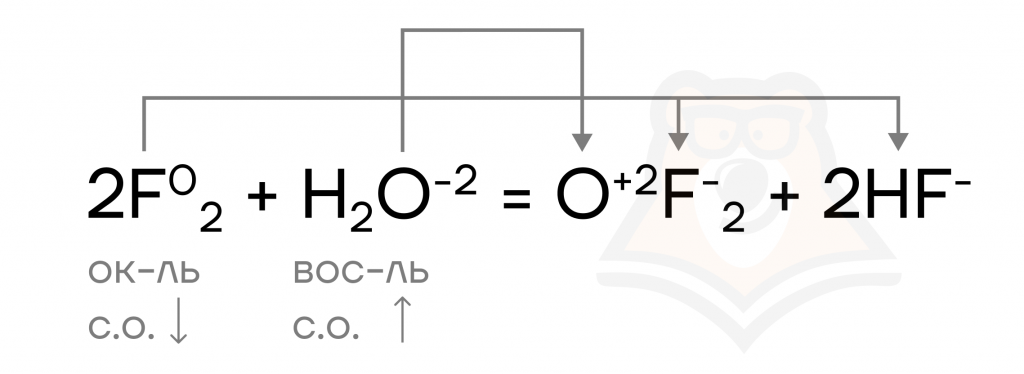
Единственный, кто может заставить воду «поработать», — это фтор. В реакции с ним воде приходится быть восстановителем («жертвой»).
| Может ли вода гореть? Интересный момент: вода в атмосфере фтора горит синим пламенем. Все потому, что в ее состав входит водород — «горючее» и кислород — «поджигатель». Такое взаимодействие может привести даже к взрыву. |
- Реакции со щелочами.
Образом, аналогичным реакциям с водой, галогены взаимодействуют и со щелочами, но еще более интересно. При разной температуре раствора реакция протекает по-разному, в холодном растворе щелочи образуется гипохлорит, а в горячем — хлорат:
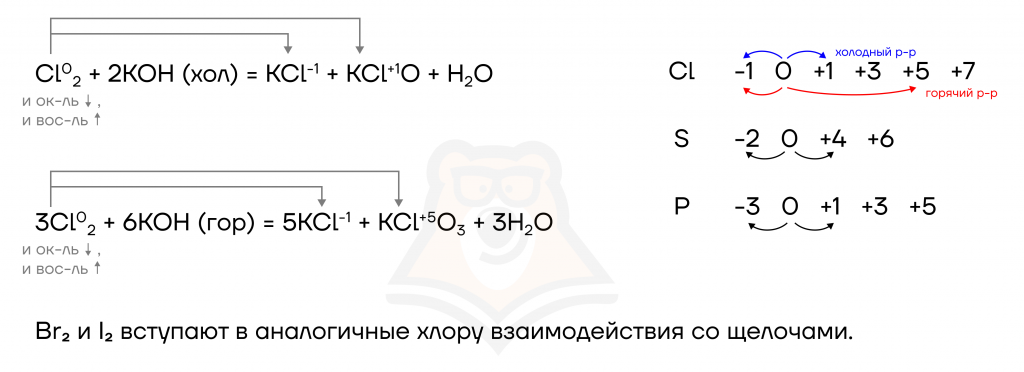
- Окислительно-восстановительные реакции (ОВР) с участием галогенов.
Галогены — сильноэлектроотрицательные элементы. Это значит, что галогены выступают в основном в роли окислителей, понижая свои степени окисления до единственно возможной -1. Иод может также выступать в роли восстановителя.
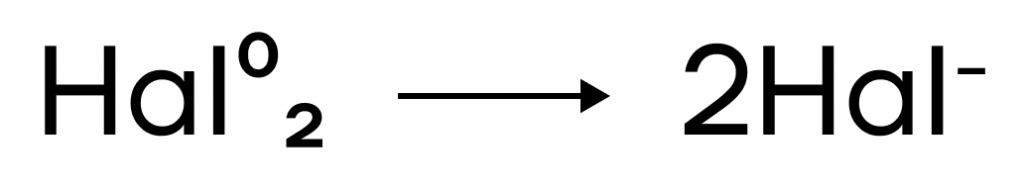
Алгоритм написания ОВР:
- Находим в реагентах окислителя и восстановителя.
- Определяем, до какой степени окисления повысит восстановитель; до какой понизит окислитель (в зависимости от условий, среды раствора и прочих факторов).
- Не поучаствовавшие в окислительно-восстановительном взаимодействии ионы «пристраиваем» к среде раствора (кислоте/щелочи/воде).
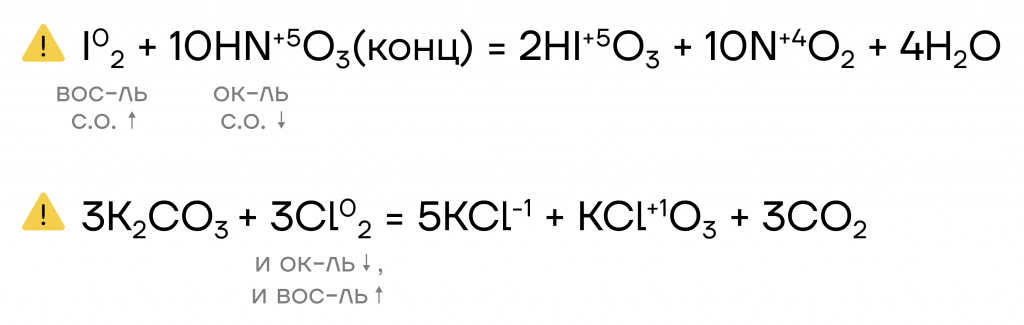

Получение галогенов
Существует несколько распространенных способов получения галогенов. В промышленности в основном используют электролиз расплавов и растворов солей. А вот в лаборатории их можно получить реакцией галогеноводородов с сильными окислителями.
| Электролиз расплавов и растворов галогенидов. Фтор можно получить только путем электролиза расплава фторида. | 2NaCl + 2H2O (эл.ток) = H2 + Cl2 + 2NaOH 2NaF (расплав, эл. ток) = 2Na + F2 |
| Реакции вытеснения галогенами менее активных галогенов из бескислородных кислот и солей ОВР: окисление HCl, HBr, HI до простых веществ. | Cl2 +2HBr = 2HCl + Br2 Br2 + 2NaI = 2NaBr + I2 |
| Способ получения галогенов в лаборатории. | 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl +8H2O K2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7H2O |
Галогеноводороды
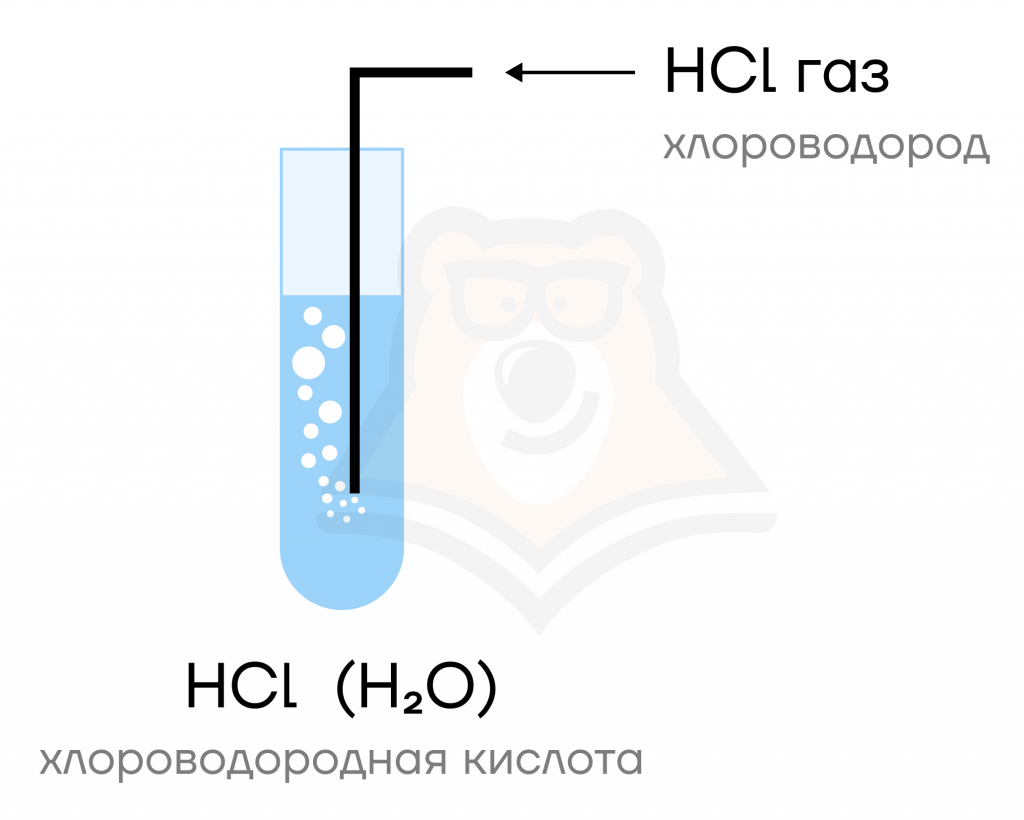
Галогеноводороды (HF, HCl, HBr, HI) представляют собой газы, хорошо растворимые в воде. Растворы этих газов в воде и являются кислотами: фтороводородной, хлороводородной и т.д.
Повторим, как формируются названия их и их солей:
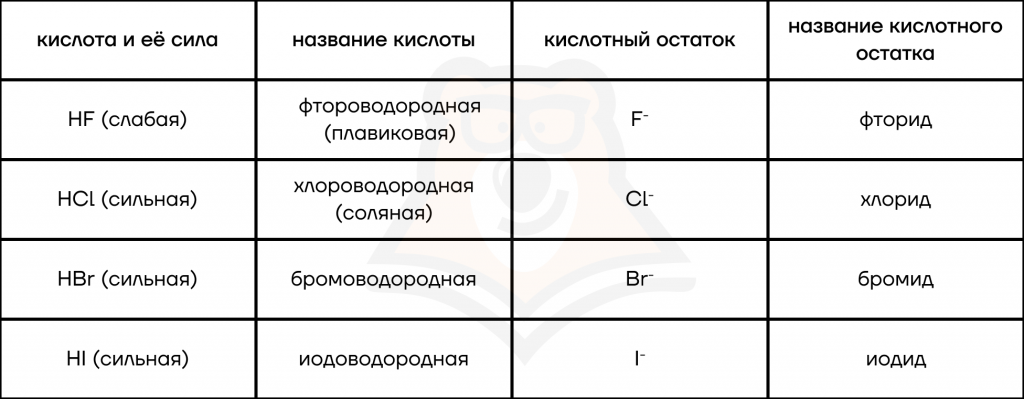
- Название водородных кислот строится из названия галогена (фтор, иод и т.д.) и водорода.
- Если нужен кислотный остаток, то к названию галогена просто добавляем суффикс -ид.
Получение галогеноводородов
В промышленности основным способом получения галогеноводородов является синтез непосредственно водорода и галогена. В лаборатории — гидролиз бинарных соединений фосфора и кремния.
| Синтез из простых веществ.Получение в промышленности. | H2 + Cl2 = 2HCl H2 + Br2 = 2HBr |
| Воздействие концентрированной серной кислоты на безводные хлориды и фториды.Для получения бромо- и иодоводорода подобный способ не используют из-за протекания ОВР.Получение в лаборатории. | H2SO4(конц.) + NaCl(т) = NaHSO4 + HCl↑ H2SO4(конц.) + NaF(т) = NaHSO4 + HF↑ |
| Гидролиз бинарных соединений фосфора и кремния. | PCl5 + 4H2O = H3PO4 + 5HCl SiCl4 + 3H2O = H2SiO3 + 4HCl |
Фактчек
- Галогены — это элементы VIIA-группы таблицы Менделеева, которые образуют простые вещества в виде двухатомных молекул: F2, Cl2, Br2, I2.
- Электронная конфигурация галогенов в основном состоянии — ns2np5.
- Галогены являются окислителями, за счет своей электроотрицательности самым сильным окислителем является фтор (отсюда и его название «разрушительный»).
- Фтороводородная кислота является единственной слабой из всех галогеноводородных кислот.
Проверь себя
Задание 1.
У атома какого из галогенов наименьший атомный радиус?
- фтор
- хлор
- бром
- иод
Задание 2.
Какой галоген при комнатной температуре представляет собой жидкость?
- фтор
- хлор
- бром
- иод
Задание 3.
С каким веществом не будет реагировать хлор?
- бромид калия
- кислород
- водород
- кремний
Задание 4.
Какая из приведенных кислот является слабой?
- плавиковая кислота
- соляная кислота
- бромоводородная кислота
- иодоводородная кислота
Ответы: 1. — 1; 2. — 3; 3. — 2; 4. — 1.


 к списку статей
к списку статей





