Соединения серы (IV) и серы (VI)
На этой странице вы узнаете
- Как спички связаны с серой?
- Каким цветом горит сернистый газ?
- Почему лук заставляет нас плакать?
- Из чего состоит атмосфера Венеры?
Сера знакома человечеству многие тысячелетия. В древности жрецы использовали ее для проведения разных обрядов и священных курений — какие последствия это несло, вы сможете догадаться, прочитав статью. Военные добавляли ее в состав различных горючих смесей, например, в небезызвестный «греческий огонь». При этом сера жизненно важна для работы нашего организма, являясь одним из главных составляющих всех существующих белков.
В этой статье мы узнаем, какими интересными свойствами обладает сера, какие соединения она образует и как мы сталкиваемся с ней, когда зажигаем спички.
Сернистый газ SO2
Оксид серы (IV) — сернистый газ SO2. По физическим свойствам сернистый газ представляет собой бесцветный ядовитый газ с резким запахом зажженной спички, хорошо растворимый в воде.
| Как спички связаны с серой? Головка спички – смесь веществ, одним из главных компонентов которой является сера. Когда мы поджигаем спичку, эта сера сгорает в кислороде воздуха с образованием оксида серы SO2, который и обладает тем самым характерным запахом горящей спички. |

Рассмотрим теперь химические свойства сернистого газа, начнем, как обычно, со способов получения. В качестве основных промышленных методов получения выступают реакции сгорания серы/сероводорода и обжиг сульфидов.
В лаборатории его можно получить реакцией неактивных металлов с кислотами и через реакции ионного обмена:
- Горение серы на воздухе
S + O2 = SO2
- Горение сульфидов и сероводорода
2H2S + 3O2 = SO2 + 2H2O
2CuS + 3O2 = 2SO2 + 2CuO
- Взаимодействие сульфитов с сильными кислотами
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O
Соли сернистой кислоты H2SO3 называются сульфитами. При их взаимодействии с кислотами происходит реакция ионного обмена с образованием соли и сернистой кислоты, которая сразу распадается на воду и диоксид серы. Это качественная реакция на сульфит-ион, признак: выделение газа с резким запахом.
- Взаимодействие неактивных металлов с концентрированной серной кислотой
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Переходим к возможным взаимодействиям, в которые вступает SO2. Это кислотный оксид, поэтому он будет вступать в основно-кислотные взаимодействия с веществами, обладающими противоположными (основными) свойствами: основаниями и основными оксидами.
За счет степени окисления серы +4 сернистый газ является сильным восстановителем, повышая в реакциях степень окисления до единственно возможной +6.
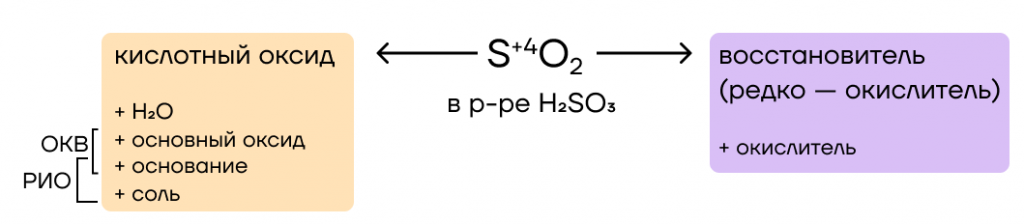
- Взаимодействие с водой
Как и практически любой кислотный оксид, SO2 способен реагировать с водой с образованием соответствующей кислоты, в нашем случае сернистой. Эта реакция обратима, так как сернистая кислота очень неустойчива и практически сразу распадается на оксид и воду:
SO2 + H2O ↔ H2SO3
- Основно-кислотные взаимодействия
SO2 обладает кислотными свойствами, а значит, может вступать в реакции со своими противоположностями: основаниями и основными оксидами с образованием солей.
Со «слабыми» (нерастворимыми) оксидами и гидроксидами он при этом не взаимодействует, так как реакции вида «слабое + слабое» обычно не протекают.
Na2O + SO2 = Na2SO3
С щелочами возможно два исхода, при избытке оксида и при избытке щелочи:
SO2 + 2NaOH(изб) = Na2SO3 + H2O
SO2(изб) + NaOH = NaHSO3
- Восстановительные свойства
За счет степени окисления серы +4 SO2 проявляет восстановительные свойства. Будучи восстановителем, в реакциях сера повышает степень окисления до +6.
Например, окисление кислородом (горение) с образованием серного ангидрида SO3:
2S+4O2 + O02 = 2S+6O-23
| Каким цветом горит сернистый газ? Сернистый газ при сгорании образует пламя голубого цвета. Это явление можно наблюдать в природе. В восточной части острова Ява, в Индонезии есть удивительное по красоте, но очень опасное место — вулкан Кавах Иджен. Жерло вулкана заполнено изумрудно-зеленой жидкостью, смесью серной и соляной кислот, а берега усыпаны чистой серой. Над одним из кратеров ночью можно увидеть голубое свечение – это горит сернистый газ. |

Окисление перекисью водорода:
S+4O2 + H2O—2 = H2S+6O-24
Обесцвечивание бромной воды:
S+4O2 + Br02 + 2H2O → H2S+6O4 + 2HBr— (аналогично реакция возможна с I2 и Cl2)
Реакция с азотной кислотой:
S+4O2 + HN+5O3 = 2N+4O2 + H2S+6O4
Крайне редко SO2 выступает в роли окислителя, понижая степень окисления до ближайшей устойчивой (нуля). Играть роль окислителя SO2 может только в реакции с очень сильным восстановителем (H2S, I⁻, C, CO):
S+4O2 + 2C0 = S0 + 2C+2O
S+4O2 + 2H2S-2 = 3S0 + 2H2O (реакция диспропорционирования, сера и окисляется, и восстанавливается)
S+4O2 + 4HI— = S0 + 2I02 + 2H2O
Серный ангидрид SO3
По физическим свойствам серный ангидрид SO3 представляет собой летучую бесцветную жидкость с удушающим запахом, активно поглощающую воду с образованием серной кислоты.
SO3 получают окислением сернистого газа кислородом.
Эта реакция нам уже знакома, мы рассматривали ее выше:
2SO2 + O2 = 2SO3
Переходим к химическим свойствам. SO3 принадлежит к классу кислотных оксидов, а следовательно, способен вступать в основно-кислотные взаимодействия со своими противоположностями.
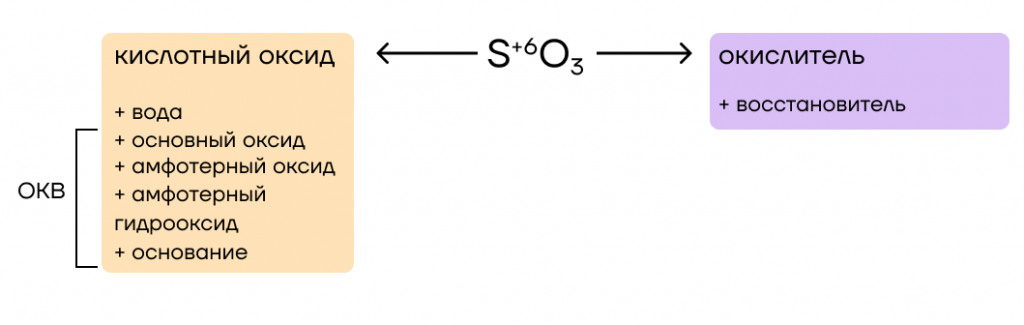
За счет высшей степени окисления серы +6 («сера ограблена и очень зла») SO3 выступает в окислительно-восстановительной реакции (ОВР) в роли окислителя.
- Реакция с водой
Как типичный кислотный оксид, SO3 способен взаимодействовать с водой с образованием соответствующей серной кислоты:
SO3 + H2O = H2SO4
- Основно-кислотные взаимодействия
Как и у всех кислотных оксидов, при взаимодействии с основными оксидами и щелочами образуются соли:
SO3 + MgO = MgSO4
В избытке щелочи и избытке оксида возможны разные варианты:
SO3 + 2NaOH(избыток) = Na2SO4 + H2O
SO3 + NaOH(избыток) = NaHSO4
Обратите внимание на то, что SO3 — оксид сильной кислоты (серной — H2SO4), а следовательно, он способен реагировать в том числе со слабыми амфотерными гидроксидами и их оксидами.
3SO3 + Al2O3 = Al2(SO4)3
- Окислительные свойства
Благодаря максимальной степени окисления серы (+6), серный ангидрид является сильным окислителем и активно взаимодействует с такими восстановителями, как KI, H2S, C:
S+6O3 + C0 = S+4O2 + C+2O
3S+6O3 + H2S-2 = 4S+4O2 + H2O
S+6O3 + 2KI— = I02 + K2S+4O3
Серная кислота H2SO4
Серная кислота – сильная двухосновная кислота. По физическим свойствам серная кислота представляет собой тяжелую маслянистую жидкость без цвета и запаха. Соли серной кислоты называются сульфатами.
| Почему лук заставляет нас плакать? Все мы хоть раз в жизни резали лук и плакали. Почему же так происходит? Когда мы режем лук, мы нарушаем целостность его клеток. Аминокислоты и ферменты, которые находились раздельно, невольно смешиваются. В луке содержатся аминокислоты, имеющие в своем составе серу. Под действием ферментов они превращаются в 1-сульфинилпропан, летучее вещество, пары которого легко попадают в слезные железы наших глаз. Там 1-сульфинилпропан растворяется в воде и образует очень малые, но достаточные для раздражения слизистой глаза количества серной кислоты, и мы чувствуем жжение и начинаем лить слезы. |
Качественной реакцией на сульфат-ион является взаимодействие с солями бария с образованием белого осадка сульфата бария, например:
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
Свойства серной кислоты зависят от того, в разбавленном или концентрированном виде она находится.
Разбавленная серная кислота является типичной кислотой-неокислителем и никакими особыми свойствами не обладает, в том числе не вступает в какие-либо «сложные» ОВР.
Как любая кислота-неокислитель, разбавленная серная кислота обладает кислотными свойствами и способна:
- Вступать в реакции вытеснения с металлами, стоящими в ряду активности до водорода.
- Вступать в основно-кислотные взаимодействия с образованием солей с веществами, обладающими противоположными свойствами: основаниями, основными оксидами, амфотерными оксидами и гидроксидами.
- Вступать в реакции ионного обмена с другими электролитами: основаниями и солями.
Подробно изучить свойства кислот можно в статье «Основные классы неорганических веществ».
Концентрированная серная кислота является кислотой-окислителем, поэтому склонна вступать в ОВР с различными восстановителями.
За счет степени окисления +6 концентрированная серная кислота в ОВР выступает в роли окислителя. Как окислитель, она может в реакциях понизить степень окисления до +4 (чаще всего), 0 или -2. Само собой, продукт восстановления серы зависит от активности восстановителя, с которым она реагирует:
- Активные металлы и сильные восстановители (I⁻: HI и иодиды) способны восстановить серу сразу до -2.
- Остальные металлы и восстановители могут восстановить серу только до +4.
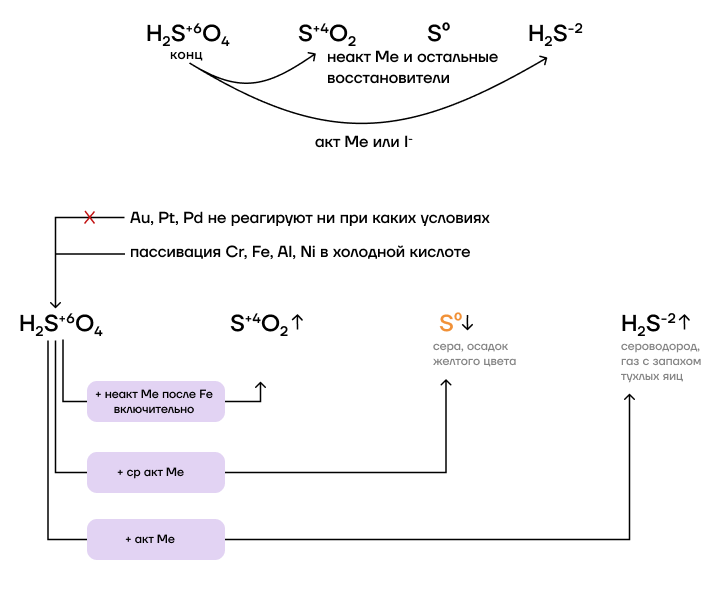
Обратите внимание на то, что некоторые металлы (Cr, Fe, Al, Ni) реагируют с концентрированными растворами кислот окислителей только при нагревании. Это происходит из-за так называемой пассивации: эти металлы на воздухе покрываются очень прочной оксидной пленкой, которая не хочет реагировать с кислотами.
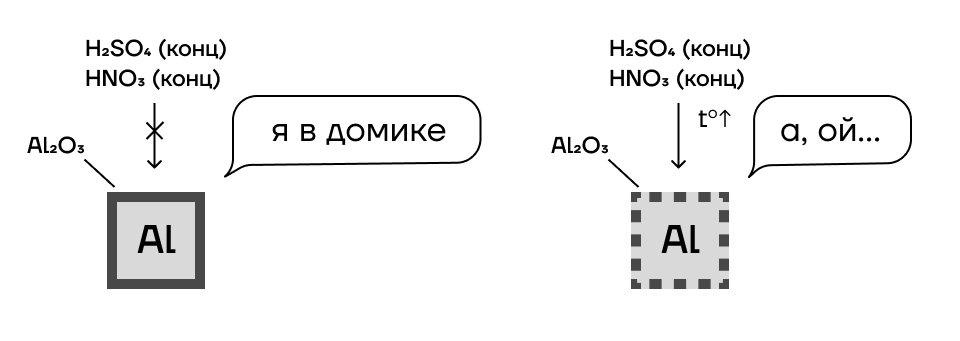
Благородные металлы — золото Au, платина Pt, палладий Pd — в принципе не взаимодействуют с кислотами-окислителями ни при каких условиях.

Рассмотрим же все эти свойства на конкретных примерах.
При взаимодействии с неактивными металлами серная кислота восстанавливается до сернистого газа:
2H2S+6O4(конц.) + Cu0 = Cu+2SO4 + S+4O2 + 2H2O
Металлы средней активности дают нам серу:
3Mg0 + H2S+6O4 = 3Mg+2SO4 + S0 + 4H2O
А активные металлы – сероводород:
5H2S+6O4(конц.) + 4Zn0 = 4Zn+2SO4 + H2S-2↑ + 4H2O
Возможны реакции с неметаллами, сера будет восстанавливаться до сернистого газа, например, с фосфором, углеродом и серой.
5H2SO4(конц.) + 2P = 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.)+ С = СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S = 3SO2↑ + 2H2O
Концентрированная серная кислота вытесняет галогены из их солей:
3H2SO4(конц.) + 2KBr = Br2↓ + SO2↑ + 2KHSO4 + 2H2O
И способна окислить сероводород:
H2SO4(конц.) + 3H2S = 4S↓ + 4H2O
Соли серной кислоты: сульфаты и гидросульфаты
Для начала давайте узнаем, в состав каких анионов солей входит атом серы:

Сейчас мы поговорим о солях серной кислоты — сульфатах и гидросульфатах.
Данные соли обладают всеми типичными химическими свойствами солей.
- Вступают в реакции ионного обмена.
K2SO4 + BaCl2 = BaSO4 + 2KCl
NaHSO4 + NaOH = Na2SO4 + H2O

- Солям серной кислоты свойственны реакции вытеснения, в которых более активный металл вытесняет из соли менее активный.
Fe + CuSO4 = FeSO4 + Cu
Ниже в таблице представлены качественные реакции на сульфат-ион:
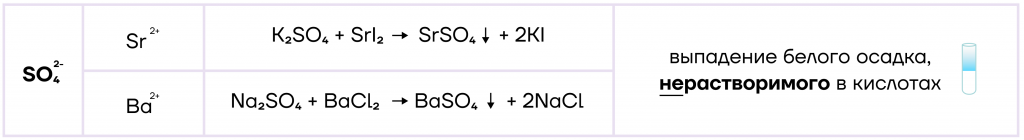
Однако гидросульфаты имеют также и особое свойство — в составе гидросульфатов есть атом водорода, который можно заместить на металл, то есть гидросульфаты обладают слабыми кислотными свойствами.
2KHSO4 + Mg = K2SO4 + MgSO4 + H2
Гидролиз гидросульфата дает нам слабокислую среду за счет диссоциации (распада) иона и образования катиона водорода.
HSO4— = SO42- + H+
Соединения серы (IV) и (VI) окружают нас повсюду: в природе, на кухне, в химической лаборатории. Они встречаются и на экзамене. Теперь, когда мы полностью изучили свойства серы и ее соединений, мы можем с легкостью решать различные экзаменационные задания. А для полноценного знания свойств элементов VIA группы предлагаем прочитать статью «Элементы VIА группы. Кислород».
Фактчек
- Оксид серы(IV) SO2 — кислотный оксид, которому соответствует слабая сернистая кислота H2SO3; SO2 проявляет преимущественно восстановительные свойства.
- Оксид серы(VI) SO3 — кислотный оксид, которому соответствует сильная кислота H2SO4 .
- Разбавленная серная кислота ведет себя как обычная кислота-неокислитель, который присущи различные реакции ионного обмена.
- Концентрированная серная кислота проявляет окислительные свойства, благодаря чему способна реагировать с различными восстановителями.
Проверь себя
Задание 1.
С каким из указанных веществ будет реагировать разбавленная серная кислота?
1. хлорид натрия
2. сера
3. оксид кремния(IV)
4. цинк
Задание 2.
Какие свойства характерны концентрированной серной кислоте?
- восстановительные
- окислительные
- нейтральные
Задание 3.
Качественной реакцией на сульфат-ион является взаимодействие с ионами:
- бария
- водорода
- хлора
- рубидия
Задание 4.
Качественной реакцией на сульфит-ион является взаимодействие с ионами:
- натрия
- водорода
- хлора
- рубидия
Ответы: 1. — 4; 2. — 2; 3. — 1; 4. — 2.


 к списку статей
к списку статей





