Элементы VА группы. Фосфор
На этой странице вы узнаете
- Какие по характеру три фосфорных брата?
- Почему P2O5 называют разбойником?
- Чеснок, тухлая рыба и фосфин — что между ними общего?
Фосфор был открыт в результате поисков философского камня. Хотели получить золото и бессмертие, а вместо этого обнаружили элемент, который светится зеленым цветом в темноте. Чем ещё отличается фосфор — расскажем в статье.
Общая характеристика
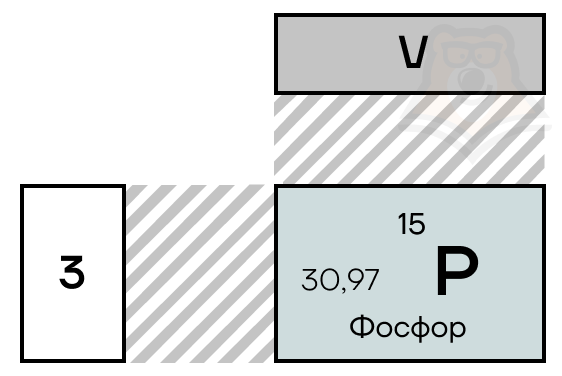
Фосфор находится в VA-группе третьего периода таблицы Менделеева, прямо под азотом. Электронная конфигурация фосфора в основном состоянии 1s22s22p63s23p3.
Конфигурация его внешнего слоя такая же, как и у азота. Но фосфор имеет на этом слое полностью свободный d-подуровень, куда в случае возбуждения атома может переехать его электрон.
Поэтому в возбужденном электронном состоянии атом фосфора имеет конфигурацию внешнего электронного уровня 3s13p33d1.
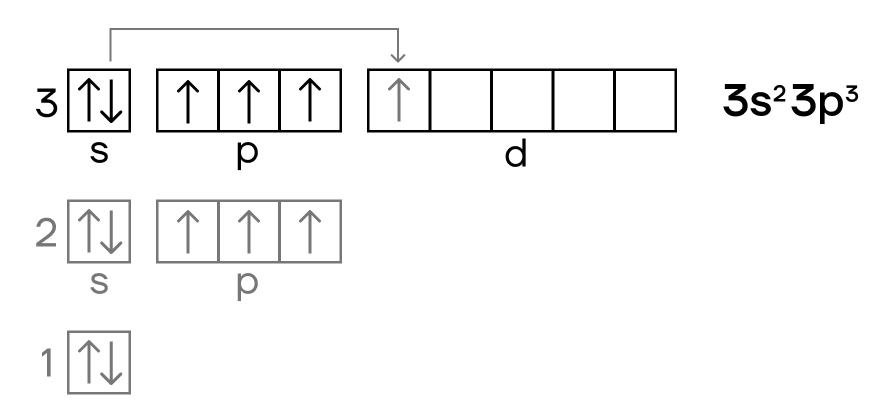
Таким образом, благодаря наличию в возбужденном состоянии пяти неспаренных электронов, фосфор может максимально образовывать в соединениях пять химических связей.
В отличие от азота, у фосфора максимальная валентность (V) и высшая степень окисления (+5) численно совпадают.
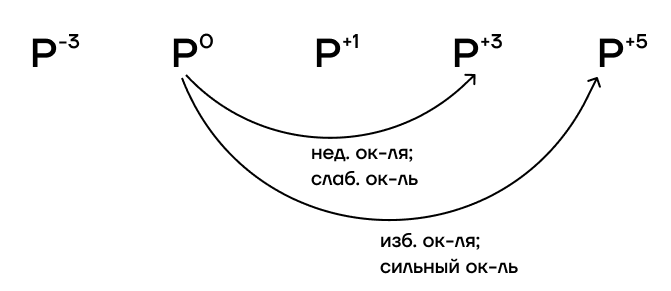
Какие степени окисления фосфора возможны?
- Высшая степень окисления равна номеру группы: +5.
- Низшая степень окисления определяется по формуле «номер группы — 8»: -3.
- Промежуточные степени окисления, как и сам номер группы, нечётные: +1, +3.
Физические свойства
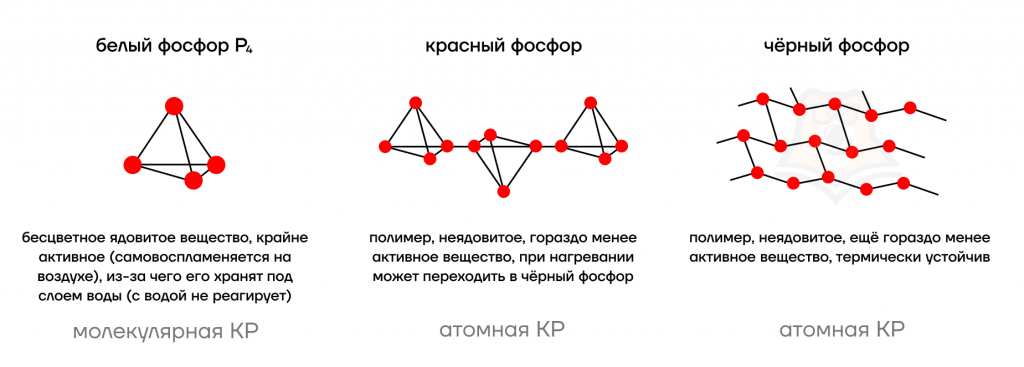
Фосфор как простое вещество, аналогично углероду, имеет несколько аллотропных модификаций.
О трех фосфорных братах
Можно запомнить основные свойства по “характерам” модификаций:
- Белый фосфор — токсичный взрывной парень, который отравляет всем жизнь и легком можно возгореться. Поэтому его от греха подальше упрятали под воду.
- Красный фосфор не очень ценит качества своего белого “брата”. Поэтому он неядовит и при высокой температуре просто превращается в любимого брата — в черный фосфор.
- Черный фосфор — полная противоположность белому, самый мирный брат из тройки. Он неядовит, фактически не реагирует на температуру. Дзен среди фосфоров.
Химические свойства
Фосфор имеет низкое значение электроотрицательности. Это значит, что фосфор проявляет ярко выраженные восстановительные свойства. Онплохо притягивает к себе электроны, поэтому у него их легко отобрать.
При избытке окислителя или воздействии такого сильного окислителя, как F2, фосфор переходит в степень окисления +5. При недостатке окислителя или воздействии такого слабого окислителя, как I2, фосфор переходит только в степень окисления +3.
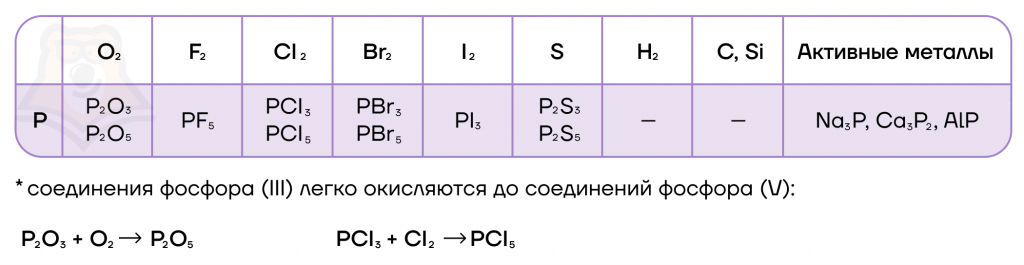
- Реакции с простыми веществами
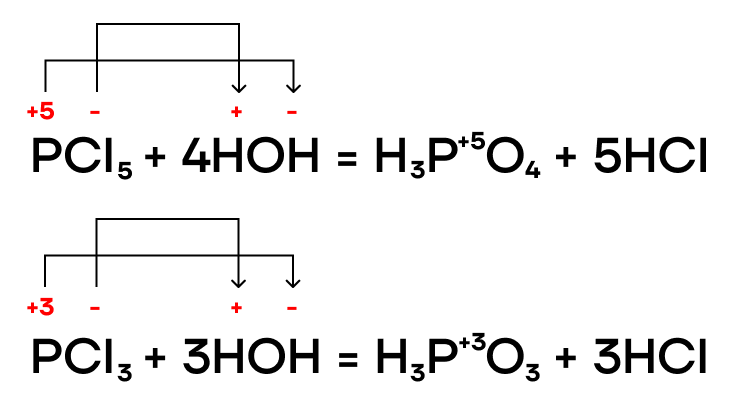
Как и многие бинарные соединения, галогениды фосфора способны гидролизоваться в различных средах (нейтральной, щелочной, кислой). Эти реакции мы, как и всегда, пишем по принципу «притяни плюс к минусу».
Фосфиды металлов также подвергаются гидролизу в разных средах.
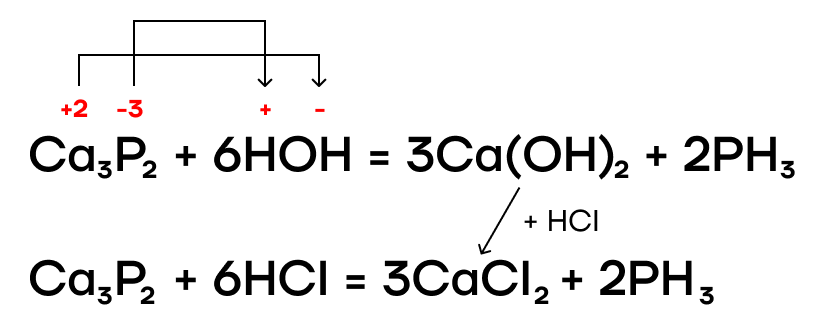
В результате протекания этих реакций образуется ядовитый газ с неприятным запахом чеснока (или тухлой рыбы) — фосфин PH3. Он проявляет очень слабые основные свойства.
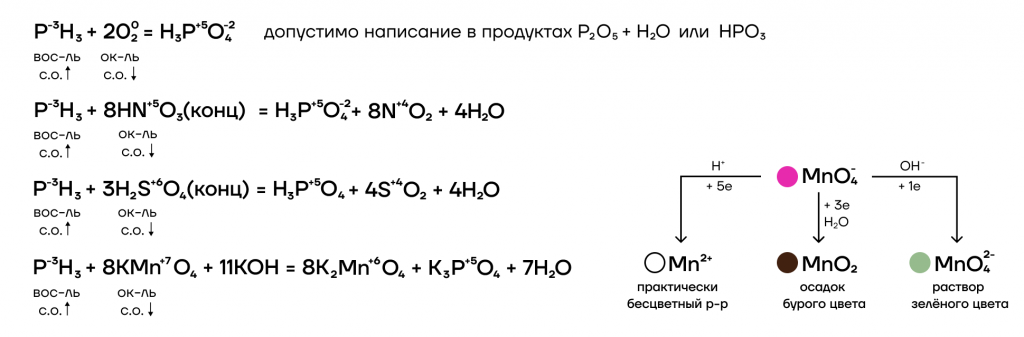
За счет степени окисления фосфора -3 он проявляет ярко выраженные восстановительные свойства. Он богат, поэтому во время реакции можно его ограбить. Следовательно, способен взаимодействовать с окислителями.
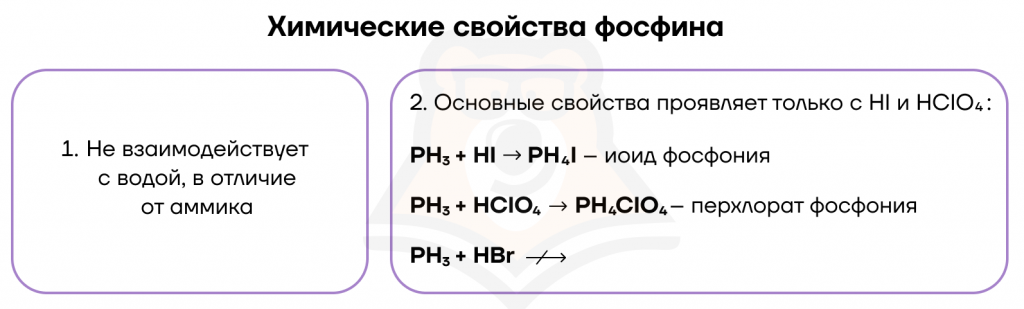

- Реакция со щелочами
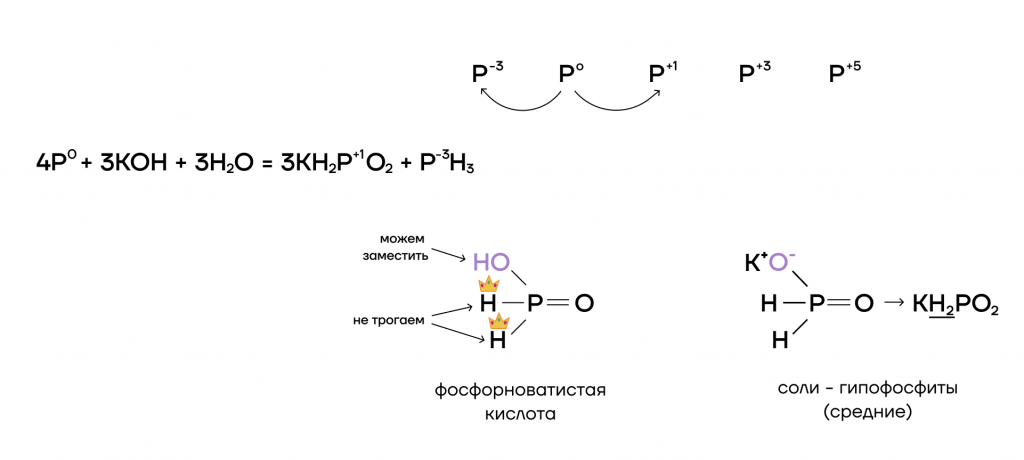
Фосфор — один из тех неметаллов, который способен взаимодействовать со щелочами (выражение для запоминания — «LiPSSi Ha»). Так как щёлочь не проявляет выраженных окислительных или восстановительных свойств, фосфору в этой реакции приходится отдуваться за двоих: играть роль как окислителя, так и восстановителя.
- Реакции с окислителями
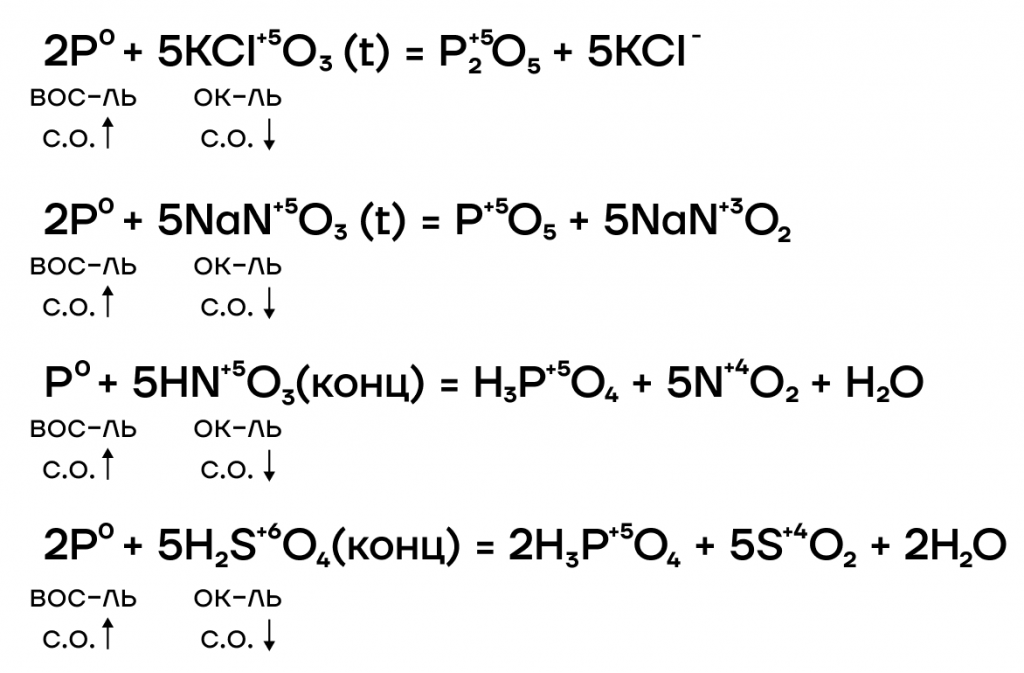
Из-за низкой электроотрицательности фосфор является типичным восстановителем («жертвой»). Поэтому он способен взаимодействовать с окислителями. В ОВР он в подавляющем большинстве случаев как восстановитель повышает свою степень окисления до +5. Она является крайне устойчивой для него. Из-за этого соединения фосфора (V) не являются типичными окислителями, потому что фосфор не хочет уходить из любимой степени окисления.
Получение фосфора
В промышленности главным способом получения фосфора является спекание фосфорита (ортофосфата кальция) с диоксидом кремния и коксом. Для чего это делают?
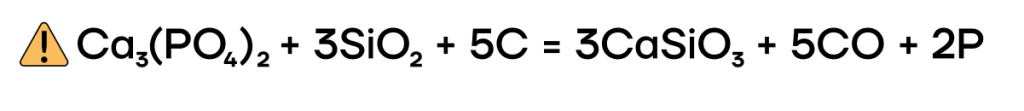
Оксид фосфора (III) P2O3 и фосфористая кислота H3PO3
Оксид фосфора (III) — типичный кислотный оксид. Это значит, он способен реагировать с водой с образованием соответствующей кислоты и вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами.
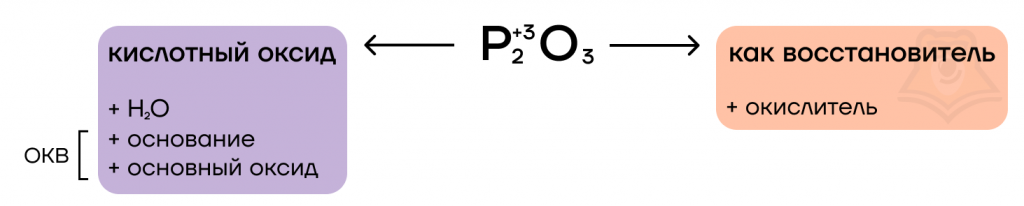
За счет степени окисления +3 оксид фосфора (III) проявляет восстановительные свойства, повышая в реакциях степень окисления до +5.
- Реакция с водой
Как типичный кислотный оксид, P2O3 способен взаимодействовать с водой с образованием соответствующего гидроксида (кислоты).
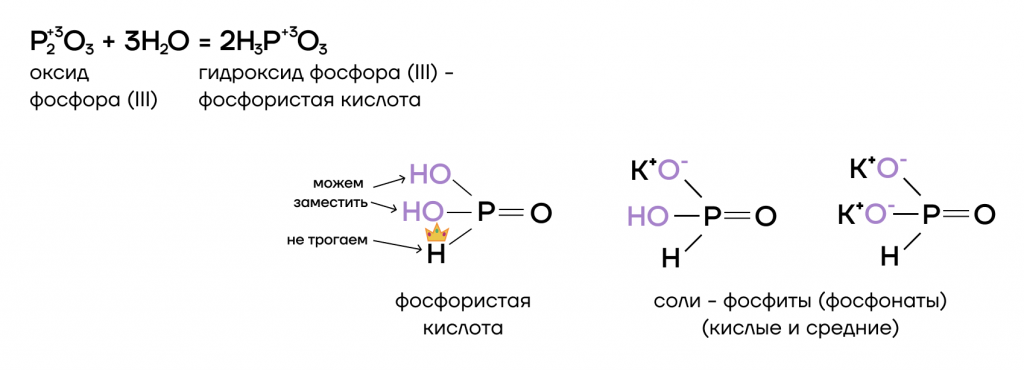
- Основно-кислотное взаимодействие
Тут все очень просто! P2O3 — кислотный оксид, он проявляет кислотные свойства. Значит, он способен вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами — с образованием солей.
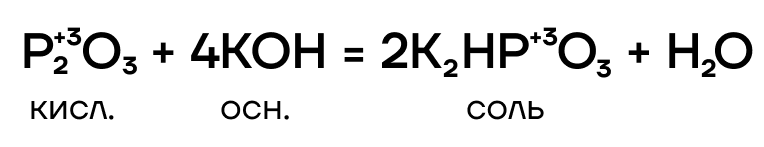
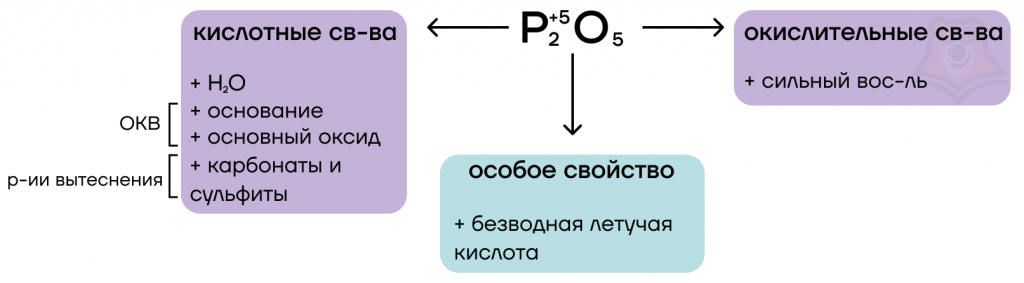
Оксид фосфора (V) P2O5
Оксид фосфора (V) P2O5 как типичный кислотный оксид будет реагировать с водой и вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами. Также как условно «сильный» оксид он способен вытеснять условно «слабые» из их солей при сплавлении.
- Реакция с водой
При взаимодействии с водой оксид фосфора (V) образует соответствующий гидроксид — ортофосфорную кислоту.

- Кислотно-основные реакции
Происходят с основаниями и основными оксидами. При этом образуются соли.
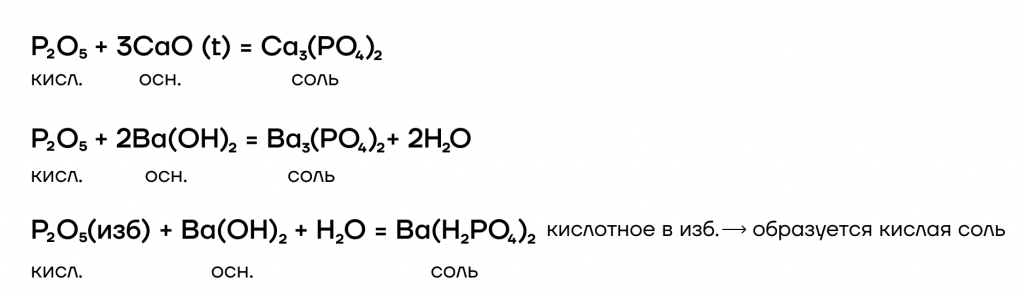
- Реакции вытеснения
В отношении реакций вытеснения P2O5 — это условно «сильный» оксид. Он способен вытеснять условно «слабые» (CO2 и SO2) из их солей при сплавлении (t).
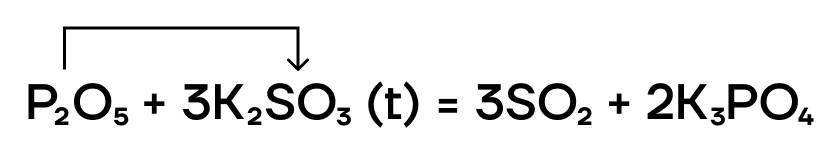
- P2O5-разбойник
Это вещество обладает крайне сильными дегидратирующими свойствами: оно активно осушает что?, отбирает воду. Он настолько жаден до воды, что может её отобрать даже у безводных кислородсодержащих летучих кислот.
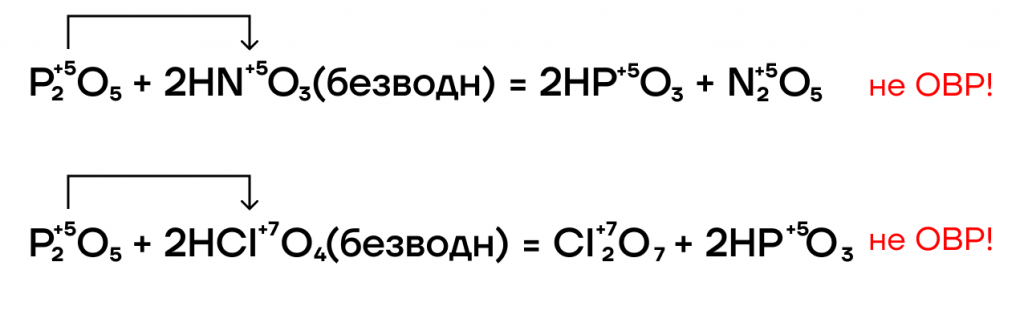
Ортофосфорная кислота H3PO4 и ее соли
Ортофосфорная кислота — ничем не примечательная слабая кислота.
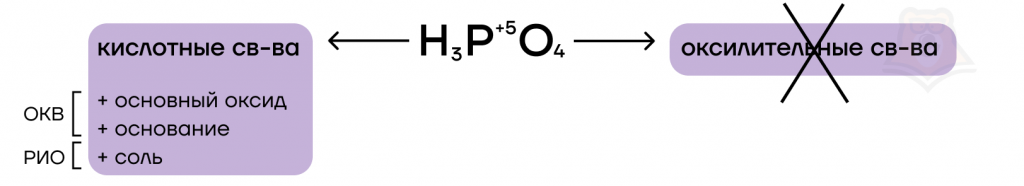
Как и все кислоты, она обладает кислотными свойствами. Она способна вступать в основно-кислотные взаимодействия с веществами, проявляющими основные свойства.
Опять же как и другие кислоты, она является электролитом. Это значит, она может распадаться на ионы и обмениваться ими с другими электролитами, то есть вступать в реакции ионного обмена. Продуктом взаимодействия кислоты с основаниями будут фосфаты.
Н3PO4 + 3NaОН = Na3PO4 + 3H2O
Соли ортофосфорной кислоты (ортофосфаты или просто фосфаты) растворимы в кислотах и также являются электролитами, а значит, тоже способны вступать в реакции ионного обмена с другими электролитами.
2K3PO4 + 3Ba(ОН)2 (изб) = 4KOH + Ba3(PO4)2 + 2H2O
Na3PO4 + 3HCl = 3NaCl + H3PO4
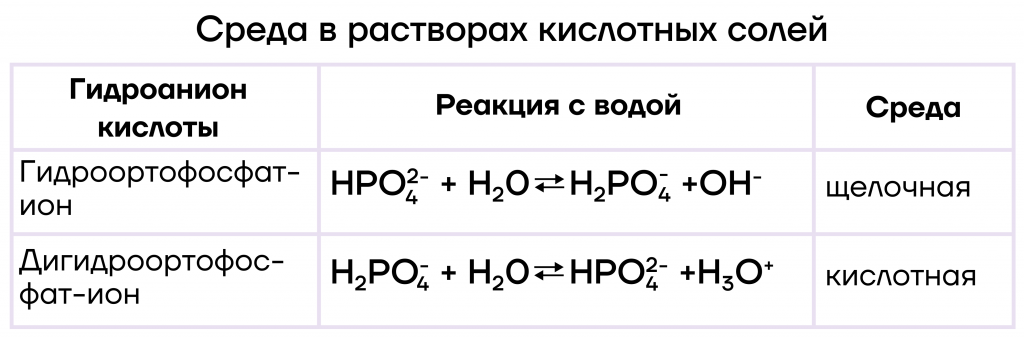
При добавлении к фосфату небольшого количества фосфорной кислоты образуется гидрофосфат, а при добавлении значительного избытка — дигидрофосфат.
Н3PO4 + Ba3(PO4)2 = 3ВaНPO4 (гидрофосфат)
Н3PO4 + BaНPO4 = Вa(Н2PO4)2 (дигидрофосфат)
При гидролизе (взаимодействии с водой) кислых солей, образованных сильным основанием и кислотами фосфора, среду раствора можно определить с помощью следующей таблицы.
Отдельного внимания заслуживает биологическая роль солей фосфора:
- Фосфаты поддерживают кислотно-щелочное равновесие на физиологическом уровне.
- Соли фосфора участвуют в образовании клеточной энергии для метаболических реакций.
- Именно из фосфатов по большей части состоит ткань костей и зубов.
Фосфор — очень интересный элемент, многообразие которого проявляется начиная от различных аллотропных модификаций и заканчивая множеством кислот и солей. В этой статье мы поближе познакомились с данным элементом, его соединениями и свойствами, а полученные знания помогут нам заработать побольше баллов в обеих частях экзамена.
Фосфор во многом похож на азот. Они оба расположены в одной и той же VА группе. Для полноценного понимания свойств и различий элементов этой группы рекомендуем ознакомиться со статьей «Элементы VА группы. Азот».
Фактчек
- Фосфор — химический элемент VA-группы третьего периода; электронная конфигурация 1s22s22p63s23p3;
- Возможные степени окисления фосфора: -3, 0, +1, +3, +5;
- Существует несколько аллотропных модификаций фосфора: белый фосфор, черный фосфор, красный фосфор;
- Фосфор является типичным восстановителем в ОВР из-за низкой электроотрицательности;
- Фосфор образует следующие соединения: фосфин, оксиды, кислоты и соответствующие соли.
Проверь себя
Задание 1.
Количество электронов на внешнем энергетическом уровне атома фосфора равно:
- 3
- 4
- 5
- 6
Задание 2.
Какой аллотропной модификации фосфора не существует?
- Белый фосфор
- Желтый фосфор
- Черный фосфор
- Красный фосфор
Задание 3.
Фосфин можно получить реакцией:
- Фосфора и водорода
- Оксида фосфора(III) и водорода
- Оксида фосфора(V) и водорода
- Фосфора и раствора гидроксида калия
Задание 4.
Фосфористая кислота H3PO3 является:
- Трехосновной кислотой
- Двухосновной кислотой
- Одноосновной кислотой
- Четырехосновной кислотой
Ответы: 1. — 3; 2. — 2; 3. — 4; 4. — 2.


 к списку статей
к списку статей





