Элементы IVА группы. Углерод
На этой странице вы узнаете
- Где идут алмазные дожди?
- Какой силой обладает углерод?
- Можно ли назвать углерод самым главным химическим элементом?
Углерод является «фундаментом» органической химии. Он очень «дружелюбен» в образовании ковалентных связей с другими элементами. Углерод вносит весомый вклад в круговорот веществ в природе. Также он является рекордсменом по перевоплощению, ведь у него существует целых 9 аллотропных модификаций. Теперь, когда мы узнали углерод чуть поближе, перейдем к его характеристике.

Общая характеристика углерода
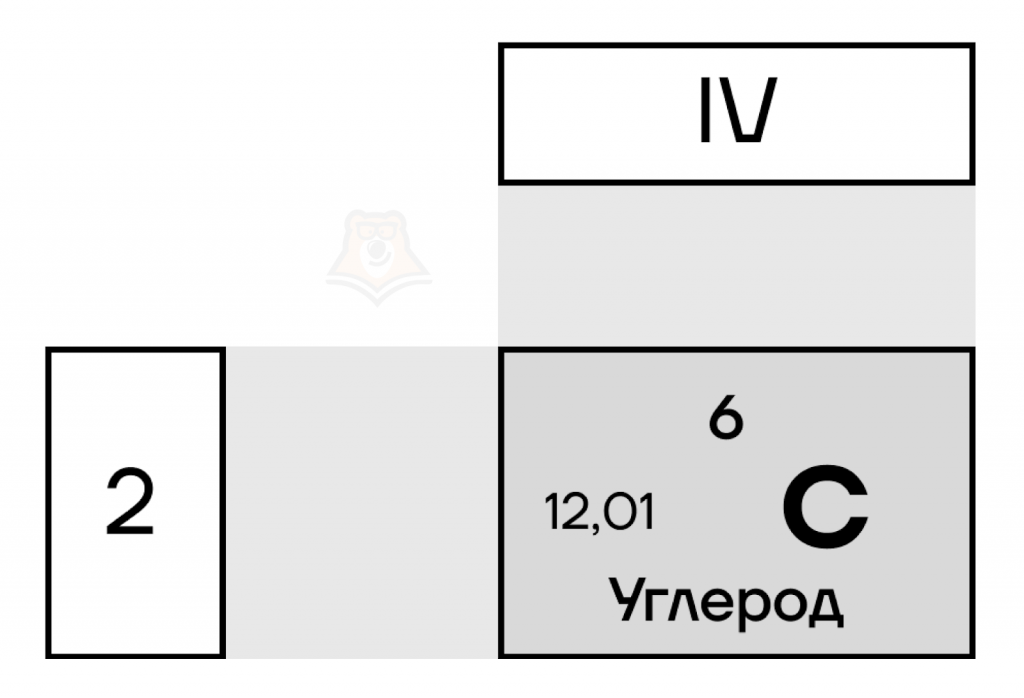
В главной подгруппе IV группы, кроме остальных, находятся самые важные элементы, без которых невозможна жизнь на Земле — это углерод и кремний. О кремнии мы поговорим в статье «Элементы IVА группы. Кремний». Так как они находятся в одной группе и подгруппе, они имеют много сходств, в том числе в строении электронных оболочек.
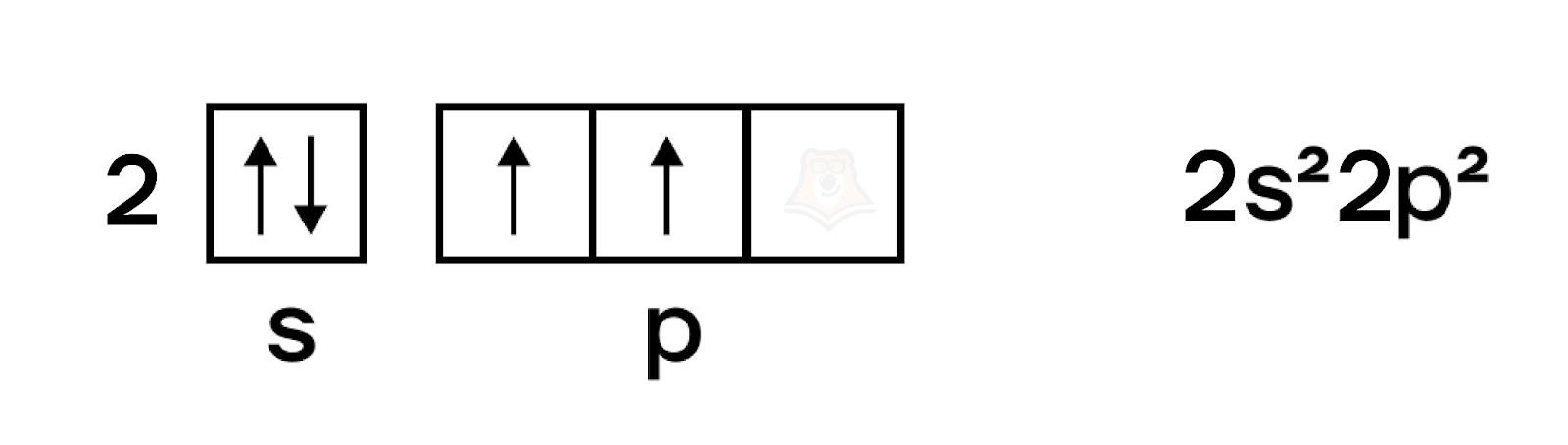
Конфигурация внешнего слоя атома углерода в основном состоянии следующая:
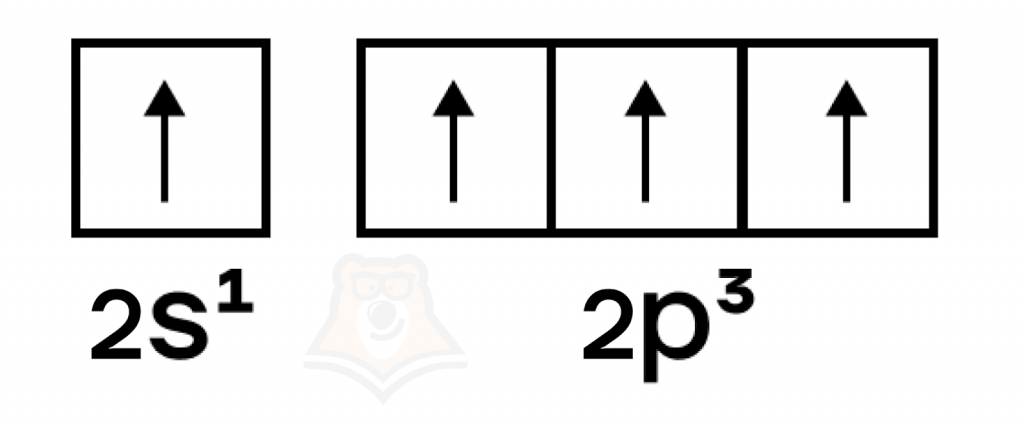
В возбужденном состоянии происходит распаривание электронов на s-орбитали и перенос одного электрона на p-орбиталь, в результате чего атом приобретает конфигурацию ns1np3. Как следствие, в возбужденном состоянии число неспаренных электронов углерода возрастает до четырех, и углерод приобретает валентность IV.

Углерод (простое вещество) может существовать в виде различных аллотропных модификаций, то есть один и тот же химический элемент образует несколько простых веществ. Как мы обсуждали в начале статьи углерод имеет целых 9 модификаций. Но наиболее распространенными являются алмаз, графит, фуллерен.
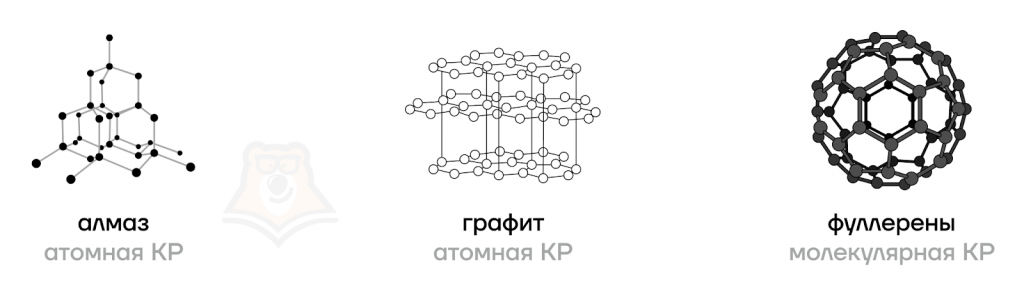
Алмаз имеет атомную кристаллическую решетку, в которой каждый атом углерода соединен с четырьмя другими атомами углерода. Алмаз — не только самый твердый из всех известных веществ, но еще и очень красивый в обработанном виде. Обработанный алмаз называется бриллиантом и широко используется для изготовления ювелирных украшений.

| Где идут алмазные дожди? На Уране, Сатурне, Юпитере и Нептуне действительно существует такое явление, как дождь из алмазов. Содержащийся в атмосфере этих планет метан под огромным давлением и при экстремальных температурах распадается на водород и углерод, который превращается в кристаллы алмаза и на большой скорости «падает» на поверхность планеты в виде дождя. Скорость этих «осадков» настолько велика, что они с легкостью проникают до самого ядра планеты. |

С графитом мы встречаемся в жизни, когда пишем простыми карандашами, именно он входит в состав стержней. У него в узлах кристаллической решетки также расположены атомы, но ее строение немного отличается от алмаза. Имея слоистую структуру, графит легко расслаивается на чешуйки. Поэтому он способен оставлять след на бумаге. Атомы углерода в графите находятся в состоянии sp2-гибридизации.


Фуллерены — достаточно молодые соединения, эта модификация углерода была открыта в 1985 году. Они имеют состав Cn, где n=60,70,76,84 и т.д. Фуллерены имеют форму футбольного мяча, их молекулы состоят из пятиугольников и шестиугольников. Свое название они получили в честь инженера и архитектора Ричарда Фуллера, предложившего конструкцию купола, построенную по такому принципу.
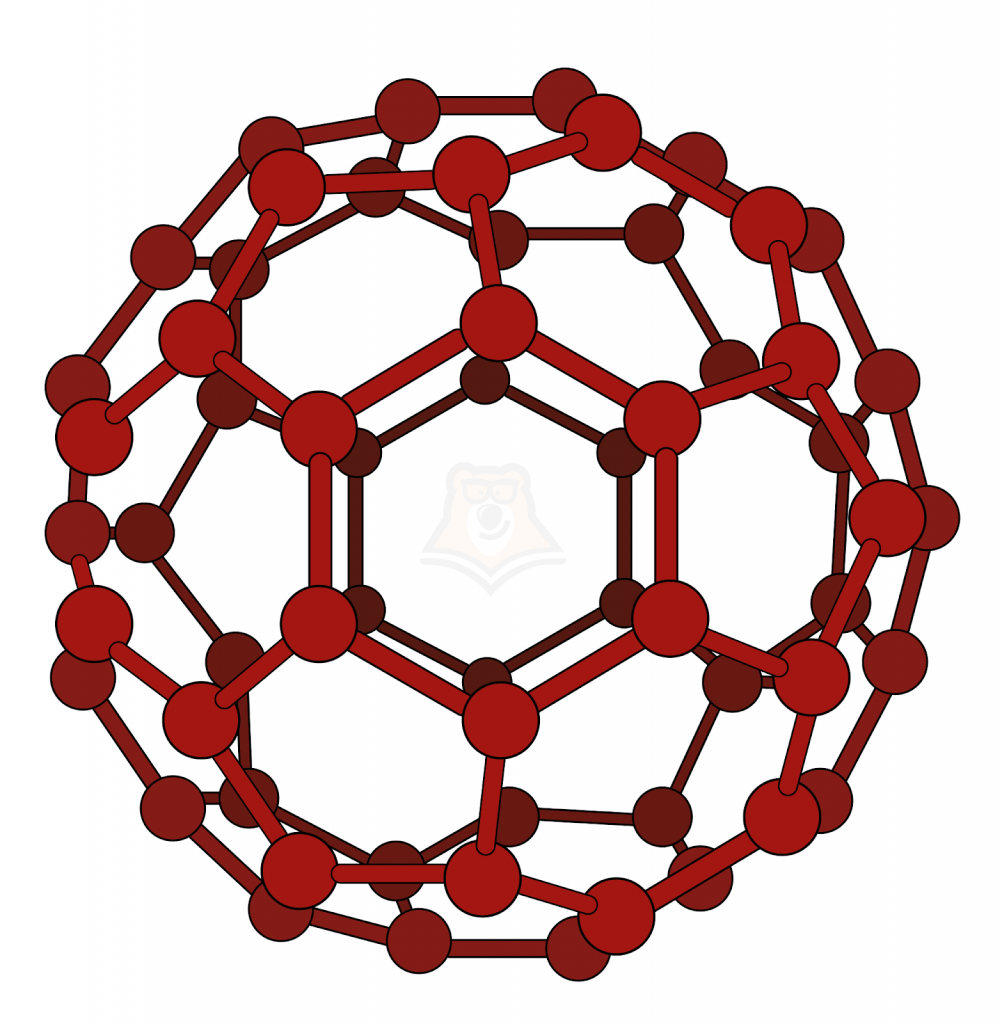
Фуллерены являются перспективным материалом и находят свое применение в металлургии, производстве полимеров, косметологии и медицине, производстве солнечных батарей и фотоэлементов.
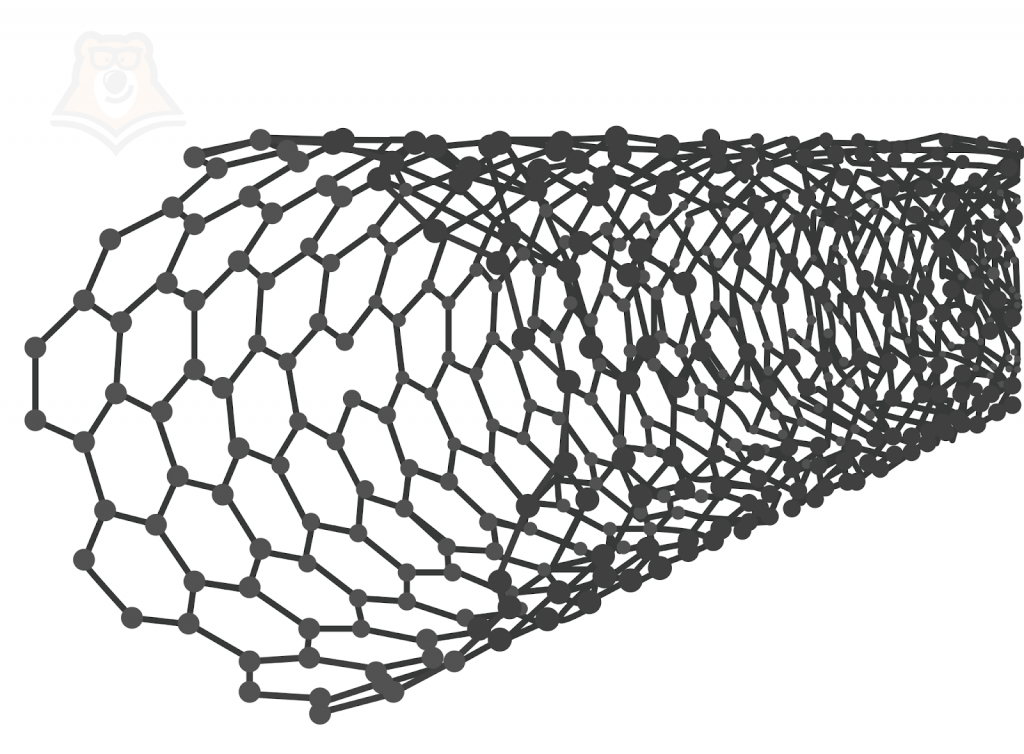
| Какой силой обладает углерод? Современная химическая наука активно нацелена на производство и изучение наноматериалов. Одним из таких наноматериалов является совсем недавно открытая аллотропная модификация углерода — углеродные нанотрубки. Они представляют собой скрученные в полые цилиндры графеновые плоскости. Нанотрубки могут выдерживать огромный вес — до тонны на один квадратный миллиметр. Это свойство предполагается использовать в будущем для изготовления тросов космического лифта. Нанотрубки уже применяются для создания связей между нейронами и электронными устройствами в нейрокомпьютерах, создания искусственных мышц, в микроэлектронике для нанопроводов и наноантенн. |
Химические свойства углерода
В нормальных условиях углерод, как правило, существует в виде кристаллов графита и алмаза, из-за чего его химическая активность не столь высока.
- Реакции с простыми веществами
Углерод может проявлять свойства как окислителя, так и восстановителя, поэтому реагирует с металлами и с неметаллами.
Из галогенов он реагирует только со фтором с образованием фторида углерода:
C + 2F2 = CF4
При сильном нагревании он реагирует с серой и кремнием с образованием сероуглерода и карбида кремния:
C + 2S = CS2
C + Si = SiC
Взаимодействием углерода с водородом можно получить метан:
C + 2H2 = CH4
С активными металлами углерод образует карбиды:
2C + Ca = CaC2
Горение углерода приводит к образованию углекислого газа:
C + O2 = CO2
А в недостатке кислорода — угарного:
2C + O2 = 2CO
- Реакции со сложными веществами
Раскаленный уголь с водой образует угарный газ и водород:
C + H2O = CO + H2
Углерод может легко восстанавливать металлы из их оксидов. Это свойство активно используется в металлургии, получение металлов из их оксидов с помощью углерода называется пирометаллургией. Например, получение цинка из его оксида:
C + ZnO = Zn + CO
При взаимодействии с оксидами активных металлов образуются карбиды:
9C + 2Al2O3 = Al4C3 + 6CO
Чем отличается предыдущее свойство от этого, спросите вы? А мы вам ответим: так как при восстановлении углеродом образуется активный металл (Al), он, в отличие от неактивного (Zn) способен полностью прореагировать с углеродом до образования карбида.
Углерод окисляется в растворе концентрированной серной и азотной кислот:
C + 2H2SO4 (конц.) = 2SO2 + CO2 + 2H2O
C + 4HNO3 (конц.) = 4NO2 + CO2 + 2H2O
Оксид углерода(II) — угарный газ CO
Оксид углерода CO — газ без цвета и запаха. Он очень ядовит, небольшие концентрации вызывают головокружение и сонливость, а большие — удушье.
Как и углерод, оксид углерода(II) проявляет выраженные восстановительные свойства, повышая в реакциях степень окисления до +4. Раз он восстановитель, следовательно, в реакции он будет вступать со своими противоположностями — окислителями. При этом монооксид углерода — несолеобразующий оксид.
- Горение. Угарный газ горит в атмосфере кислорода:
2CO + O2 = 2CO2
- Взаимодействие с хлором. Угарный газ с хлором образует ядовитый газ фосген:
CO + Cl2 = COCl2
- Синтез-газ.
Смесь угарного газа с водородом называется синтез-газом. В разных условиях они могут прореагировать с образованием разных веществ. Например, под давлением 20 атмосфер и при температуре 350℃ получается метанол:
CO + 2H2 = CH3OH
Также возможно образование метана и других углеводородов.
Синтез-газ является одним из главных источников сырья для промышленного органического синтеза метилового спирта. Его получают паровой конверсией метана, а еще при переработке природного газа, нефти, а в некоторых случаях и каменного угля. Синтез-газ можно использовать как экологически чистое топливо.
- Взаимодействие со щелочами. При сплавлении со щелочами образуются формиаты — соли муравьиной кислоты:
NaOH + CO = HCOONa
- Восстановление металлов из их оксидов. Аналогично углероду, угарный газ восстанавливает металлы из их оксидов:
3CO + Fe2O3 = 2Fe + 3CO2
Разберем подробнее химические свойства углерода, решив пример задания №6ЕГЭ.
Задание. В пробирку с твердым веществом X добавили концентрированный раствор вещества Y. В результате протекания реакции наблюдали выделение бурого газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) H2
2) C
3) HNO3
4) SiO2
5) H2SO4
Решение.
1. В задании сказано, что вещество X твердое. Отсюда мы понимаем, что у нас остается два варианта: оксид кремния (SiO2) и углерод(C).
2. Для вещества Y мы понимаем, что реакция с раствором подразумевает жидкое состояние этого вещества (значит вариант 1 не подходит, так как H2 при нормальных условиях является газом), а последующее образование бурого газа (NO2) наталкивает на мысль, что реакция происходила с концентрированной азотной кислотой. Серная кислота не подходит, так как ОВР с ее участием сопровождается выделением бесцветного газа (SO2). Отсюда получаем, что вещество Y — HNO3.
3. Остается понять, с кем прореагировала кислота. Исходя из наших знаний о химических свойствах углерода, мы понимаем, что вещество X — C. Химическая реакция выглядит следующим образом: 4HNO3 (конц.) + С = 4NO2 + CO2 + 2H2O. Значит под веществом X возьмем 2, а под Y — 3.
Ответ: 23
Оксид углерода(IV) — углекислый газ CO2
Оксид углерода(IV) (CO2) — газ без цвета, запаха и вкуса, не поддерживает горение, в отличие от чистого кислорода. Повсеместно встречается в природе: принимает участие в фотосинтезе, образуется при дыхании, сгорании органических соединений и т.д.
При взаимодействии с углеродом (коксом), магнием и другими сильными восстановителями проявляет окислительные свойства.

Является типичным кислотным оксидом, благодаря чему может:
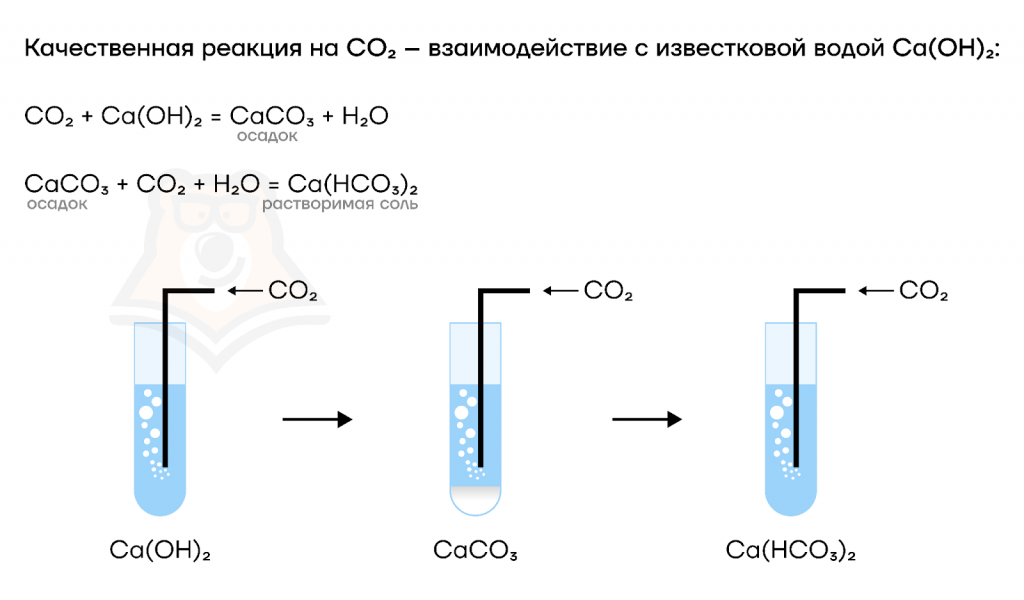
- Реагировать с водой с образованием угольной кислоты:
CO2 + Н2О = Н2CO3
- Реагировать с основными оксидами с образованием солей:
BaO + CO2 = BaCO3
- Реагировать с растворами щелочей с образованием солей и воды.
В таких реакциях очень важно, какое вещество было взято в избытке, а какое в недостатке:
- если щелочь взята в избытке, то реакция идет с образованием средней соли — карбоната:
2NaOH (изб.) + CO2 = Na2CO3 + Н2О
- если в избытке находится углекислый газ, то образуется кислая соль — гидрокарбонат:
NaOH + CO2 (изб.) = NаНCO3
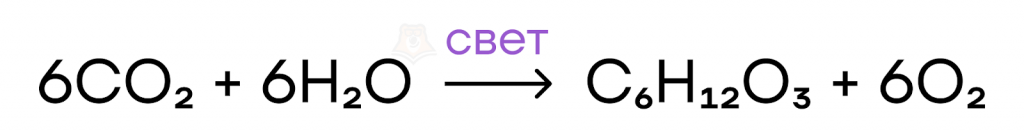
Уникальной для CO2 является реакция фотосинтеза — образование из углекислого газа углеводов под действием солнечного света, которая протекает в клетках растений и является основным источником энергии для них.
Угольная кислота (углекислота) Н2CO3
Угольная кислота (Н2CO3) — это водный раствор углекислого газа (CO2), данная кислота является очень неустойчивой и распадается на воду и соответствующий оксид, поэтому в реакциях мы всегда записываем ее как СО2 + Н2О. Является слабой кислотой, из-за чего считается слабым электролитом.
За счет кислотных свойств может вступать:
- в реакции ионного обмена;
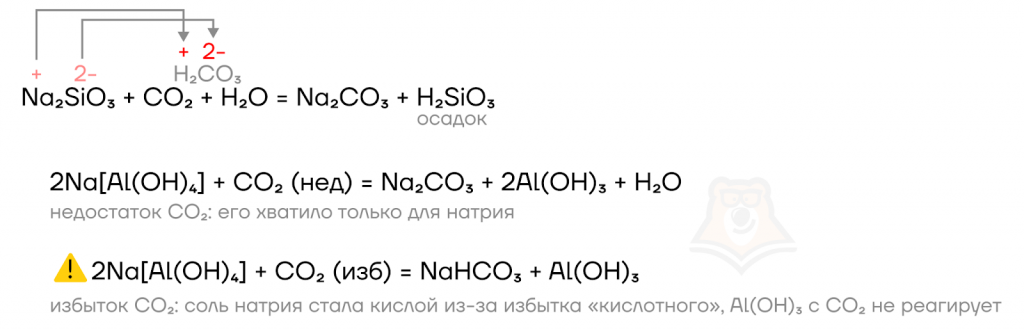
- в реакции соединения со средними солями (карбонатами) с образованием кислых солей (гидрокарбонатов).

Соли угольной кислоты — карбонаты и гидрокарбонаты
Карбонаты — средние соли угольной кислоты с общей формулой MeCO3, то есть они состоят из катиона металла и карбонат-аниона СО32-.
Гидрокарбонаты — кислые соли угольной кислоты с общей формулой MeНCO3, то есть они состоят из катиона металла и гидрокарбонат-аниона НСО3—.
Теперь, когда мы знаем и можем различать карбонаты и гидрокарбонаты, давайте изучим их химические свойства.
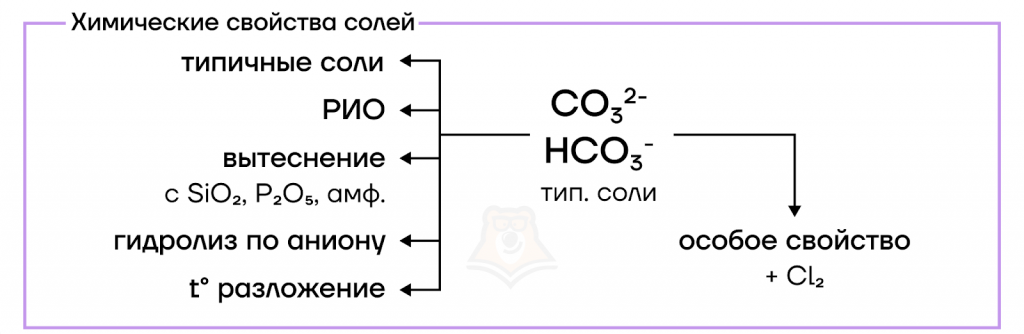
- Соли — хорошие электролиты, поэтому они вступают в реакции ионного обмена с другими электролитами: солями, основаниями и кислотами.

- Более «сильные» оксиды (SiO2, P2O5 и амфотерные) способны при сплавлении вытеснять слабый CO2 из его солей.

- Растворимые карбонаты и гидрокарбонаты подвергаются гидролизу по аниону, из-за чего среда их растворов слабощелочная:
К2СО3 + H2O ⇄ КНСО3 + КОН
КНСО3 + H2O ⇄ Н2СО3 (H2O + CO2) + КОН
- Нерастворимые карбонаты и все гидрокарбонаты термически разлагаются.
Разложение средних солей протекает с образованием оксида металла и углекислого газа (CO2), кислые соли разлагаются до средних солей, воды и СО2.
MgCO3 (t) = MgO + CO2 ↑
Ca(HCO3)2 (t) = CaCO3 + CO2↑ + H2O
(CuOH)2CO3 (t) = 2CuO + CO2↑ + H2O (разложение малахита)
- Карбонаты алюминия, хрома(III) и железа(III) подвергаются необратимому гидролизу:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
- Карбонаты активных металлов вступают с хлором в особую окислительно-восстановительную реакцию:
3К2СО3 + 3Cl2 = 5KCl + KClO3 + 3CO2↑
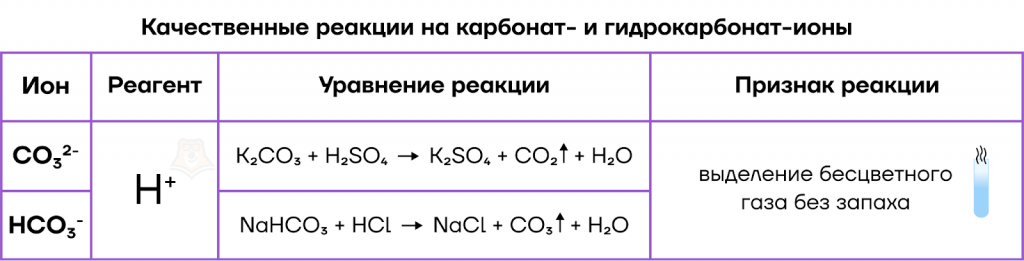
Карбиды
Соединения углерода с другими элементами называются карбидами. Карбиды бывают следующих видов.
- Ковалентные. Это карбиды, в которых атом углерода связан ковалентными связями с неметаллами. Например, SiC (карбид кремния) — редкий минерал, по свойствам похожий на алмаз. Такие карбиды образуют очень прочные атомные кристаллы, поэтому химически малоактивны.
- Ионные. Это соединения углерода с металлами. Они легко разлагаются водой и кислотами с образованием разных веществ в зависимости от конкретного карбида.
Например, гидролиз карбида алюминия приводит к образованию метана:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Карбида кальция — к образованию ацетилена:
СаС2 + 2Н2O = Са(OH)2 + HCCH
И наконец, карбид магния разлагается соляной кислотой с образованием пропина:
Mg2C3 + 4HCl = 2MgCl2 + HCC–CH3
Теперь, когда мы изучили химические свойства кремния и его соединений, закрепим наши знания на примере задания №8 ЕГЭ.
Задание. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) CO2
Б) С
В) СО
Г) H2O
1) NaOH, Cl2, H2
2) H2SO4 (конц.), Ca, Al2O3
3) C, Al4C3 , CO2 (h)
4) NaOH (изб.), Ca(OH)2, Mg
5) Li, KOH, Si
Решение.
1. Начнем с CO2. Он реагирует со щелочами, Mg и C, значит нам подходит 4 вариант (А — 4).
Реакции:
2NaOH (изб.) + CO2 = Na2CO3 + H2OCa(OH)2 + CO2 = CaCO3 + H2OCO2 + 2Mg = 2MgO + C
2. Переходим к углероду. Как мы уже знаем, этот «товарищ» может реагировать с концентрированными азотной и серной кислотами, активными металлами и их оксидами. Под это описание подходит вариант 2 (Б — 2).
Реакции:
C + 2H2SO4 (конц.) = 2SO2 + CO2 + 2H2O9C + 2Al2O3 = Al4C3 + 6CO
2C + Ca = CaC2
3. Угарный газ является несолеобразующим оксидом, значит для него не характерны реакции со щелочами и другими оксидами. Методом исключения остается вариант под номером 1 (В — 1).
Реакции:
NaOH + CO = HCOONaCO + Cl2 = COCl2
CO + 2H2 = CH3OH4.
4. Вода не реагирует с основаниями, кислотами, а значит мы выбираем 3 вариант, как единственно верный (Г — 3).
Реакции: C + H2O = CO + H26CO2 + 6H2O = С6H12O6 + 6O2Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Ответ: 4213
Круговорот углерода в природе
Углерод непрерывно циркулирует в биосфере Земли под влиянием химических и прочих процессов: в фотосинтезе, дыхании растений, человеческой деятельности. Кратко это отражено на схеме.
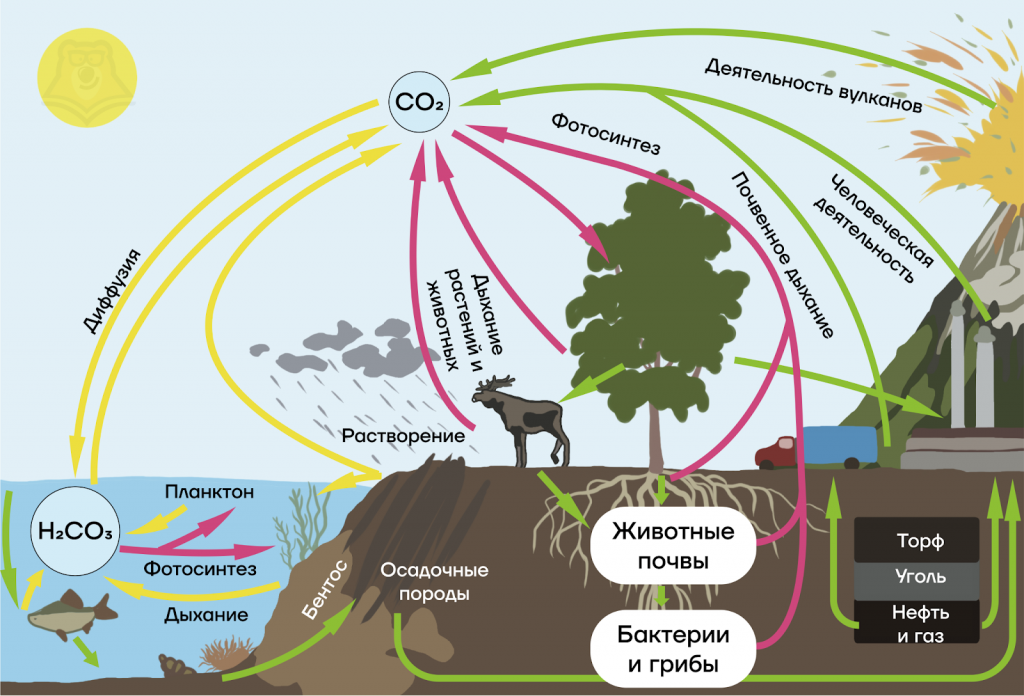
Основной запас углерода на Земле — углекислый газ CO2. Он находится в атмосфере и растворен в Мировом океане.
Из атмосферы углекислый газ поглощается растениями. В процессе фотосинтеза они перерабатывают его в органические вещества. Растения могут быть съедены травоядными животными, которые возвращают углерод в атмосферу в виде углекислого газа в процессе дыхания, а также после своей смерти, разлагаясь с образованием CO2. Растения могут погибнуть сами и начать разлагаться или стать пищей для редуцентов — организмов, питающихся мертвым органическим веществом. После полного разложения углерод опять же возвращается в атмосферу в виде CO2.
Между Мировым океаном и атмосферой происходит постоянный газообмен CO2. Углерод, входящий в ткани морских животных и растений, постепенно накапливается в виде известковых отложений и переходит в осадочные породы, где становится ископаемым топливом — торфом, углем, нефтью и газом.
В современном мире углерод включен в круговорот еще и как продукт человеческой деятельности: продукты и отходы нефтепереработки и другой промышленности.
| Можно ли назвать углерод самым главным химическим элементом? Вся жизнь на Земле связана с углеродом. Углерод входит в состав и является основой любого органического вещества. А значит, он входит в молекулы каждого живого существа в виде аминокислот, ДНК, АТФ, белков, жиров и углеводов, участвует в процессах дыхания, синтеза веществ, метаболизма, энергетическом обмене. |

Сегодня нам удалось достаточно глубоко изучить углерод и его соединения. На этом наше увлекательное путешествие по миру неорганической химии, конечно, не заканчивается. Ну а в следующей статье вы подробнее узнаете о фосфоре и его «трех братьях» «Элементы VА группы. Фосфор».
Термины
Восстановление — процесс приобретения частицей электронов.
Ковалентная связь — это тип химической связи, в которой электроны двух атомов неметаллов образуют общие электронные пары, тем самым соединяясь в молекулы (примеры: H2, Cl2, CH4 и т.д.). Данный тип связи характерен только для неметаллов.
Кристаллическая решетка — это упорядоченное пространственное расположение атомов, ионов или молекул в кристалле.
Окислитель — вещество, атомы которого присоединяют к себе электроны.
Слабый электролит — вещество, которое лишь частично диссоциирует на ионы.
Фактчек
- Углерод — «элемент жизни», который входит в состав всех органических соединений и некоторых неорганических соединений.
- Возможные степени окисления углерода в неорганике: -4, 0, +2, +4.
- Синтез-газ — смесь угарного газа с водородом, активно используется в органическом синтезе.
- У углерода есть несколько аллотропных модификаций: графит, алмаз, фуллерены.
- Получение металлов из их оксидов с помощью углерода называется пирометаллургией.
- Способность углерода образовывать «крепкие» связи с другими элементами позволяет ему создавать разнообразные органические соединения, включая углеводороды, аминокислоты и нуклеотиды, которые являются основой жизни.
Проверь себя
Задание 1.
Какова максимальная валентность углерода?
- I
- II
- III
- IV
Задание 2.
Какими свойствами обладает оксид углерода(IV)?
- Кислотными свойствами
- Основными свойствами
- Амфотерными свойствами
- Нейтральными свойствами
Задание 3.
Что можно получить дегидратацией муравьиной кислоты?
- Углерод
- Угарный газ
- Углекислый газ
- Угольную кислоту
Задание 4.
Какие соли образуются при сплавлении угарного газа со щелочами?
- Соли угольной кислоты
- Комплексные соли
- Соли муравьиной кислоты
- Гидрокарбонаты
Ответы: 1. — 4; 2. — 1; 3. — 2; 4. — 3.


 к списку статей
к списку статей





