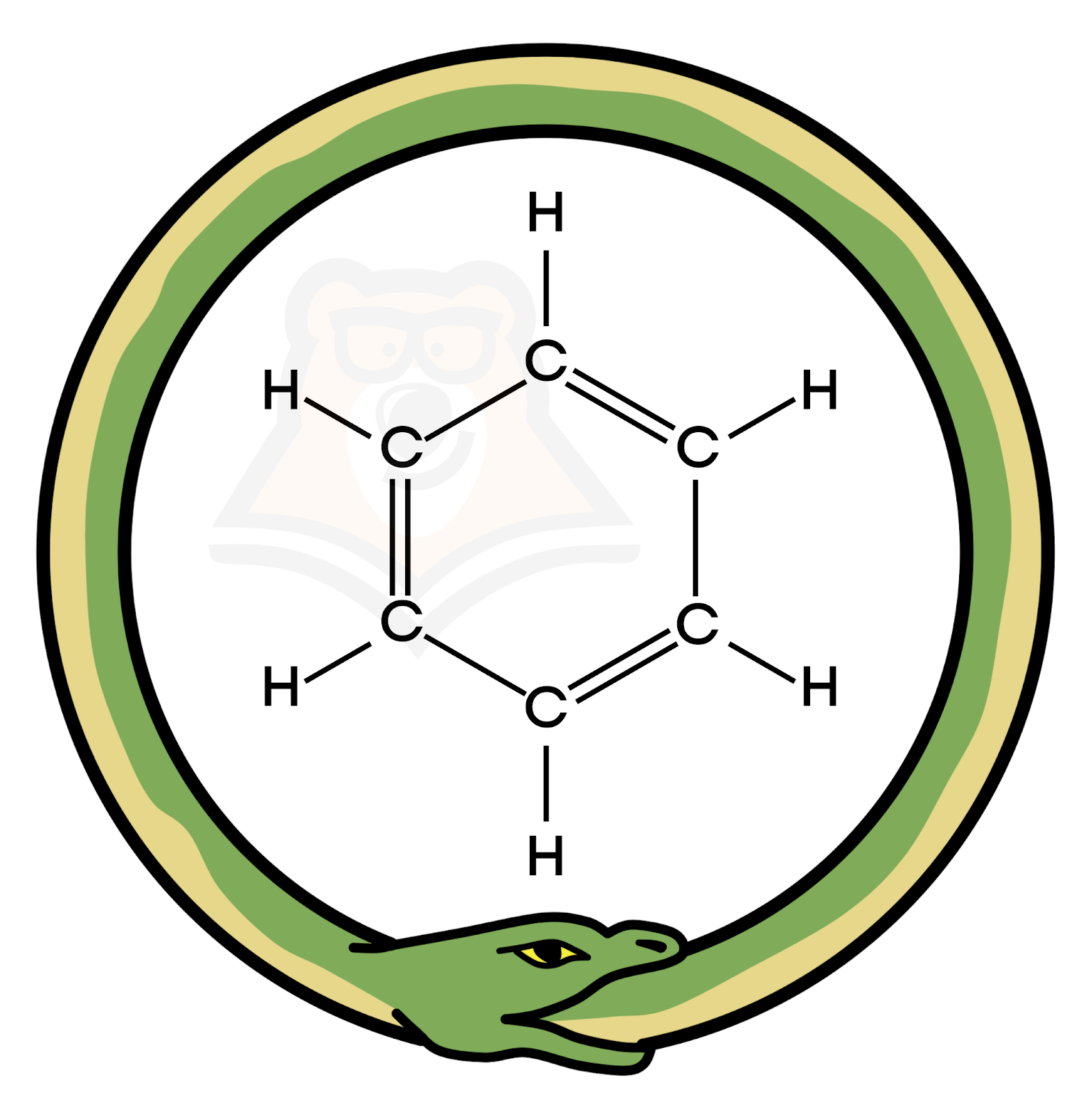
Арены. Бензол как представитель ароматических углеводородов
На этой странице вы узнаете
- Как связано бензольное кольцо с кольцом убитой графини?
- Если арены — это ароматические углеводороды, значит, у них есть приятный и душистый аромат?
- Взрывные открытия: как тринитротолуол, тротил и Нобелевская премия стали символами научных открытий и разрушения?
Сегодня мы с вами поговорим о шестиугольниках. Нет, вы попали не на урок математики, вы все еще на химии. Просто тема этой статьи — арены, а абсолютно каждый представитель этого класса содержит «шестиугольник» с колечком посередине.
Строение аренов
Арены — это ароматические углеводороды с одним или более бензольным кольцом в молекуле.
| Как связано бензольное кольцо с кольцом убитой графини? В 1865 году немецкий химик Фридрих Кекуле определил структурную формулу бензола. Но до этого времени он долго пытался понять, как устроена молекула бензола, ведь в нем шесть атомов углерода, и ровно столько же водорода. В то время он проходил свидетелем по делу об убийстве одной графини. Преступник похитил у нее кольцо в виде двух переплетенных между собой змей. Эти змеи врезались ему в память, и как рассказывал он сам о своем сновидении: «Атомы углерода и водорода принялись танцевать перед моими глазами… Длинные нити очень часто сближались и сворачивались в трубу, напоминая двух зверей. Но что это? Одна из них вцепилась в собственный хвост, продолжая насмешливо кружиться перед моими глазами. Я внезапно пробудился и провел остаток ночи, чтобы изучить следствие моей гипотезы». После этого сна ему в голову сразу же пришла мысль о том, что атомы углерода в молекуле бензола связаны между собой в кольцо. |
Общая формула аренов: СnH2n−6
Бензольное кольцо — шестичленный цикл, образованный молекулами углерода с чередующимися простыми и двойными связями.
В отличии от алкенов двойные связи в бензоле очень прочные и просто так не разрушаются. Для объяснения этого явления рассмотрим строение молекулы бензола.
Атомы углерода, участвующие в образовании бензольного кольца, находятся в состоянии sp2-гибридизации. Подробнее про гибридизацию можно прочитать в статье «Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа».
В sp2-гибридизации участвуют три электронные орбитали углерода. Одна из трех р-орбиталей остается негибридизированной. Поскольку электроны на орбиталях заряжены отрицательно, орбитали занимают такое положение в пространстве, чтобы быть максимально удаленными друг от друга, поэтому три гибридизированные орбитали находятся в одной плоскости с углом в 120° (длина связи 0,140 нм), перпендикулярно этой области расположена негибридизированная р-орбиталь.
На изображении ниже видно, что форма молекулы плоская, все атомные орбитали выстраиваются в «плоское кольцо». Перпендикулярно плоскости кольца находятся негибридизированные р-орбитали. Все 6 электронов, расположенные на этих орбиталях, объединяются в единую систему, которую можно изобразить в виде двух кругов снизу и сверху от циклов. Такое объединение называется сопряжением.
Электроны принадлежат сразу всем атомам углерода. Говорят, что они делокализованы. Это ароматическая π-система или π-электронное облако прочно связывает все атомы углерода, придавая дополнительную химическую устойчивость молекуле.
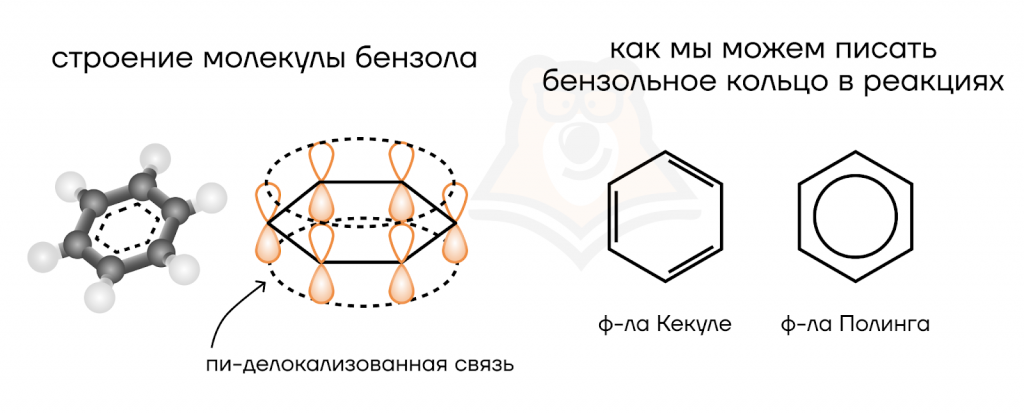
- Гибридизация атомов C=С: sp2;
- связи: двойная (σ + π) и одинарные (σ);
- форма молекул (участок С=С): плоская;
- валентный угол: 120°;
- длина связи: 0,140 нм.
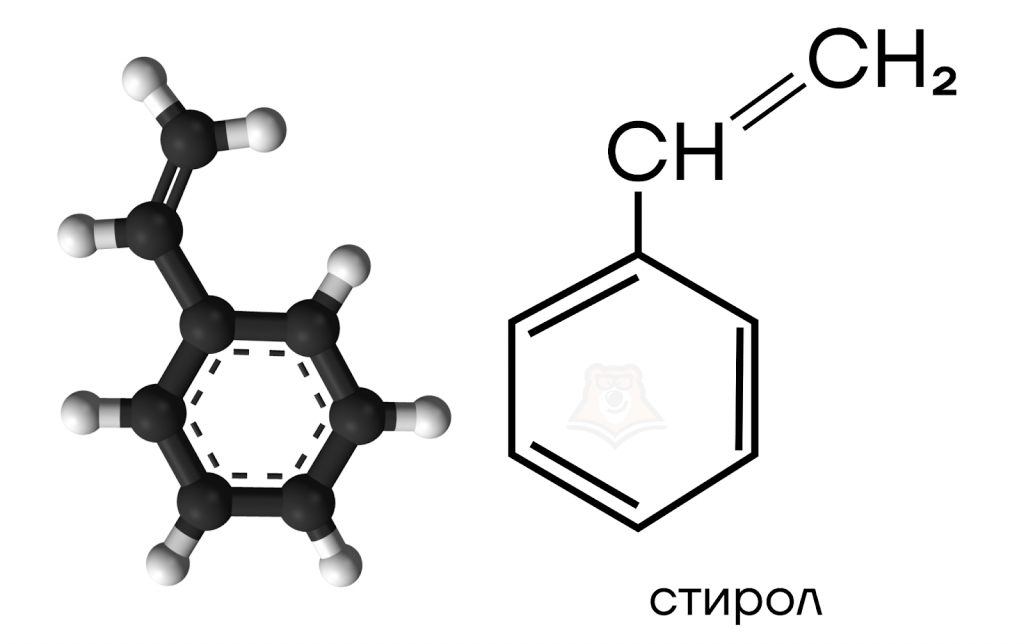
Рассмотрим строение еще одного важного представителя аренов — стирола.
Стирол — тривиальное название винилбензола. В своем строении стирол содержит бензольное кольцо и радикал -CH=CH2, который называют «винил».
Гомологический ряд аренов
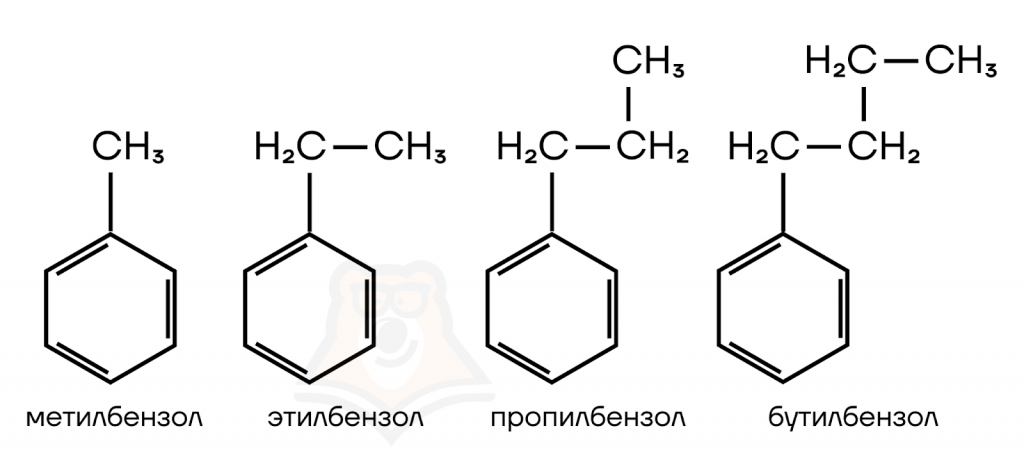
Гомологами бензола будут являться вещества, включающие помимо бензольного кольца еще и предельные углеводородные радикалы, различающиеся на одну или несколько CH2-групп.
Метилбензол, этилбензол — гомологи бензола, т.к. соответствуют общей формуле гомологического ряда и отличаются от бензола по составу на одну и две СН2-группы соответственно.
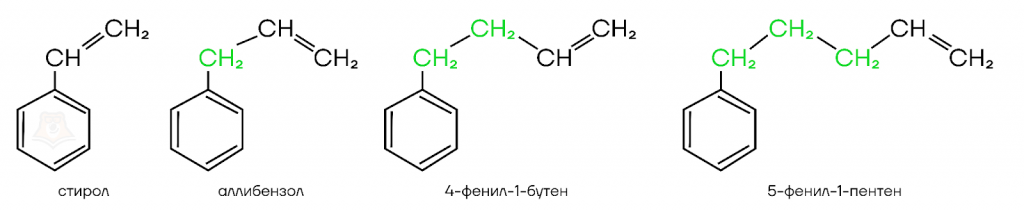
Общая формула гомологического ряда стирола: CnH2n-8. Первые четыре представителя гомологического ряда стирола: стирол (первый представитель), аллилбензол (радикал -СH2-CH=CH2 называют «аллил»), 4-фенил-1-бутен, 5-фенил-1-пентен.
Давайте научимся правильно называть арены, рассмотрим виды номенклатуры этих соединений.
Номенклатура аренов
Для формирования названий аренов используют систематическую номенклатуру IUPAC или существующие тривиальные названия.
- Систематическая номенклатура IUPAC
Согласно номенклатуре ИЮПАК, все арены являются производными бензола.
Название формируется следующим образом.
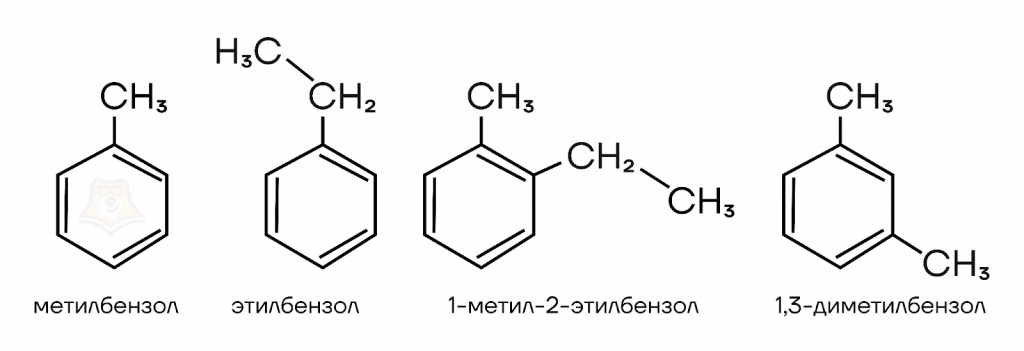
- В основе молекулы бензол.
- Заместители нумеруем так, чтобы у них были минимальные номера.
- Если заместители разные, то нумеруем по старшинству. Метил — старший, далее чем больше атомов углерода, тем старше заместитель. Одинаковые заместители соединяются префиксами ди-, три-, тетра- и так далее.
- В названии указывается (при наличии) цифрами местоположения заместителей в бензоле, затем название заместителя, в конце слово «бензол».
Рассмотрим примеры:
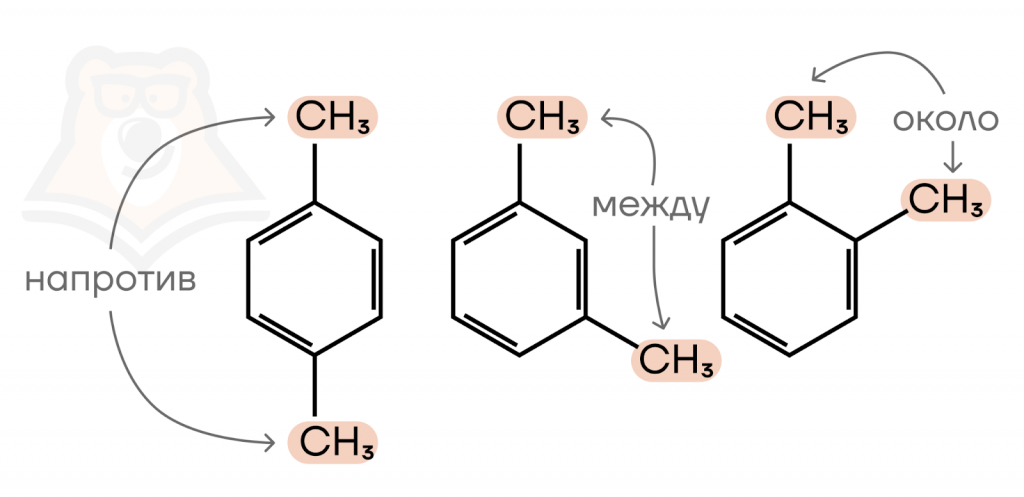
Если же в бензольном кольце два заместителя, часто вместо использования длинного названия используются приставки в зависимости от положения заместителей:
- заместители рядом друг с другом — орто—положение (о, ты рядом).
- атом углерода между заместителями — мета-положение (садитесь через место);
- напротив друг друга — пара-положение (противоположно)
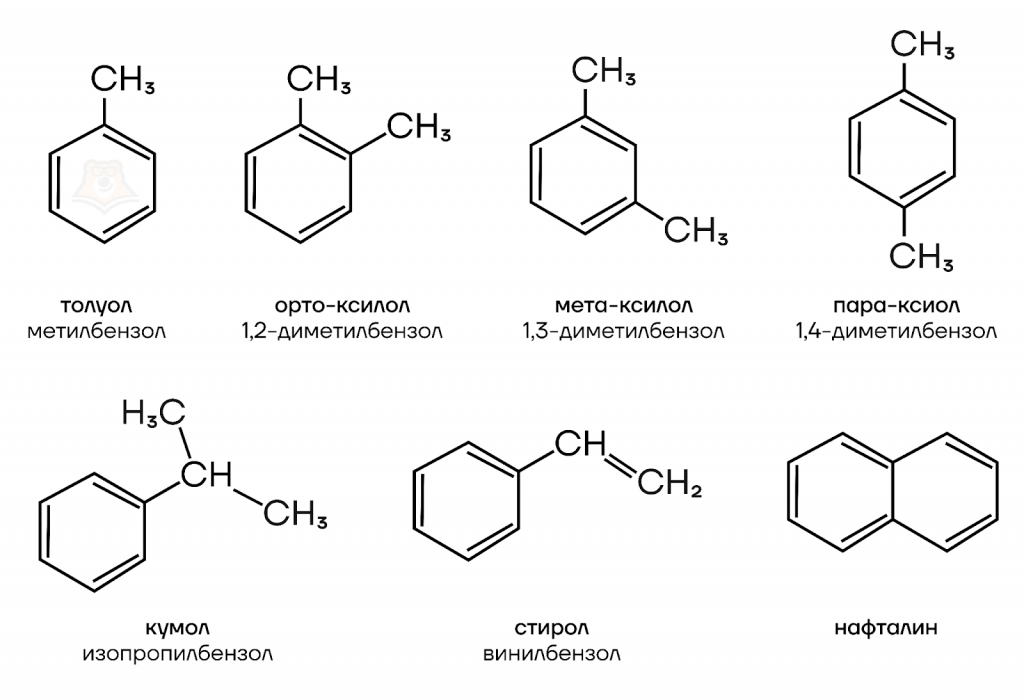
- Тривиальные названия
Наиболее распространенные арены и их тривиальные названия представлены на рисунке ниже:
Для закрепления знаний решим задание подобное заданию №10 ЕГЭ.
Задание.
Установите соответствие между названием соединения и его химической формулой.
А) этилбензол
Б) толуол
В) винилбензол
Г) изопропилбензол
1) C6H4(CH3)2
2) C6H5-CH3
3) C6H5-C2H5
4) C6H5-CH=CH2
5) C6H5-CH2-CH2-CH3
6) C6H5-CH(CH3)2

Решение.
Для решения этого задания необходимо знать тривиальные названия производных бензола и названия радикалов: винил -CH=CH2, изопропил -CH(CH3)2, этил -C2H5. Тогда не составит трудности выбрать правильные варианты ответа.
А) Этилбензол — производное бензола. Бензольному кольцу соответствует молекулярная формула С6Н5-, а алкильному радикалу этилу — молекулярная формула С2Н5-. Подходит ответ 3.
Б) Толуол — тривиальное название производного бензола метилбензола. Молекула состоит из бензольного кольца с молекулярной формулой С6Н5— и заместителя метила с формулой СН3-. Подходит ответ 2.
В) Винилбензол состоит из бензольного кольца и винильного радикала с формулой -CH=CH2. Подходит ответ 4.
Г) Изопропилбензол состоит из бензольного кольца и изопропильного радикала. Изопропил — разветвленный пропильный радикал с формулой -CH(CH3)2. Подходит ответ 6.
Ответ: 3246
Рассмотрим физические свойства аренов.
Физические свойства аренов
Арены плохо растворимы в воде, но хорошо — во многих органических растворителях. Большинство из них — ядовитые вещества, многие являются канцерогенами.
Бензол — бесцветная жидкость со специфическим запахом, легче воды, высокотоксичен, особенно при пероральном приеме, сильный канцероген, мутаген, ирритант (раздражает кожу, опасен для органов зрения), огнеопасен.
Толуол — бесцветная жидкость с характерным запахом, является сильно токсичным ядом, при длительном воздействии на организм способен вызвать необратимые поражения центральной нервной системы, взрывоопасен, пожароопасен.
Стирол — бесцветная жидкость со сладковатым запахом, вызывает раздражение слизистых оболочек дыхательных путей и глаз.
Ксилолы токсичны и пожароопасны.
| Если арены — это ароматические углеводороды, значит, у них есть приятный и душистый аромат? Ароматичность не имеет непосредственного отношения к запаху органических соединений и является понятием, характеризующим совокупность структурных и энергетических свойств некоторых циклических молекул, содержащих систему сопряженных двойных связей. Как сказано выше, большинство аренов очень ядовиты, поэтому их лучше даже не пытаться понюхать, иначе можно получить раздражение слизистой. Термин «ароматичность» был предложен потому, что первые исследованные представители этого класса веществ обладали приятным запахом. |

Настало время поговорить об изомерии аренов.
Изомерия аренов
Вспомним, что изомеры — вещества, имеющие одинаковый качественный и количественный состав, но разное строение и свойства.
Для аренов характера структурная изомерия. Рассмотрим подробнее каждый вид структурной изомерии.
- Изомерия положения заместителей в бензольном кольце.
Мы уже выяснили, что в зависимости от положения заместителей относительно друг друга добавляются приставки пара— (заместители напротив друг друга), мета— (атом C между заместителями) и орто— (заместители рядом друг с другом).
Например орто-, мета-, пара-ксилол и этилбензол — изомеры с общей формулой С8Н10:
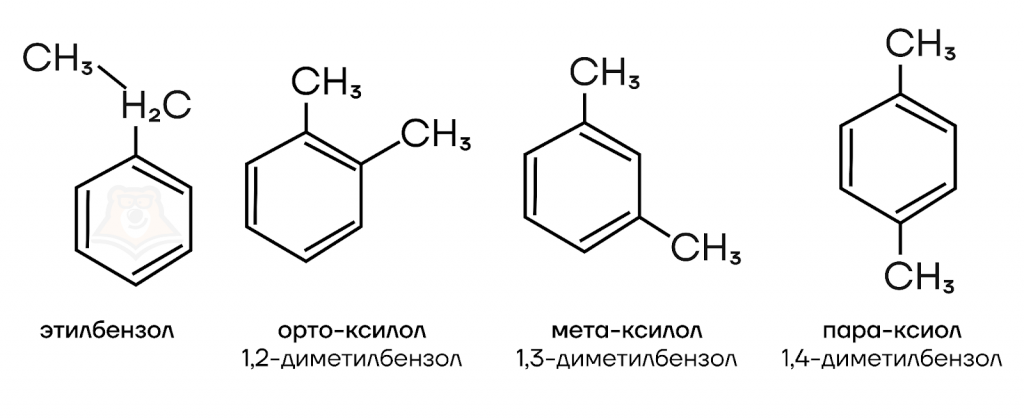
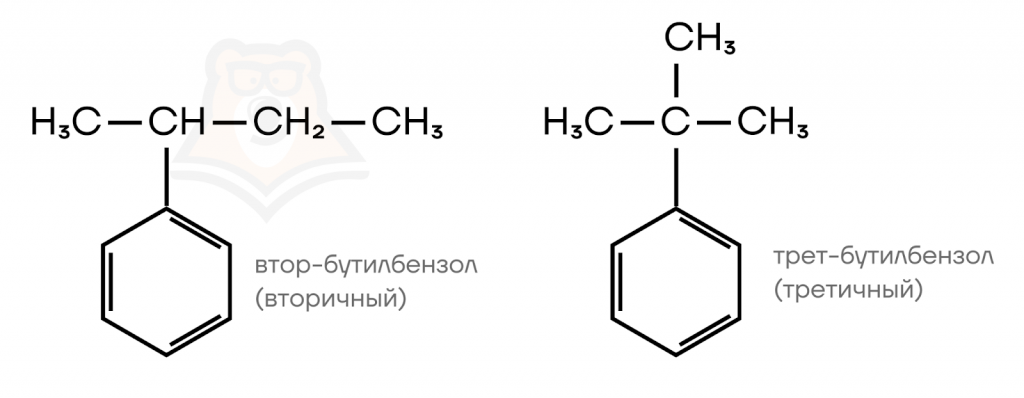
- Изомерия углеродного скелета радикалов.
Меняется только строение углеводородного скелета заместителей.
Перейдем к рассмотрению химических свойств аренов.
Химические свойства аренов
Арены вступают в реакции замещения, в реакции присоединения и окисления.
Перед тем, как начать изучать химические свойства аренов, стоит сказать про ориентанты.
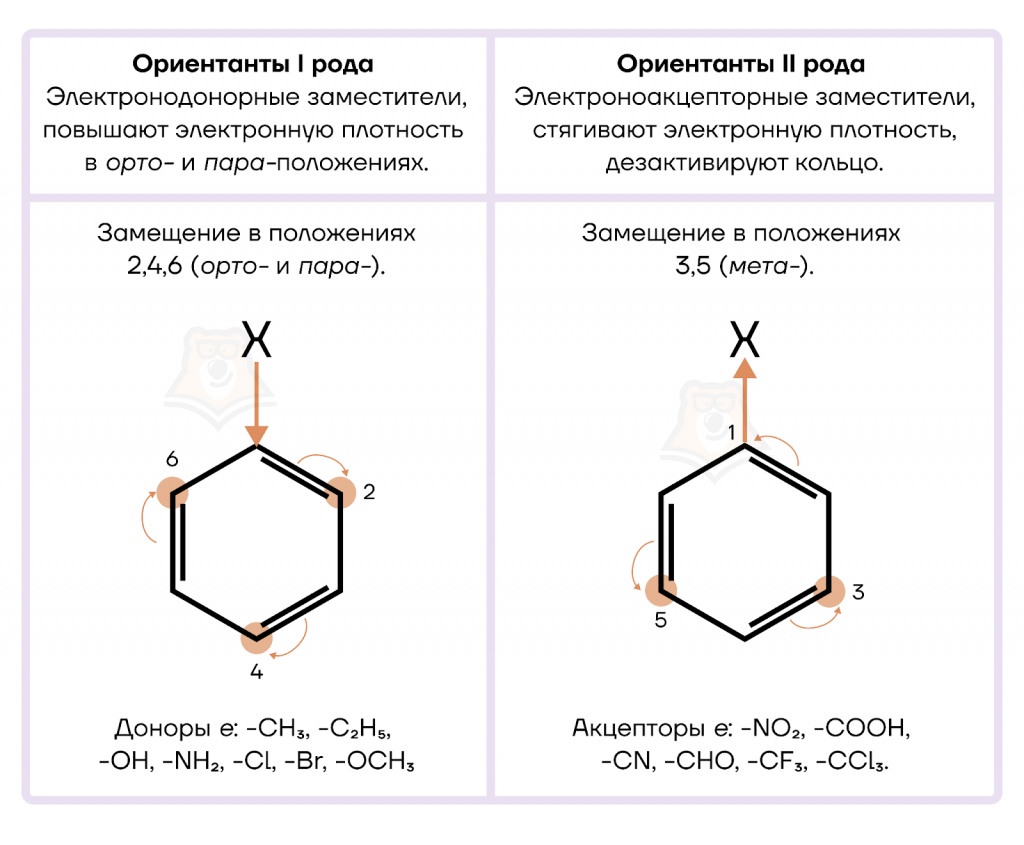
Ориентанты — заместители, которые за счет электронных эффектов вызывают в бензольном ядре перераспределение электронной плотности, таким образом облегчается замещение атомов водорода в определенных положениях.
Правила ориентации при электрофильном замещении в бензольном кольце основаны на взаимном влиянии атомов в молекуле. Если в незамещенном бензоле электронная плотность в кольце распределена равномерно, то в замещенном бензоле под влиянием заместителя происходит перераспределение электронов и возникают области повышенной и пониженной плотности. Это оказывает влияние на легкость и направление реакций электрофильного замещения. Подробнее о реакциях электрофильного замещения в статье «Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии».
То есть ориентация замещения связана с повышением и понижением электронной плотности в орто-, мета— и пара— положениях в бензольном кольце.
Ориентанты делятся на две группы: I рода и II рода.
- Ориентанты I рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.
- Ориентанты II рода направляют замещение преимущественно в мета-положение. К ним относят электроноакцепторные группы.
Подробнее про электронные эффекты заместителей, доноров и акцепторов электронов можно узнать в статье «Теория строения органических соединений».
Арены содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходят в первую очередь замещение атомов водорода, а не разрушение бензольного кольца. Для аренов характерен ионный механизм реакций замещения. Про ионный механизм реакций подробнее написано в статье «Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии».
Начнем с реакций замещения атомов водорода бензольного кольца.
- Галогенирование.
Для аренов галогенирование может протекать по двум механизмам:
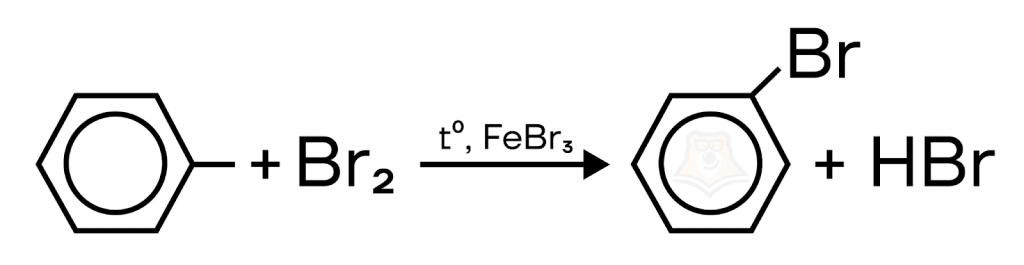
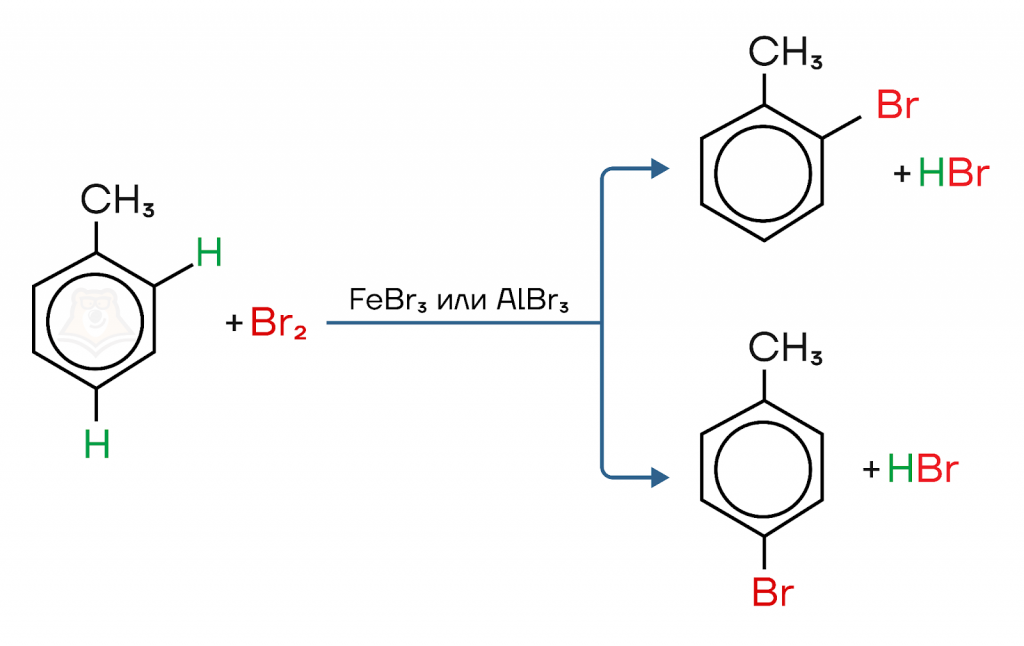
а) Ароматическое электрофильное замещение.
Замещение атома водорода на атом галогена (хлора или брома). Катализаторы в случае с хлором — хлорид алюминия или хлорид железа(III), с бромом — бромид железа(III) или бромид алюминия.
Если в реакцию электрофильного замещения вступают арены, содержащие заместители, то галоген занимает разные положения в зависимости от того, какого рода ориентантом является заместитель в бензольном кольце.
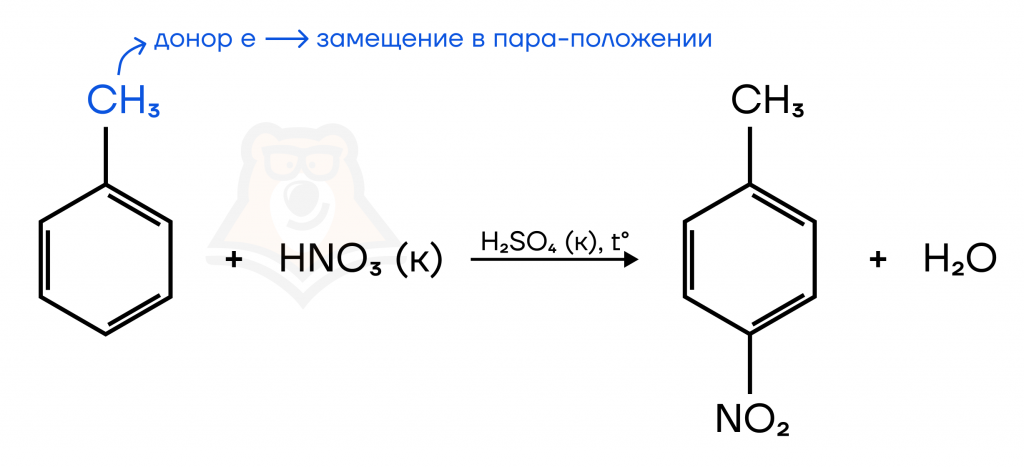
Например, при взаимодействии толуола с бромом образуется смесь орто- и пара- изомеров, так как метильная группа — ориентант I рода, повышает электронную плотность в орто- и пара- положениях.
б) Радикальное замещение.
Реакция протекает по радикальному механизму замещения на свету. Атом хлора замещает атом водорода в заместителе, не в бензольном кольце.
Если заместитель разветвленной структуры, то атом галогена замещает водород у α-атома углерода в заместителе.
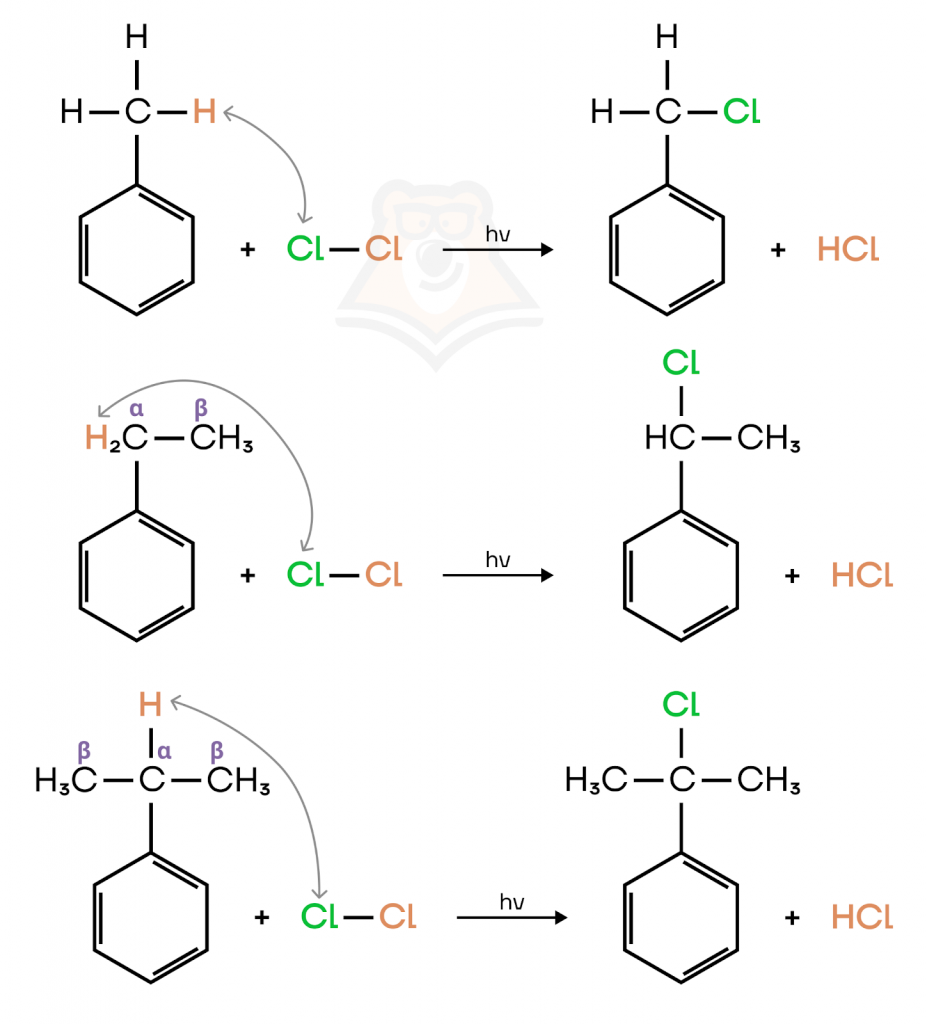
Нужно запомнить, что электрофильное замещение проходит в присутствии AlCl3, а радикальное — на свету.

Арены не вступают в реакцию с бромной водой и, соответственно, не обесцвечивают ее.
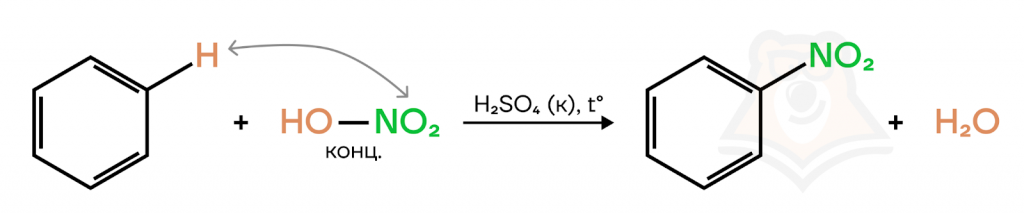
- Нитрование.
Для нитрования используют «нитрующую сместь» — смесь концентрированных азотной и серной кислот. Реакция является качественной, протекает при нагревании. В результате реакции образуется желтоватое вещество с резким запахом горького миндаля — нитробензол.
При написании реакции можно расписать азотную кислоту на «составляющие»: гидроксильную группу и нитрогруппу HO-NO2. Так проще понять, как происходит процесс замещения, и верно записать продукты реакции.
В реакции с гомологами образуется смесь изомеров, опять же, потому что метильная группа — ориентант I рода. В уравнении пишем только один из изомеров.
В более жестких условиях: при повышенной температуре и давлении, нитрогруппа замещает все атомы водорода в орто- и пара- положениях. Образуется тринитротолуол.
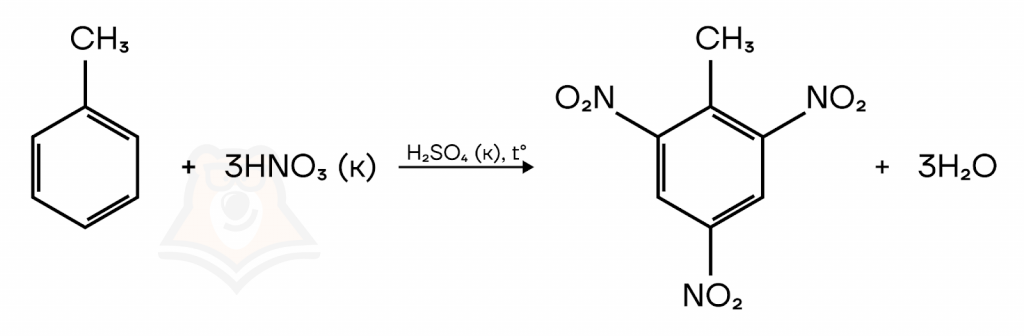
| Взрывные открытия: как тринитротолуол, тротил и Нобелевская премия стали символами научных открытий и разрушения? Вещество, которое образуется при нитровании толуола— тринитротолуол, в жизни является распространенным взрывчатым веществом — тротилом. История изобретения тротила интересна и связана с работой шведского химика Альфреда Нобеля. Сочетая различные химические вещества и экспериментируя с их пропорциями, Нобель наконец нашел соединение, которое стало известным как тротил. Для создания тротила он использовал тринитротолуол (TNT) в сочетании с другими добавками, такими как абсорбирующие вещества и структурные стабилизаторы. Тротил получил широкое применение и быстро стал одним из наиболее эффективных взрывчатых веществ своего времени. Он демонстрировал большую стабильность и силу взрыва, что сделало его популярным выбором в различных отраслях, включая горнодобывающую промышленность, строительство и армию. В 1888 году произошло недопонимание, когда объявление о смерти Альфреда Нобеля было опубликовано в СМИ по ошибке. На самом деле умер его брат, Людвиг. Альфред Нобель прочитал свой некролог во французской газете, который назывался «Торговец смертью мертв». Это заставило его задуматься о том, каким образом он хотел бы, чтобы его помнили люди. В результате этого события, он решил изменить свое завещание. В своем завещании, составленном в 1895 году, Нобель указал, что его огромное состояние должно быть использовано для создания премии, которая будет вручаться тем, кто сделал выдающиеся достижения в области науки и мирном решении конфликтов. Завещание Нобеля вызвало сильное впечатление в международном сообществе, и его последователи в Швеции работали над созданием фонда, который бы надежно управлял финансовыми средствами премии. Нобелевская премия была впервые вручена в 1901 году, и с тех пор стала одной из самых престижных и уважаемых наград в мире. |
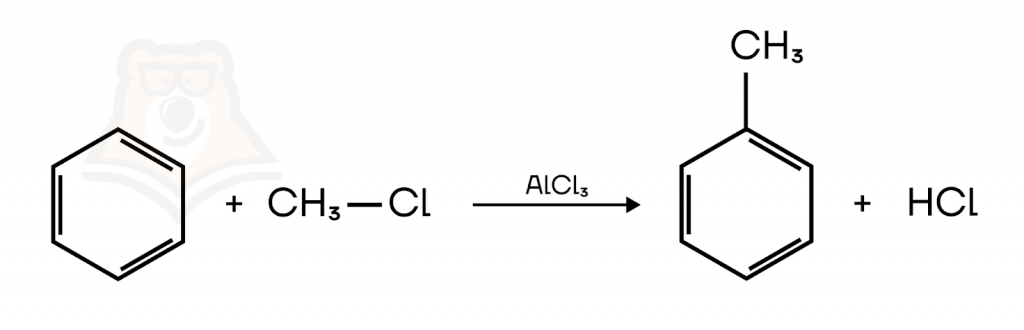
- Алкилирование. Реакция Фриделя-Крафтса.
Алкилирование — введение алкильного заместителя в молекулу органического соединения.
Алкилирование ароматических соединений протекает в присутствии катализаторов кислотного характера, например, AlCl3, BF3, ZnCl2, FeCl3, H3PO4.
Рассмотрим реакцию алкилирования бензола и его производных на примере их взаимодействия с галогеналканами и алкенами:
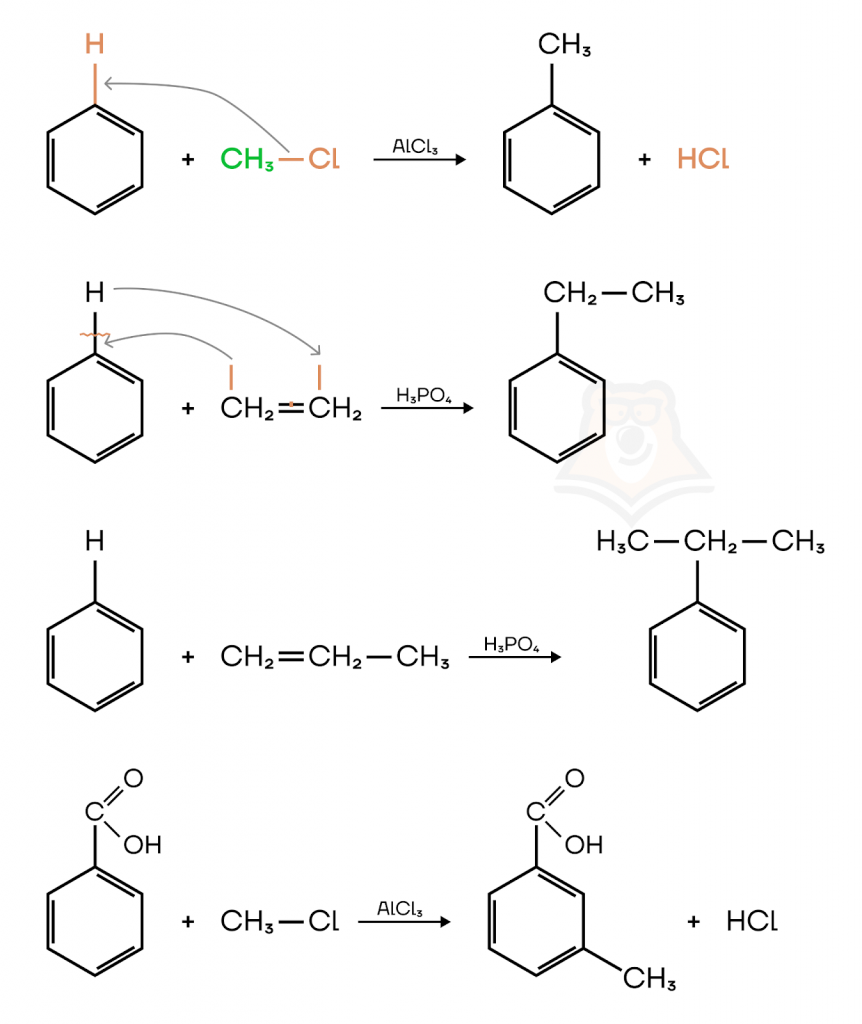
Теперь рассмотрим реакции присоединения.
- Галогенирование.
Реакция возможна только с хлором. Она протекает на свету, образуется гексахлоран, который по строению напоминает солнышко.
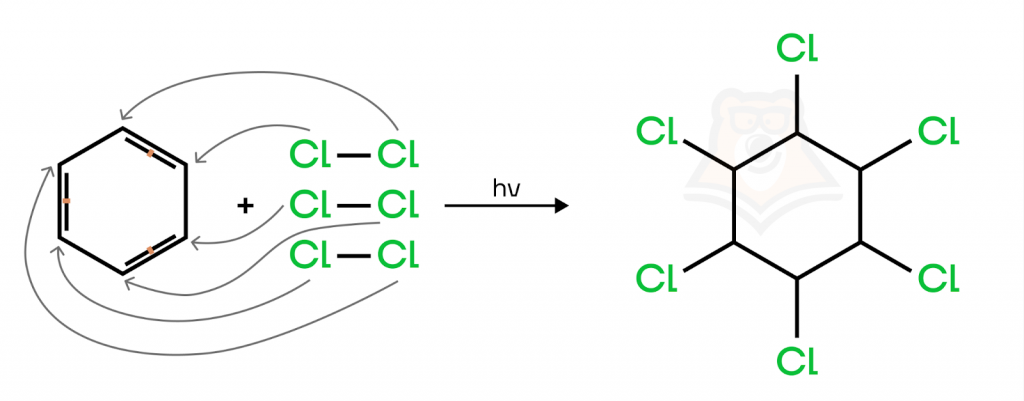
- Гидрирование.
Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов: никеля, платины, палладия. Причем, мягко говоря, не самых дешевых металлов.
В результате реакции все двойные связи восстанавливаются до одинарных, образуются циклоалканы.
Например, при взаимодействии бензола с водородом образуется циклогексан, в случае толуола — метилциклогексан, изопропилбензола — изопропилциклогексан.
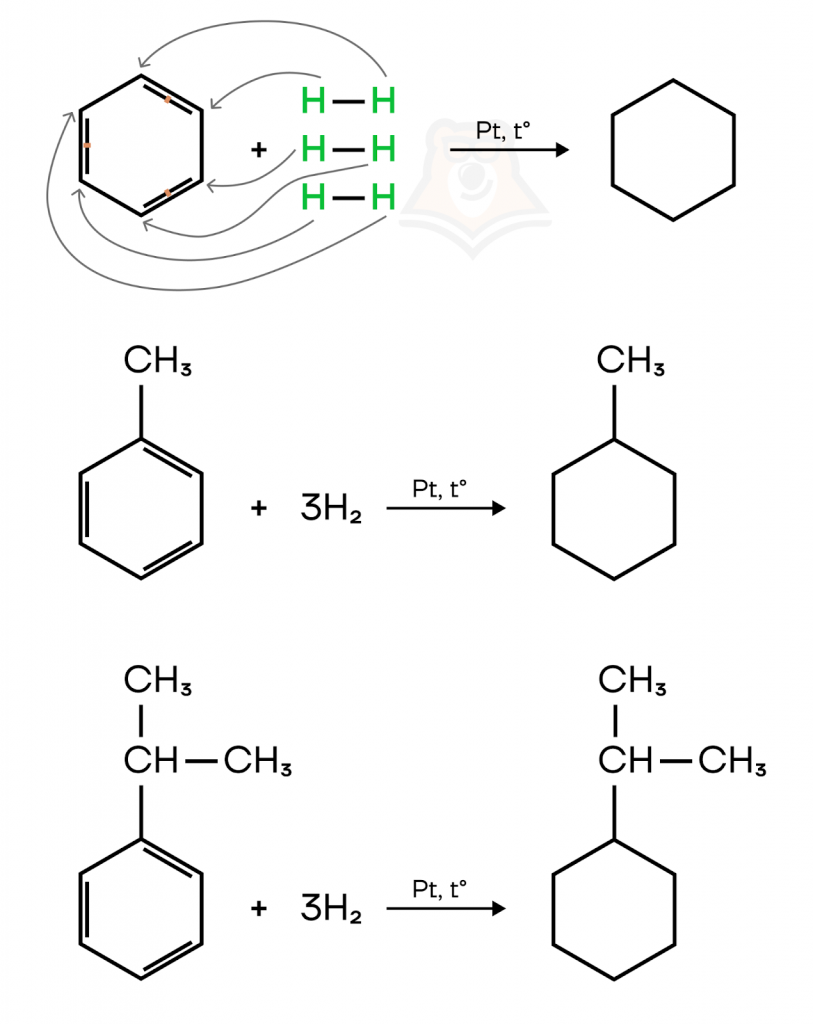
Теперь давайте узнаем, как у аренов протекают реакции окисления.

Бензол не вступает в реакции окисления с перманганатом калия.
Окисляются только арены с углеродными радикалами. Изменений в структуре самого бензольного кольца не происходит — нарушить его целостность довольно сложно. Радикалы окисляются до карбоксильной группы в кислой среде и до солей карбоновых кислот в щелочной среде.
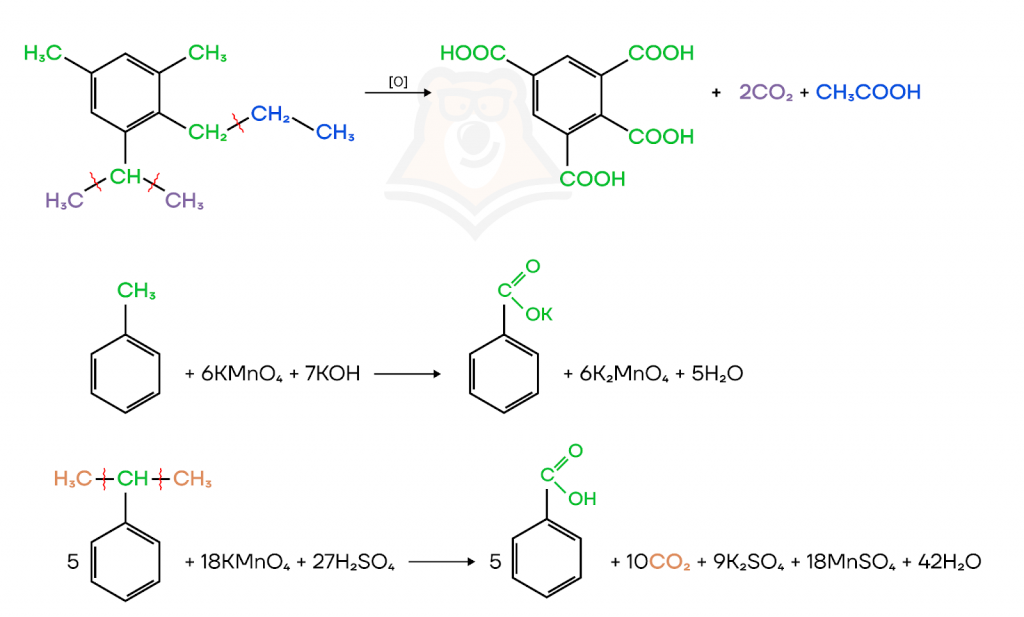
Арены так же, как и вся органика горят.
Все углеводороды сгорают до углекислого газа и воды. Пламя называют коптящим. Коптящее пламя обусловлено примесями копоти и угарного газа — это продукты неполного окисления кислородом органического вещества.
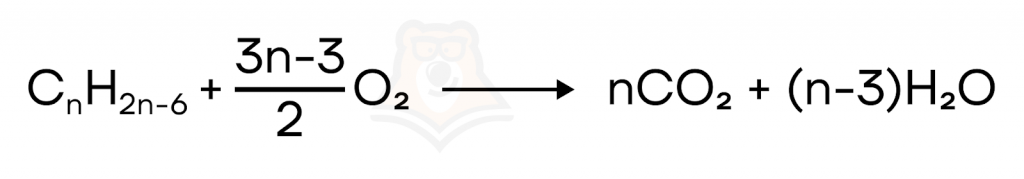
Отдельно рассмотрим химические свойства стирола.
Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов: вступает в реакции присоединения, окисления, полимеризации.
- Реакции присоединения
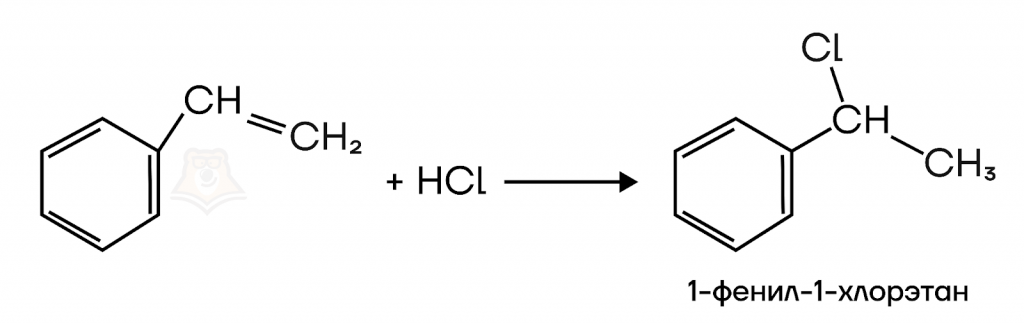
Стирол присоединяет галогеноводороды и воду в соответствии с правилом Марковникова.
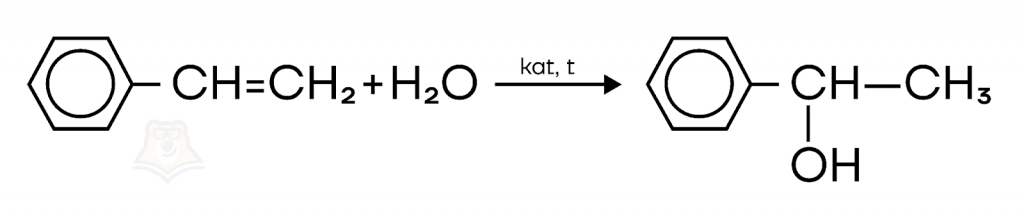
Например, при гидратации стирола образуется спирт 1-фенилэтанол-1. Реакция протекает с использованием катализатора и при нагревании.
При взаимодействии стирола с хлороводородом образуется 1-фенил-1-хлорэтан. Реакция протекает по правилу Марковникова.
Стирол присоединяет бром, обесцвечивая бромную воду.
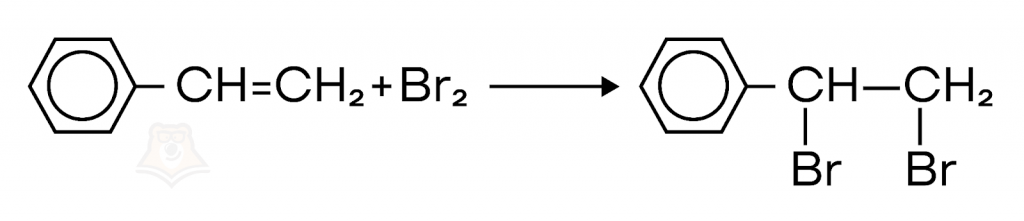
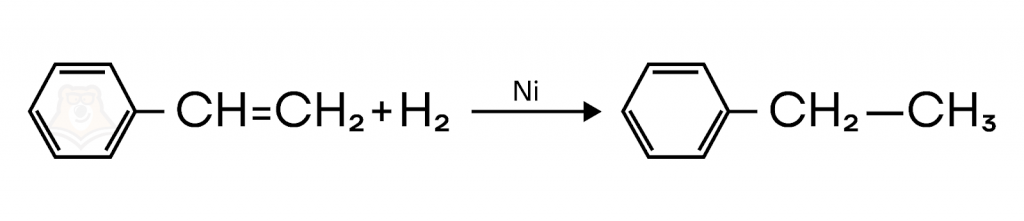
При гидрировании стирола образуется этилбензол.
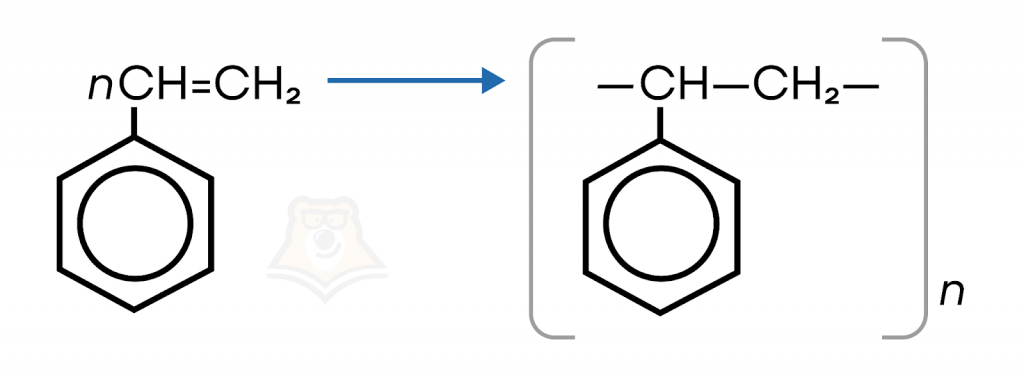
- Реакции полимеризации.
В результате реакции полимеризации образуется полистирол.
Уравнение в общем виде выглядит следующим образом:
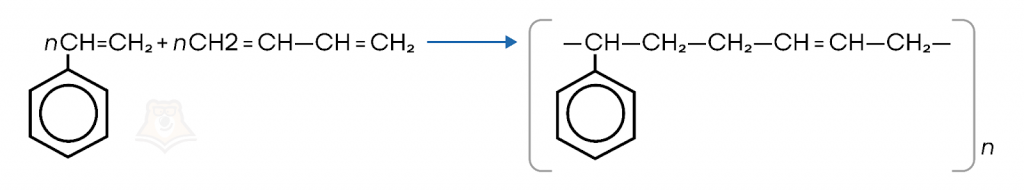
Реакций сополимеризации стирола с бутадиеном получают бутадиен-стирольный каучук.
- Реакции окисления.
- Мягкое неполное окисление. Реакция Вагнера.
Мягкое окисление в нейтральном растворе перманганата калия без нагревания. В качестве органического продукта реакции образуется двухатомный спирт.
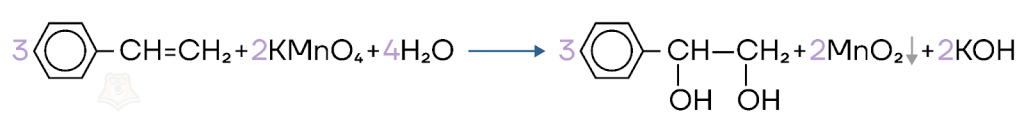
- Жесткое окисление.
Реакция протекает в кислой среде с перманганатом калия при нагревании. В результате реакции образуются бензойная кислота и углекислый газ.
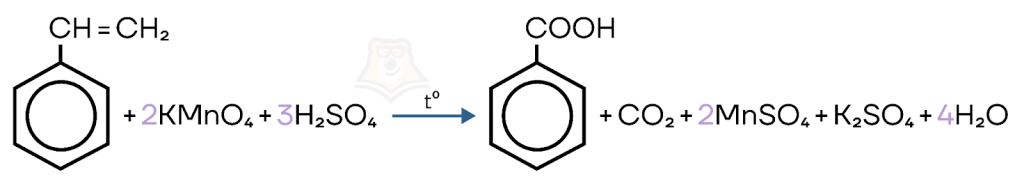
- Горение.
Как и все органические соединения, в избытке кислорода стирол сгорает с образованием углекислого газа и воды.
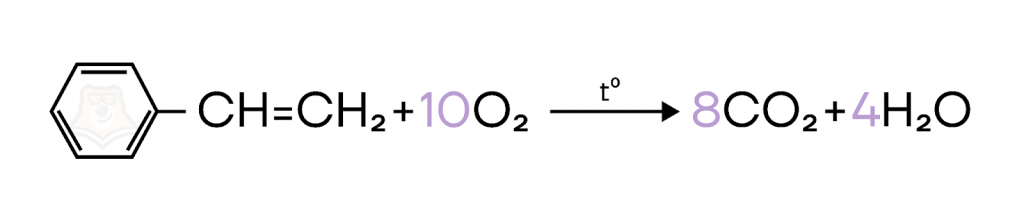
Решим задание подобное вопросу №12 ЕГЭ.
Задание.
Из предложенного перечня выберете все вещества, с которыми реагирует бензол.
1) хлорэтан
2) Br2
3) KMnO4
4) Na
5) HNO3
Решение.
Рассмотрим все варианты ответа.
1) Реакции хлоралканов с бензолом — реакции алкилирования, в результате которых образуются производные бензола. Ответ подходит.

2) При взаимодействии с бромом образуется бромбензол. Ответ подходит.
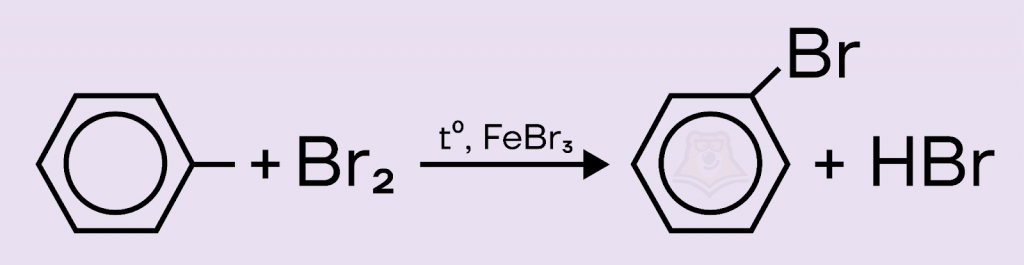
3) Бензол не окисляется перманганатом калия, это надо запомнить. Ответ не подходит.
4) С натрием бензол не вступает в реакцию. Ответ не подходит.
5) При взаимодействии с азотной концентрированной кислотой в присутствии концентрированной серной кислоты происходит нитрование бензола. Ответ подходит.
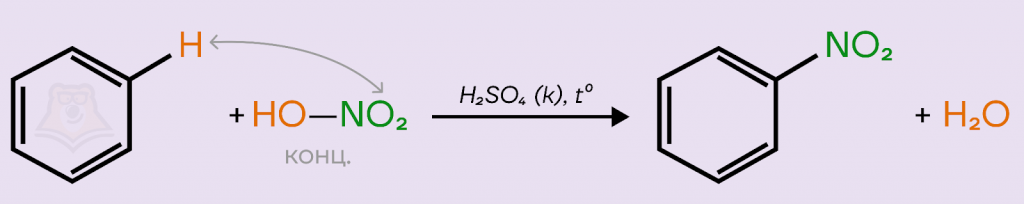
Ответ: 125
Теперь узнаем как же получают арены в промышленности и в лаборатории.
Методы получения аренов
Рассмотрим методы получения аренов.
1. Сплавление солей бензойной кислоты с щелочами. Реакция Дюма.
Реакция протекает при нагревании. Сплавляют соль бензойной кислоты со щелочью.

С реакцией Дюма мы уже встречались, когда рассматривали способы получения алканов, смотрите статью «Алканы».
2. Реакция Вюрца-Фиттига.
Реакцией Вюрца-Фиттига получают производные бензола путем взаимодействия галогенаренов с металлическим натрием и галогеналканами.
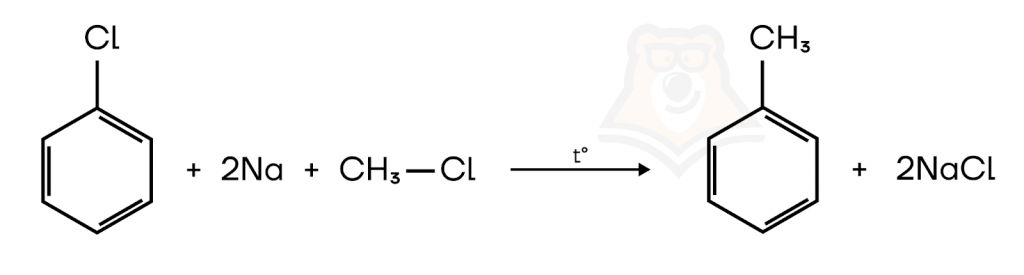
Реакция аналогична реакции Вюрца, смотрите статью «Алканы».
3. Алкилирование бензола и его гомологов.
При взаимодействии бензола и галогеналканов происходит замещение атома водорода на углеводородную группу.
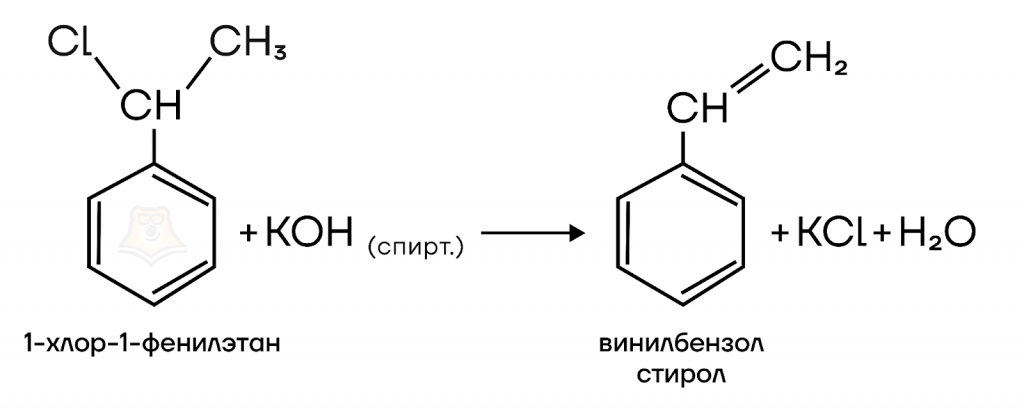
4. Получение стирола действием спиртового раствора щелочи на 1-хлор-1-фенилэтан.
Под действием спиртового раствора щелочи происходит отщепление галогена и атома водорода, образуется двойная связь.
5. Ароматизация алканов и циклоалканов.
Путем дегидрирования при нагревании на платиновом катализаторе получают бензол и толуол. Ароматизация лежит в основе риформинга — переработки фракций нефти с целью получения высококачественного топлива.

6. Дегидрирование.
Дегидрированием этилбензола получают стирол. Реакция протекает в присутствии катализатора, при повышенной температуре.
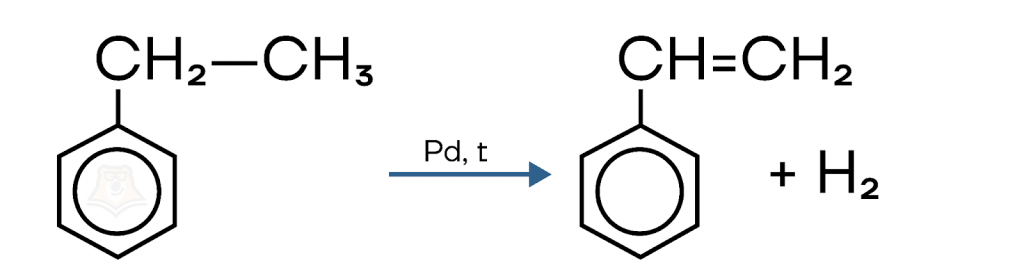
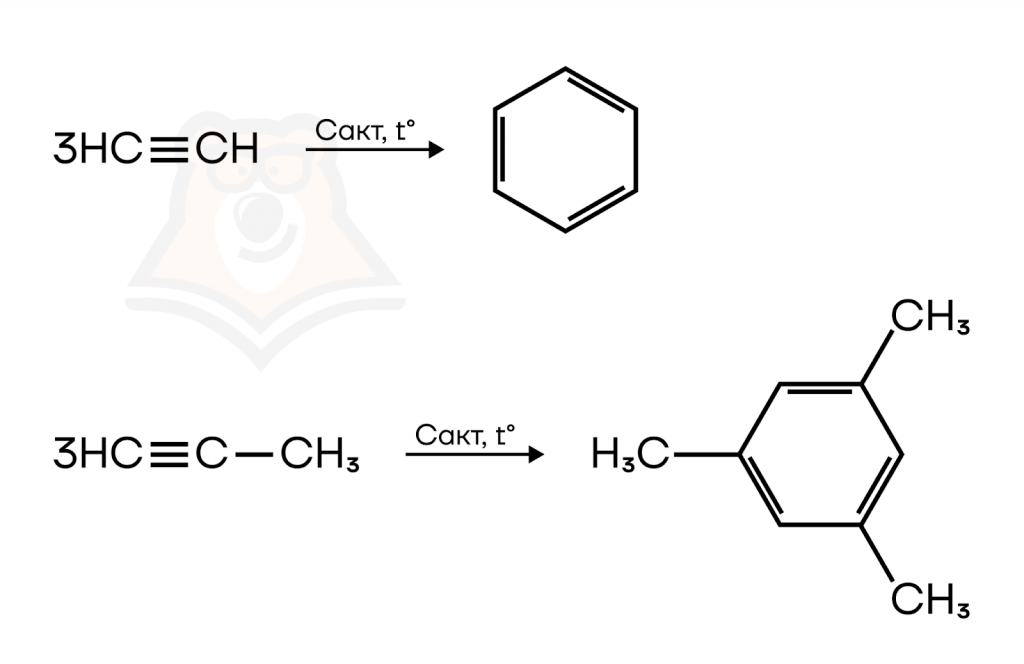
7. Тримеризация ацетилена и гомологов (реакция Зелинского).
При нагревании ацетилена под действием активированного угля образуется бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
Рассмотрим области применения аренов.
Применение аренов
Бензол широко используется для получения ароматических соединений — нитробензола, фенола, стирола, из которых изготавливают пластмассу, растворители, красители, резину и каучук, используют в фармацевтике.
Толуол используется для производства тротила — взрывчатого вещества.
Винилбензол при полимеризации дает вещество под названием полистирол, из которого изготавливают одноразовую посуду, детские игрушки, канцелярские товары.
Гексахлоран широко используется в сельском хозяйстве для борьбы с паразитами животных как инсектицид. В последнее время от применения гексахлорана стараются отказываться, так как он наносит вред здоровью человека и экологии.
Стирол — очень важный мономер в производстве полимерных материалов. Он широко используется в производстве пластиков, включая полистирол, который используется для изготовления пенопласта, одноразовой посуды, упаковки и других предметов.
Еще одно важное применение стирола связано с его использованием в производстве синтетической резины, известной как стирол-бутадиеновая резина, которая широко применяется в производстве автомобильных шин, ремней, уплотнений и других резиновых изделий.
Стирол также используется в производстве важных химических соединений, таких как бутадиен-стирольные латексы, которые являются основой для производства латексных красок и клеев. Кроме того, стирол применяется в производстве светочувствительных материалов, лаков, смол и других продуктов повседневного использования.
Мы рассмотрели строение и свойства бензола и его гомологов, которых относят к классу органических соединений арены. Вы также можете прочитать следующую статью «Предельные одноатомные и многоатомные спирты, фенол», посвященную не менее важному классу кислородсодержащих органических соединений.
Термины
Канцерогены — вещества и смеси, которые могут вызывать образование злокачественных опухолей или повышать частоту их появления.
Катализатор — вещество, ускоряющее химическую реакцию, но не расходующееся в ней.
Органические растворители — низкомолекулярные жидкости, состоящие из летучих органических соединений.
Сополимеризация — это реакция получения полимера из двух или более различных мономеров.
Электронная плотность — плотность вероятности обнаружения электрона в данной точке конфигурационного пространства.
Фактчек
- Арены — это ароматические углеводороды с одним или более бензольным кольцом в молекуле.
- Общая формула аренов выглядит так: СnH2n−6.
- Атомы углерода, участвующие в образовании бензольного кольца (две связи — сигма, одна — пи), находятся в состоянии sp2-гибридизации.
- Валентный угол и длина связи равны 120° и 0,140 нм соответственно.
- Гомологами аренов отличаются на одну или больше CH2-групп.
- Большинство аренов — бесцветные жидкости с характерными запахами, канцерогены.
- Для аренов характерны два вида структурной изомерии: изомерия по положению заместителей в бензольном кольце и изомерия углеродного скелета радикалов.
- Для аренов характерны реакции замещения, присоединения, окисления и горения.
Проверь себя
Задание 1.
Какое из представленных соединений является ареном?
- Этилбензол
- Ацетилен
- Фенол
- Орто-хлорстирол
Задание 2.
С чем не реагируют арены?
- С бромной водой
- С бромом
- С алкенами
- С галогеналканами
Задание 3.
С чем бензол реагирует на свету?
- С бромом
- С иодом
- С хлором
- С фтором
Задание 4.
Какое вещество бензол образует при взаимодействии с хлором на свету?
- Гексан
- Гексанол
- Гексахлоран
- 1,3,5-трихлорбензол
Задание 5.
Какое вещество образуется при взаимодействии бензола с пропеном в присутствии H3PO4?
- Метилбензол
- Пропилбензол
- Изопропилбензол
- Винилбензол
Ответы: 1. — 1; 2. — 3; 3. — 3; 4. — 3; 5. — 3.


 к списку статей
к списку статей