Халькогены. Сера, сероводород и сульфиды
На этой странице вы узнаете
- Как сера побеждает ртуть?
- Чем так коварен сероводород?
В этой статье мы рассмотрим интересный химический элемент, который имеет три внешних облика, образует металлические руды и входит в состав газа с очень неприятным запахом. Да-да, это все про серу.
Халькогены. Общая характеристика
Халькогены, что в переводе означает «образующие руды» (название связано с наличием халькогенов в медных рудах) образуют элементы VIA группы Периодической системы: кислород O, сера S, теллур Te и полоний Po. Все элементы — неметаллы, кроме полония — он проявляет металлические свойства.
На внешнем энергетическом уровне (ВЭУ) у халькогенов по шесть электронов, электронная конфигурация ВЭУ: ns2ns4.
В невозбужденном состоянии халькогены имеют валентность II — 2 неспаренных электрона на ВЭУ.

Халькогены довольно широко распространены в природе. Кислород является составной частью воздуха, входит в состав воды, горных пород земной коры. Сера встречается во многих минералах: например, Cu2S — медный блеск, FeS2 — пирит, HgS — киноварь.
| Как сера побеждает ртуть? Ртуть — очень токсичное вещество, ее пары могут привести к отравлению. Поэтому, если ртуть оказалась на открытом воздухе, например, вытекла из разбитого градусника, ее нужно как можно быстрее собрать и утилизировать. А что делать, если ртуть оказалась в труднодоступном месте? В таком случае сотрудники МЧС засыпают этот участок порошкообразной серой. Между ртутью и серой происходит химическая реакция, и образуется киноварь — совершенно безопасное для человека вещество. |
Сера
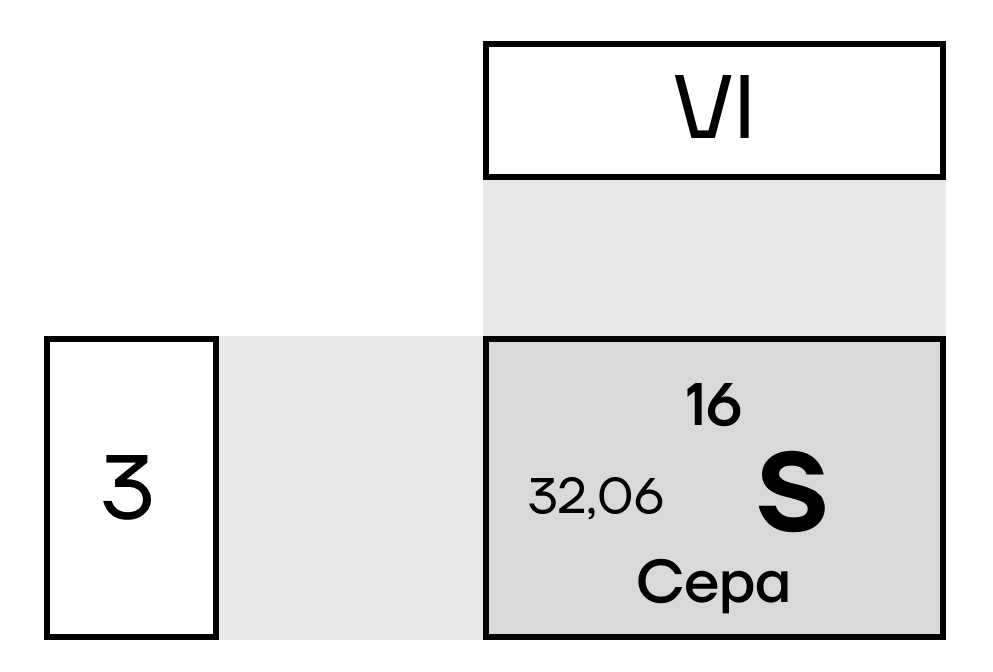
Сера — элемент VI группы главной подгруппы таблицы Менделеева. На внешнем слое атом серы имеет две электронные пары и полностью свободный d-подуровень.
Следовательно, для атома серы, кроме основного, возможны также два возбужденных состояния. В первом возбужденном состоянии разделяются спаренные электроны p-подуровня, количество неспаренных электронов на ВЭУ — 4, валентность IV. Во втором возбужденном состоянии — при распаривании обеих электронных пар — она имеет шесть неспаренных электронов, а значит, ее максимальная валентность равна VI (то есть в соединениях сера максимально может образовывать 6 химических связей):

Степени окисления серы в неорганике логичны:
- высшая степень окисления равна номеру группы: +6;
- низшая степень окисления определяется по формуле «номер группы — 8»: -2;
- промежуточные степени окисления в большинстве своем четные: +2, +4.
Набор степеней окисления серы: -2, 0, +2, +4, +6.
У серы, как у углерода и кремния есть несколько аллотропных модификаций, в виде которых она может существовать, и которые отличаются своими физическими свойствами.

В природе же сера встречается в самородном виде, в виде различных минералов — сульфидов (например, ZnS, FeS2, HgS) и сульфатов (CaSO4·2H2O, Na2SO4·10H2O).
Химические свойства серы
Химическая активность серы не очень велика. Сера не обладает такой высокой электроотрицательностью, как, например, у галогенов, поэтому в подавляющем большинстве случаев проявляет восстановительные свойства. То есть в ОВР она выступает в роли «жертвы»: она слабо притягивает к себе электроны, поэтому «их можно у нее отнять». Но она может быть и окислителем, а значит, реагировать как с металлами, так и с неметаллами.
- Реакции с неметаллами. Сера взаимодействует практически со всеми неметаллами с образованием бинарных соединений, за исключением азота и иода, потому что у них низкая активность.
С водородом взаимодействие приводит к образованию сероводорода:
H2 + S = H2S
Горение серы приводит к образованию сернистого газа:
S + O2 = SO2
С галогенами (кроме иода) образуются галогениды, например, хлорид серы:
S + Cl2 = SCl2
С фосфором образуется сульфид фосфора:
2S + 3S = P2S3
2S + 5S = P2S5
- Реакции с металлами. Сера здесь будет проявлять свойства окислителя и образовывать с металлами сульфиды. С щелочными металлами реакция идет без нагревания, а со всеми остальными — при нагревании.
Например, образование сульфида алюминия:
3S + 2Al = Al2S3
Помним, что железо восстановится только до +2, так как сера хоть и является здесь окислителем, но довольно слабым:
Fe + S = FeS
- Реакции со сложными веществами. Со сложными веществами протекают ОВР реакции. Электроотрицательность серы невысокая. А это значит, что она является типичным восстановителем, но может также диспропорционировать.
Азотная кислота окисляет серу до серной кислоты:
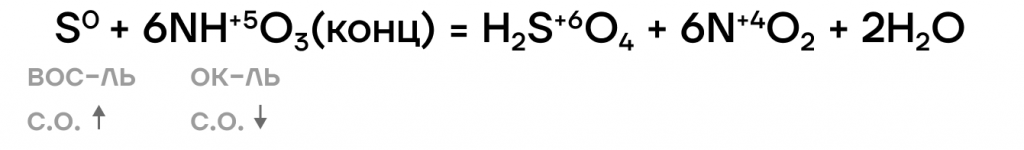
Серная кислота тоже окисляет серу, но уже до сернистого газа:

И до сернистого газа окисляет серу бертолетова соль:
3S + 2KClO3 = 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
S + Na2SO3 = Na2S2O3
Сера — один из тех неметаллов, которые могут взаимодействовать с растворами щелочей. Так как щелочи не обладают выраженными окислительными или восстановительными свойствами, в процессе этой реакции сере «приходится играть обе роли»: и окислителя, и восстановителя. Поэтому она сама и понижает, и повышает степень окисления (диспропорционирует):

Получают серу в промышленности открытым способом на ее месторождениях или из вулканов. В лаборатории применяют следующие способы:
- Неполное окисление сероводорода
2H2S + O2 = 2S + 2H2O
- Взаимодействие сероводорода с оксидом серы
2H2S + SO2 = 3S + 2H2O
Сероводород H2S
Сероводород H2S — ядовитый газ с неприятным запахом тухлых яиц. Его раствор в воде называется сероводородной кислотой. Геометрическая форма молекулы сероводорода — уголковая молекула, как и у молекулы воды.
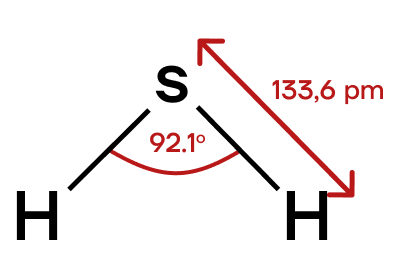
pm = пикометр = *10⁻¹²м
| Чем так коварен сероводород? Кроме своего неприятного запаха, этот газ еще и очень ядовит. Особенно опасно его свойство притуплять обоняние, из-за чего человек при отравлении перестает замечать пары сероводорода. Сероводород может попасть в организм не только через дыхание, но и трансдермальным путем, то есть через кожу. Молекулы газа легко могут проникнуть во все человеческие клетки и блокировать доставку кислорода. Сероводород в больших количествах выделяется на мусорных полигонах, выгребных ямах, канализациях, где происходят процессы гниения, на предприятиях по производству целлюлозы, и загрязняет атмосферу. Во многих российских городах уже отмечается превышение допустимой нормы содержания сероводорода в воздухе. |
Сероводородная кислота как типичная кислота будет вступать в основно-кислотные взаимодействия со своими противоположностями: основаниями, основными оксидами, некоторыми амфотерными оксидами и гидроксидами.
За счет степени окисления -2 H2S проявляет свойства восстановителя («сера богата электронами, ее можно ограбить»), а значит, он будет вступать в реакции с окислителями.
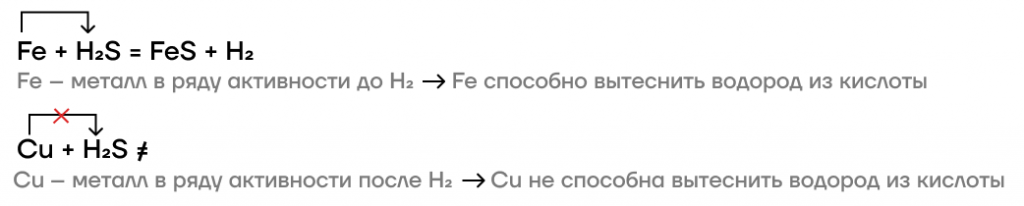
- Реакции с металлами до H2.
Как и любая кислота-неокислитель, сероводородная кислота будет реагировать с металлами, стоящими в ряду активности до водорода, с вытеснением из нее водорода.
- Основно-кислотное взаимодействие.
Сероводородная кислота, очевидно, обладает кислотными свойствами. А что это значит? Это значит, что она будет вступать в реакции со своими противоположностями: основаниями, основными оксидами. Как и в любых основно-кислотных взаимодействиях, в этих реакциях образуются соли — сульфиды.
Например, взаимодействие сероводорода с гидроксидом калия с образованием сульфида калия:
H2S + 2KOH = K2S + 2H2O
В избытке сероводорода образуется кислая соль — гидросульфид калия:
H2S(изб.) + KOH = KHS + H2O
Так как сероводородная кислота — кислота слабая, она не будет реагировать с амфотерными оксидами и нерастворимыми основаниями.
- Реакции ионного обмена.
Как и все кислоты, H2S является электролитом (то есть может распадаться на ионы) и вступает в реакции ионного обмена с другими электролитами с образованием осадка, газа или воды.
С солями Ag⁺, Pb²⁺, Cu²⁺, Cd²⁺, Hg²⁺ образуются нерастворимые сульфиды черного цвета. Реакции с солями этих металлов — качественные на сульфид-ион.
H2S + Pb(NO3)2 = PbS↓ + 2HNO3
- Реакции с окислителями.
За счет степени окисления -2 сера в сероводороде проявляет свойства восстановителя («жертвы»), а значит, вступает в реакции с различными окислителями. Как восстановитель в ОВР она чаще всего повышает степень окисления до ближайшего устойчивого нуля. И только о-о-очень сильные окислители способны окислитель ее по максимуму — до +6 (HNO3(конц), Cl2).
Хлор и бром окисляют сероводород до простого вещества серы:
H2S + Br2 = 2HBr + S (с Cl2 аналогично)
В водном растворе хлор окисляет сероводород до серной кислоты:
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
Концентрированная азотная кислота окисляет сероводород до простого вещества серы:
H2S + 2HNO3(конц.) = S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) = H2SO4 + 8NO2 + 4H2O
Серная кислота также окисляет серу до простого вещества:
H2S + H2SO4(конц.) = S + SO2 + 2H2O
Сульфиды
Сульфиды — это бинарные соединения серы и металлов или некоторых неметаллов, соли сероводородной кислоты.
По растворимости в воде и кислотах сульфиды разделяют на:
- Растворимые в воде. Это сульфиды щелочных металлов и аммония.
Они реагируют с минеральными кислотами с образованием сероводорода. Это еще одна качественная реакция на сульфид-ионы, признак: выделение газа с неприятным запахом.
ZnS + 2HCl = ZnCl2 + H2S↑
- Нерастворимые в воде, но растворимые в минеральных кислотах. Это сульфиды остальных металлов до железа включительно. С кислотами они реагируют аналогично.
- Нерастворимые ни в воде, ни в минеральных кислотах. Черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS).
- Гидролизуемые водой. Сульфиды алюминия и хрома. В воде они разлагаются на основание и сероводород:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Фактчек
- Халькогены — химические элементы VIA группы Периодической системы. В нее входят кислород O, сера S, теллур Te и полоний Po. Электронная конфигурация внешнего электронного уровня атома в основном состоянии ns2np4.
- Возможные степени окисления серы: -2, -1, 0, +1, +2, +4, +6.
- Существует три аллотропные модификации серы: ромбическая, моноклинная и пластическая сера.
- В подавляющем большинстве случаев сера проявляет восстановительные свойства.
- Бинарное водородное соединение серы — сероводород — является слабой кислотой, вступает в характерные реакции ионного обмена.
Проверь себя
Задание 1.
Чему равна минимально возможная степень окисления?
- +4
- -2
- -4
- 0.
Задание 2.
С каким из неметаллов сера не будет реагировать?
- хлор
- углерод
- кислород
- азот
Задание 3.
С каким веществом будет реагировать сера?
- гидроксид калия
- сульфат натрия
- гидроксид алюминия
- вода
Задание 4.
Какой сульфид не растворяется даже в растворах кислот?
- сульфид калия
- сульфид железа(II)
- сульфид бария
- сульфид кадмия
Ответы: 1. — 2; 2. — 4; 3. — 1; 4. — 4.


 к списку статей
к списку статей





