Водород
На этой странице вы узнаете
- Что водород забыл в лампочках?
- Взрываем натрий: как можно получить водород?
- Почему ученые хотят сделать водород топливом будущего?
Победитель во всем! Самый легкий газ, самый распространенный элемент, первый элемент в Периодической системе — это все про водород. В этой статье подробнее разберем все его особенности и характеристики.
Строение атома водорода

Водород — самый первый элемент таблицы Менделеева. Латинское название водорода означает «рождающий воду». Это двухатомная молекула H2, которая является самым легким газом без цвета, запаха и вкуса.
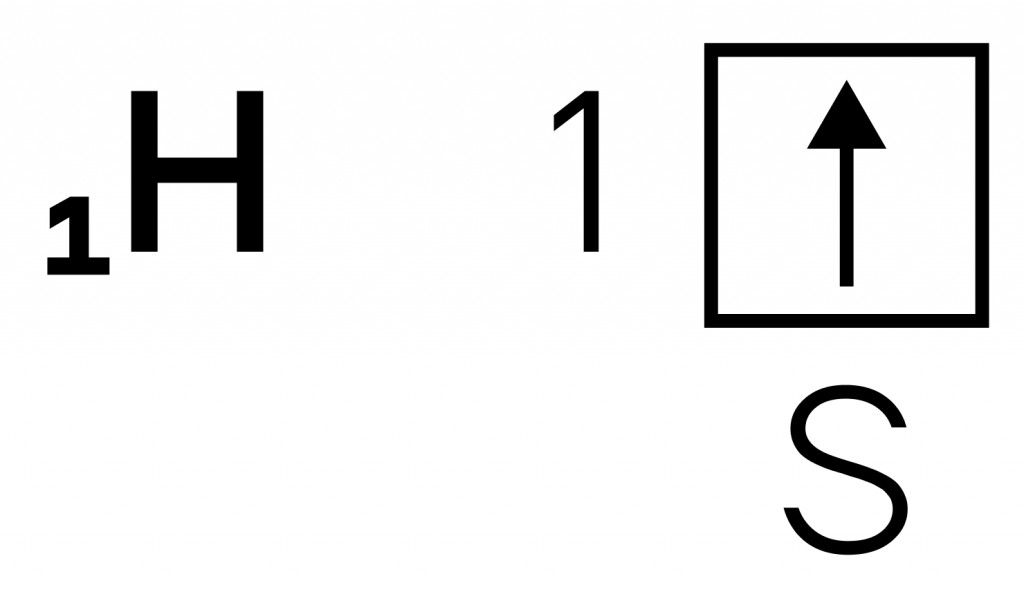
Он находится в IA-группе первого периода и имеют электронную конфигурацию 1s¹. Свой единственный электрон он может щедро отдать и приобрести степень окисления (с.о.) +1, а может, наоборот, с жадностью принять еще один, проявляя при этом с.о. –1.
Физические свойства водорода
Скрытности водорода могут позавидовать лучшие спецагенты и шпионы из боевиков, даже сам Агент 007. Водород не имеет ни цвета, ни запаха, ни вкуса.
Благодаря своей маленькой массе, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее передают тепло от одного тела к другому. Отсюда следует, что водород обладает высокой теплопроводностью.
| Что водород забыл в лампочках? Вошедшие в моду в наши дни ретро-лампочки в стиле лофт называются филаментные LED-лампочки. Для заполнения их стеклянных колб применяется водород с его высокой теплопроводностью. |
Химические свойства водорода
На самом деле, водород очень «ленивый», поэтому будет мало с кем вступать в реакции соединения, а если все же будет, то, как правило, при очень высоких температурах или при наличии катализатора.
- Реакции с металлами.
Водород — неметалл, поэтому способен вступать в реакции со своими противоположностями — металлами, но только с самыми активными из них — металлами IA- и IIA-групп (щелочными и щелочно-земельными). В ходе реакции образуются гидриды соответствующих металлов.
| Na, t | Cs, t | Ca, t | Fe | |
| H2 | NaH | CsH | CaH2 | реакция не идет |
В гидридах металлов водород проявляет с.о. –1 из-за большей, чем у металлов, электроотрицательности.
Разберем химические свойства гидридов:
- Реакции гидролиза
Гидриды металлов способны гидролизоваться водой или кислотами. В обоих типах гидролиза происходит выделение водорода (H2), однако при взаимодействии с водой также образуется щелочь, а при взаимодействии с кислотой — соль.
NaH + H2O = NaOH + H2
CaH2 + 2HCl = CaCl2 + 2H2
- Реакции разложения
Гидриды вступают в реакции разложения при нагревании, в ходе которых образуются металл и водород.
2КН = 2К + Н2
- Взаимодействие с кислородом
Гидриды бурно взаимодействуют с кислородом в составе воздуха, образуются оксид металла и вода.
CaH2 + O2 = CaO + H2O
Если полученный оксид реагирует с водой (для этого нужно, чтобы его гидроксид был растворим), то вместо оксида и воды можем записать в продукты сразу гидроксид.
CaO + H2O = Ca(OH)2
CaH2 + O2 = Ca(OH)2
- Реакции электролиза
Гидриды вступают в реакции электролиза, как и при реакции разложения, образуются металл и водород.
2KH = 2K + H2
Вернемся к свойствам водорода.
- Реакции с неметаллами.
Водород реагирует практически со всеми неметаллами, кроме тех, с кем он имеет очень близкие значения электроотрицательностей:

Рядом с водородом стоит кремний с фосфором. Из этого следует следующее:
- Они имеют схожие значения электроотрицательностей.
- Из-за этого они «не могут определиться» с тем, кто в реакции будет восстановителем, а кто — окислителем.
- Как итог, реакция между ними не протекает.
Водород (H) не реагирует с кремнием (Si) и фосфором(P). Запоминалка — PSiH.
| F2 | Cl2, hv | I2, t | O2, t | N2, Pt, t | C, Ni, t | |
| H2 | HF | HCl | HI | H2O | NH3 | CH4 |
В образующихся бинарных соединениях водород находится в своей почти постоянной степени окисления +1, а атом более электроотрицательного неметалла — в своей низшей с.о. (она определяется по формуле «номер группы-8»).
- Реакции с оксидами.
Из-за своей низкой электроотрицательности, атом водорода легко «ограбить» — отнять у него электрон. Именно поэтому в окислительно-восстановительных реакциях он выступает в роли «жертвы», то есть восстановителя.
При этом водород является настолько сильным восстановителем, что способен восстанавливать даже металлы и неметаллы из их оксидов при сплавлении (t)!
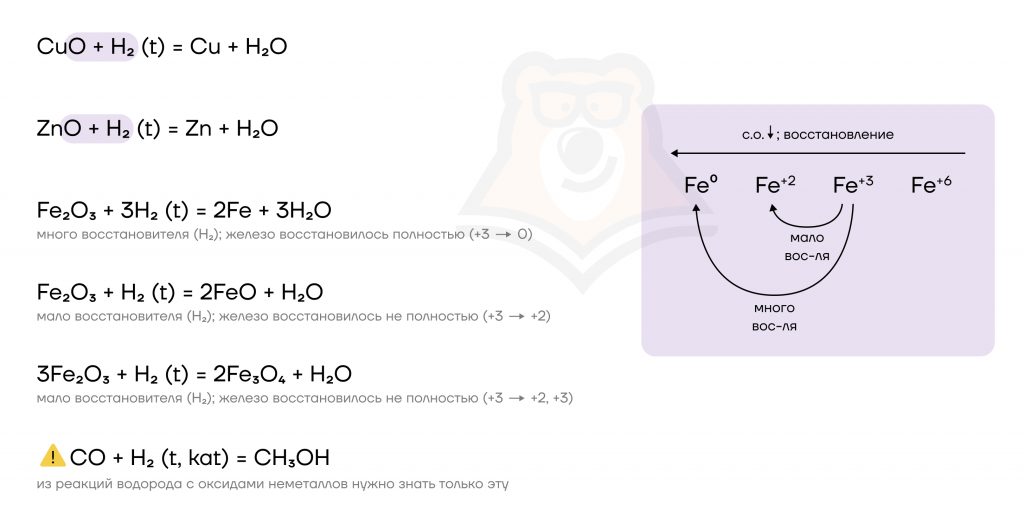
Запомним: активные (щелочные и щелочноземельные) металлы из оксидов не восстанавливают — их получают только электролизом расплавов их соединений.
Получение водорода
Водород можно получить несколькими способами. Например, при взаимодействии металлов с водой/кислотами/щелочами (но все зависит от того, какой металл мы берем).
| Взрываем натрий: как можно получить водород? Активные металлы достаточно бурно реагируют с водой, некоторые даже со взрывом! Если кинуть кусочек щелочного металла в воду, то можно увидеть небольшое «шипение» металла в воде и выделение газообразного водорода на поверхности. Красиво реагирует с водой калий. Здесь и яркий розовый оттенок, и вспышки света, и бурное шипение выделяемого водорода — буйство спецэффектов! |

В лаборатории водород часто получают с помощью этих реакций:
| Взаимодействие металлов до водорода в ряду активности с водой | 2H2O + 2Na = 2NaOH + H2 \(\uparrow\) Zn + H2O (пар) = ZnO + H2 [600—800° C] |
| Взаимодействие металлов до водорода в ряду активности с растворами кислот-неокислителей | 2HCl + Fe = FeCl2 + H2 (\uparrow\) 2Al + 3H2SO4 (разб.) = Al2(SO4)3+ 3H2 |
| Взаимодействие амфотерных металлов (Be, Zn, Al), а также кремния, со щелочами | Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2 Si + 2KOH + H2O = K2SiO3 + 2H2 |
Важными промышленными способами получения водорода являются:
- Паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород.
СН4 + Н2O \(\rightarrow\) СО + 3Н2
- Паровая конверсия угля.
C + H2O \(\rightarrow\) CO + H2
- Электролиз воды.
2H2O (эл.ток) = 2H2 + O2
Такой способ получения водорода является очень энергозатратным, но зато экологически чистым, ведь не выделяется угарный газ, как при паровой конверсии метана или угля.
Получение водорода электролизом воды лежит в основе домашней станции от компании Honda, которая позволяет заправлять автомобили, работающие на водородном топливе. Конечно, таких автомобилей сейчас очень мало, да и станция не получила широкого признания. Но инженеры активно продолжают вести свои разработки. Возможно, уже через несколько десятков лет мы будем наслаждаться автомобилями, работающими без выхлопных газов и не загрязняющими окружающую среду!
- Крекинг нефти.
Крекинг — это разложение нефти и ее фракций с целью получения более ценных продуктов (бензин и т.п.).
Оставшийся после этого процесса водород можно использовать в качестве водородного топлива.
| Почему ученые хотят сделать водород топливом будущего? В мировых лабораториях ученые активно занимаются разработкой топлива будущего. И на эту роль хорошо может подойти водород. Ведь отходом при использовании этого топлива является не угарный газ, загрязняющий атмосферу, а вода, которую можно использовать снова и снова. Фантастика! |
Набирает популярность и получение биоводорода. Существует несколько способов такой добычи водорода:

- Термохимический, при котором биомасса — например, отходы древесины — нагревается без доступа кислорода до 500—800 °C. В результате выделяется метан, угарный газ и водород.
- Биохимический. Водород выделяют различные бактерии.
- Биофотолиз. Этот способ основан на том, что у водорослей при недостатке кислорода и серы ослабевает процесс фотосинтеза, но при этом бурно выделяется водород.
Преимуществом всех этих способов является экономичность.
Применение водорода
Водород активно применяется в промышленности, например:
- Жидкий водород используется в ракетном топливе.
- Его сильные восстановительные свойства используются для получения необходимых металлов из их оксидов.
- В производстве маргарина, превращая жидкие растительные жиры в твердые.
- Для синтеза аммиака, необходимого для производства удобрений.
Фактчек
- Водород — самый распространенный элемент во Вселенной, существует в виде двухатомной молекулы H2.
- Водород имеет один единственный электрон, его электронная конфигурация 1s¹.
- Возможные степени окисления водорода: –1, 0, +1.
- Водород крайне малоактивен, он реагирует с некоторыми неметаллами и щелочными/щелочноземельными металлами.
Проверь себя
Задание 1.
Соединения металлов с водородом называются:
- оксиды
- гидраты
- гидриды
- гидроксиды
Задание 2.
С каким металлом будет реагировать водород?
- кальций
- железо
- кадмий
- никель
Задание 3.
Сколько электронов у атома водорода на внешнем энергетическом уровне?
- 4 электрона
- 3 электрона
- 2 электрона
- 1 электрон
Задание 4.
С каким оксидом будет реагировать водород?
- оксид серы (IV)
- оксид меди
- оксид кремния (IV)
- оксид рубидия
Ответы: 1. — 3; 2. — 1; 3. — 4; 4. — 2.


 к списку статей
к списку статей






