Металлы IA группы
На этой странице вы узнаете
- «Неорганический фотосинтез» — миф или реальность?
- Почему щелочные металлы не берут в реакции с кислотами?
- Как можно распознать катионы щелочных металлов?
Общая характеристика металлов IA группы.
Металлы IA группы — щелочные металлы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Щелочные металлы — химически активные серебристо-белые металлы (за исключением цезия, имеющего серебристо-желтую окраску). Щелочные металлы обладают относительно невысокой плотностью, литий, натрий и калий легче воды, кроме того эти металлы очень мягкие, их можно нарезать ножом или раскатать в блин с помощью скалки.
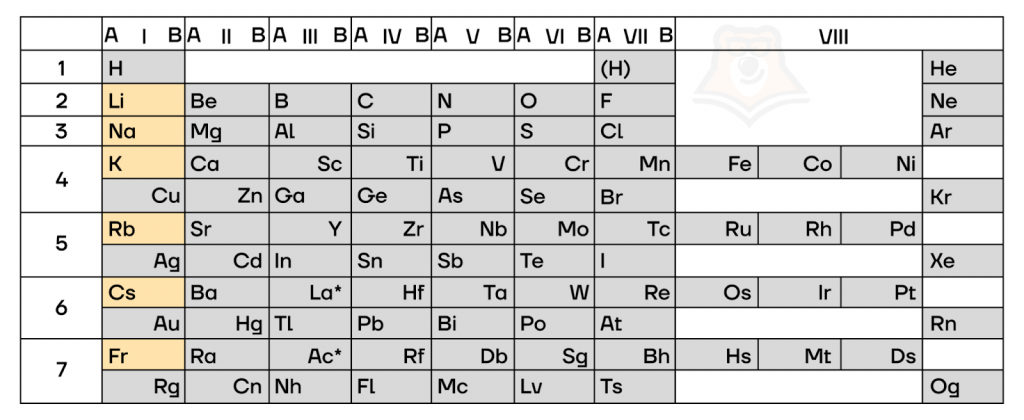
Атомы щелочных металлов содержат один электрон на внешнем энергетическом уровне, электронную конфигурацию внешнего энергетического уровня можно отразить как ns1 (на картинке представлена электронно-графическая схема лития, для остальных щелочных металлов она аналогична).
Возможная валентность: I
Возможные степени окисления: 0, +1
Единственный электрон на внешнем энергетическом уровне атомов щелочных металлов может быть легко оторван, в таком состоянии электронная оболочка атома щелочного металла станет такой же, как у благородного газа, предшествующего ему в периодической системе.
Щелочные металлы в соединениях проявляют постоянную валентность и степень окисления I и +1 соответственно.
Способы получения металлов IA группы
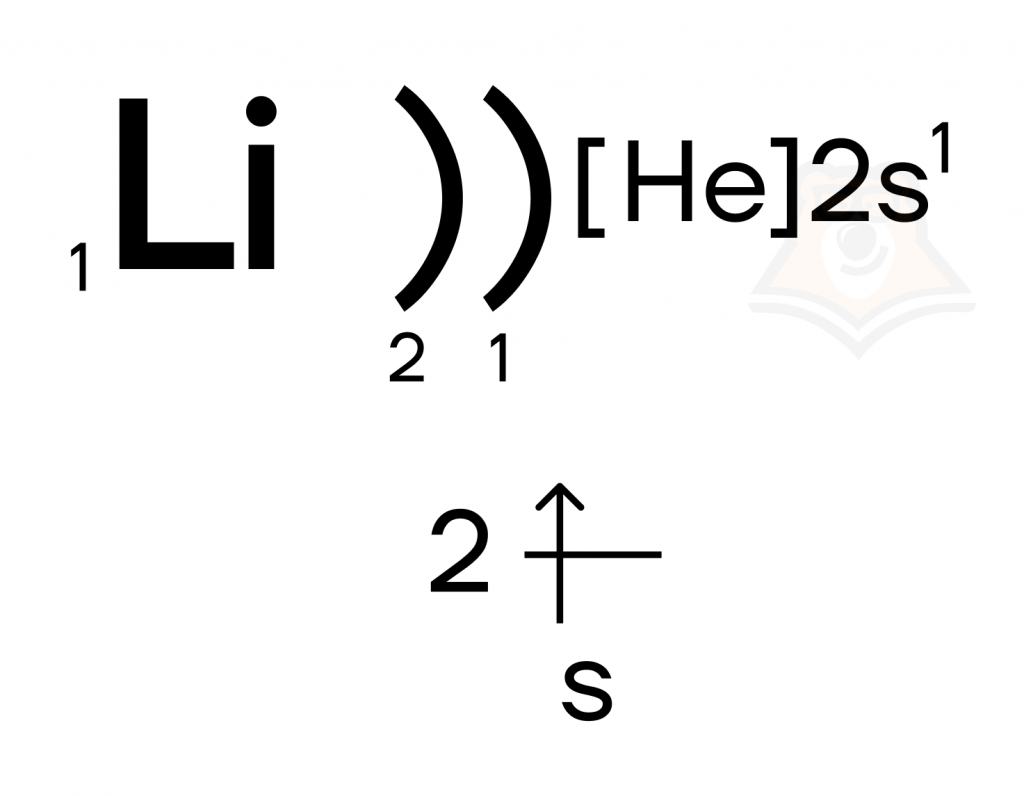
Из-за высокой химической активности щелочные металлы на встречаются в свободном виде, в природе они распространены преимущественно в виде солей. Таким образом, для получения щелочного металла нужно восстановить его из соли, однако поскольку щелочные металлы — очень активные металлы, восстановить их из солей чисто химическим путем задача крайне сложная, поэтому для получения щелочных металлов используют электролиз расплавов их солей или гидроксидов:
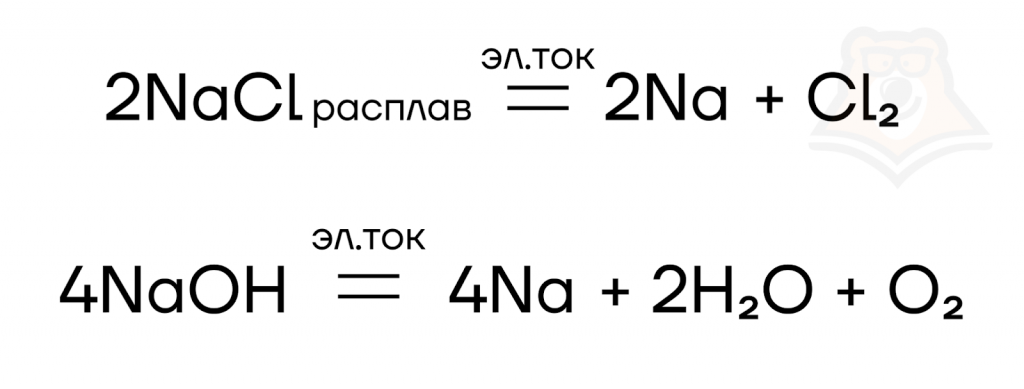
Химические свойства металлов IA группы
Щелочные металлы — очень активные металлы, обладают выраженными восстановительными свойствами, легко вступают в реакции с большинством неметаллов, водой и кислотами.
- Взаимодействие с неметаллами
Как типичные восстановители, щелочные металлы могут взаимодействовать со своими противоположностями — неметаллами.
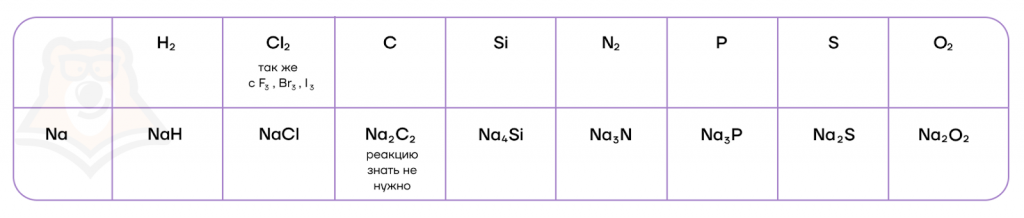
Продукты взаимодействия щелочных металлов с водородом — гидриды металлов, являются представителями редкой группы веществ, в которых водород находится в степени окисления -1, легко подвергаются гидролизу, образуя щелочь и водород, а в присутствии кислот — соль и водород.
NaH + H2O = NaOH + H2
NaH + HCl = NaCl + H2
Несмотря на то, что при повышенной температуре с азотом способны взаимодействовать все щелочные металлы, легко эта реакция протекает лишь с литием (даже при комнатной температуре):
6Li + N2 = 2Li3N
Кроме того, щелочные металлы ведут себя «необычно» при взаимодействии с кислородом — в зависимости от того, какой именно из металлов вступает в реакции, образуются различные продукты.
- Литий, как и подавляющее большинство металлов, образует оксид:
2Li + O2 = 2Li2O
- Натрий образует пероксид — соединение с кислородом, проявляющим степень окисления -1:
2Na + O2 = Na2O2
- Калий и все нижестоящие металлы образуют надпероксиды (супероксиды) — соединения, содержащие кислород, степень окисления которого условно составляет -1/2:
K + O2 = KO2
Подробнее со свойствами пероксидов можно ознакомиться в статье «Элементы VIA группы. Кислород», однако про одно свойство вспомним здесь.
| «Неорганический фотосинтез» — миф или реальность? Пероксиды щелочных металлов вступают в реакцию с углекислым газом, выделяя кислород: 2Na2O2 + 2CO2 = 2Na2CO3 + O2 Иногда этот процесс называют «неорганическим фотосинтезом», поскольку в ходе реакции поглощается углекислый газ и выделяется кислород, но, конечно, с настоящим фотосинтезом он не имеет ничего общего. Эта реакция находит применение, когда нужно в экстренных условиях «регенерировать» воздух — понизить концентрацию углекислого газа и повысить концентрацию кислорода, например, при авариях на подводных лодках. |
- Взаимодействие с водой
Щелочные металлы относятся к активным металлам и взаимодействуют с водой, вытесняя из нее водород.
Реакция щелочных металлов с водой протекает очень бурно и может сопровождаться взрывом.
2Na + 2H2O = 2NaOH + H2

| Почему щелочные металлы не берут в реакции с кислотами? При взаимодействии с растворами кислот щелочные металлы легко вступают во взаимодействии не только с растворенной кислотой (соляной, например), но и с молекулами воды: 2Na + H2O = 2NaOH + H2 2Na + 2HCl = 2NaCl + H2 Реакция протекает очень бурно, сопровождается взрывом, а кто хочет, чтобы при взрыве его еще и раствором кислоты обрызгало… Кстати, щелочь, образующаяся при взаимодействии щелочного металла с водой (если вам удалось не расплескать реакционную смесь), вступает в реакцию с растворенной кислотой, образуя соль и воду, так что конечным продуктом при взаимодействии щелочных металлов с растворами кислот, все равно будут соль и водород. NaOH + HCl = NaCl + H2O |
- Взаимодействие с аммиаком
Кроме того, что щелочные металлы способны к взаимодействию с водой, они могут вступать в реакции и с аммиаком, в состав которого, как и в состав воды, входят атомы водорода в степени окисления +1. При взаимодействии щелочных металлов с аммиаком образуются соответствующие амиды и водород.
2Na + 2NH3 = 2NaNH2 + H2
Образующиеся в ходе реакции амиды подвержены гидролизу:
NaNH2 + H2O = NaOH + NH3
NaNH2 + 2HCl = NaCl + NH4Cl
- Взаимодействие с оксидами и галогенидов металлов
Щелочные металлы способны восстанавливать менее активные металлы из их оксидов и галогенидов при нагревании.
2Na + CuO = Cu + Na2O
3K + AlCl3 = Al + 3KCl
Применим полученные знания на практике — разберем задание №9 из ЕГЭ.
Задание.
Задана следующая схема превращений.
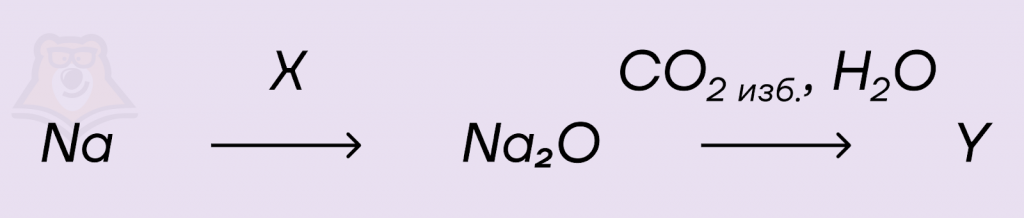
Определите, какие из предложенных веществ являются веществами X и Y:
1. Na2C2
2. Na2CO3
3. NaHCO3
4. FeO
5. O2
Решение.
Оксид натрия нельзя получить прямым синтезом, но можно в ходе восстановления оксидов других металлов, тогда вещество X — FeO:
2Na + FeO = Na2O + Fe
При действии избытка водного раствора углекислого газа на оксид натрия образуется кислая соль, а значит вещество Y — NaHCO3:
Na2O + 2CO2 + H2O = 2NaHCO3
Ответ: 43
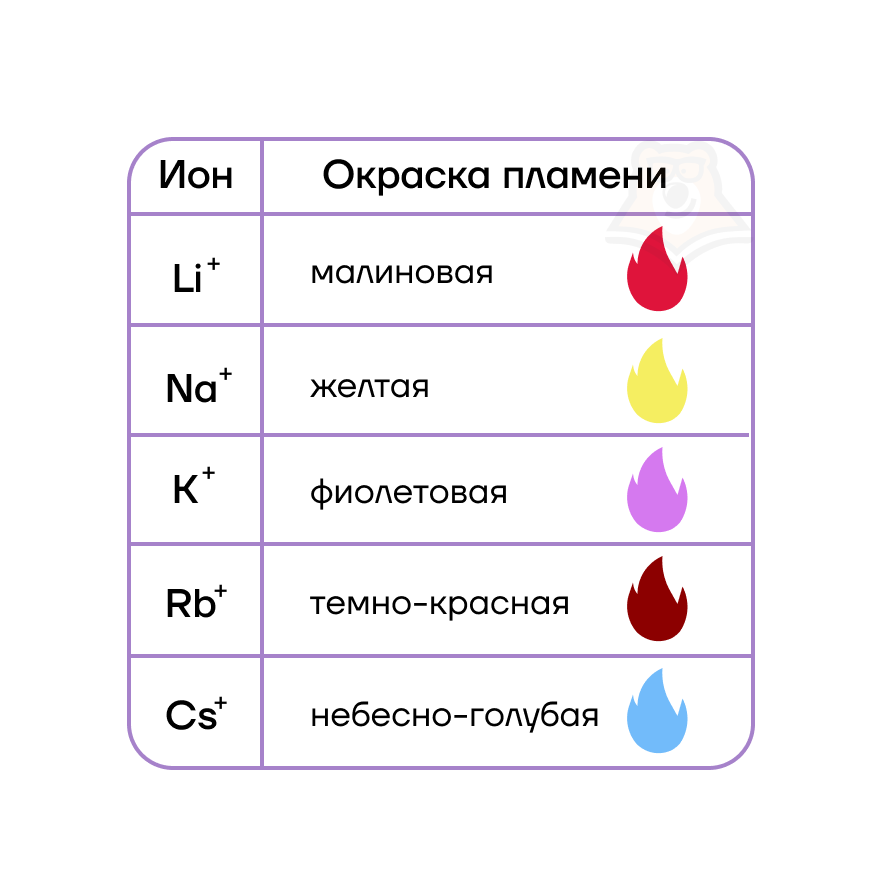
| Как можно распознать катионы щелочных металлов? Как же можно отличить катионы щелочных металлов друг от друга? Самый простой и распространенный метод — по окраске цвета пламени! Соединения этих металлов придают пламени характерные цвета, которые приведены в таблице. Кстати, это свойство используют в пиротехнике при изготовлении смесей для салютов и фейерверков. |
Применение щелочных металлов
Литий и его соединения имеют довольно широкое применение: они используются для создания подшипниковых сплавов, применяются как катализаторы, используются в органической химии (например, алюмогидрид лития используется для синтеза спиртов из альдегидов), соли лития находят применение в медицине. Также многие из нас сталкивались с литий-ионными аккумуляторами — это самый популярный тип аккумуляторов в телефонах, камерах и ноутбуках.
Натрий применяется в медицине, газоразрядных лампах, фотоэлементах и огнетушителях, а также в ядерных реакторах. Но его роль огромна прежде всего в функционировании организмов. Натрий поддерживает осмотическое давление крови, задерживает в организме жидкость. Именно поэтому после употребления очень соленой пищи (а в составе поваренной соли NaCl как раз есть ионы натрия) возможно развитие отеков.
Соединения калия повсеместно используются как удобрения, а еще применяются в медицине. Калий, как и натрий, влияет на осмотическое давление.
А еще избыток ионов натрия в тканях головного мозга может привести к состоянию депрессии, избыток ионов калия — к маниакальным состояниям (состояниям очень хорошего и импульсивного настроения), а соли лития регулируют и нормализуют скачки настроения.

Наш разговор о щелочных металлах и их соединениях подошел к концу, мы познакомились с электронным строением их атомов, физическими и химическими свойствами простых веществ и важнейших соединений. Дальше стоит ознакомиться с материалом по двоюродным братьям щелочных металлов — щелочноземельным металлам, в статье «Металлы IIA группы».
Фактчек
- Атомы металлов IA группы имеют 1 электрон на внешнем энергетическом уровне, постоянная валентность щелочных металлов I, а в соединениях проявляют постоянную степень окисления — +1.
- Все щелочные металлы, за исключением цезия, — серебристо-белые твердые вещества.
- Основной способ получения щелочных металлов — электролиз расплавов солей.
- Простые вещества металлов IA группы — активные восстановители.
Проверь себя
Задание 1.
Какой из щелочных металлов имеет самое большое число электронов?
- Литий
- Натрий
- Калий
- Рубидий
Задание 2.
Какая степень окисления характерна для щелочных металлов?
- +1
- +2
- +3
- +4
Задание 3.
Какую степень окисления в гидридах щелочных металлов проявляет водород?
- +1
- -1
- 0
- -2
Задание 4.
Какой продукт образуется при взаимодействии калия с кислородом?
- Оксид калия
- Пероксид калия
- Супероксид калия
- Озонид калия
Задание 5.
Какую окраску приобретает пламя, при внесении в него солей натрия?
- Фиолетовую
- Желтую
- Небесно-голубую
- Малиновую
Ответы:1. — 6; 2. — 1; 3. — 2; 4. — 3; 5. — 2.


 к списку статей
к списку статей




