Металлы IIA группы
На этой странице вы узнаете
- Какие из щелочноземельных металлов самые распространенные и самые редкие?
- Как появляется накипь на чайнике?
- Как распознать катионы щелочноземельных металлов?
Металлы IIA группы, хоть и не такие активные, как их двоюродные братья — металлы IA группы (о них вы можете прочитать в статье «Металлы IA группы»), но все еще ого-го-го: они применяются в ядерной энергетике, медицине и даже поддерживают нашу жизнедеятельность. Что ж, давайте посмотрим поближе, найдем сходства и отличия, обсудим особенности!
Что особенного в элементах IIА группы
Во IIA подгруппе расположены элементы: бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. Согласно рекомендациям ИЮПАК все металлы IIA группы относят к щелочноземельным металлам (ЩЗМ).
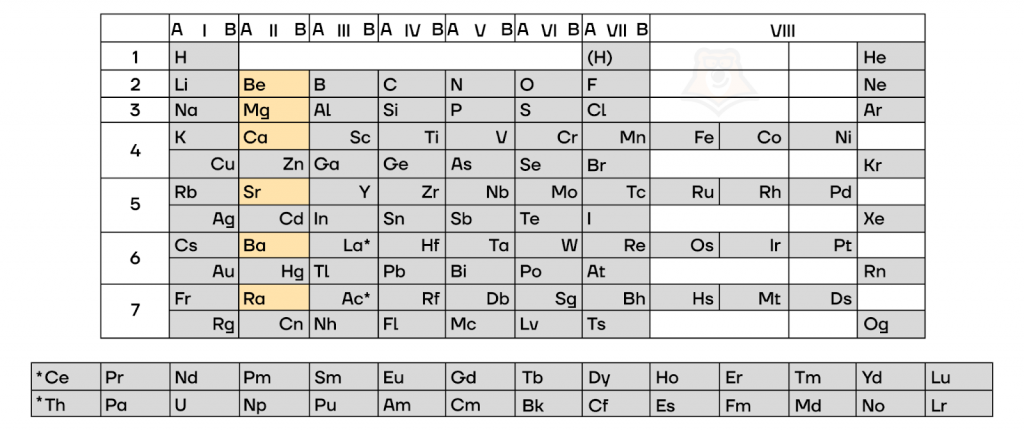
Бериллий и магний, однако, значительно отличаются по свойствам от своих соседей по группе, поэтому стоят особняком. В рамках экзамена к щелочноземельным металлам мы относим металлы IIA группы начиная с кальция: кальций Ca, стронций Sr, барий Ba и радий Ra.
Щелочноземельные металлы существенно более твердые, чем щелочные, но все также имеют серебристо-белый цвет.
На внешнем энергетическом уровне атомы щелочноземельных металлов содержат два электрона, и в основном состоянии конфигурация их внешнего электронного слоя ns2.
Но так как для образования связей с другими элементами необходимо наличие валентных электронов, то металлам IIA группы необходимо распарить электроны. Таким образом, они помещают каждый из них в свою отдельную «комнату» — в квантовую ячейку.
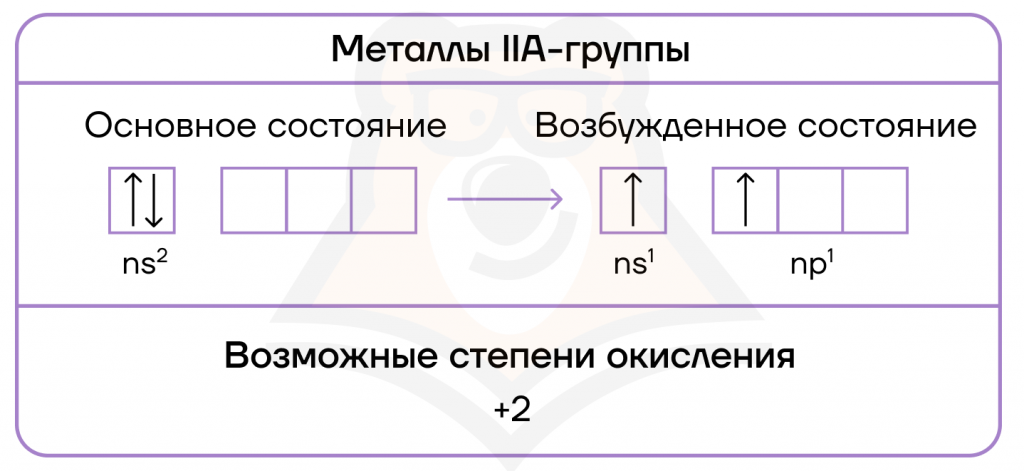
К чему же это все приводит? Атомы этих металлов переходят в возбужденное состояние и в составе сложных веществ приобретают электронную конфигурацию внешнего энергетического уровня ns1np1.
В результате, появляются два неспаренных электрона, поэтому у металлов IIA группы постоянная валентность II и постоянная степень окисления +2.
| Какие из щелочноземельных металлов самые распространенные и самые редкие? Наиболее распространенными в природе являются кальций (4,7% массы Земли) и магний (2,7% массы Земли), содержание стронция и бария примерно в сто раз меньше, бериллия еще в сто раз меньше. Радия на Земле крайне мало — он не имеет стабильных изотопов, а значит весь запас радия потихоньку распадается (в ходе радиоактивного распада). За все время с момента открытия радия (а это более 100 лет!) во всем мире его было добыто всего 1,5 кг! |
Способ получения металлов IIA группы
Как и при получении щелочных металлов, основным способом получения щелочноземельных металлов является электролиз расплавов солей и гидроксидов:
MgCl2 (t) = Mg + Cl2
Подробнее об электролизе можно почитать в статье «Электролиз расплавов и растворов».
Химические свойства металлов IIA группы
- Взаимодействие с неметаллами
Щелочноземельные металлы, являясь достаточно активными металлами, легко взаимодействуют с типичными неметаллами, проявляя свои восстановительные свойства и образуя бинарные соединения.
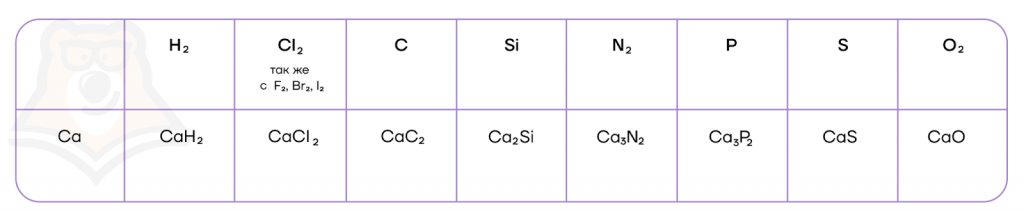
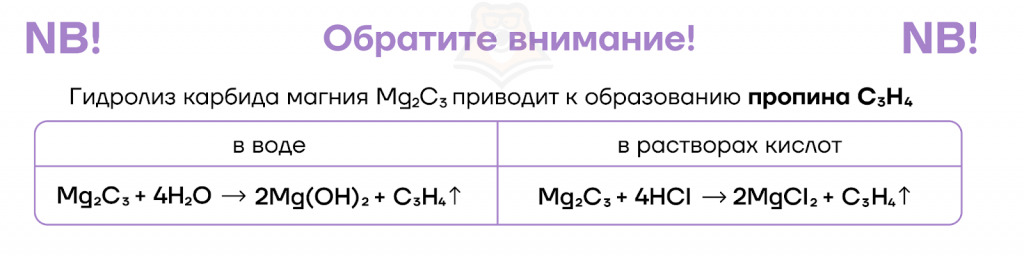
Щелочноземельные металлы начиная с магния при взаимодействии с углеродом образуют карбиды состава MeC2. Эти соединения являются ацетиленидами, т.е. солями ацетилена, который выделяется при гидролизе этих соединений:
CaC2 + 2H2O = Ca(OH)2 + C2H2
Однако могут быть получены и другие карбиды, так, например, трикарбид димагния Mg2C3 является солью пропина и гидролизуется соответственно. Такой карбид образуется при прокаливании ацетиленида магния.
При взаимодействии с кислородом металлы IIA группы (в отличие от щелочных металлов) образуют оксиды, однако действие на оксид бария избытка кислорода приводит к образованию пероксида.
BaO + O2 = BaO2
Карбиды и пероксиды могут доставить неприятностей в задании №4 ЕГЭ по химии. Будьте осторожны! А чтобы было легко в бою, разберем пример аналогичного задания.
Задание.
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
1. CaCl2
2. CaC2
3. Ba(NO3)2
4. Ca(OH)2
5. BaO2
Решение.
1. Между атомами типичного металла и типичного неметалла реализуется ионная связь, так что хлорид кальция нам не подходит.
2. Карбид кальция CaC2 является ацетиленидом, т.е. содержит анион C22-, в котором между атомами углерода реализуется ковалентная неполярная связь. Первый правильный вариант есть.
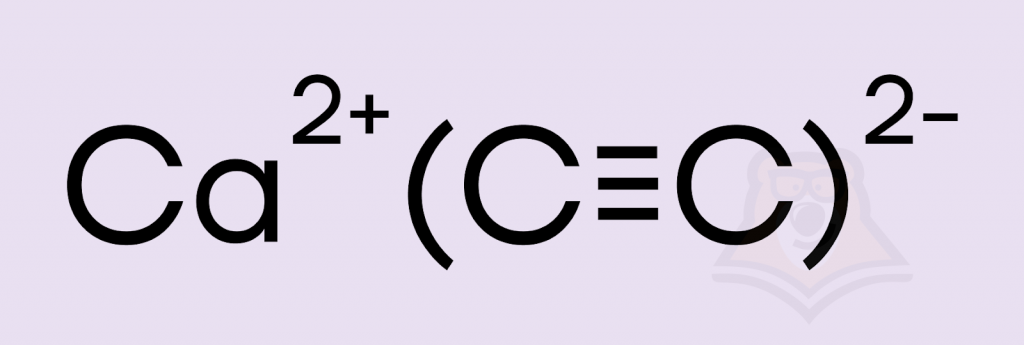
3. В нитрате бария имеется ионная связь (между катионом бария и нитрат-анионом), а внутри нитрат-аниона между атомами кислорода и азота присутствует ковалентная полярная связь. Не наш вариант.
4. В гидроксиде кальция присутствует ионная связь (между атомом кальция и гидроксильными ионами) и ковалентная полярная связь (между атомами кислорода и водорода в OH-группе). Снова не то, что мы ищем.
5. Связь между атомами бария и кислорода в пероксиде ионная, но в пероксидах есть и связь O-O, которая является ковалентной неполярной. Вот и наш второй вариант.
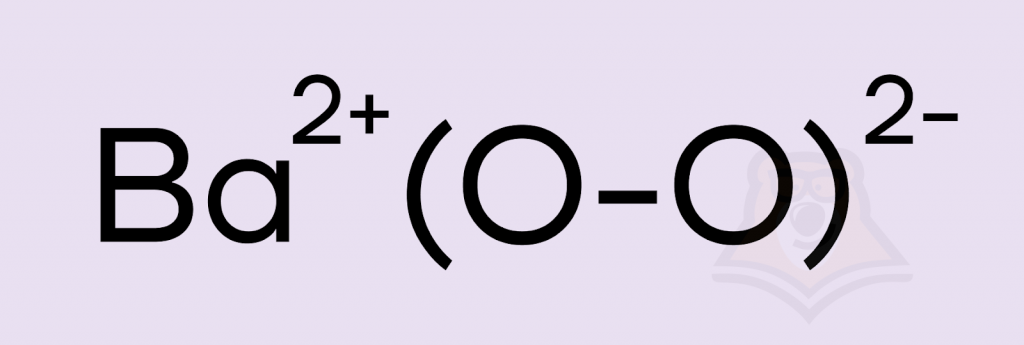
Ответ: 25
- Взаимодействие с водой.
Щелочноземельные металлы, начиная с кальция, легко реагируют с водой при комнатной температуре. В ходе таких реакций, как и в случае с щелочными металлами, образуются соответствующий гидроксид и водород:
Ba + 2H2O = Ba(OH)2 + H2↑
Магний реагирует только с горячей водой:

Бериллий и вовсе с водой не реагирует:
Be + H2O -/→
- Взаимодействие с кислотами.
Металлы IIA группы реагируют с растворами кислот, при этом образуя соответствующие соли:
Ca + 2HCl = CaCl2 + H2↑
При взаимодействии с кислотами-окислителями бериллий ведет себя как металл средней активности, остальные же — как активные.
4Ca + 5H2SO4(конц.) = 4CaSO4 + H2S + 4H2O
Be + 2H2SO4(конц.) = BeSO4 + SO2 + 2H2O
4Сa + 10HNO3(оч. разб.) = 4Ca(NO3)2 + NH4NO3 + 3H2O
Be + 4HNO3(конц.) = Be(NO3)2 + 2NO2 + 2H2O
А подробнее про свойства важнейших кислот-окислителей (концентрированной серной и азотной) вы можете почитать в статьях «Соединения серы(IV) и серы» и «Элементы VА группы. Азот».
- Взаимодействие с солями.
Металлы IIA группы, начиная с кальция, не используют для вытеснения других металлов из растворов их солей, поскольку они реагируют с водой.
Бериллий и магний при обычных условиях с водой не реагируют и могут быть использованы в реакциях замещения:
Mg + CuSO4 = MgSO4 + Cu
| Как появляется накипь на чайнике? Наверняка вы не раз обнаруживали на дне чайника непонятные белые образования после кипячения воды. Это называется накипью. В чем же причина ее образования? Все дело в растворенных в воде солях кальция и магния. При нагревании на разогретых местах оседают их нерастворимые соли, например, карбонаты. Чаще всего с ней борются при помощи кипячения с кислотой (обычно лимонной), которая разрушает накипь. CaCO3 + 2H+ = Ca2+ + CO2 + H2O |
Жесткость воды
Раз уж мы заговорили о накипи, то необходимо разобрать и причину ее возникновения — жесткость воды.
Жесткость воды — совокупность свойств, зависящих от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
При этом различают:
- постоянную жесткость, или некарбонатную, которая обусловлена присутствием сульфатов и хлоридов кальция и магния;
- временную жесткость, или карбонатную, которая обусловлена присутствием гидрокарбонатов кальция и магния.
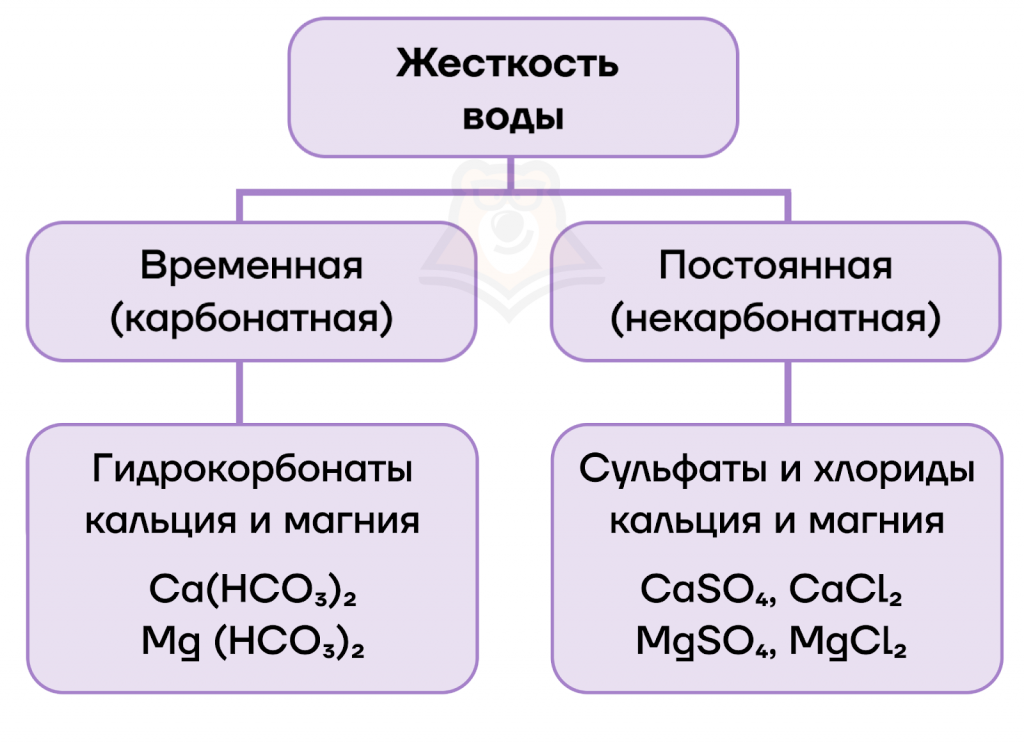
Как можно устранить жесткость воды?
- Кипячение воды.
При этом гидрокарбонаты будут разлагаться на соответствующие нерастворимые карбонаты, выпадающие в осадок.
Ca(HCO3)2 = CaCO3 + СО2 + Н2О
- Добавление карбоната натрия.
Этот метод также вызывает осаждение нерастворимых карбонатов кальция и магния. Этим способом можно устранить и постоянную, и временную жесткость.
Ca(HCO3)2 + Na2CO3 = CaCO3↓ + 2NaHCO3
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4
Посмотрим, какие еще сюрпризы может преподнести карбонат кальция на примере задания №9 ЕГЭ по химии.
Задание.
Задана следующая схема превращения веществ:
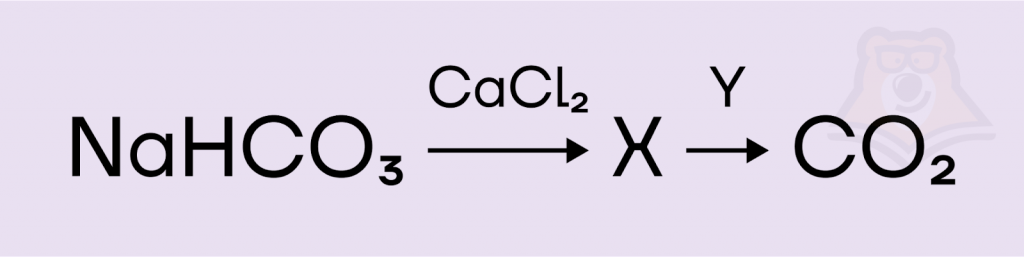
В предложенном перечне веществ определите вещества X и Y, вступающие в указанные реакции.
1. CaO
2. CaCO3
3. Ca(HCO3)2
4. NaOH
5. HCl
В ответ запишите выбранные номера в порядке XY.
Решение.
В результате реакций ионного обмена между гидрокарбонатом натрия и хлоридом кальция образуется осадок карбоната кальция (2):
2NaHCO3 + CaCl2 = CaCO3↓ + 2NaCl + CO2 + H2O
Карбонаты (даже нерастворимые) легко реагируют с растворами кислот, например, с соляной кислотой (5). В ходе таких реакций выделяется углекислый газ:
CaCO3 + 2HCl = CaCl2 + H2O
Ответ: 25
Применение щелочноземельных металлов
Спектр применения щелочноземельных металлов огромен и охватывает многие сферы жизни и производства.
Бериллий в большинстве случаев используется для создания различных сплавов: он повышает твердость и прочность материалов, хорошо защищает поверхность от воздействия коррозии. Также бериллий используется при изготовлении рентгеновских аппаратов и в ядерной энергетике.
Магний используют при восстановлении металлов из соединений и получении титана и создании сплавов — его сплавы отличаются высокой прочностью и легкостью, поэтому используются при производстве самолетов, автомобилей, ракет. Магний является одним из важнейших элементов, необходимых для поддержания жизнедеятельности организма как человека (участвует в проведении нервных импульсов и энергетическом обмене), так и растений (входит в состав хлоропластов), а также применяется в медицине.
Оксид магния находит применение в военной отрасли: благодаря способности ярко гореть он используется для изготовления сигнальных ракет и светошумовых гранат.
Металлический кальций используется в производстве и очистке стали и чугуна, а также восстановлении некоторых металлов из их оксидов. Кроме промышленного применения, кальций и его соединения являются компонентами многих строительных материалов, применяются при изготовлении топлива, огнеупорных материалов и лекарственных средств. Ионы кальция участвуют в процессе свертывания крови, регулируют мышечные сокращения, а также формируют кости и зубы.
Стронций применяется в металлургии, радиоэлектронике, ядерной энергетике, магнитных материалах и источниках электричества. Изотопы применяются для лечения злокачественных образований в организме человека. Частично стронций может замещать кальций в тканях человека.
Барий применяется при производстве вакуумных приборов, оптических линз, источников тока, жидких теплоносителей, а также в атомной энергетике. Сульфат бария применяется в медицине: так как он не пропускает рентгеновские лучи, его используют как рентгеноконтрастное вещество.
Радий востребован в медицине, ядерной промышленности, используется с осторожностью из-за высокой токсичности.
| Как распознать катионы щелочноземельных металлов? Катионы щелочноземельных металлов, попадая в пламя, придают ему окраску, что позволяет проводить качественный анализ путем внесения капли раствора соли в пламя. |
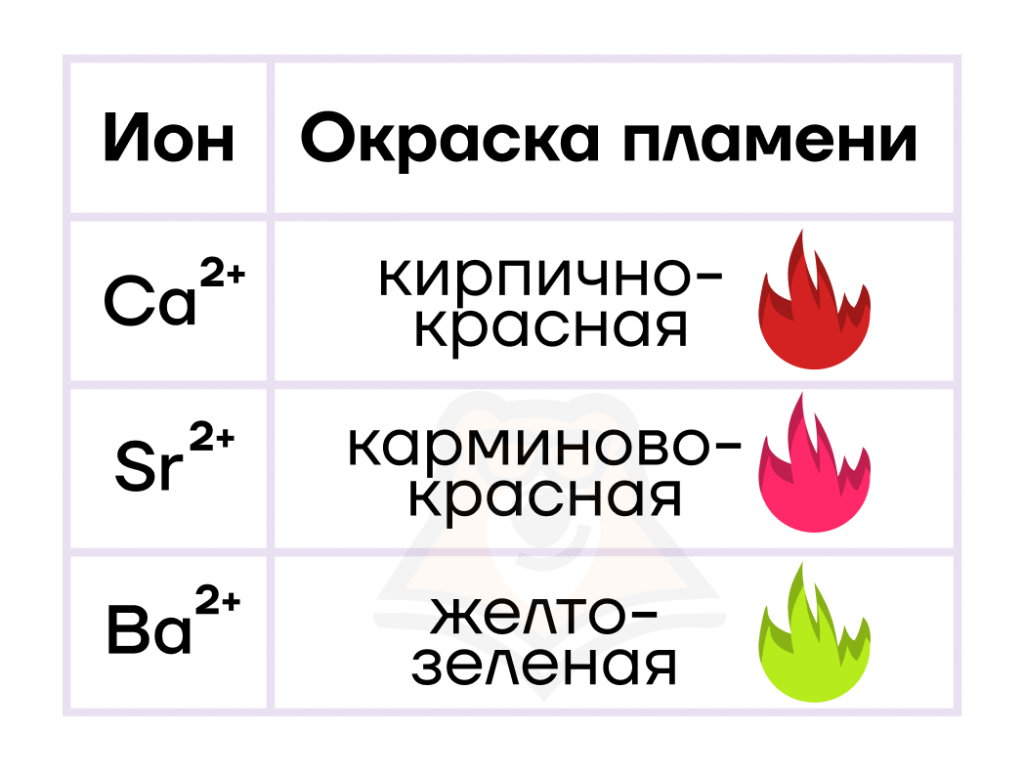
Катионы ЩЗМ можно обнаружить в растворе и с помощью некоторых качественных реакций.
Магний, кальций и барий можно обнаруживать по образованию нерастворимых карбонатов (осадки белого цвета, растворимые в кислотах):
Ca2+ + CO32- = CaCO3↓
Для качественного определения бария в растворе также используют образование труднорастворимого сульфата (осадок белого цвета, нерастворимый в кислотах):
Ba2+ + SO42- = BaSO4↓

На этом наше знакомство со ЩЗМ металлами подходит к концу. Мы познакомились с их электронным строением, распространенностью в природе, свойствами и способами получения простых веществ. Но не стоит останавливаться на достигнутом, рекомендуем прочитать про свойства алюминия и цинка в статье «Амфотерные металлы: цинк, алюминий».
Термины
Изотопы — разновидности атомов химического элемента, имеющие одинаковое количество протонов и электронов, но разное количество нейтронов, следовательно, и разную атомную массу.
Фактчек
- К металлам IIA группы относят бериллий, магний, кальций, стронций, барий и радий, их называют щелочноземельными металлами.
- Традиционно к щелочноземельным металлам относят лишь кальций, стронций, барий и радий.
- В соединениях с другими элементами металлы IIA группы проявляют постоянную валентность II, степень окисления +2.
- Магний, кальций, стронций, барий и радий относятся к активным металлам, бериллий — к металлам средней активности.
- Жесткость воды и накипь на нагревательных приборах обуславливаются присутствием в воде некоторых солей кальция и магния.
Проверь себя
Задание 1.
Какую степень окисления проявляют металлы IIA группы в соединениях?
- +1;
- +2;
- +3;
- +4.
Задание 2.
Какой из металлов IIA группы реагирует с водой только при нагревании?
- бериллий;
- кальций;
- магний;
- барий.
Задание 3.
Что образует кальций при взаимодействии его с кислородом?
- оксид кальция;
- пероксид кальция;
- надпероксид кальция;
- озонид кальция.
Задание 4.
Чем обусловлена временная жесткость воды?
- Присутствием хлоридов кальция и магния.
- Присутствием гидрокарбонатов кальция и магния.
- Присутствием сульфатов кальция и магния.
- Присутствием карбонатов кальция и магния.
Ответы:1. — 2; 2. — 3; 3. — 1; 4. — 2.


 к списку статей
к списку статей





