Предельные одноатомные и многоатомные спирты, фенол
На этой странице вы узнаете
- «Гори оно все синим пламенем» — о безнадежности или о спиртах?
- Что такое оенофобия и кто такой корк-тизер?
- Аспирин — яд или лекарство?
Перед знакомством с кислородсодержащими веществами обычно рассматривают углеводороды — с этим мы справились в статье «Алканы». Сегодня познакомимся с двумя классами кислородсодержащих веществ — спиртами и фенолами, узнаем, что между ними общего и чем они отличаются, как делают вино и откуда берутся блуждающие огни.
Спирты
Спирты — один из важнейших классов функциональных производных алифатических углеводородов. Объединяет все соединения этого класса, как обычно, общий элемент строения — наличие OH-группы.
Спирты не только используются человеком в его хозяйственной деятельности, но и распространены в природе. Например, в листьях и стеблях многих растений содержится «зеленый спирт» — гексен-3-ол-1, который и придает им любимый Гермионой Грейнджер «запах свежескошенной травы».
Спирты — производные углеводородов, в молекулах которых один или более атомов водорода замещены на гидроксильную группу (OH-группу).
Простейший представитель ряда спиртов — метанол — используют в синтезе других органических веществ, в качестве растворителя и топлива. Область применения другого спирта — этанола — еще шире, его также используют в синтезе, как растворитель и топливо. Кроме того, этанол применяется в медицине, косметической и пищевой промышленности, в том числе как консервант.
Несмотря на то, что некоторые спирты используют в пищевой промышленности, не стоит забывать, что все спирты — яды. Так, например, продуктом естественного метаболизма этанола в организме человека является ацетальдегид, который затем окисляется в уксусную кислоту. При избытке этанола организм не справляется и происходит накопление ацетальдегида, который оказывает токсическое воздействие на организм: повреждает нативную структуру белков, изменяет свойства фосфолипидов клеточных мембран и вызывает мутации в ДНК.

Классификация спиртов
Мы разобрались, что такое спирты, теперь поговорим о том, какие они бывают.
Спирты можно классифицировать по различным признакам: по строению углеводородного радикала, по виду атома углерода, связанного с ОН-группой, и по количеству таких групп. Рассмотрим эти классификации подробнее.
- По строению углеводородного радикала:
- насыщенные (не содержат кратных связей C-C):
CH3-CH2-CH2-CH2-OH
Бутанол-1
- ненасыщенные (содержат кратные связи):
H2C=CH-CH2-OH
Пропен-2-ол-1 (аллиловый спирт)
- ароматические (освежить в памяти, что такое ароматичность, можно в статье «Арены. Бензол как представитель ароматических углеводородов»):

(бензиловый спирт)
- По типу атома углерода, связанного с ОН-группой:
- Первичные спирты — гидроксильная группа связана с первичным атомом углерода.

- Вторичные спирты — гидроксильная группа связана со вторичным атомом углерода.
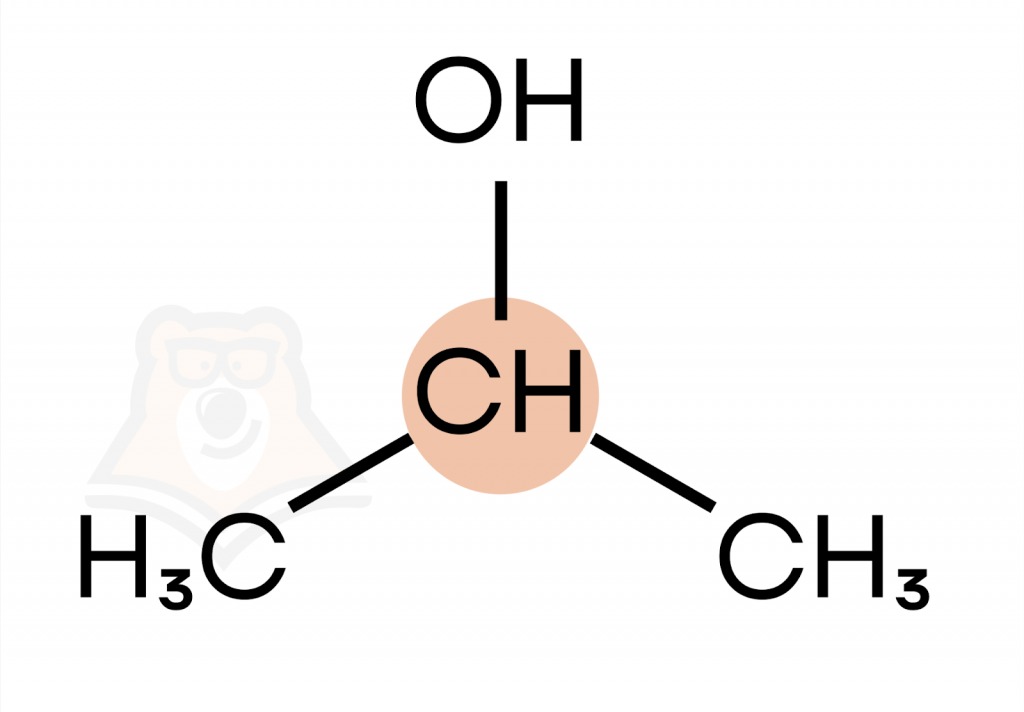
(изопропиловый спирт)
- Третичные спирты — гидроксильная группа связана с третичным атомом углерода.
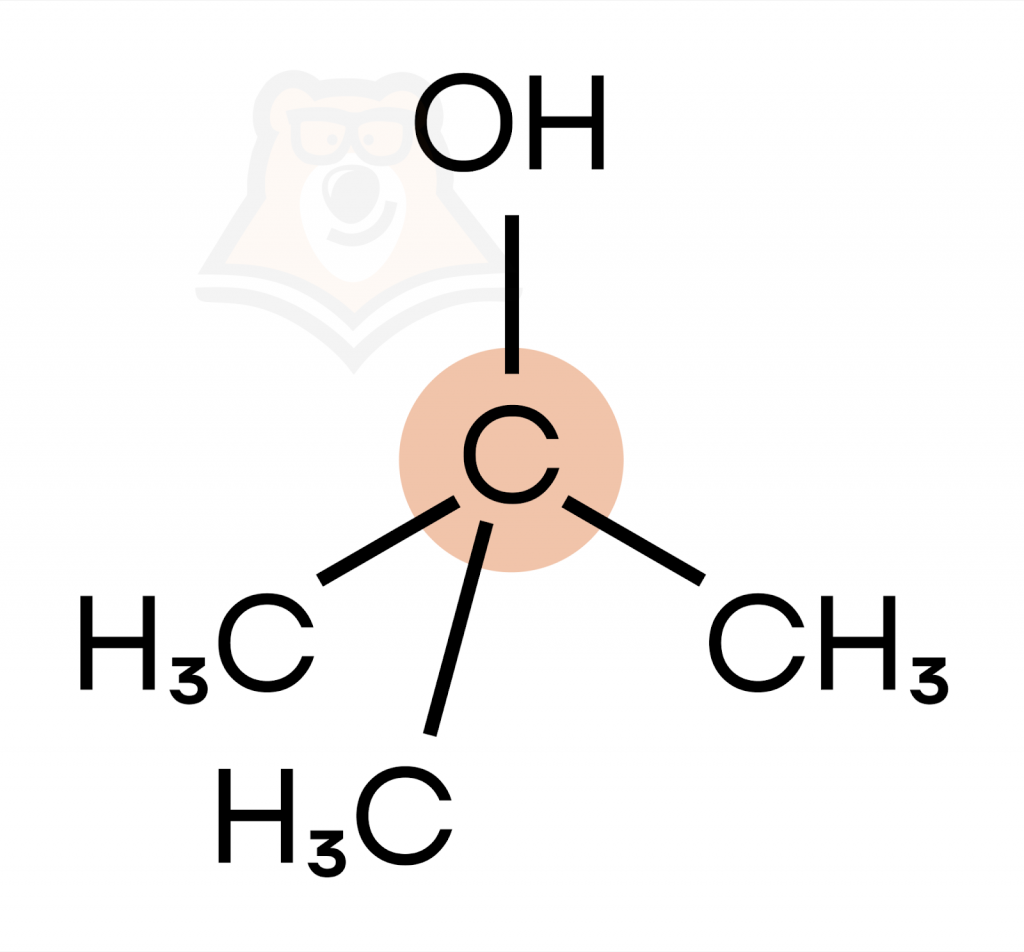
(трет-бутиловый спирт)
- По количеству гидроксильных групп:
- Одноатомные спирты содержат одну гидроксильную группу.
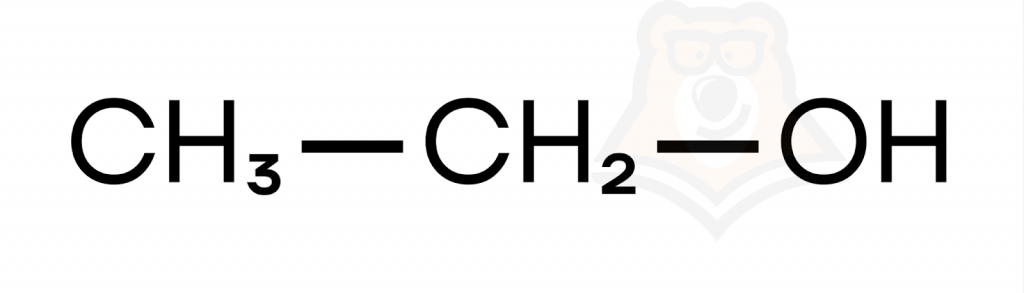
- Двухатомные спирты содержат две гидроксильные группы.
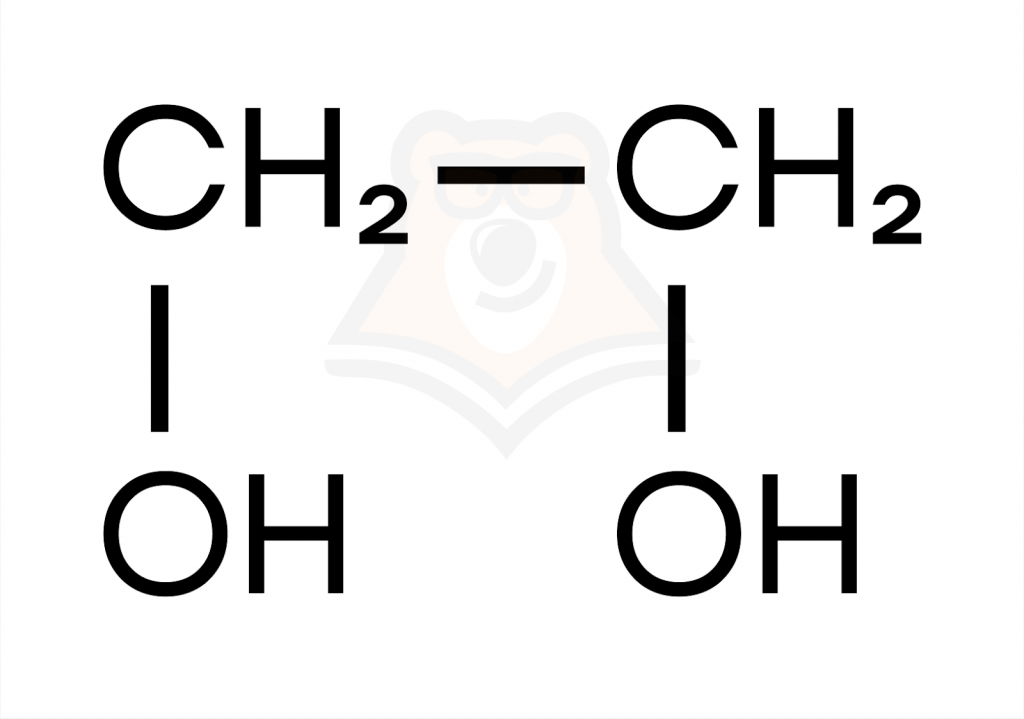
- Трехатомные спирты содержат три гидроксильные группы.
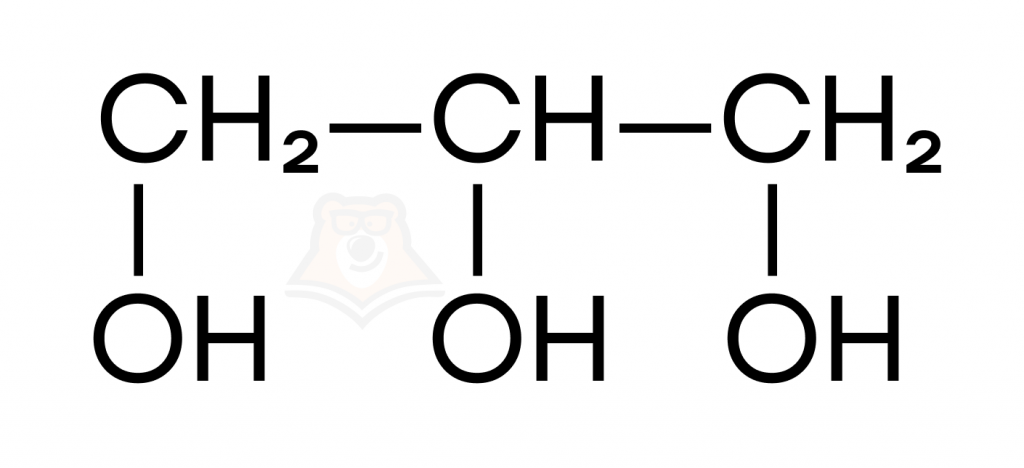
Гомологические ряды спиртов
Для органических веществ характерно явление гомологии, спирты здесь не исключение.
Гомологи — соединения, относящиеся к одному классу веществ и отличающиеся друг от друга на одну или несколько гомологических разниц.
Гомологическая разница — атом или группа атомов, на которую отличаются соседние гомологи. Обычно гомологической группой является метиленовая группа (-CH2-).
Родоначальником гомологического ряда предельных одноатомных спиртов является метанол — CH3OH. Следующие члены ряда: этанол CH3-CH2-OH, пропанол-1 CH3-CH2-CH2-OH и т.д.
Общая формула ряда предельных одноатомных спиртов: CnH2n+1OH
Аналогичным образом вы сами можете получить формулы гомологических рядов непредельных или ароматических спиртов.
Изомерия спиртов
Как и для других классов органических соединений, для спиртов характерно явление структурной изомерии.
Структурная изомерия — существование веществ с одинаковым качественным и количественным составом, но разным строением.
У спиртов можно встретить несколько типов структурной изомерии: изомерия углеродного скелета, положения ОН-группы и межклассовая.
- Изомерия углеродного скелета — различие в порядке связывания атомов углерода.
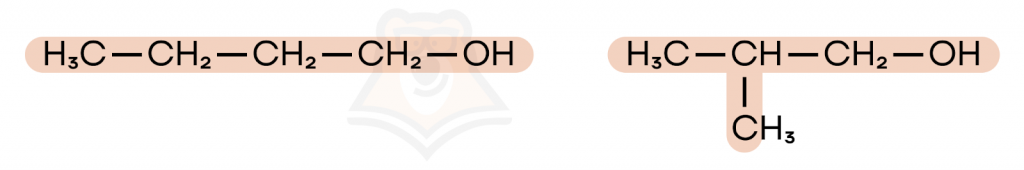
- Положения OH-группы — OH-группа связана с разными атомами углерода.
- Межклассовая — вещества относятся к разным классам.
Для спиртов характерна межклассовая изомерия с простыми эфирами.
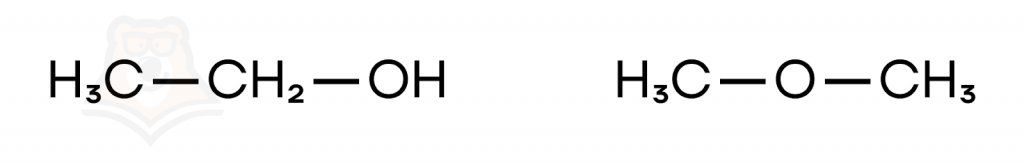
Физические свойства спиртов
К важнейшим физическим свойствам любого вещества относятся агрегатное состояние при н.у., температуры плавления и кипения, цвет, запах, растворимость в воде и органических жидкостях.
С увеличением молекулярной массы вещества обычно происходит увеличение температур плавления и кипения. И спирты здесь не исключение.

Но есть один нюанс… Вещества с близкой молекулярной массой, как правило, и плавится, и кипеть начинают при близких температурах. Спирты, однако, кипят при температурах значительно более высоких, чем углеводороды со схожей молекулярной массой.
| Формула | CH3OH | C2H6 | C2H4 |
| M (г/моль) | 32 | 30 | 28 |
| Температура плавления (°C) | 64,7 | -89 | -103,7 |
Такое поведение спиртов связано с возможностью образования между их молекулами водородной связи.
Водородная связь — взаимодействие между положительно заряженным атомом водорода одной молекулы и сильно электроотрицательным атомом другой молекулы (N, O, F).

Химические свойства спиртов
Характерные химические свойства спиртов обусловлены наличием OH-группы и ее влиянием на углеводородный радикал.
- Кислотные свойства спиртов
Спирты содержат полярную гидроксильную группу.
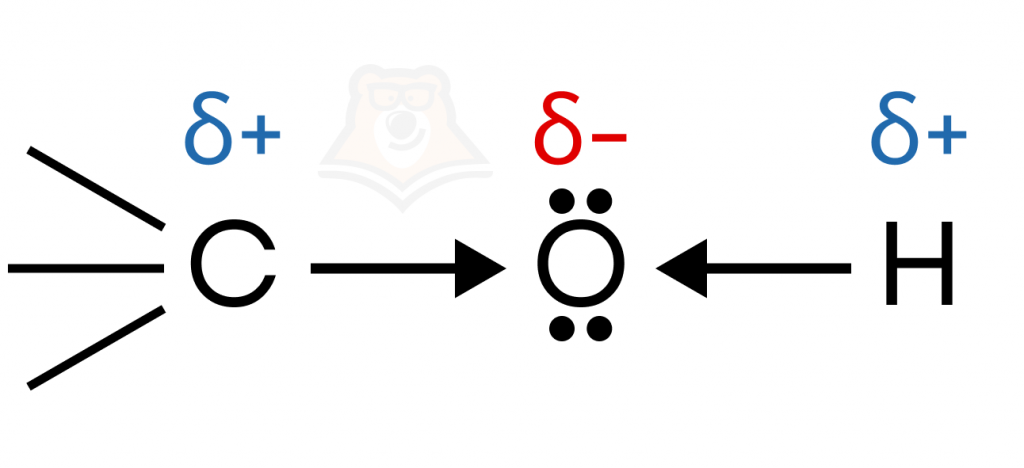
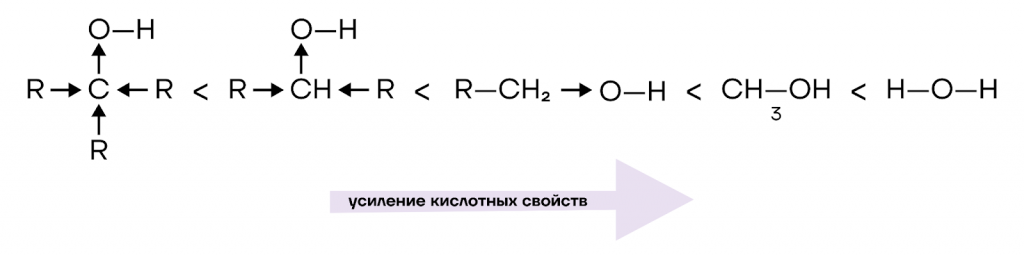
Из-за возможности гетеролитического разрыва связи O-H спирты способны проявлять кислотные свойства. Спирты, однако, являются очень слабыми кислотами: они не диссоциируют в водном растворе, в их присутствии индикаторы не изменяют окраску, а в реакцию вступают лишь с наиболее активными металлами.
Атом кислорода, как видно на картинке выше, стягивает на себя электронную плотность не только с атома водорода, но и с углеводородного радикала. Чем больше «соседей» у ɑ-атома углерода, тем больше электронной плотности стягивается к кислороду, и тем менее полярной становится связь O-H. Поэтому кислотность одноатомных спиртов уменьшается от первичных спиртов к третичным.
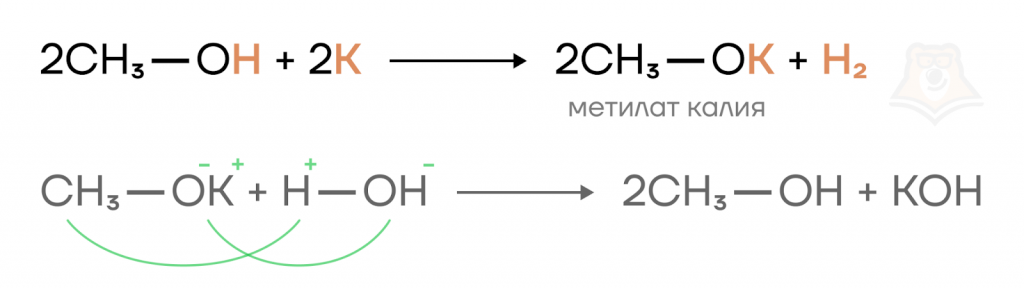
Спирты вступают в реакцию замещения с активными металлами, в результате реакции образуются алкоголяты — белые кристаллические вещества, растворимые в воде.

Например, при взаимодействии метанола и калия образуется метилат калия.
- Реакция этерификации (образование сложных эфиров)
За счет взаимодействия гидроксильной группы карбоновых кислот и водорода гидроксильной группы спирта образуется вода. Освободившиеся связи кислоты и спирта соединяются, за счет чего образуется сложный эфир.
Например, при взаимодействии метанола и пропионовой кислоты образуется метилпропионат.

Возможны также реакции с многоосновными кислотами и многоатомными спиртами.

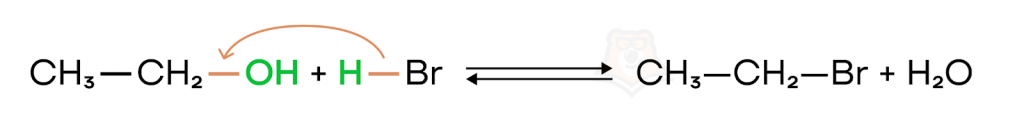
- Замещение гидроксильной группы на галоген
При гетеролитическом разрыве связи C-O в спиртах возможно замещение OH-группы на другой отрицательно заряженный фрагмент, например, на атом галогена.
При взаимодействии, например, этанола и бромоводорода гидроксильная группа замещается на галоген и образуется бромэтан.
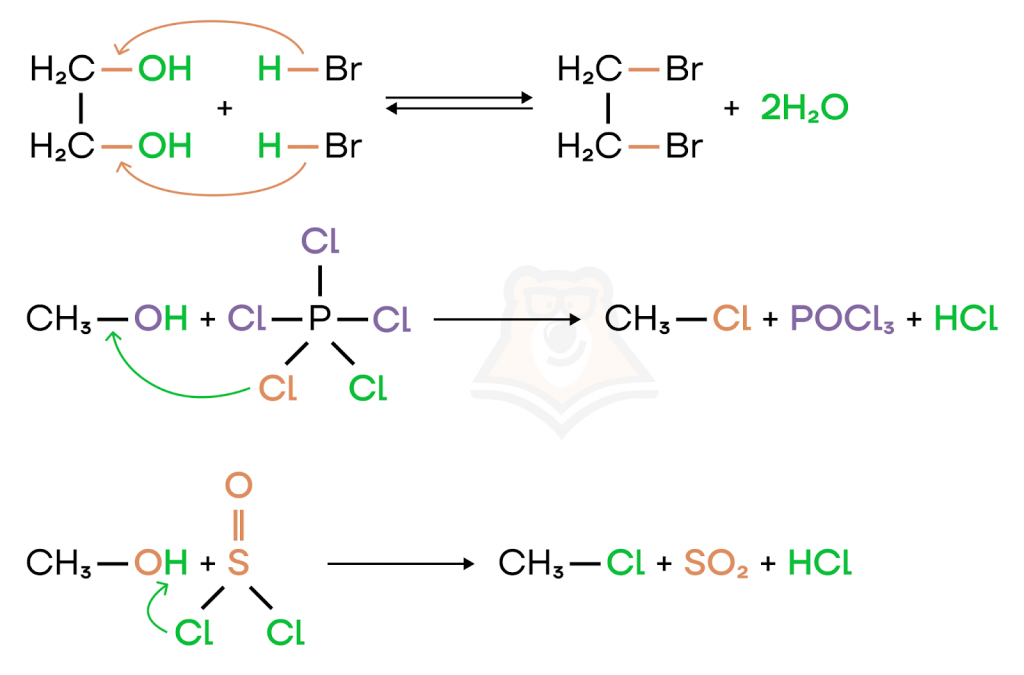
Возможны также реакции с многоатомными спиртами, пентахлоридом фосфора (PCl5), тионилхлоридом (SOCl2).
- Дегидратация (просто отнимаем воду)
Сильные водоотнимающие агенты, такие как концентрированная серная кислота, способны отрывать воду от молекул спиртов. Все просто, отрываем OH-группу и еще атом водорода.

С отрывом водорода, впрочем, все не так просто. Здесь возможны варианты.
- Отрыв атома происходит от соседнего атома углерода той же молекулы — внутримолекулярная дегидратация. Продуктом такой реакции является алкен.
- Отрыв атома водорода происходит от OH-группы другой молекулы спирта — межмолекулярная дегидратация. В ходе межмолекулярной дегидратации образуется простой эфир.

Тип реакции дегидратации зависит от условий: внутримолекулярная дегидратация (t > 140°C) и межмолекулярная (t ≤ 140°C).
Например, этанол при температуре 180°C образует этилен, а при температуре 140°C — диэтиловый эфир.

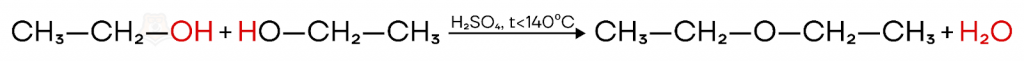
Соединения образующиеся в ходе межмолекулярной дегидратации спиртов — простые эфиры.
Простые эфиры — кислородсодержащие органические вещества, имеющие общий вид R-O-R’, где R и R’ — органические заместители.
Для названия простых эфиров широко используется радикально-функциональная номенклатура. Для названия простого эфира необходимо назвать оба заместителя при кислороде, перечислить их в алфавитном порядке и добавить слово эфир.
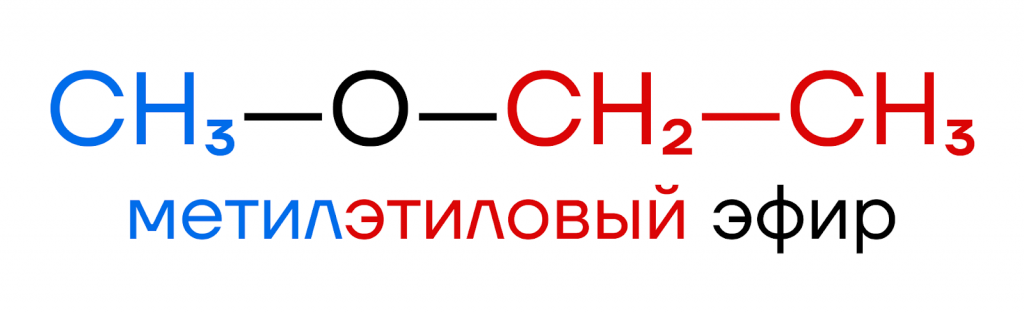
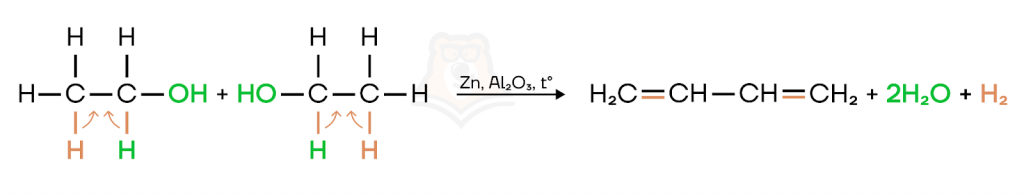
- Реакция Лебедева
С этой реакцией мы уже встречались, когда проходили алкадиены. Подробнее про их свойства можно прочитать в статье «Алкадиены».
При нагревании в присутствии ZnO, Al2O3 как катализатора этанол подвергается дегидратации и дегидрированию с образованием бутадиена.
- Окисление
Под реакциями окисления в органике, в первую очередь, подразумевают реакции, сопровождающиеся разрывом связей C-H или C-C и образованием на их месте связей C-O. Окисление спиртов, таким образом, может приводить к образованию карбонильных соединений или карбоновых кислот, в которых больше связей углерода с кислородом.
Окислять спирты можно действием:
- оксида меди(II) (CuO);
- перманганата калия (KMnO4);
- бихромата калия (K2Cr2O7).
Под действием оксида меди(II) из первичных спиртов образуются альдегиды, из вторичных — кетоны, третичные спирты не вступают в подобные реакции.

Реакция с оксидом меди(II) является качественной на одноатомные спирты, образуется красный осадок меди.
Аналогичные продукты образуются и при каталитическом дегидрировании спиртов на медном катализаторе.
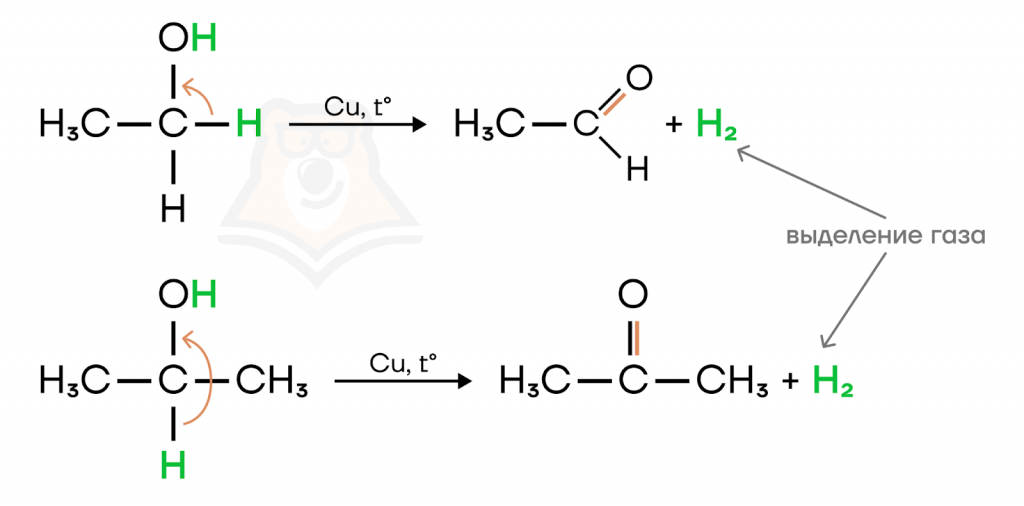
При использовании более сильных окислителей, таких как перманганат или бихромат калия, получить из первичного спирта альдегид становится непростой задачей. Дело в том, что альдегиды в таких условиях окисляются дальше, конечным продуктом окисления являются карбоновые кислоты.
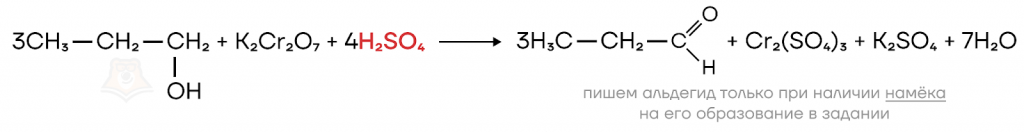

Окисление вторичных спиртов все так же приводит к образованию кетонов.

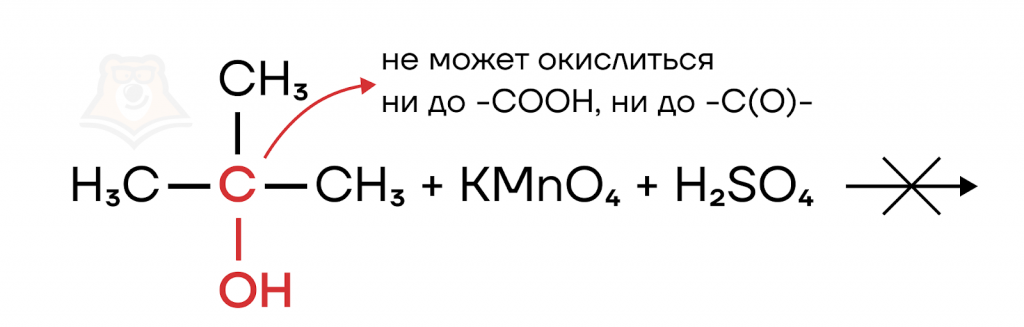
Третичные спирты гораздо более устойчивы к действию окислителей, поскольку для их окисления необходимо разрушить углеродный скелет.
- Горение
Все просто: все кислородсодержащие соединения горят до углекислого газа и воды. Спирты горят голубым пламенем.

| «Гори оно все синим пламенем» — о безнадежности или о спиртах? Так говорят о деле, которое уже невозможно исправить. Эта ассоциация вызвана тем, что ночью иногда можно увидеть огоньки синего пламени на кладбищах, болотах. С научной точки зрения они появляются, когда метан, выделяющийся при гниении органики, горит синим цветом. Это связано с незначительными количествами выделяющегося также фосфина, который вспыхивает на воздухе и поджигает метан, имеющий синий цвет пламени при горении (вспомним газовую плиту). Наши предки связывали такие огоньки с душами утопленных в болоте людей. И хоть метан принадлежит классу алканов, а не спиртов, цвет горения последних можно запомнить благодаря этому фразеологизму. |
| Химические свойства спиртов часто встречаются в задании №15 ЕГЭ по химии. Давайте разберем пример. Задание. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Решение. А) Под действием кислого раствора перманганата калия проводят реакции окисления органических веществ. Карбоновые кислоты можно получить при окислении соответствующих первичных спиртов. Вещество X — бутанол-1. Подходит ответ 4. Б) Сырьем для получения дивинила (бутадиена-1,3) в присутствии катализатора ZnO/Al2O3 является этанол. Сам процесс носит имя его создателя — синтез Лебедева. Подходит ответ 1. В) Здесь описана реакция внутримолекулярной дегидратации, которая протекает по правилу Зайцева (водород отрывается от наименее гидрогенизированного из соседей атома углерода, связанного с гидроксидной группой). Таким образом, получить бутен-1 можно из бутанола-1 и нельзя из бутанола-2. Подходит ответ Г) Здесь в ходе реакции межмолекулярной дегидратации образуется дивторбутиловый эфир (содержащий вторичный бутиловый радикал), т.е. в реакцию должен вступать бутанол-2. Подходит ответ Ответ: 4143 |
Особенности многоатомных спиртов
Молекулы многоатомных спиртов содержат несколько гидроксильных групп, из-за чего они обладают рядом отличий от одноатомных спиртов.
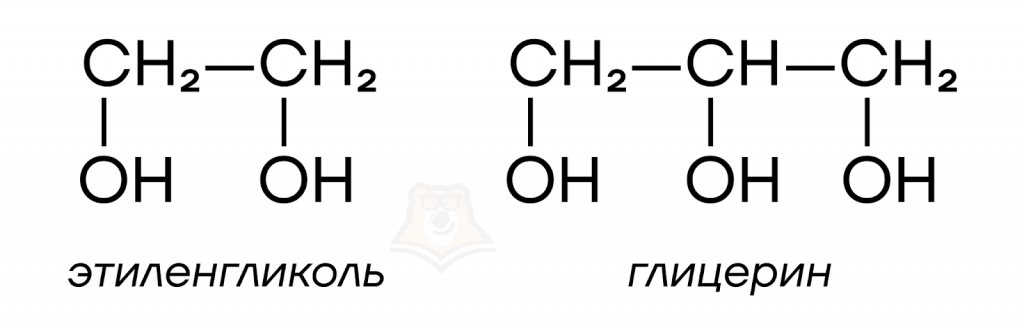
Многоатомные спирты проявляют более выраженные кислотные свойства, чем одноатомные спирты. Каждая гидроксильная группа оттягивает электронную плотность к себе, увеличивая поляризацию связи O-H другой. Такой эффект проявляется только в случае, когда гидроксильные группы расположены при соседних атомах углерода.
Взаимное влияние гидроксильных групп приводит к тому, что они вступают во взаимодействие не только с активными металлами, но и со щелочами.

Реакция со свежеосажденным Cu(OH)2 является качественной на многоатомные спирты. В ходе такого взаимодействия образуется комплексное соединение, окрашивающее раствор в синий цвет. В случае глицерина образуется глицерат меди.
Отдельного внимания заслуживает реакция между глицерином и азотной кислотой. Образующееся соединение — тринитроглицерин (сложный эфир глицерина и азотной кислоты) — примечательно тем, что может и сердце вылечить, и дом взорвать. Буквально. Нитроглицерин используют для купирования приступов стенокардии и в производстве динамита.
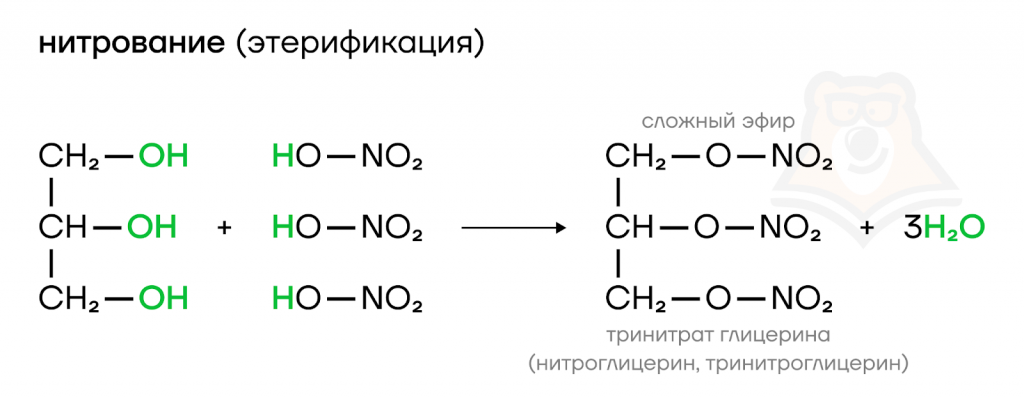
У глицерина, как и у этиленгликоля, есть и менее интересные применения, в изготовлении незамерзающих жидкостей, парфюмерии и в качестве растворителей.
Получение спиртов
Спирты необходимо постоянно синтезировать, потому что они применяются во многих сферах жизни.
Спирты используются для производства красок для типографии и текстильного производства, входят в состав антифризов, тормозных жидкостей и используются в качестве дезинфицирующих средств.
Есть несколько способов получения спиртов. Узнаем о каждом из них подробнее.
- Гидратация алкенов
При добавлении воды происходит разрыв двойной связи, что приводит к образованию спиртов. Присоединение воды к двойной связи протекает по правилу Марковникова (о нем вы можете подробнее узнать в статье «Алкены»), т.е. водород присоединяется к более гидрогенизированному атому углерода при двойной связи, а OH-группа — к менее.

- Брожение глюкозы
Из глюкозы можно под действием ферментов получить этанол и углекислый газ. За счет ферментов происходит брожение и образуется спирт.

| Что такое оенофобия и кто такой корк-тизер? Брожение виноградного сока — микробиологическое превращение сахаров (глюкозы и фруктозы) в этиловый спирт, осуществляемое винными дрожжами. То есть необходимые для процесса брожения ферменты выделяют микроорганизмы. Это основной процесс в виноделии. И для расширения словарного запаса или просто для любителей необычных слов у нас две новинки: — оенофобия — так называется боязнь вина. Список фобий огромен, и все они имеют оригинальные названия. Можете полистать на досуге. — корк-тизер — это человек, который постоянно говорит о том, что он откроет бутылку вина, но никогда этого не делает. Происхождение данного словосочетания затерялось на просторах интернета, но само оно продолжает существовать и активно использоваться. |
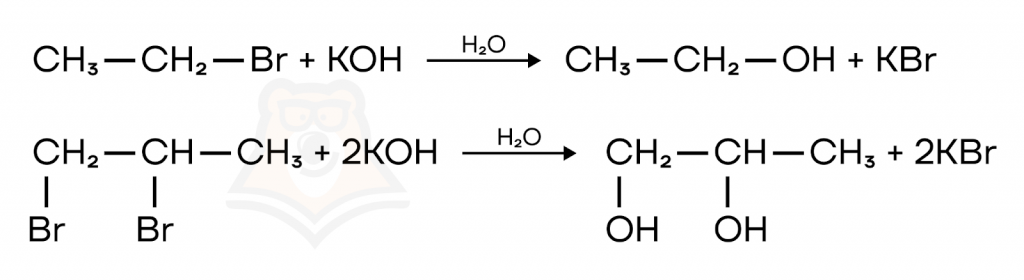
- Гидролиз сложных эфиров, жиров и галогеналканов
При реакциях со щелочами важно указывать, что нужно брать именно водный раствор, так как в спиртовом растворе протекает реакция дегидрогалогенирования — образуется алкен.

- Восстановление карбонильных соединений
За счет добавления водорода происходит разрыв двойной связи и образуется спирт.

В задании №16 ЕГЭ по химии рассматривается взаимосвязь углеводородов и кислородсодержащих органических соединений, так что там частенько можно встретить вопросы, связанные со способами получения спиртов. Посмотрим на пример.
Задание. Задана схема превращений:
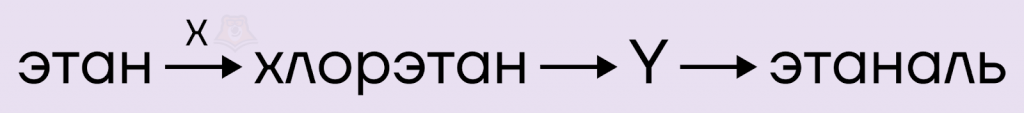
Определите, какие из предложенных веществ являются веществами X и Y.
1) Cl2
2) HCl
3) CH2=CH2
4) CH3-CH2-OH
5) CH3-CH2-CH2-CH3
В ответ запишите выбранные номера в порядке XY.
Решение. С веществом X все легко, галогеналканы получают из алканов в ходе реакции галогенирования, так что вещество X — Cl2.
CH3-CH3 + Cl2 → CH3-CH2-Cl + HCl
Вещество Y должно получаться из галогеналкана в одну стадию, и в одну же стадию превращаться в альдегид. На роль вещества Y подходит спирт. Этиловый спирт можно получить в ходе щелочного гидролиза хлорэтана, а при его окислении оксидом меди(II) образуется этаналь.
CH3-CH2-Cl + NaOH → CH3-CH2-OH + NaClCH3-CH2-OH + CuO → CH3-CHO + Cu + H2O
Ответ: 14
На этом закончим разговор о спиртах и перейдем к фенолам.
Что такое фенолы?
Фенолы — ближайшие родственники спиртов, также содержат гидроксильную группу, вот только связана она с ароматическим фрагментом, например, бензольным кольцом.
Простейшим представителем (любезно предоставившим свое имя всему классу) данного класса веществ является гидроксибензол, он же фенол.
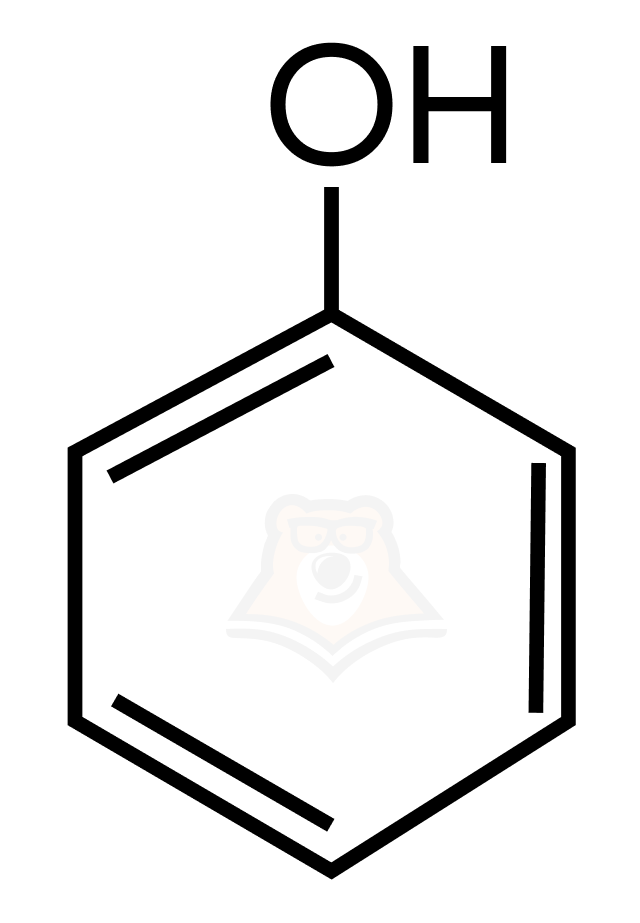
Фенолы — это производные ароматических углеводородов, в молекулах которых один или более атомов водорода в бензольном кольце замещены на гидроксильную группу (ОН-группу).
Для названия многих фенолов используются тривиальная номенклатура. Некоторые формулы и соответствующие им тривиальные названия представлены ниже.
фенол орто-крезол гидрохинон пирогаллол

Давайте рассмотрим строение фенолов на примере молекулы фенола, как бы это ни звучало. В молекуле фенола все атомы углерода находятся в sp2-гибридизации, т.е. мы имеем дело с ароматическим углеводородным радикалом. Однако свойства этого фрагмента несколько отличаются от свойств «чистого» бензольного кольца из-за взаимного влияния гидроксильной группы и ароматической системы.
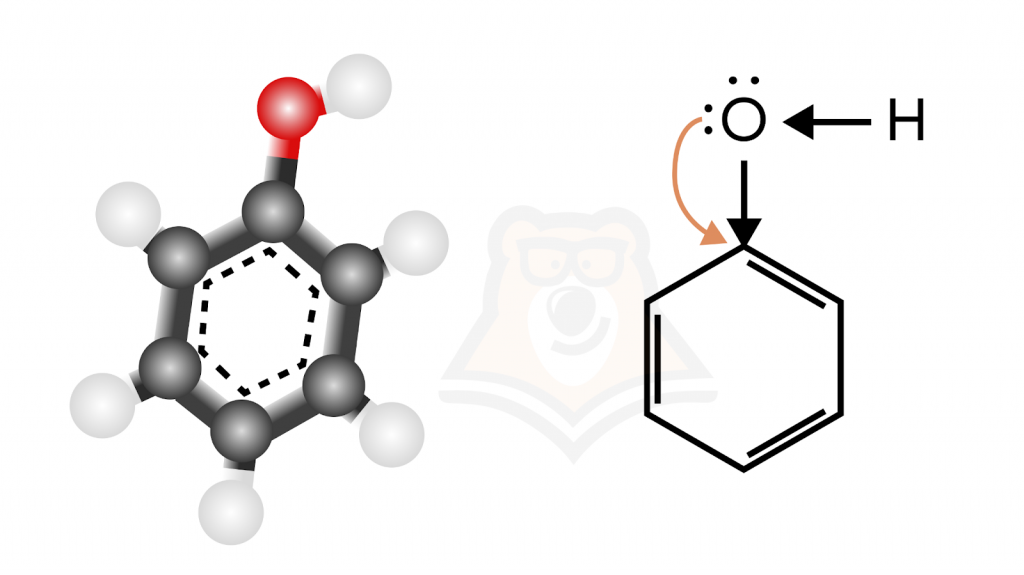
Чтобы лучше понять строение, можно представить, что водород и C6H6-O — спортсмены, которые перетягивают канат на себя, из-за чего связь О-Н очень легко рвется, поэтому фенол проявляет более выраженные кислотные свойства, чем спирты.
| Аспирин — яд или лекарство? Действующим веществом всем известного аспирина является ацетилсалициловая кислота. Это соединение обладает способностью блокировать один из ферментов метаболизма, за счет чего лекарство оказывает обезболивающее, жаропонижающее и противовоспалительное действие. Однако при длительном и неразумном применении аспирин все же довольно вреден для человека: он повышает риск развития язвы желудка и поражения почек. Это связано с тем, что ацетилсалициловая кислота нарушает синтез не только «плохих» веществ, отвечающих за боль и воспаление, но и «хороших», защищающих слизистую оболочку желудка и регулирующих работу почек. Впрочем, многие лекарственные препараты, не только лечат, но и немного калечат. Именно поэтому не стоит заниматься самолечением и перед приемом лекарственных препаратов проконсультироваться с врачом. |
Какими физическими свойствами обладают фенолы?
Нужно знать, что с увеличением числа атомов углерода происходит переход из жидкости в твердое агрегатное состояние.
Фенол — ядовитое вещество без цвета, обладающее характерным запахом гуаши. Легко окисляется кислородом воздуха (розовеет). Малорастворим в холодной воде, хорошо — в горячей.
Фенолы розовеют на воздухе из-за окисления, приводящего к образованию окрашенных веществ (это связано с промежуточным образованием хинонов — циклогексадиенонов).

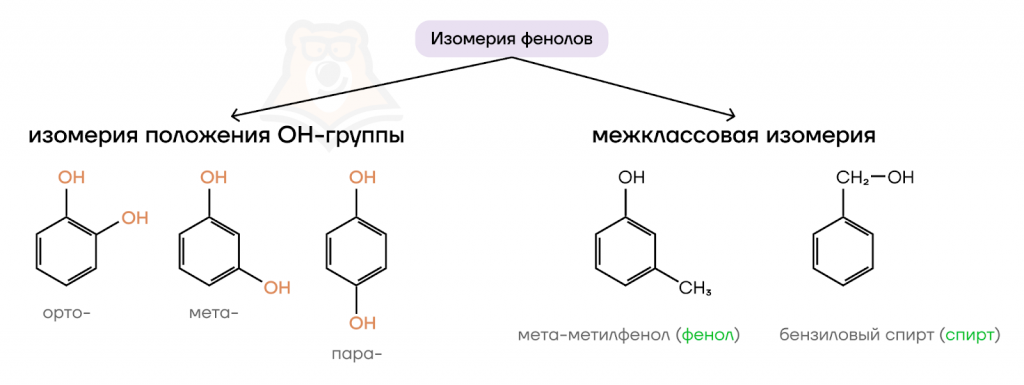
Химические свойства фенолов
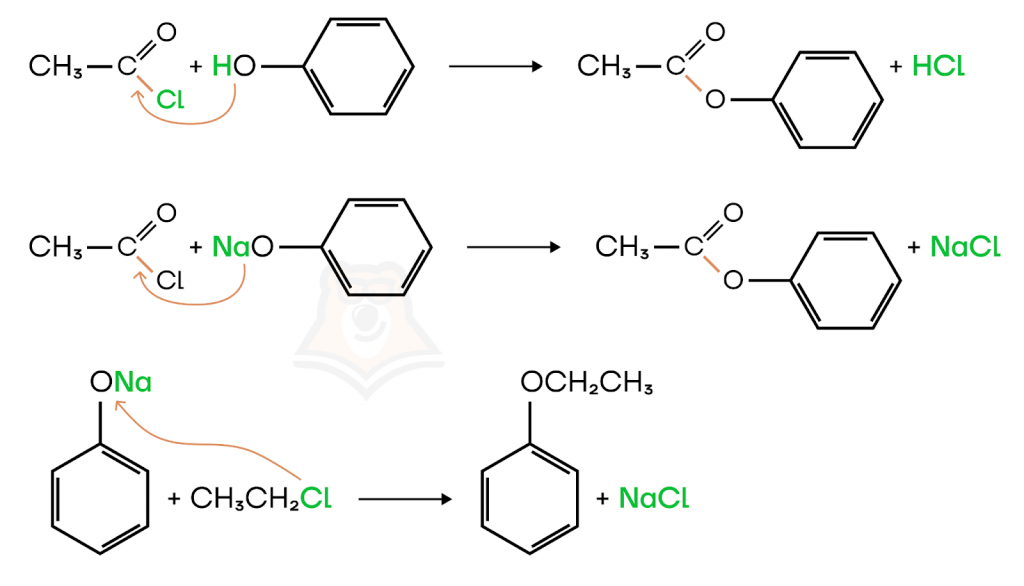
- Реакция образования сложных эфиров
Фенол не реагирует с карбоновыми кислотами, в отличие от спиртов, но взаимодействует с их более активными производными — галогенангидридами.
- Замещение водорода на металл
Так как фенолы являются более сильными кислотами, чем спирты, они способны реагировать не только с активными металлами, но и со щелочами. Несмотря на то, что фенолы обладают более сильными кислотными свойствами, чем спирты, они все еще остаются очень слабыми по сравнению с «классическими» кислотами.

Фенолы можно вытеснить из их солей — фенолятов, даже действием угольной кислоты (при пробулькивании через раствор углекислого газа).

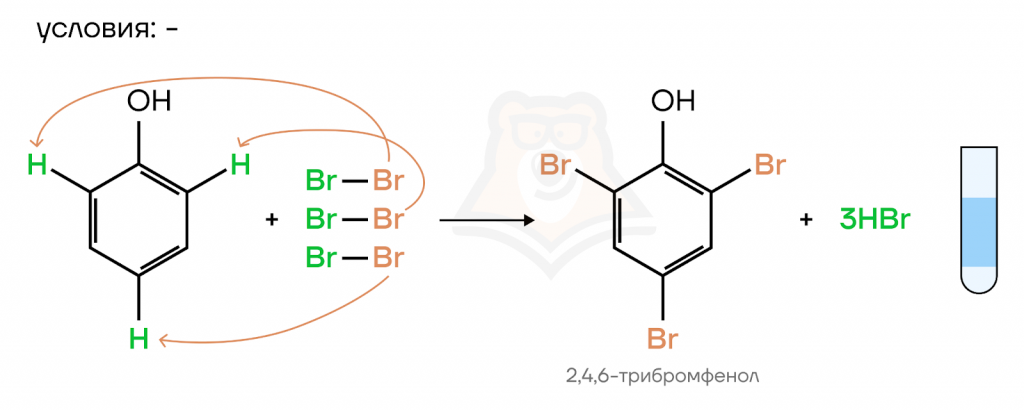
- Галогенирование
Качественная реакция для фенолов, так как в результате взаимодействия фенола с бромом образуется белый осадок 2,4,6-трибромфенола.
- Нитрование
В результате реакции образуется желтая кислота — 2,4,6-тринитрофенол. Это явный признак, значит, такая реакция тоже будет качественной.
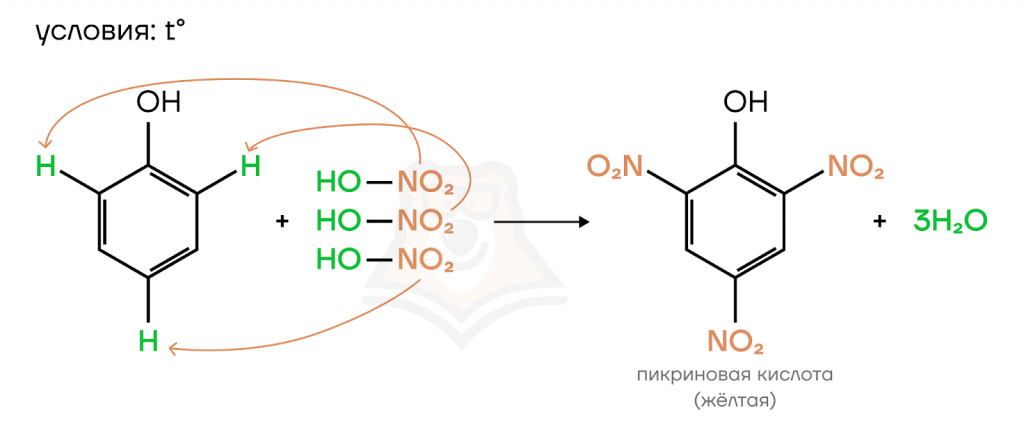
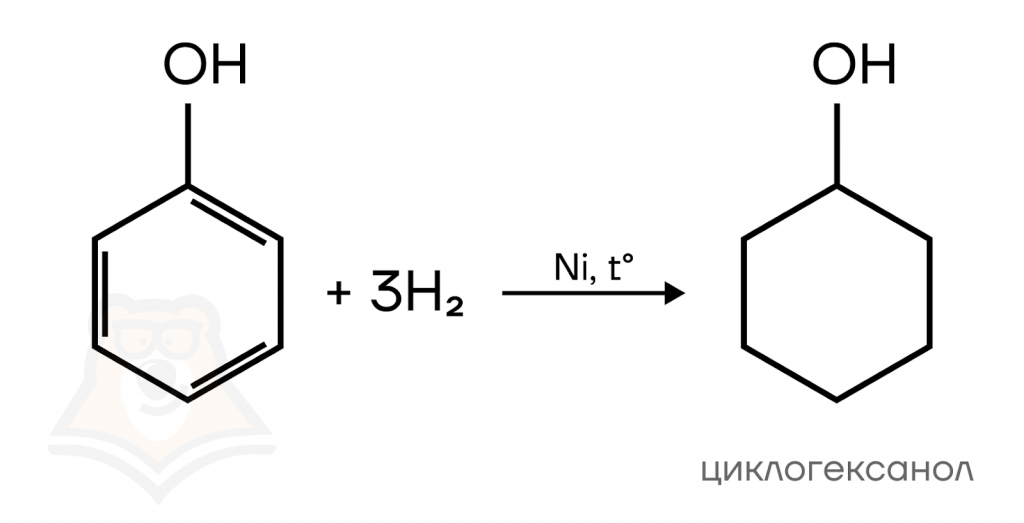
- Гидрирование
Как и другие производные бензола, фенол можно подвергнуть каталитическому гидрированию (взаимодействию с водородом в присутствии катализатора), при этом образуется циклогексанол — циклический спирт.
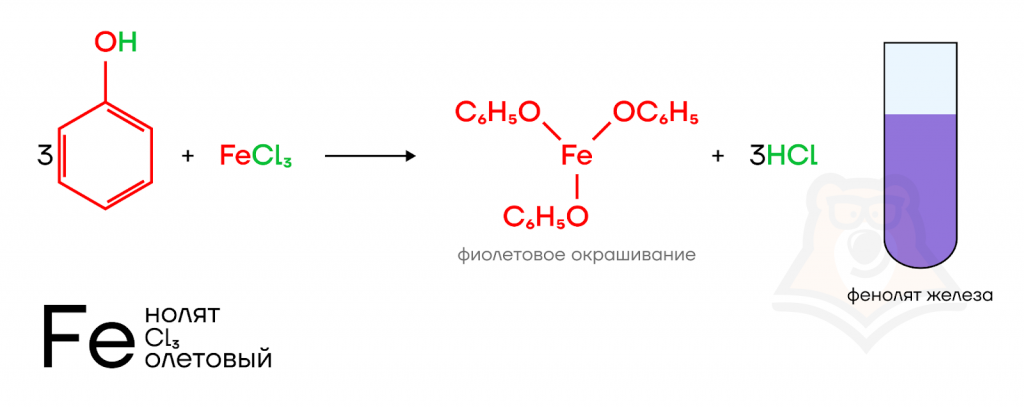
- Качественная реакция на фенолы с хлоридом железа(III)
При взаимодействии фенола с хлоридом железа(III) образуется комплексное соединение, окрашивающее раствор в фиолетовый цвет.
Получение фенолов
Фенолы, как и спирты, используются в самых различных областях. Например, сам фенол используют для получения лекарственных препаратов, моющих средств, полимерных материалов, для защиты деревянных конструкций от насекомых и это далеко не полный список.
Большое количество различных применений фенола обуславливает высокую потребность в его получении. Рассмотрим способы получения фенола.
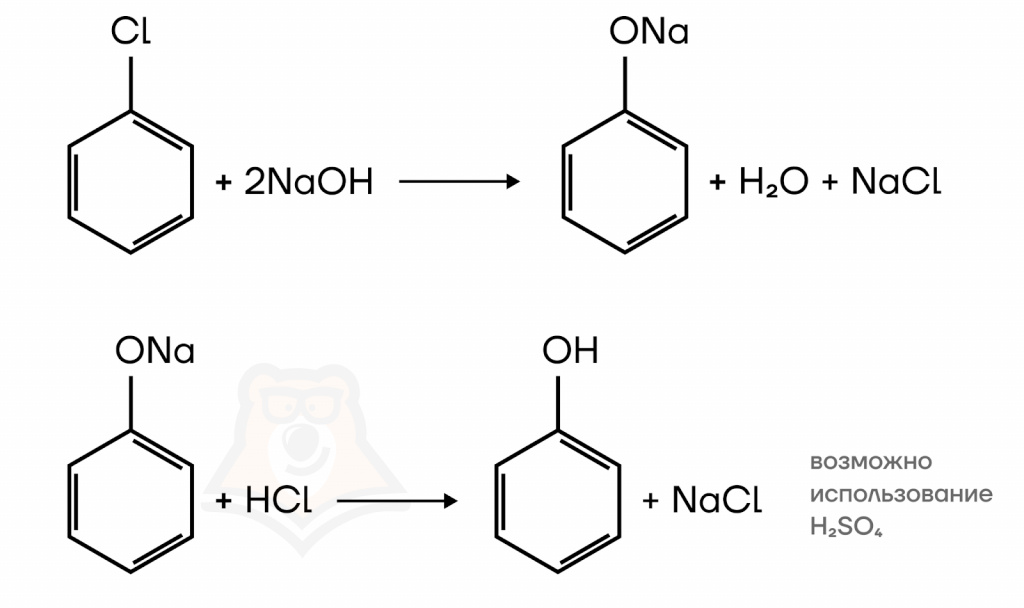
- Щелочной гидролиз галогенбензола
Взаимодействии хлорбензола с водным раствором щелочи должно бы приводить к образованию фенола (по аналогии с получением спиртов). Но, как уже было отмечено выше, фенолы реагируют со щелочами, поэтому в ходе такой реакции образуется соответствующий фенолят. Сам фенол получают путем его вытеснения из фенолята действием сильной кислоты.
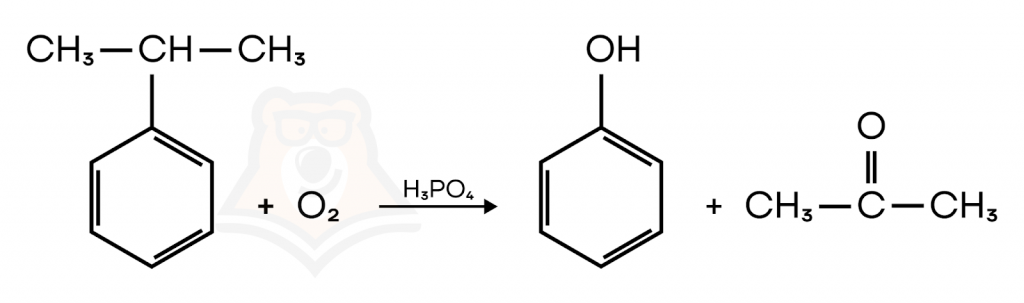
- Кумольный способ
Важным промышленным способом получения фенола является окисление кумола — изопропилбензола. В ходе этого процесса образуется сразу два важных органических вещества — фенол и ацетон.
На этом наше знакомство со спиртами и фенолами подходит к концу. Мы познакомились с их строением, важнейшими физическими и химическими свойствами, а также способами получения. Однако спирты — это лишь первый класс кислородсодержащих органических соединений, с которыми необходимо познакомиться. Дальнейшее знакомство рекомендуем продолжить в статье «Альдегиды и кетоны».
Термины
Алифатические углеводороды — углеводороды, содержащие открытые (незамкнутые) углеродные цепи.
Гетеролитический разрыв связи — тип разрыва связей, при котором электроны, задействованные в образовании связей, остаются у более электроотрицательного атома. В ходе такого разрыва образуются ионы. Гетеролитический разрыв характерен для полярных связей.
Фактчек
- Спирты — класс кислородсодержащих органических соединений, содержащих гидроксильную группу (OH-группу).
- Благодаря наличию OH-группы спирты проявляют кислотные свойства, вступают в реакции замещения OH-группы и окисления.
- Многоатомные спирты обладают рядом особенностей из-за наличия нескольких OH-групп. Они проявляют более сильные кислотные свойства, чем одноатомные спирты, а с гидроксидом меди(II) образуют комплексное соединение синего цвета.
- Фенолы — ароматические кислородсодержащие соединения, в молекулах которых содержится гидроксильная группа (ОН-группа).
- Особенности фенолов объясняются взаимным влиянием ароматической системы и гидроксильной группы. Так, фенол является более сильной кислотой, чем спирты, и активнее, чем бензол, вступает в реакции замещения по бензольному кольцу.
Проверь себя
Задание 1.
Какое из перечисленных веществ является спиртом?
- Пропанол-1
- Дивинил
- Ацетилен
- Толуол
Задание 2.
Какое из перечисленных веществ является фенолом?
- Бензол
- Этанол
- Мета-метилфенол
- Ксилол
Задание 3.
С каким из предложенных веществ фенол вступает в реакцию?
- Водородом
- Соляной кислотой
- Оксидом меди(II)
- Медью
Задание 4.
Какого цвета осадок образуется при реакции фенола с бромом?
- Белого
- Желтого
- Черного
- Осадок не образуется
Задание 5.
Для производство чего, из предложенного ниже списка, не используются фенолы?
- Лекарств
- Резины
- Антифризов
- Красителей
Ответы:1. — 1; 2. — 3; 3. — 1; 4. — 1; 5. — 3.


 к списку статей
к списку статей






