Расчеты по химическим формулам и уравнениям реакций. Часть 2
На этой странице вы узнаете
- Как отбор порции используется на производстве?
- Что может стать причиной разложения вещества?
- Какие кристаллогидраты могут встретиться на экзамене?
С расчетами по химическим формулам мы уже познакомились в первой части этой статьи — «Расчеты по химическим формулам и уравнениям реакций. Часть 1». Сегодня мы продолжаем изучать эту огромную и очень важную тему, чтобы на экзамене нам все было по плечу!
Расчеты с использованием массовой доли для двух растворов
Массовая доля вещества (ω) и объемная доля газа (φ) имеют очень схожие формулы, да и суть этих формул одна. Мы берем массу или объем какого-то конкретного вещества и делим его на массу или объем соответственно всего раствора/смеси.
В чем же тогда разница между массовой и объемной долями?
Разница лишь в том, что массовая доля используется для жидкостей и твердых веществ, где мы используем понятие массы, а объемная доля только для газов, где применяется понятие объема.
Чтобы было понятнее, давайте рассмотрим пример. На парте лежало 10 телефонов (смесь/раствор). Из них 3 самсунга и 7 айфонов. Чему равна доля самсунгов (вещества)?
Чтобы решить эту задачу, мы берем количество телефонов самсунг (масса вещества) и делим на количество всех телефонов (масса раствора). То есть мы 3 делим на 10, а затем, чтобы получить ответ в процентах, умножаем число на сто. (3:10)*100=30%. Согласитесь, что не так уж и сложно.
Если мы возьмем некое вещество и добавим его в растворитель, то получим раствор, в составе которого будет растворенное вещество. Разберем на примере со стаканом подсоленной воды.
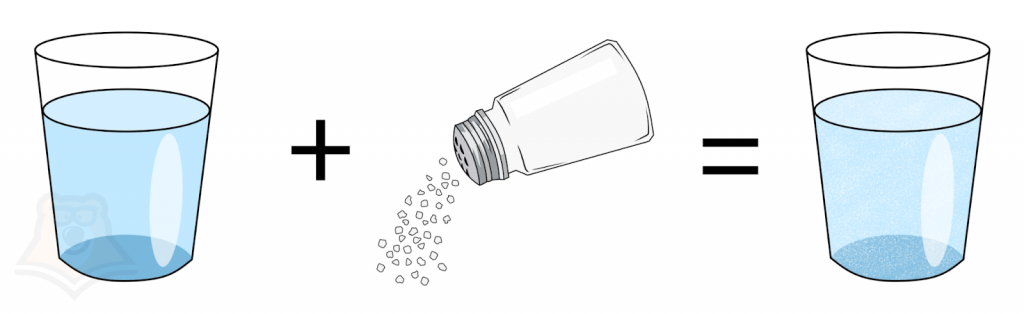
То есть изначально чистая вода — растворитель. Когда его подсолили — добавили вещество, в результате этого получилась соленая вода — раствор, который состоит из воды и соли. Соль растворилась в воде, следовательно, ее масса теперь тоже входит в массу раствора.
Чтобы узнать, какую массовую долю (в процентах) занимает соль от всей соленой воды, мы пользуемся этой формулой:
\(ωв-ва =\frac{m в-ва}{m р-ра} * 100%\)
А если нам в задаче будет дана не масса, а объем воды?

Важно помнить, что объем воды в миллилитрах численно равняется массе воды в граммах. Это объясняется тем, что плотность воды ρ = 1 г/мл, по формуле массы m = ρ*V получим, что m = 1*V или просто m = V.
Давайте рассмотрим задачу, в которой нам нужно будет найти массовую долю вещества в растворе.
Задача 1.
При взаимодействии раствора хлорида натрия массой 75 г с избытком раствора нитрата серебра(I) выпало 2,87 г осадка. Определите массовую долю хлорида натрия в исходном растворе.
Записываем, что нам известно и что мы ищем.
Дано:
mр-ра(NaCl) = 75 г
m(AgCl) = 2,87 г
Найти:
ω(NaCl)
Решение. Записываем уравнение реакции.
NaCl + AgNO3 = AgCl + NaNO3
Осадком в этой реакции является хлорид серебра AgCl, нам известна его масса, а значит, мы можем найти его количество.
n(AgCl) = m(AgCl)/M(AgCl) = 2,87/143,5 г/моль = 0,02 моль
Теперь мы можем найти количество NaCl:
Из УХР следует, что n(AgCl) = n(NaCl)
n(NaCl) = 0,02 моль
Теперь выходим на финишную прямую, считаем искомую массовую долю. Делается это по следующей формуле:
\(ωв-ва =\frac{m в-ва}{m р-ра} * 100%\)
Как мы видим, здесь используется масса вещества, значит, количество хлорида натрия переводим в массу:
m(NaCl) = n(NaCl)*M(NaCl) = 0,02 моль*58,5 г/моль = 1,17 г
А теперь считаем массовую долю хлорида натрия в исходном растворе:
ω(NaCl) = m(NaCl)/mр-ра(NaCl) * 100% = 1,17 г/75 г * 100% = 1,56%
Ответ: 1,56%
Задача 2.
К 140 г 5% го раствора сульфата натрия добавили 60 г 15% раствора этой же соли. После упаривания масса раствора уменьшилась на 40 г. Вычислите массовую долю сульфата натрия в нем. Ответ дайте в процентах с точностью до целых.
Решение. Для начала найдем массу соли в первом и втором растворе.
m1(соли) = ω*m(p-pa) = 5/100 * 140 = 7 г
m2(соли) = 15/100 * 60 = 9 г
Найдем общую массу соли и массу раствора.
m(соли) = m1(соли) + m2(соли) = 7 + 6 = 16 г
m(р-ра) = m1(р-ра) + m2(p-pa) = 140 + 60 = 200 г
После упаривания раствора часть воды испарилась и покинула раствор, масса соли при этом не изменилась. Найдем массу полученного раствора.
m(кон. р-ра) = m(р-ра) — m(воды) = 200 — 40 = 160 г
Найдем массовую долю соли в конечном растворе.
ω(соли) = m(соли)/m(кон. р-ра) = 16/160 * 100% = 10%
Ответ: 10
Задача 3.
К 100 г раствора с массовой долей хлорида натрия 25% добавили 200 г раствора этой же соли с массовой долей 15%. После охлаждения раствора часть соли выпала в осадок, массовая доля конечного раствора равна 10%. Определите массу выпавшей в осадок соли. Ответ дайте с точностью до десятых.
Решение. Найдем изначальную массу аналогично тому, как мы это сделали в предыдущем задании.
m1(соли) = ω*m(p-pa) = 25/100 * 100 = 25 г
m2(соли) = 15/100 * 200 = 20 г
m(соли) = m1(соли) + m2(соли) = 25 + 20 = 45 г
Найдем массу раствора до осаждения.
m(р-ра) = m1(р-ра) + m2(p-pa) = 100 + 200 = 300 г
При выпадении соли в осадок масса воды остается неизменной, при этом масса соли и масса раствора уменьшаются. Примем массу осажденной соли за Х и составим формулу массовой доли.
ω = m(соли)/m(р-ра) = (45 — Х)/(300-Х) = 10%
Найдем Х через полученное уравнение.
(45 — Х)/(300-Х) = 0,1
0,1*(300-Х) = 45- Х
30 — 0,1Х = 45 — Х
0,9Х = 15
Х = 16,7
Таким образом, масса выпавшей в осадок соли равна 16,7 г.
Ответ: 16,7
Данный тип задач встречается в №26 ЕГЭ. В случае получения верного ответа за него можно получить один балл.
Так как первая часть проверяется компьютером, очень важно дать верный числовой ответ, для этого нужно учитывать, в каких единицах измерения и с какой точностью нас просят дать ответ.
Задачи на отбор порции
Разберем, что такое порция, на простом примере, встречающемся в нашей жизни постоянно.
Допустим, у нас была литровая кастрюля супа. На ужин мы взяли одну пятую этой кастрюли, то есть 0,2 л или 200 мл. Взятие некой части от общего раствора и есть отбор порции.
| Как отбор порции используется на производстве? Продукты, лекарства и другие товары должны быть качественными. Но невозможно же проверить абсолютно все товары в партии. Именно поэтому при анализе качества отбирается проба, но не одна, а сразу несколько. Отобранные пробы изучаются на соответствие всем заявленным характеристикам, безопасность и качество, а в дальнейшем результаты разных исследований объединяют и выносят вердикт по всей партии товаров. |

Задача 4.
От раствора соляной кислоты массой 182,5 г отобрали одну пятую. К отобранной порции добавили избыток раствора нитрата серебра(I), при этом наблюдали выпадение белого творожистого осадка. Определите массу осадка.
Решение. Запишем уравнение реакции:
HCl + AgNO3 = AgCl↓ + HNO3
В порции содержится ⅕ исходного раствора, найдем массу порции и количество вещества соляной кислоты в ней.
m(порции) = 182,5/5 = 36,5 г
n(HCl) = m/M = 36,5/36,5 = 1 моль
Количество вещества осадка по уравнению реакции равно количеству вещества соляной кислоты, поэтому n(AgCl) = n(HCl) = 1 моль.
Найдем массу осадка:
m(AgCl) = n(AgCl)*M(AgCl) = 1*143,5 = 143,5 г
Ответ: 143,5 г
Задачи на отбор порции встречаются в №34 ЕГЭ. Разберем критерии данного задания и попробуем понять, как заработать максимальное количество баллов за данный номер.
Первый балл: правильно записаны уравнения реакций, соответствующих условию задания.
Этот балл проще всего получить, достаточно просто записать уравнения реакций, указанных в задании. Очень важно записать все(!) уравнения, а не останавливаться только на самых первых, для этого нужно очень внимательно полностью прочитать задание и убедиться, что реакции в решении описывают все взаимодействия веществ в условии.
Если вы столкнулись с очень сложным заданием, для которого не можете записать решение, не волнуйтесь и не пропускайте задание, попробуйте расписать все реакции, это позволит получить хотя бы 1 балл за трудный номер.
Второй балл: правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания.
Данный балл также получить несложно, особенно если получилось записать все уравнения реакций. Достаточно просто посмотреть, какие величины нам даны в задании, и рассчитать по ним все, что может пригодиться при решении.
Третий балл: продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которой проводятся расчеты.
Получить балл за логику сложнее — важно не запутаться в ходе решения, не забыть про все нюансы формул и реакций.
На экзамене может возникнуть ситуация, когда верный ответ найден, но при этом в решении есть ошибка — в такой ситуации получить максимум за номер не получится. Именно поэтому важно внимательно перепроверить все свое решение.
Представьте, что эксперт плохо понимает химию, а все формулы проверяет по справочнику. Вы должны расписать все понятно, последовательно, чтобы каждая формула была теоретически верной.
Четвертый балл: в соответствии с условием задания определена искомая физическая величина.
Данный балл можно получить только при верном решении задачи.
Обязательно перепроверьте, что именно вас спрашивают в номере, какая размерность у величин должна быть. Исходя из того, по какой формуле находится итоговое значение, проверьте расчеты всех компонентов, входящих в конечную формулу.
Задачи на электролиз
Перед тем, как мы приступим к решению задач, давайте вспомним, в чем заключается суть реакции электролиза.
Электролиз — это окислительно-восстановительная реакция (ОВР), протекающая на электродах при прохождении электрического тока через раствор или расплав электролита.
Подробнее о том, как протекает электролиз, можно узнать, прочитав статью «Электролиз расплавов и растворов (солей, щелочей, кислот)».
Задача 5.
Для проведения электролиза приготовили 50% раствор йодида калия. После окончания электролиза объем выделившейся смеси газов составил 28 л, при этом на катоде выделилось в 4 раза больше газообразного продукта, чем на аноде. Определите массу исходного раствора.
Решение. Запишем уравнение электролиза раствора йодида калия:
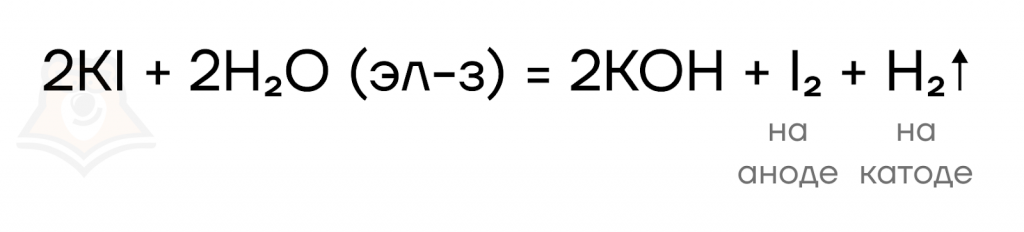
Так как на аноде выделился газ, то протекал не только электролиз соли, но и электролиз воды:
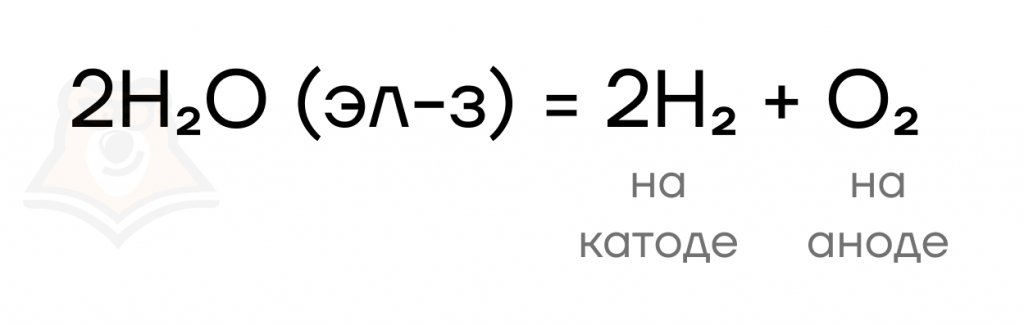
Примем количество вещества газа на аноде за Х, тогда на катоде будет 4Х, а суммарно — 5Х.
Найдем общее количество выделившейся смеси газов:
n(смеси) = V(смеси)/Vm = 28/22,4 = 1,25 моль
Так как общее количество газов равно 5Х и при этом составляет 1,25 моль, найдем Х:
5Х = 1,25
Х = 0,25
Таким образом, количество кислорода равно 0,25 моль, а общее количество водорода 4*0,25 = 1 моль.
По коэффициентам второй реакции водорода выделилось в два раза больше, чем кислорода:
n2(H2) = 2n(O2) = 2*0,25 = 0,5 моль
Тогда весь оставшийся водород выделился в первой реакции, найдем его количество:
n1(H2) = nобщ(Н2) — n2(H2) = 1 — 0,5 = 0,5 моль
Количество вещества соли по первой реакции в два раза больше количества водорода:
n(KI) = 2n(H2) = 2*0,5 = 1 моль.
Найдем массу соли.
m(KI) = n*M = 1* 166 = 166 г
А теперь найдем массу исходного раствора через форму массовой доли.
m(p-pa) = m(coли) ω = 166/0,5 = 332 г
Ответ: 332 г
Задача 6.
Раствор хлорида меди(II) массой 270 г подвергли электролизу, в результате процесса выделилось 33,6 л газа. От полученного раствора отобрали порцию массой 13,5 г и добавили избыток гидроксида калия. Определите массу осадка.
Решение. Запишем уравнение электролиза:
CuCl2 (эл-з) = Сu + Cl2↑
Найдем количество вещества хлорида меди(II) и водорода.
n(CuCl2) = m/M = 270/135 = 2 моль
n(H2) = V/Vm = 33,6/22,4 = 1,5 моль
Количество вещества хлорида, подвергшегося электролизу, равно количеству вещества газа:
nпрореаг(CuCl2) = n(Cl2) = 1,5 моль
Электролиз прошел не полностью, часть соли осталась в растворе. Найдем ее количество:
nпосле эл-за(CuCl2) = n(CuCl2) — nпрореаг(CuCl2) = 2 — 1,5 = 0,5 моль
Найдем массу раствора после электролиза: в ходе электролиза произошло выпадение осадка и выделение газа, их массы нужно вычесть:
m(р-ра после эл-за) = m(исх. р-ра) — m(Cu) — m(Cl2)
m(Cu) = n(Cu)*M
n(Cu) = n(Cl2) — по коэффициентам реакции
m(Cu) = 1,5*64 = 96 г
m(Cl2) = n*M = 1,5*71 = 106,5
m(р-ра после эл-за) = 270 — 96 — 106,5 = 67,5 г
Определим, какую долю отобрали от исходного раствора:
13,5/67,5 = ⅕ — отобрали одну пятую.
Количество вещества в порции в 5 раз меньше, чем в исходном растворе:
nпорции(CuCl2) = ⅕ * 0,5 = 0,1 моль
Запишем реакцию с гидроксидом:
CuCl2 + 2KOH = Cu(OH)2↓ + 2KCl
Количество вещества осадка равно количеству вещества хлорида меди(II):
n(Cu(OH)2) = n(CuCl2) = 0,1 моль.
Найдем массу осадка:
m(Cu(OH)2) = n*M = 0,1*98 = 9,8 г
Ответ: 9,8 г
Задачи на избыток и недостаток веществ
Предположим, в реакции количество вещества одного реагента больше, чем количество вещества другого (при пересчете на одну молекулу каждого). По какому соединению в таком случае мы определим количество вещества продукта?
Разберем на примере, как в задаче может выглядеть такая ситуация.
Допустим, нам дана реакция Сu(NO3)2 + 2KOH = Cu(OH)2 + 2KNO3
По условию общее количество щелочи равно 1 моль, а количество нитрата меди(II) — 0,75 моль. Явно видно, что одного из реагентов больше, чем необходимо для реакции, остается только понять, какого именно. На первый взгляд может показаться, что щелочи — 1 больше 0,75. Но давайте посчитаем количество вещества для одной молекулы с учетом коэффициентов реакции.
По коэффициентам в реакции принимает участие только одна молекула нитрата меди(II), значит, все общее количество вещества уйдет на нее.
Таким образом, nреаг(Cu(NO3)2) = nобщ(Cu(NO3)2) = 0,75 моль
У щелочи в реакции стоит коэффициент 2, то есть общее количество вещества делится между двумя молекулами.
Для одной молекулы nреаг(KOH) = ½*nобщ(KOH) = ½*1 = 0,5 моль.
Теперь мы видим, что при пересчете на одну молекулу количество вещества нитрата меди(II) больше, чем количество вещества щелочи.
Химическая реакция всегда идет по наименьшему количеству вещества (недостатку): взять вещества больше, чем нам дано, мы все равно не можем. Что же тогда делать с избытком — веществом, взятом в количестве большем, чем нужно для протекания реакции? Все, что не прореагирует, просто останется плавать в растворе и либо просто повлияет на массу раствора, либо в дальнейшем прореагирует с чем-то еще. Разберем на примере.
Задача 7.
Навеску гидроксида калия массой 84 г растворили в 405 г 20%-ного раствора бромоводородной кислоты. Определите массовую долю оставшегося в конечном растворе реагента.
Решение. Запишем уравнение реакции:
KOH + HBr = KBr + H2O
Рассчитаем массу и количество бромоводородной кислоты:
m(HBr) = ω(HBr)* m(р-ра HBr) = 0,2*405 г = 81 г
n(HBr) = m(HBr)/M(HBr) = 81/81 = 1 моль
Рассчитаем количество гидроксида калия:
n(KOH) = m(KOH)/M(KOH) = 84/56= 1,5 моль
По уравнению реакции: nпрореаг.(KOH) = n(HBr) = n(KBr) = 1 моль — гидроксид калия в избытке, именно он остался в растворе.
Рассчитаем количество вещества и массу оставшегося после реакции гидроксида калия:
nост.(KOH) = nобщ.(KOH) – nпрореаг.(KOH) = 1,5 моль – 1 моль = 0,5 моль
mост.(KOH) = nост.(KOH) * M(KOH) = 0,5 моль • 56 г/моль = 28 г
Рассчитаем массу конечного раствора — она будет складываться из навески гидроксида калия и раствора бромоводородной кислоты (осадки и газы не образовывались в реакции, значит, вычитать ничего не нужно):
mкон. р-ра = m(KOH) + m(р-ра HBr) = 84 г + 405 г = 489 г
Определим массовую долю щелочи в растворе:
ω = mост.(KOH)/mкон. р-ра * 100% = 28/489 *100% = 5,7%
Ответ: 5,7%
От избытка или недостатка реагентов зависит также продукт реакции.
Задача 8.
10%-ный раствор гидроксида натрия массой 32 г смешали с 32 г 50%-ного раствора ортофосфорной кислоты. Вычислите массу полученной в ходе реакции соли.
Решение. Запишем возможные уравнения реакций:
3NaOH + H3PO4 = Na3PO4 + 3H2O
2NaOH + H3PO4 = Na2HPO4 + 2H2O
NaOH + H3PO4 = NaH2PO4 + H2O
Определим массу и количество вещества гидроксида натрия:
m(NaOH) = ω*m(p-pa NaOH) = 0,4*32 = 12,8 г
n(NaOH) = m/n = 12,8/40 = 0,32 моль
Аналогичные действия проводим для ортофосфорной кислоты:
m(H3PO4) = ω*m(p-pa H3PO4) = 0,5*32 = 16 г
n(H3PO4) = m/n = 16/98 = 0,16 моль
Таким образом, в ходе реакции соотношение щелочи к кислоте 2:1, образуется гидрофосфат натрия.
Его количество равно количеству кислоты:
n(Na2HPO4) = n(H3PO4) = 0,16 моль
Найдем массу соли:
m(Na2HPO4) = n(Na2HPO4)*M = 0,16*142 = 22,72 г
Ответ: 22,7 г
Задачи на неполное разложение
Прежде чем мы перейдем к рассмотрению задач, давайте разберемся, что такое неполное разложение?
Представим, что у нас была навеска карбоната кальция (CaCO3). Мы подвергли его разложению, но реакция прошла не до конца — часть карбоната разложилась, часть осталась в исходном состоянии. В итоге в твердом остатке у нас не только продукт разложения, оксид кальция (CaO), но и сам карбонат кальция.

Задача 9.
При нагревании 100 г образца карбоната кальция масса твердого остатка оказалась в 1,25 раза меньше массы исходного образца. Определите объем газа, выделившегося в ходе реакции.
Решение. Запишем уравнение реакции:
CaCO3 (t) = CaO + CO2
Обозначим количество вещества карбоната, вступившего в реакцию, за Х. Тогда по коэффициентам реакции количество оксида кальция тоже Х.
Найдем массу разложившегося карбоната и оксида кальция:
mразл(CaCO3) = n*M = X*100 = 100X г
m(CaO) = n*M = X*56 = 56X г
Так как масса твердого остатка а 1,25 раз меньше массы исходного образца, можем найти полученную массу:
mтв.ост. = 100/1,25 = 80 г
Если бы реакция протекала полностью, тогда количество разложившегося карбоната было бы равно:
nтеор=m/M = 100/100 = 1 моль
Тогда твердый остаток состоял бы только из оксида кальция и его масса была бы равна 56*1 = 56 г, что не соответствует условию.
Твердый остаток состоит из неразложившегося карбоната и оксида, составим уравнение:
mост(СаСО3) = 100 — 100Х г
mтв.ост. = mост(СаСО3) + m(CaO) = 100 — 100Х + 56Х = 100 — 44Х г
100 — 44Х = 80
44Х = 20
Х = 0,45 моль
Значит, количество вещества оксида кальция равно 0,45 моль. По коэффициентам реакции количество вещества газа равно количеству вещества оксида, найдем объем газа:
V(CO2) = n*Vm = 0,45*22,4 = 10,08 л
Ответ: 10,08 л
Задача 10.
При нагревании образца нитрата хрома(III) часть вещества разложилась, в результате образовалось 78,38 г твердого остатка. Остаток отделили и поместили в избыток водного раствора сульфида калия. По окончании реакции было получено 147 г раствора, массовая доля нитрата калия в котором составила 2%. Определите объем смеси газов, образовавшейся в результате частичного термического разложения исходного образца.
Решение. Запишем уравнения реакций:
4Сr(NO3)3 = 2Cr2О3 + 12NO2 + 3O2
2Cr(NO3)3 + 3K2S + 6H2О = 2Cr(OH)3 + 3H2S + 6KNO3
Найдем массу и количество вещества нитрата калия в конечном растворе:
m(KNO3) = mкон. р-ра * ω(KNO3) = 147*0,02 = 2,94 г
n(KNO3) = m/M = 2,94/101 = 0,03 моль
По второму уравнению реакции найдем количество оставшегося нитрата хрома(III):
nост.(Cr(NO3)3) = n(KNO3)/3 = 0,01 моль — количество оставшегося нитрата хрома(III) mост.(Cr(NO3)3) = nост.(Cr(NO3)3)*M = 0,01*238 = 2,38 г
Твердый остаток состоит из оксида хрома(III) и оставшегося нитрата хрома(III). Мы можем найти массу и количество вещества оксида хрома(III), который образовался в ходе реакции разложения:
m(Cr2О3) = mтв. ост. − mост.(Cr(NO3)3) = 78,38 − 2,38 = 76 г
n(Cr2О3) = 76/152 = 0,5 моль
Найдем количество вещества газов, выделившихся в ходе термического разложения:
n(NO2) = 6n(Cr2О3) = 3 моль
n(O2) = 3/2n(Cr2О3) = 0,75 моль
Найдем суммарное количество вещества газов и их объем (мы можем складывать газы, потому что при нормальных условиях любой газ занимает один и тот же объем):
nгазов = 3 + 0,75 = 3,75 моль
Vгазов = nгазов · Vm = 3,75*22,4 = 84 л
Ответ: 84 л
| Что может стать причиной разложения вещества? Существует множество причин разложения вещества: — влияние жизнедеятельности организмов — один из основных механизмов разрушения отходов; — разложение под воздействием растворителя, например, необратимый гидролиз; — радиация; — электричество — реакция электролиза; — свет — например, разложение озона под действием светового излучения; — температура. Температура является наиболее частым фактором разложения. Если химическое соединение плавится без разложения, то оно считается устойчивым. А вот вещество, которое с повышением температуры разлагается до плавления можно назвать неустойчивым химическим соединением. |
Задачи на кристаллогидраты
Для того чтобы научиться решать данные задачи, нужно сначала определить, что же из себя представляет кристаллогидрат.
Кристаллогидрат — это кристалл, содержащий как соль, так и связанные с ней молекулы воды.
| Какие кристаллогидраты могут встретиться на экзамене? 1. Глауберова соль (Na2SO4*10H2O) используется для синтеза соды, гидроксида натрия и красителя ультрамарина, а также применяется в строительной промышленности и медицине. 2. Медный купорос (CuSO4*5H2O) — чаще всего его используют в сельском хозяйстве (подкормка, борьба с вредителями). 3. Железный купорос (FeSO4*7H2O) используется для профилактики и лечения заболеваний растений. 4. Цинковый купорос (ZnSO4*7H2O) применяется в лабораторной практике, металлургии и медицине. 5. Гипс (CaSO4*2H2O) чаще всего применяется в строительстве. 6. Кристаллическая сода (Na2CO3*10H2O) — применяют в качестве наполнителя в производстве мыла и как составную часть стиральных порошков. 7. Горькая (английская) соль (MgSO4*7H2O) — применяется как соль для ванн, а также в качестве косметического продукта. 8. Алюмокалиевые (KAl(SO4)2*12H2O) и хромокалиевые (KCr(SO4)2* 12H2O) квасцы. |
Задача 11.
Кристаллогидрат хлорида железа(II) массой 19,9 г может прореагировать с 20 г 40%-ного раствора гидроксида натрия. Определите формулу кристаллогидрата.
Решение. Запишем уравнение реакции:
FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl
Рассчитаем массу и количество вещества гидроксида натрия:
m(NaOH) = m(р-ра NaOH)* ω(NaOH) = 20*0,4 = 8 г
n(NaOH) = m/M = 8/40 = 0,2 моль
Рассчитаем количество вещества соли и ее массу:
n(FeCl2) = 1/2n(NaOH) = 0,1 моль
m(FeCl2) = M*n= 127*0,1 = 12,7 г
Рассчитаем массу и количество воды, которая содержится в кристаллогидрате:
m(H2O) = mкристаллогидрата — m(FeCl2) = 19,9 — 12,7 = 7,2 г
n(H2O) = m/M= 7,2/18 = 0,4 моль
Составим формулу кристаллогидрата:
n(FeCl2) : n(H2O) = 0,1 : 0,4 = 1 : 4
Значит, формула кристаллогидрата — FeCl2*4H2O
Ответ: FeCl2*4H2O
Задача 11.
Пентагидрат сульфата меди(II) массой 50 г растворили в 150 г воды. Вычислите массовую долю соли в образовавшемся растворе.
Решение. Молярная масса кристаллогидрата складывается из молярной массы соли и молярной массы воды, умноженной на количество молекул воды:
M(CuSO4*5H2O) = M(CuSO4) + 5*М(H2O) = 160 + 5*18 = 250 г/моль
Рассчитаем количество вещества кристаллогидрата:
n(CuSO4*5H2O) = m(CuSO4*5H2O)/M(CuSO4*5H2O) = 50/250 = 0,2 моль
Растворение кристаллогидрата условно можно показать так:
CuSO4*5H2O = CuSO4 + 5H2O
Мы видим, что по «уравнению» количество вещества сульфата меди(II) равно количеству кристаллогидрата:
n(CuSO4) = n(CuSO4*5H2O) = 0,2 моль
Рассчитаем массу сульфата меди(II):
m(CuSO4) = n(CuSO4)*M(CuSO4) = 0,2*160 = 32 г
Рассчитаем массу раствора, полученную при растворении кристаллогидрата в воде:
mр-ра = m(CuSO4*5H2O) + m(H2O) = 50 + 150 = 200 г
Массовая доля соли будет равна:
ω(CuSO4) = m(CuSO4)/m(р-ра CuSO4)* 100% = 32/200 * 100% = 16%
Ответ: 16%
А теперь решим обратную задачу: в которой вместо приливания воды происходит выпаривание.
Задача 12.
Раствор сульфата железа(II) массой 152 г с массовой долей соли 30% аккуратно выпаривали. В результате получили некоторое количество железного купороса. Найдите его массу.
Решение. Рассчитаем массу и количество вещества сульфата железа(II):
m(FeSO4) = ω(FeSO4)* m(р-ра FeSO4) = 0,3*152 г = 45,6 г
n(FeSO4) = m(FeSO4)/M(FeSO4) = 45,6/152 = 0,3 моль
Выпаривание раствора и образование кристаллогидрата условно можно показать так:
FeSO4 + 7H2O = FeSO4*7H2O
Мы видим, что по «уравнению» количество вещества кристаллогидрата равно количеству сульфата железа(II):
n(FeSO4*7H2O) = n(FeSO4) = 0,3 моль
Вычислим массу кристаллогидрата:
m(FeSO4*7H2O) = n(FeSO4*7H2O)* M(FeSO4*7H2O) = 0,3*278 = 83,4 г
Ответ: 83,4 г
Сегодня мы узнали о многих типах задач, теперь мы точно готовы к экзамену и не боимся никаких расчетов!

Однако химия — это огромная и очень интересная наука, в которой много различных вычислений. Пора познакомиться с новой темой, а для этого рекомендуем прочитать статью «Химические реакции по тепловому эффекту».
Фактчек
- Для решения задач на массовую долю вещества важно найти массу соли и массу всего раствора.
- При отборе порции мы берем некоторую часть раствора и работаем с ней. При этом все характеристики в отобранной порции (масса и количество вещества соли, масса раствора) пропорциональны характеристикам в исходном растворе и составляют определенную долю.
- Для решения задачи на электролиз важно записать уравнения электролиза исходного вещества и не забыть о возможном электролизе воды.
- В задачах на избыток и недостаток один из компонентов дан в количестве, большем, чем необходимо для протекания реакции (в избытке), а расчеты при этом ведутся по компоненту с наименьшим количеством (по недостатку).
- При неполном разложении часть вещества подвергается реакции разложения, а часть остается в исходном состоянии. Твердый продукт реакции и неразложившееся соединение вместе составляют твердый остаток.
- Для решения задач на кристаллогидраты важно уметь рассчитывать молярную массу кристаллогидрата.
Проверь себя
Задание 1.
Чему равна массовая доля воды в растворе массой 200 г, содержащем 25 г соли?
- 12,5;
- 87,5;
- 0,875;
- 0,125.
Задание 2.
От раствора хлорида калия массой 300 г отобрали треть. Чему равно количество вещества соли в отобранной порции?
- 100;
- 2,6;
- 4,0;
- 1,3.
Задание 3.
В ходе электролиза 83 г йодида калия выделения газа на аноде не наблюдалось. Чему равен объем газа на катоде?
- 22,4;
- газ не выделялся;
- 11,2;
- 33,6.
Задание 4.
К 56 г гидроксида калия добавили 85 г нитрата серебра. Чему равна масса осадка?
- 70;
- 140;
- 29;
- 125.
Задание 5.
Чему равна массовая доля воды в глауберовой соли?
- 44%;
- 56%;
- 37%;
- 63%.
Ответы: 1. – 2; 2. – 4; 3. – 3; 4. – 1; 5. – 2.


 к списку статей
к списку статей





