Переходные элементы: хром, железо, марганец
На этой странице вы узнаете
- Как благодаря хрому наша жизнь становится ярче?
- Откуда берутся кровавые реки?
- От любви до ненависти один шаг: как марганец из жизненно необходимого элемента может стать причиной безумия?
Соединения марганца, железа и хрома встречаются не только во многих задачах в учебнике, но и в повседневной жизни — стоит вспомнить, например, ржавчину на капоте машины или кране в ванной, раствор марганцовки, которым мы обрабатываем раны, или красиво переливающиеся хромированные автомобили. О том, почему эти металлы нашли такое широкое применение и где еще они могут нам встретиться, мы сегодня и узнаем.
Общая характеристика
Кто такие переходные элементы и куда они переходят?
К переходным элементам относятся элементы, которые расположены в побочных подгруппах больших периодов периодической системы Д.И. Менделеева. К ним принадлежат d- и f-элементы. Название «переходные» связано с тем, что переходные элементы расположены между s- и р-элементами.

Железо — металл VIIIB группы четвертого периода. Его особенностью, как и особенностью других переходных металлов, является наличие валентных (участвующих в образовании химической связи) электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях.
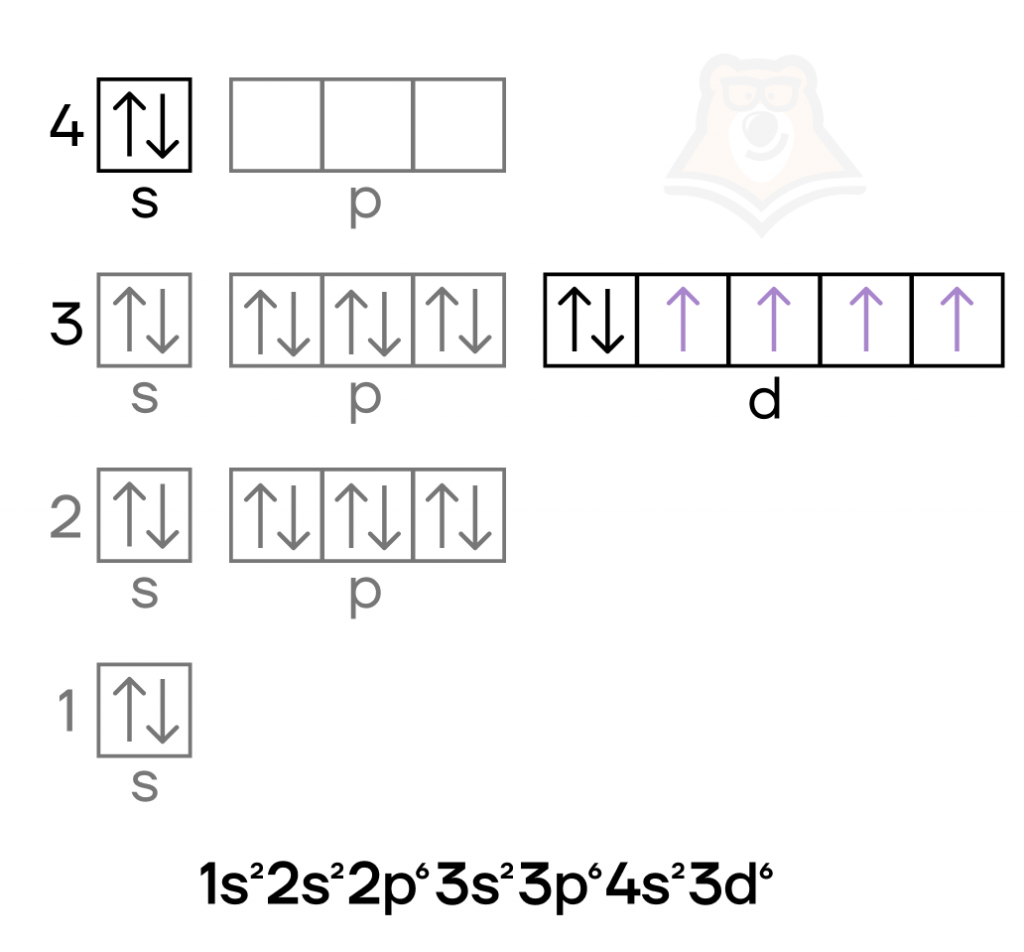
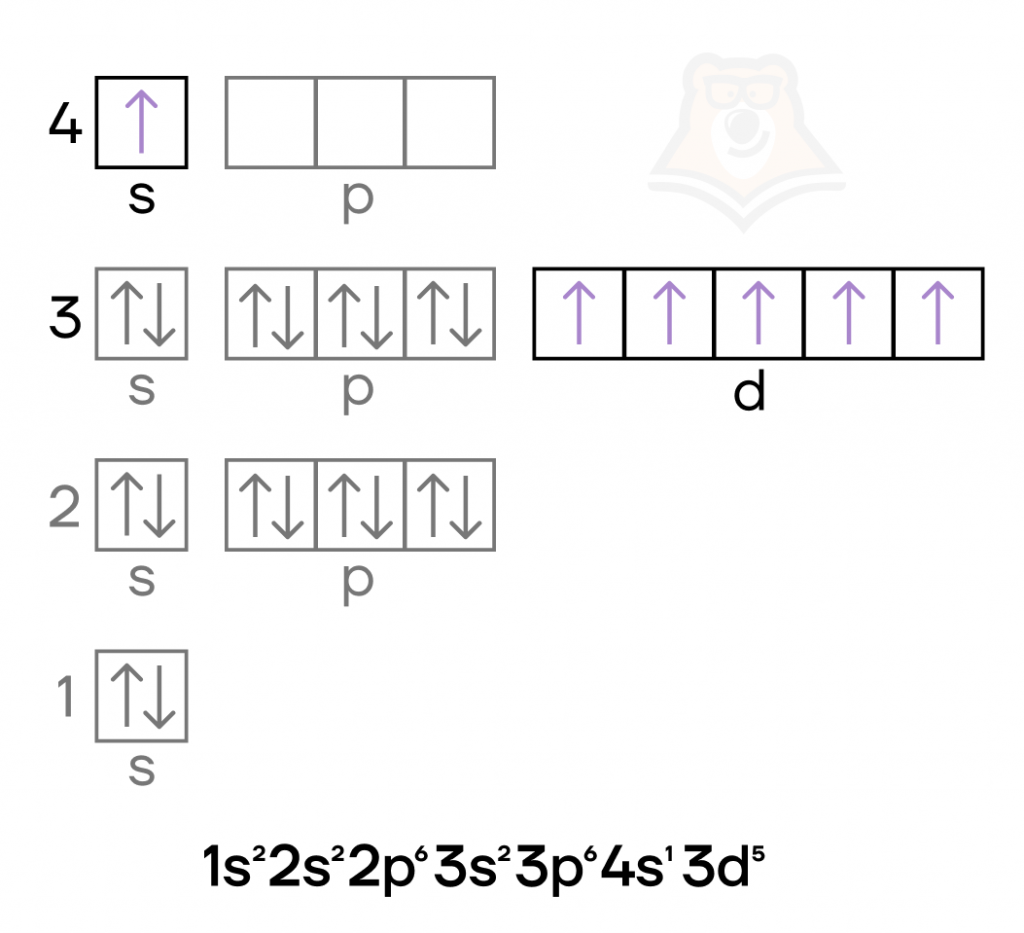
Хром — металл VIB группы четвертого периода. Как и железо, это d-элемент, у которого валентные электроны находятся и на внешнем, и на предвнешнем подуровне. Иметь конфигурацию 3d5 более энергетически выгодно, чем 3d4, поэтому у хрома происходит проскок (провал) электрона: электрон с верхнего «этажа» как будто проваливается на «этаж» ниже.
Провал (проскок) электрона — переход электрона с внешнего энергетического уровня на предвнешний (нижележащий).
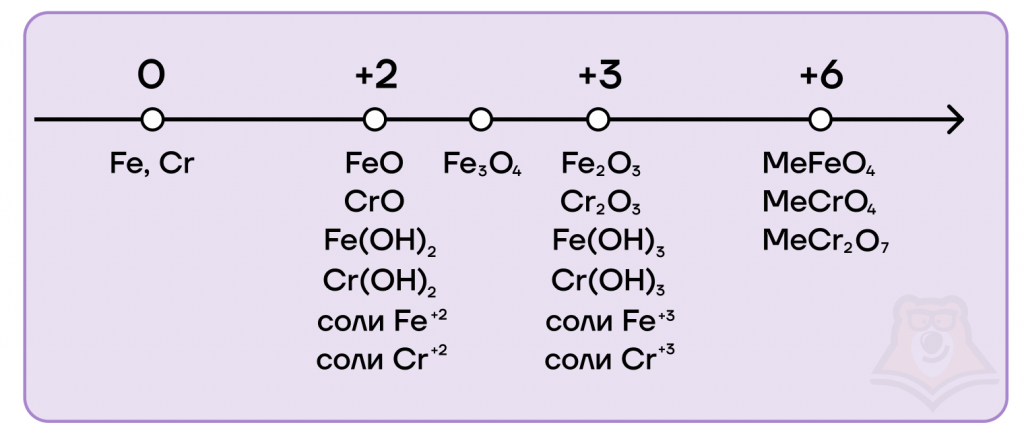
Железо и хром имеют идентичный набор степеней окисления (0, +2, +3, +6), а также возможных оксидов и гидроксидов.
Марганец — металл VIIB группы четвертого периода. Как и у других переходных металлов (d-элементов), валентные электроны располагаются на внешнем (4s) и на предвнешнем (3d) подуровнях.
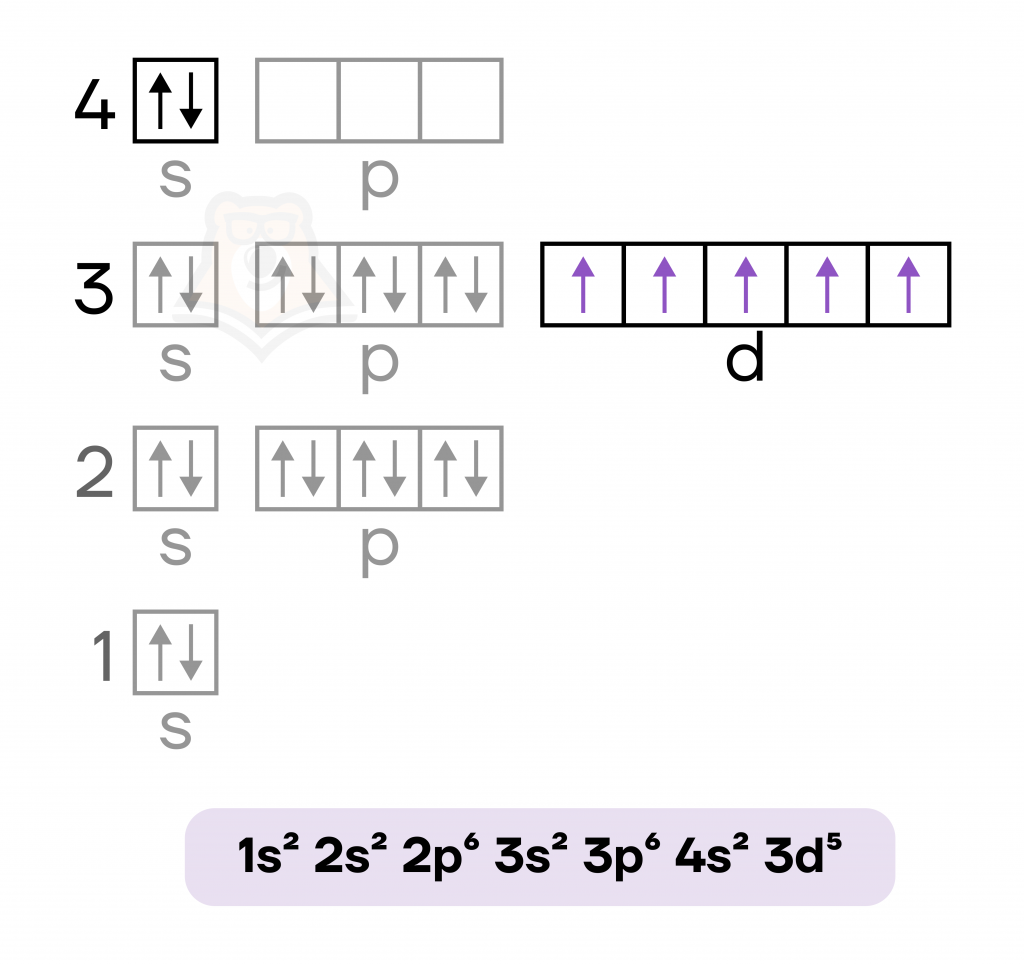
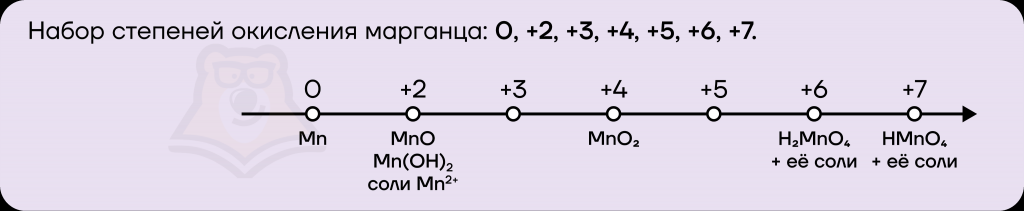
Марганец имеет довольно необычный набор степеней окисления:
- низшая степень окисления равна 0, как и у всех металлов;
- высшая степень окисления равна номеру группы: +7;
- промежуточные степени окисления — все значения от низшей до высшей (+2, +3, +4, +5, +6), за исключением +1.
Чаще всего рассматриваются степени окисления 0, +2, +4, +6 и +7. Степени окисления +3 и +5 на экзамене практически не встречаются.
После изучения основных характеристик разберемся, какими физическими свойствами обладают металлы и как мы можем их получить.
Физические свойства и способы получения металлов
По физическим свойствам железо, хром и марганец — совершенно типичные металлы серебристо-белого цвета (вы только посмотрите на красавца хрома!), которые не растворяются в воде, а на воздухе покрываются прочной оксидной пленкой.

Особенностью железа является его быстрая коррозия (то есть разрушение под действием окисления) кислородом во влажном воздухе. По статистике суммарный мировой ущерб от коррозии, которая приводит к разрушению трубопроводного транспорта, конструкций мостов, водопровода и т.д. — более 5 триллионов долларов ежегодно.
3Fe + 2O2 = Fe3O4
Особенность хрома — высокая твердость: он является одним из самых твердых металлов. Не зря же из него изготавливают комплектующие для мощнейших плазмотронов (генераторов плазмы) в космической промышленности!
| Как благодаря хрому наша жизнь становится ярче? Хром — элемент, необходимый для приготовления различных пигментов: красных, желтых и зеленых. Благодаря ему стекла окрашиваются в зеленый цвет, рубины — в красный и изумрудный цвета, а также этот металл находит применение в качестве декоративного и защитного покрытия. Многие видели на улицах красиво переливающиеся металлические покрытия машин, данный эффект называется хромированием. Краска содержит мельчайшие частички металла, которые и создают тот удивительный зеркальный блеск с переливами. |


Основным способом получения марганца, хрома и железа является пирометаллургия, то есть различные реакции, происходящие при высоких температурах.

Когда мы смогли изучить физические свойства и способы получения данных металлов, можем рассмотреть, как полученные чистые металлы реагируют с другими элементами и веществами.
Химические свойства металлов
Химические свойства марганца, хрома и железа являются довольно типичными для всех металлов средней активности (стоящих в промежутке от алюминия до водорода).
- Взаимодействие с простыми веществами
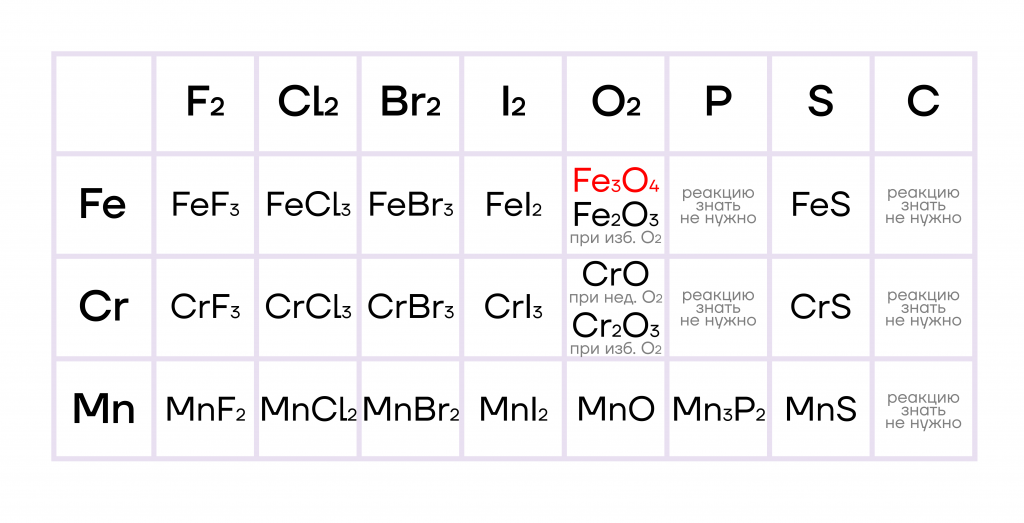
Как и другие металлы, железо, марганец и хром способны взаимодействовать со своими противоположностями, неметаллами, с образованием различных бинарных соединений.
При этом неметаллы, являющиеся сильными окислителями, окисляют железо и хром до +3, а неметаллы, являющиеся слабыми окислителями, — только до +2.
Железо, марганец и хром не реагируют с водородом и азотом ввиду неактивности последних. При взаимодействии с кислородом железо ржавеет: образуется смесь оксидов железа(II) и (III), то есть железная окалина Fe3O4.
- Реакция с водой
Железо и хром являются металлами, стоящими в ряду активности до водорода, поэтому они могут вытеснять его из воды с образованием оксидов (соединений кислорода в степени окисления -2 с другими элементами) и вытесненного водорода.

Так как это металлы средней активности, они реагируют с водой не при нормальных условиях, а при очень высокой температуре.
3Fe + 4H2O = Fe3O4 + 4H2
2Cr + 3H2O = Cr2O3 + 3H2
Марганец в ряду активности расположен до водорода, он может вступать в реакцию с водой, вытесняя из нее водород, но в отличие от хрома и железа образуется не оксид, а гидроксид.
Mn + 2H2O = Mn(OH)2 + H2
- Реакция с кислотами-неокислителями
Благодаря нахождению железа, марганца и хрома до водорода в ряду активности металлов, они также способны вытеснять водород из растворов кислот-неокислителей.
Fe + 2HCl = FeCl2 + H2
Cr + H2SO4 (разб.) = CrSO4 + H2
Mn + 2HBr = MnBr2 + H2
- Реакция с солями
Как и прочие металлы, железо, марганец и хром могут вытеснять менее активные металлы, стоящие правее в ряду активности, из растворов их солей.
Fe + CuSO4 = FeSO4 + Cu
Cr + ZnCl2 ≠
Mn + AlCl3 ≠
- Реакции с окислителями
Из-за низких значений электроотрицательности, железо, марганец и хром являются типичными восстановителями, а следовательно, способны реагировать с окислителями.
Mn + 3NaNO3 + 2NaOH = Na2MnO4 + 3NaNO2 + H2O
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + H2O
2Cr + KClO3 = Cr2O3 + KCl
После изучения свойств самих металлов, мы можем перейти к рассмотрению химических свойств соединений этих металлов.
Соединения железа и хрома
- Оксиды, гидроксиды и соли железа(II) и хрома(II)
По физическим свойствам оксиды железа(II) и хрома(II), как и гидроксиды железа(II) и хрома(II), представляют собой не растворимые в воде соединения.
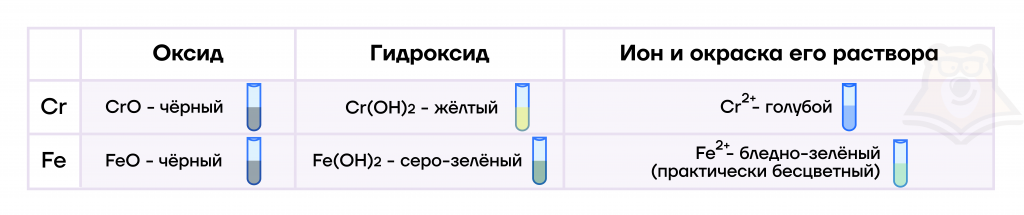
По химическим свойствам CrO и FeO — типичные основные оксиды, а Cr(OH)2 и Fe(OH)2 — типичные основания, что и объясняет их химические свойства.
- Реакция с водой
Оксидам железа(II) и хрома(II) соответствуют нерастворимые гидроксиды, поэтому и сами оксиды с водой не реагируют.
- Основно-кислотное взаимодействие
Оксиды и гидроксиды железа(II) и хрома(II) обладают основными свойствами. Это значит, что для них характерно взаимодействие с кислотами и кислотными оксидами.
FeO + 2HCl = FeCl2 + H2O
Cr(OH)2 + H2SO4 = CrSO4 + 2H2O
- Термическое разложение
Как и другие нерастворимые гидроксиды, Fe(OH)2 и Cr(OH)2 способны разлагаться при нагревании на соответствующий оксид и воду.
Fe(OH)2 = FeO + H2O
Cr(OH)2 = CrO + H2O
- Реакции с типичными окислителями
При реакции с типичными окислителями соединения железа(II) и хрома(II) будут повышать свою степень окисления до +3, в редких ситуациях до +6.
4CrO + O2 = 2Cr2O3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
2CrCl2 + Cl2 = 2CrCl3
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
3CrSO4 + 2KBrO3 + 12KOH = 3K2CrO4 + 2KBr + 3K2SO4 + 6H2O
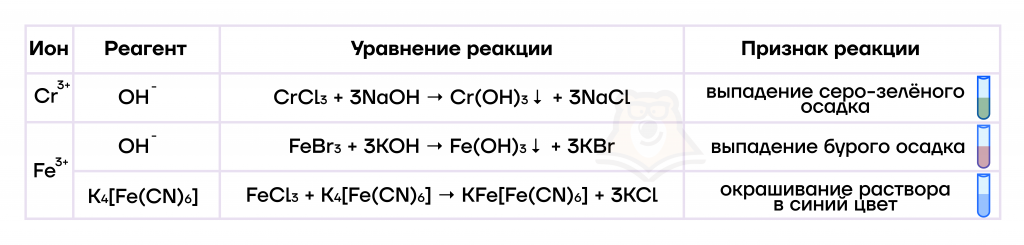
Чтобы уметь в лабораторных условиях определять наличие в растворе тех или иных ионов, в данном случае железа(II) и хрома(II), необходимо знать качественные реакции.

Гексацианоферрат(III) калия K3[Fe(CN)6] называют «красной кровяной солью» из-за цвета порошка этой соли. Тривиальные (использующиеся в быту) названия KFe[Fe(CN)6]: «берлинская лазурь», «турнбулева синь».
- Оксиды, гидроксиды и соли железа(III) и хрома(III)
По физическим свойствам оксиды железа(III) и хрома(III) представляют порошкообразные вещества, не растворимые в воде. При этом Fe2O3 — оксид красновато-бурого цвета, а Cr2O3 — зеленого цвета.
| Откуда берутся кровавые реки? Кровавые реки встречаются во всех частях света: в Европе, Азии, в Северной Америке и даже в Антарктиде. А названы они так за свою схожесть с человеческой кровью: вместо обычного сине-голубого цвета вода в них окрашена в красный. Но сходства между кровью и водой в реках на этом не заканчиваются. Человеческая кровь окрашена в красный цвет за счет железа, который содержится в гемоглобине, — кровавые реки имеют свой цвет также за счет соединений железа. Зачастую на месте протекания подобных рек в древние времена находились залежи железной руды или оксида железа, постепенное размывание пород водой привело к окрашиванию воды в кроваво-красный цвет. Звучит жутко, но выглядит завораживающе. |
Гидроксиды железа(III) и хрома(III) также являются твердыми нерастворимыми веществами, при этом они имеют цвета, аналогичные их оксидам.
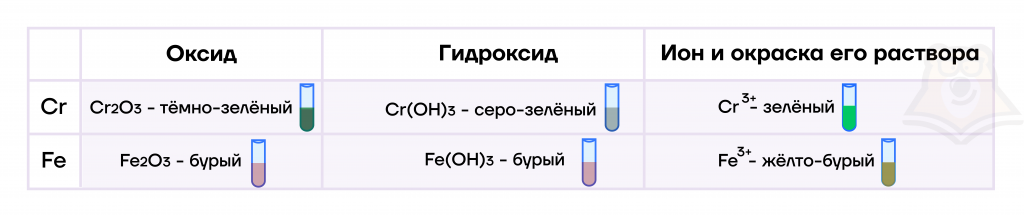
По химическим свойствам они представляют собой типичные амфотерные оксиды и гидроксиды: вступают в реакции как с веществами, проявляющими основные свойства, так и с веществами, проявляющими кислотные свойства.
- Реакция с водой
Оксидам железа(III) и хрома(III) соответствуют нерастворимые гидроксиды, поэтому и сами оксиды с водой не взаимодействуют.
- Основно-кислотное взаимодействие
Оксиды и гидроксиды железа(III) и хрома(III) вступают во взаимодействие с кислотами с образованием солей и воды.
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
С растворами щелочей оксиды железа(III) и хрома(III) не взаимодействуют: они не способны проявлять настолько выраженные кислотные свойства, как оксиды алюминия и цинка. С очень концентрированными растворами способны реагировать только гидроксиды железа(III) и хрома(III):
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Cr2O3 + Na2CO3 = 2NaCrO2 + CO2
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Fe(OH)3 + 3NaOH (оч. конц.) = Na3[Fe(OH)6]
- Реакции вытеснения
Амфотерные оксиды, в том числе Fe2O3 и Cr2O3, способны вытеснять летучие CO2 и SO2 из их солей — карбонатов и сульфитов.
Fe2O3 + K2CO3 (t) = 2KFeO2 + CO2
Cr2O3 + CaSO3 (t) = Ca(CrO2)2 + SO2
- Термическое разложение гидроксидов
Нерастворимые гидроксиды разлагаются на соответствующие оксиды и воду.
2Fe(OH)3 (t) = Fe2O3 + 3H2O
2Cr(OH)3 (t) = Cr2O3 + 3H2O
- Реакции с восстановителями
За счет высокой степени окисления металла +3 оксиды и гидроксиды хрома(III) и железа(III) являются типичными окислителями, а значит, реагируют с восстановителями, понижая степень окисления чаще всего до соседней +2. В отличие от реакций с другими кислотами, при взаимодействии с HBr и HI будут протекать ОВР, так как эти кислоты — типичные восстановители, а Fe+3 и Cr+3 — типичные окислители.
2CrCl3 + Cr = 3CrCl2
2FeCl3 + Na2SO3 + H2O = Na2SO4 + 2FeCl2 + 2HCl
2FeCl3 + H2S = 2FeCl2 + S + 2HCl
2FeCl3 + 3К2S = 2FeS + S + 6КCl
За счет промежуточной степени окисления металла +3 существует возможность как понизить степень окисления до 0 или +2, так и повысить до +6. Поэтому, помимо окислительных свойств, соединения железа(III) и хромa(III) способны проявлять также слабые восстановительные свойства, повышая при этом степень окисления до +6, в основном только в реакции с сильными окислителями в щелочной среде.
Cr2O3 + KClO3 + 4KOH = 2K2CrO4 + KCl + 2H2O
Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O
Cr2O3 + KClO3 + 2K2CO3 = 2K2CrO4 + KCl + 2CO2
2NaFeO2 + 3Na2O2 = 2Na2FeO4 + 2Na2O
Гексацианоферрат(II) калия K4[Fe(CN)6] называют «желтой кровяной солью» из-за цвета порошка этой соли.
- Соединения хрома(VI)
Хром имеет две кислоты: хромовую H2CrO4 и дихромовую H2Cr2O7, — соли которых называются соответственно хромат и дихромат.
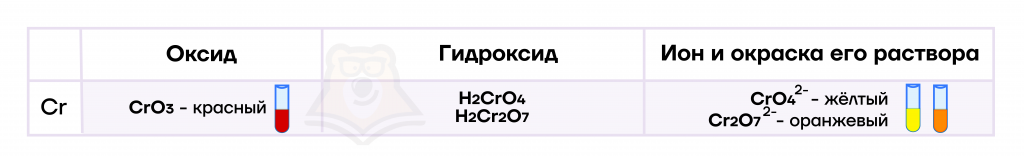
Хромат-ион устойчив в щелочной среде, а дихромат — в кислой. При изменении среды изменяется и соль.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2О
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2О
Мы можем закрепить полученные знания, решив задание №6 ЕГЭ. Именно в нем встречаются вопросы на понимание химических свойств веществ.
Задание. В пробирку с солью Х добавили раствор Y. В результате реакции наблюдали изменение цвета раствора с желтого на оранжевый.Из предложенного перечня выберите вещества X и Y, которые могут вступать в указанную реакцию.
1) K2Cr2O7;
2) KOH;
3) K2CrO4;
4) Cr2O3;
5) HNO3.
Решение. В задании сказано, что вещество Х — соль, значит это может быть либо дихромат калия K2Cr2O7, либо хромат калия KCrO4. Вспомним цвета этих солей: дихромат оранжевый, а хромат — желтый. Так как в задании наблюдалось изменение цвета с желтого на оранжевый, то исходная соль и вещество Х — хромат, берем вариант ответа 3.
Хромат-ион устойчив в щелочной среде, дихромат-ион — в кислой, поэтому переход из соли желтого цвета в соль оранжевого цвета будет происходить вместе со сменой среды с щелочной на кислую, добавим азотную кислоту HNO3 (вариант ответа номер 5).
2K2CrO4 + 2HNO3 = K2Cr2O7 + 2KNO3 + H2О
Ответ: 35
Дихроматы термически разлагаются:
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 + 3O2
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
За счет хрома в высшей степени окисления +6 хроматы и дихроматы являются сильными окислителями и реагируют со многими восстановителями, при этом хром понижает степень окисления в ОВР до +3. Продукты зависят от среды, в которой протекает реакция.
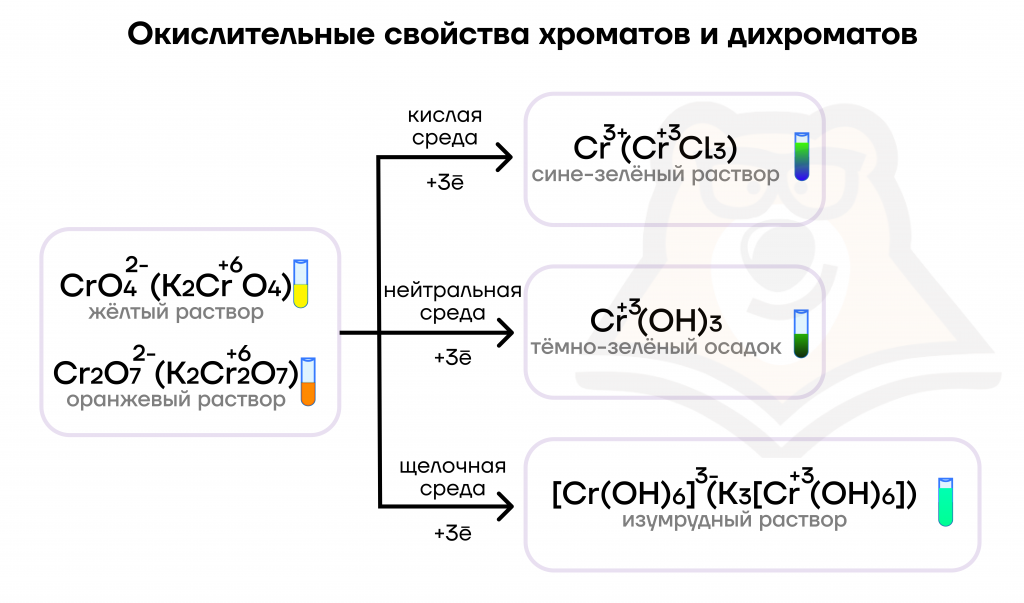
K2Cr2O7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2 + 7H2O
3K2SO3 + 2K2CrO4 + 5H2O = 2Cr(OH)3 + 3K2SO4 + 4KOH
3Na2SO3 + K2Cr2O7 + 4KOH + 4H2O = 3Na2SO4 + 2K3[Cr(OH)6]
- Оксид железа(II, III) — железная окалина Fe3O4
Железная окалина представляет собой двойной оксид черного цвета, образующийся при окислении железа водой или кислородом и содержащий в себе как FeO, так и Fe2O3.
Поэтому окалина обладает двойственностью:
- за счет железа в степени окисления +2 проявляет свойства восстановителя, а соответственно, реагирует с окислителями;
- за счет железа в степени окисления +3 — свойства окислителя, в виду чего это соединение реагирует с восстановителями.
Разберем подробнее ее химические свойства.
- Реакция с водой
Так как ни FeO, ни Fe2O3 не реагируют с водой, железная окалина тоже с ней не взаимодействует.
- Реакция с кислотой-неокислителем
В реакции с кислотами-неокислителями степени окисления железа в смешанном оксиде сохраняются, то есть образуются соли железа(II) и железа(III):
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
- Реакции с окислителями
В составе железной окалины есть FeO, являющийся за счет степени окисления железа +2 типичным восстановителем, поэтому железная окалина способна реагировать с различными окислителями, повышая степень окисления железа до +3.
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
2Fe3O4 + 10H2SO4 (конц.) = 3Fe2(SO4)3 + SO2 + 10H2O
Fe3O4 + 10HNO3 (конц.) = 3Fe(NO3)3 + 5H2O + NO2
- Реакции с восстановителями
Помимо FeO, в составе железной окалины также есть Fe2O3, являющийся за счет железа в степени окисления +3 типичным окислителем. Следовательно, железная окалина способна реагировать с восстановителями, понижая степень окисления железа до +2.
Fe3O4 + 8HI = 3FeI2 + I2 + 4H2O
Fe3O4 + 4H2 (изб.) = 3Fe + 4H2O
Fe3O4 + H2 (нед.) = 3FeO + H2O
После изучения свойств соединений железа и хрома, можем закрепить полученные знания, решив задание №8 ЕГЭ.
Задание. Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

Решение:
А) Предположим, что протекает реакция ионного обмена, в таком случае образуется сульфид железа(III) и соляная кислота (Fe2S3 + HCl). Однако сульфид железа(III) неустойчив в водной среде и мгновенно распадается на сульфид железа(II) и серу.
Сульфид железа(II) растворим в кислотах, поэтому он прореагирует с образовавшейся кислотой. Запишем всю цепочку превращений:
2FeCl3 + 3H2S = Fe2S3 + 6HCl
Fe2S3 = 2FeS + S
FeS + 2HCl = FeCl2 + H2S
Объединим все вышеописанные реакции в одну поэтапно.
2FeCl3 + 3H2S = 2FeS + S + 6HCl
Так как 2FeS + 4HCl = 2FeCl2 + 2H2S, заменим сульфид железа(II) и соляную кислоту на продукты реакции, останется 2 молекулы HCl.
2FeCl3 + 3H2S = 2FeCl2 + 2H2S + S + 2HCl
Сократим H2S и получим:
2FeCl3 + H2S = 2FeCl2 + S + 2HCl
Таким образом, правильный ответ под цифрой 2.
Б) Логика взаимодействия между хлоридом железа(III) и сульфидом калия аналогичная, однако здесь нет кислоты, в которой образующийся сульфид растворился бы, поэтому данный этап пропускаем.
2FeCl3 + 3K2S = Fe2S3 + 6KCl
Fe2S3 = 2FeS + S
Объединим реакции и получим:
2FeCl3 + 3К2S = 2FeS + S + 6КCl
Правильный ответ под цифрой 4.
В) Взаимодействие между хлоридом железа(III) и иодоводородом аналогично реакции под А: иодид железа(III) неустойчив и распадается на иодид железа(II) и иод, образовавшаяся соль реагирует с соляной кислотой из продуктов (сильная кислота выталкивает слабую). Распишем все уравнения реакций
FeCl3 + 3HI = FeI3 + 3HCl
2FeI3 = 2FeI2 + I2
FeI2 + 2HCl = FeI2 + 2HI
Объединим реакции в одну поэтапно.
2FeCl3 + 6HI = 2FeI3 = 2FeI2 + I2 + 6HCl
Так как 2FeI2 + 4HCl = 2FeI2 + 4HI, заменим иодид железа(II) и соляную кислоту на продукты реакции, останется 2 молекулы HCl.
2FeCl3 + 6HI = 2FeI3 = 2FeI2 + 4HI + I2+ 2HCl
Сократим HI и коэффициенты:
2FeCl3 + 2HI = I2 + 2FeCl2 + 2HCl
В ответ берем цифру 6.
Г) Реакция между железной окалиной и иодоводородом также протекает ступенчато.
Fe2О3 + 8HI = 2FeI3 + FeI2 + 4Н2О
2FeI3 = 2FeI2 + I2
Объединим реакции:
Fe3O4 + 8HI = 3FeI2 + I2 + 4H2O
Правильный ответ под цифрой 5.
Ответ: 2465
Знакомство с соединениями железа и хрома закончено, теперь перейдем к самому интересному — соединениям марганца.
Соединения марганца
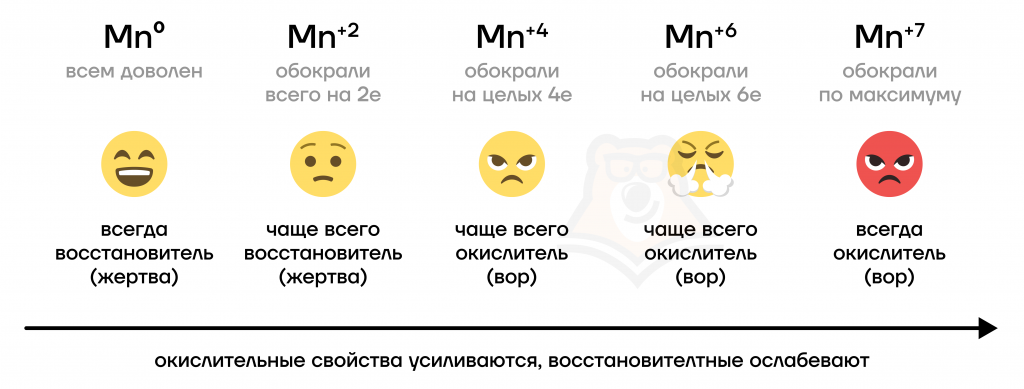
Марганец — удивительный элемент, чтобы это понять, достаточно взглянуть на возможные для него степени окисления (СО). Этот металл способен принимать СО, равные 0, +2, +3, +4, +5, +6 и +7, теперь было бы интересно проследить, как меняются свойства элемента в соединениях в зависимости от степени окисления.
Соединения марганца встречаются не только в химии, они присутствуют и внутри нас.
| От любви до ненависти один шаг: как марганец из жизненно необходимого элемента может стать причиной безумия? Марганец является одним из самых жизненно важных микроэлементов, он принимает участие в биохимическом функционировании нервной системы, нормализует ее работу, способствует образованию костной, мышечной и соединительной ткани, регулирует углеводный и жировой обмен. Этот металл влияет на гормональный фон, уровень сахара в крови, а также участвует в процессе образования крови. Но в высоких дозах и этот необходимый микроэлемент может стать опасным для здоровья. Избыток марганца приводит к нарушению работы нервной системы, возникают утомляемость, слабость, сонливость. При дальнейшем ухудшении состояния возникает мнительность, а в худших ситуациях могут начаться галлюцинации. Именно это состояние и называется «марганцевым безумием». |

Перейдем к непосредственному изучению различных соединений марганца, начнем со степени окисления +2.
- Оксид, гидроксид и соли марганца(II)

Химические свойства оксида и гидроксида определяются основным характером веществ и восстановительными свойствами.
- Основно-кислотные взаимодействия:
Mn(OH)2 + 2HCl = MnCl2 + 2H2O
MnO + 2HNO3 (конц.) = Mn(NO3)2 + H2O, не ОВР, так как Mn2+ устойчив в кислой среде!
- Окислительно-восстановительные реакции:
2Mn(OH)2 + О2 = 2MnO2 + 2H2O
MnO + 2KNO3 + 2KOH = K2MnO4 + 2KNO2 + H2O
Есть и особые свойства для каждого вещества:
- Оксид не реагирует с водой, так как гидроксид марганца(II) нерастворим.
MnO + H2O ≠
- А вот гидроксид подвергается термическому разложению.
Mn(OH)2 (t) = MnO + H2O
- Оксид марганца(IV)
Марганец способен также проявлять степень окисления +4, наиболее устойчивым соединением с такой степенью окисления является оксид марганца(IV) — бурый осадок.
За счет высокой степени окисления диоксид марганца MnO2 проявляет сильные окислительные свойства, а следовательно, вступает в ОВР с разнообразными восстановителями, понижая в этих реакциях свою степень окисления до более устойчивой в данной среде.
MnO2 + 4HCl (конц.) = MnCl2 + Cl2 + 2H2O
2MnO2 + 2H2SO4 (конц.) = 2MnSO4 + O2 + 2H2O
MnO2 + 2FeSO4 + 2H2SO4 = MnSO4 + Fe2(SO4)3 + 2H2O
Возможны также и реакции, в которых оксид проявляет восстановительные свойства.
3MnO2 + KBrO3 + 6KOH = 3K2MnO4 + KBr + 3H2O (в щелочной среде марганец повышает СО до +6)
2MnO2 + 3PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2H2O (в кислой среде марганец повышает СО до +7)
Оксид марганца(IV) проявляет амфотерные свойства и реагирует со щелочами при сплавлении, в растворе реакция не идет.
MnO2 + 2KOH (t) = K2MnO3 + H2O, образуется манганит
MnO2 + 2KOH + H2O ≠
- Оксиды, гидроксиды и соли марганца(VI) и (VII)
Оксиды марганца(VI) и (VII) не встречаются в рамках школьной программы, достаточно знать их цвета и помнить, что они, в принципе, существуют.

Гидроксид марганца(VI) неустойчив, а вот гидроксид(VII), марганцевая кислота, при обычных условиях стабилен, зато при нагревании разлагается.
4HMnO4 = 4MnO2 + 2H2O + 3O2
Также гидроксид марганца(VII) может вступать в ОВР с понижением степени окисления марганца.
2HMnO4 + 3H2S = 3S + 2MnO2 + 4H2O
2HMnO4 + 5SO2 + 2H2O = 3H2SO4 + 2MnSO4
Гидроксиду марганца(VI) соответствует такая соль, как манганат, а вот гидроксиду(VII) — перманганат.
Манганаты проявляют восстановительные свойства.
K2MnO4 + 2HNO3 = KMnO4 + KNO3 + NO2 + H2O
Перманганаты способны термически разлагаться аналогично дихроматам.
2KMnO4 = K2MnO4 + MnO2 + O2
2NH4MnO4 = 2MnO2 + N2 + 4H2О
В реакциях за счет максимальной степени окисления +7 перманганаты выступают сильными окислителями, продукты реакции зависят от среды раствора.
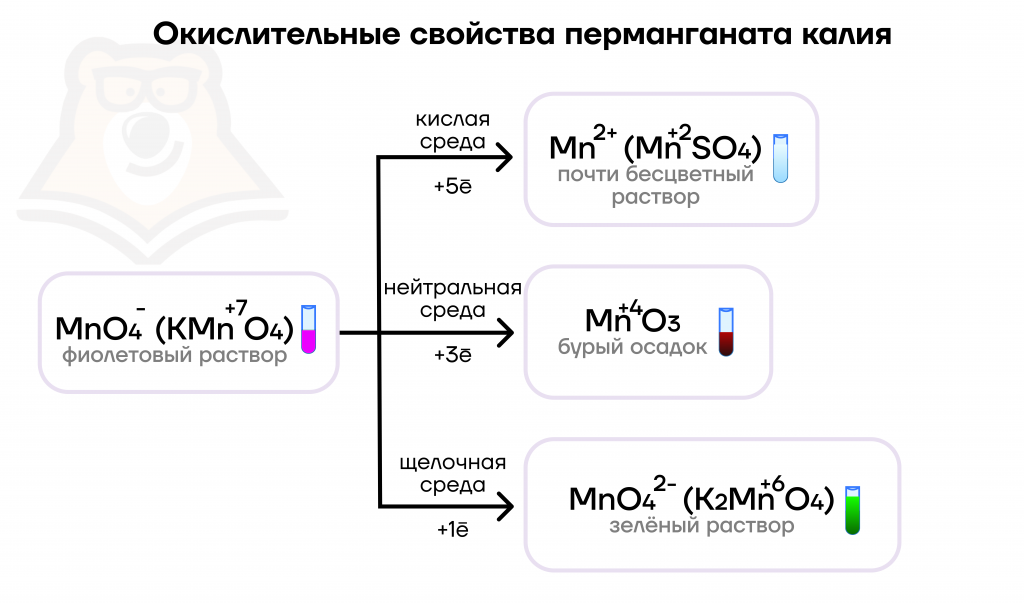
8KMnO4 + 5PH3 + 12H2SO4 = 5H3PO4 + 8MnSO4 + 4K2SO4 + 12H2O
2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
NaNO2 + 2KMnO4 + 2KOH = NaNO3 + 2K2MnO4 + H2O
Наше знакомство со свойствами марганца, хрома и железа подходит к концу, но знакомство с переходными металлами не заканчивается. Для полноценного понимания данной темы рекомендуем ознакомиться со статьей «Переходные металлы: медь, серебро, ртуть».
Термины
Бинарные соединения — соединения, которые состоят из двух элементов: металла и неметалла или двух неметаллов.
Восстановители — это соединения, отдающие электроны в окислительно-восстановительных реакциях, при этом сами они повышают свою степень окисления.
Неметаллы — вещества, не обладающие металлическими свойствами. Они способны взаимодействовать с металлами и некоторыми неметаллами, водой, щелочами и некоторыми кислотами, а также могут вступать в окислительно-восстановительные реакции.
Окислители — это соединения, охотно принимающие электроны в окислительно-восстановительных реакциях, при этом сами они понижают свою степень окисления.
Степень окисления (СО) — это условный заряд атома элемента, вычисленный на основе предположения, что все связи в данном соединении являются ионными (показывает, сколько электронов атом «притянул» или, наоборот, «отдал» при образовании химической связи).
Фактчек
- Марганец, хром и железо относятся к переходным металлам, то есть таким, которые расположены в побочных подгруппах больших периодов. Возможные степени окисления железа и хрома совпадают и равны 0, +2, +3 и +6; марганец чаще всего проявляет степени окисления 0, +2, +4, +6 и +7.
- Основным способом получения металлов является пирометаллургия.
- Марганец, хром и железо способны реагировать с простыми веществами, с водой и кислотами-неокислителями, солями и вступать в ОВР.
- Оксиды и гидроксиды данных металлов способны вступать в основно-кислотные взаимодействия, ОВР, а также термически разлагаться.
- Продукты реакций с хроматом, дихроматом и перманганатом зависят от среды протекания реакции.
Проверь себя
Задание 1.
У атома какого химического элемента наблюдается «проскок» электрона?
- Хром
- Марганец
- Железо
- Наблюдается у всех
Задание 2.
Какое вещество образуется при реакции между марганцем и водой?
- MnO
- MnO2
- Mn(OH)2
- HMnO4
Задание 3.
Что образуется при взаимодействии хлорида железа(III) с сероводородом?
- Сульфид железа(III) и хлороводород
- Сульфид железа (II), хлор и хлороводород
- Сульфид железа (II), сера и хлороводород
- Хлорид железа (II), сера и хлороводород
Задание 4.
В какой реакции наблюдается только обесцвечивание раствора?
- Взаимодействие дихромата калия с соляной кислотой
- Взаимодействие перманганата калия с фосфином в кислой среде
- Взаимодействие перманганата натрия с нитритом натрия в нейтральной среде
- Взаимодействие гидроксида марганца(VII) с сероводородом
Ответы: 1. – 1; 2. – 3; 3. – 4; 4. – 2.м


 к списку статей
к списку статей





