Алканы
На этой странице вы узнаете
- Бесконечность не предел — сколько атомов углерода в самом длинном алкане?
- Жевательная резинка из алканов?
- Как связаны нефть и алканы?
Если вдруг вы едете на автомобиле с пропановым двигателем, имеющем резиновые колеса, а ваш пассажир читает газету, то вас окружают алканы.
Алканы — это первые представили углеводородов, которые изучаются в органической химии. Они являются самыми простыми по своему строению, ведь содержат только атомы углерода и водорода, никаких кратных связей и функциональных групп, но именно с них начинается наше путешествие в удивительный мир органической химии.
Строение самой простой молекулы в органике — метана
Первым в ряду алканов веществом является метан СН₄. Рассмотрим его характеристики:
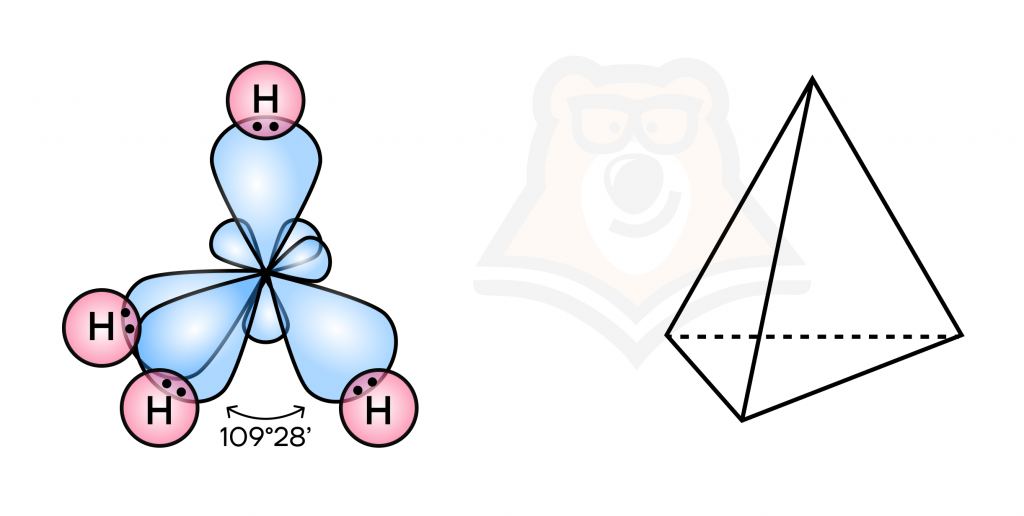
- гибридизация атомов углерода: sp3-гибридизация;
- связи: только одинарные (сигма-), поэтому они крайне малоактивные;
- форма молекул: тетраэдрическая (пирамида с треугольным основанием), то есть объемная;
- валентный угол: 109°28′;
- длина связи: 0,154 нм;
- бесцветный газ без вкуса и запаха.
Строение молекулы метана имеет очень важное значение для всей органической химии, так как дает нам представления относительно атома углерода (гибридизация, связи между атомами).
Интересно, что вода может замерзнуть в трубопроводе при температуре +20 °C, если в этой воде присутствует метан — точнее, из воды и метана образуется газовый гидрат. Молекулы метана «расталкивают» молекулы воды, так как занимают больший объем. Это приводит к понижению внутреннего давления воды и повышению температуры замерзания.
Гомологический ряд алканов
Конечно, метан является не единственным в своем роде, у него есть куча «родственников». Гомологический ряд алканов (их «родословная») имеет общую формулу CnH2n+2 и представлен следующими веществами, название которых зависит от количества атомов C в главной цепи молекулы:

Напомним, что называть вещества мы учились в статье «Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)». В ней же говорили о родственных связях химических соединений.
| Бесконечность не предел — сколько атомов углерода в самом длинном алкане? В 1985 году английскими химиками был синтезирован самый длинный на данный момент алкан — нонаконтатриктан, содержащий 390 атомов C в своей углеродной цепи. |
Итак, алканы — предельные (насыщенные) нециклические углеводороды. Насыщенные — так как все 4 валентности углерода полностью заполнены, имеются только одинарные связи. Физические свойства алканов зависят от количества атомов C. «Легкие» вещества с малым количеством углеродных атомов — газы, а «тяжелые» — твердые вещества.

| Жевательная резинка из алканов? На самом деле, да. Смесь высших алканов называют парафином, именно он является жевательной основой для всеми любимых жвачек. Также туда добавляют латекс, смолу, ароматизаторы и подсластители. Так что, зная состав, жевательную резинку лучше все-таки не проглатывать. |
Химические свойства алканов
Мы уже выяснили, что алканы — предельные углеводороды, поэтому реакции присоединения для них не характерны. Они вступают в реакции замещения, разложения и окисления, при этом только по радикальному механизму. Также важно помнить, что в реакциях замещения с алканами, имеющих три и более атома C, мы получим смесь изомерных продуктов. Но преимущественно будет образовываться результат замещения третичного, затем вторичного и только потом первичного атома C. Проще говоря, замещение проводится по наименее гидрогенизированному атому углерода.
- Реакции замещения:
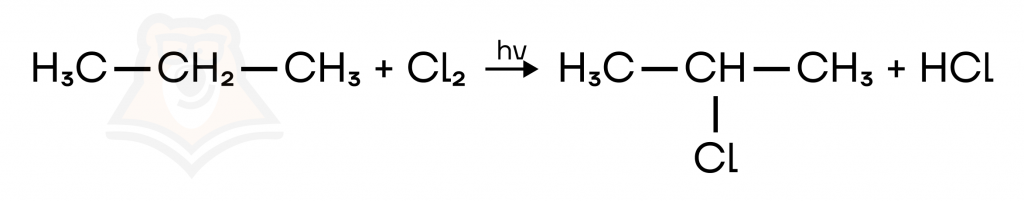
- Галогенирование. Алканы реагируют с хлором Cl и бромом Br (именно чистым, с бромной водой реакция не идет) на свету.
CH4 + Cl2 = (hv) CH3-Cl + HCl
Галогенирование можно продолжать и дальше, при этом образуются дихлорметан, трихлорметан, тетрахлорметан.
CH3-Cl + Cl2 = Cl-CH2-Cl +HCl
В реакциях с алканами, имеющими 3 и более атома C, галоген замещает водород у наименее гидрогенизированного атома углерода.
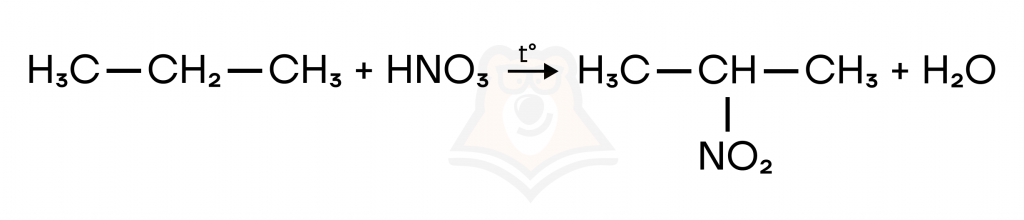
- Нитрование. Алканы реагируют с разбавленной азотной кислотой HNO₃ при нагревании до 140оС.
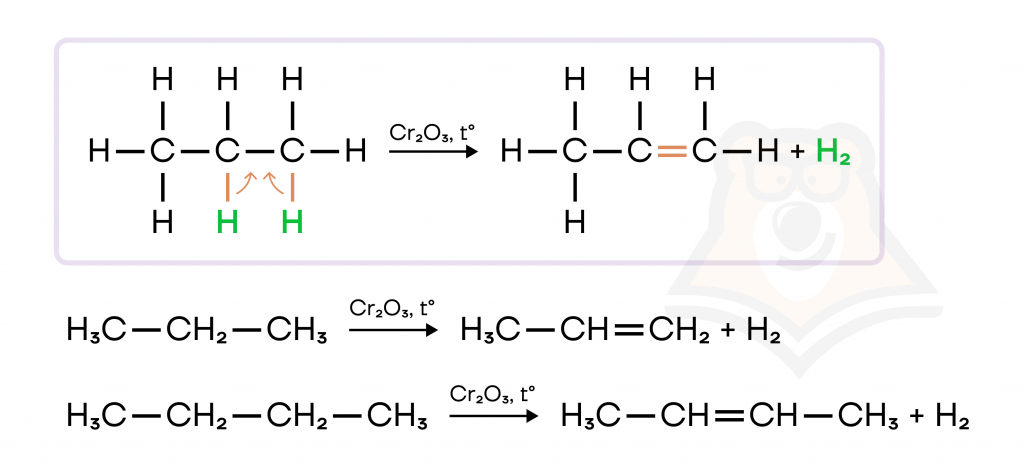
2. Реакции разложения:
- Дегидрирование. При нагревании и под действием таких катализаторов, как никель Ni, платина Pt, палладий Pd, оксиды хрома (III), железа (III), цинка, C-H связи способны разрываться, водород «убегает» и образуются двойные связи.
- Дегидроциклизация. Алканы, содержащие 5 и более атомов углерода «зацикливаются» при дегидрировании. Например, пентан образует циклопентан.
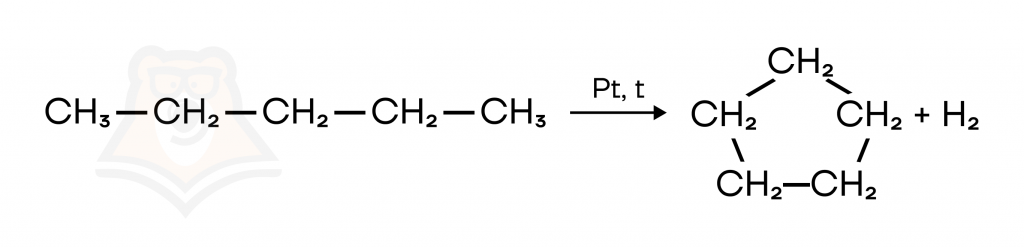
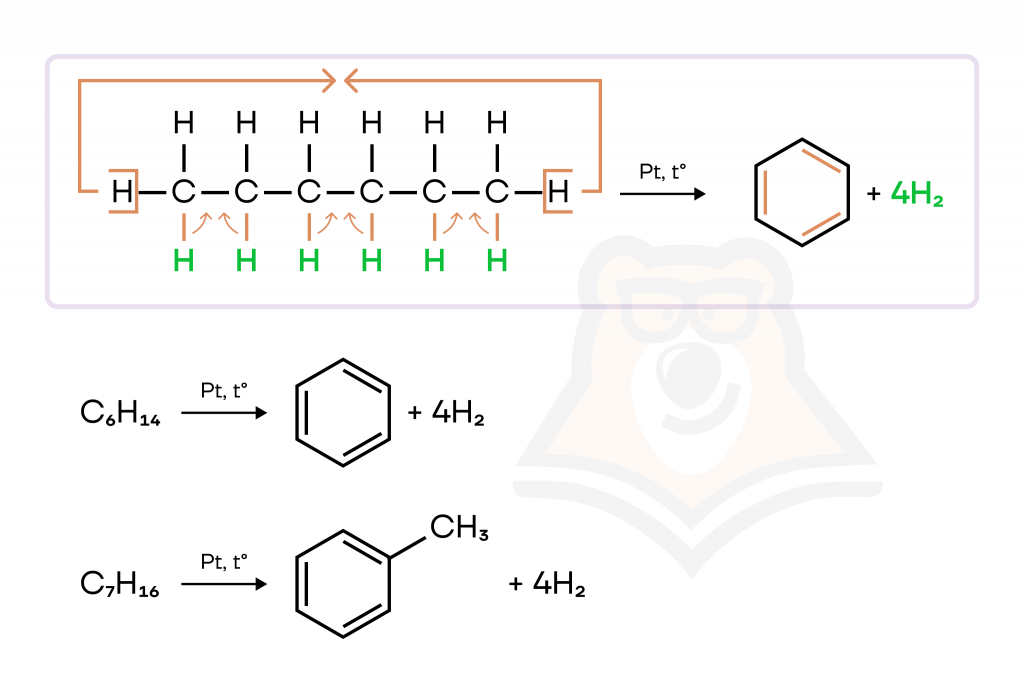
Гексан C6H14 способен образовать бензол, а гептан C7H16 — толуол.
- Пиролиз метана. Реакция характерна только для метана СН₄, при нагревании он разлагается до простых веществ, либо же до ацетилена C₂H₂. Пиролиз метана — промышленный способ получения ацетилена.
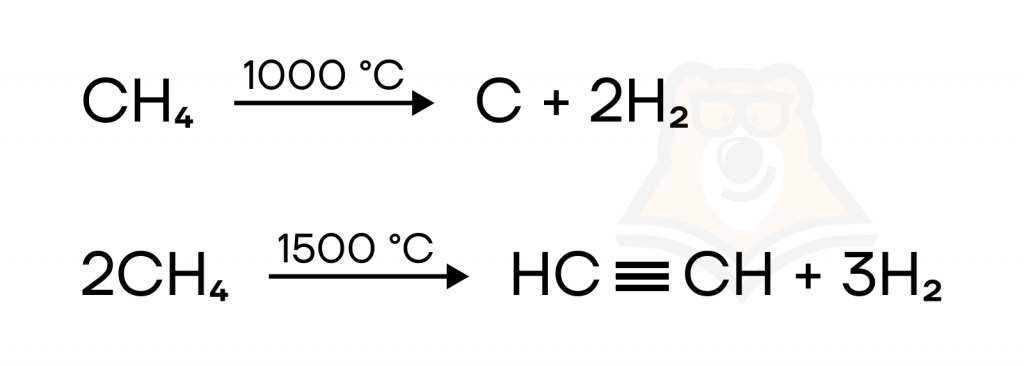
- Крекинг (не путать с крекерами). Длинные молекулы алканов «разламываются» на другой алкан и алкен. Как, например, на изображении.
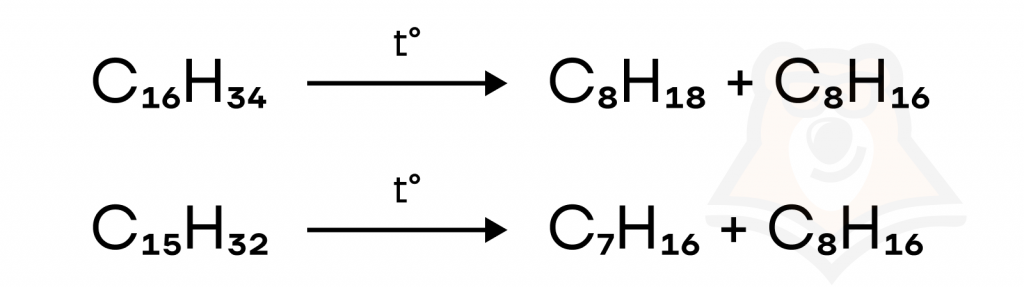
| Как связаны нефть и алканы? Крекинг алканов — основа нефтепереработки. Благодаря распаду алканов, получают ценное сырье: смазочные масла, моторное топливо. Чем разветвлённее алкан, тем выше качество топлива, в состав которого он входит. |
- Изомеризация алканов. Изменяется каркас молекулы. Например, из бутана получаем изобутан.
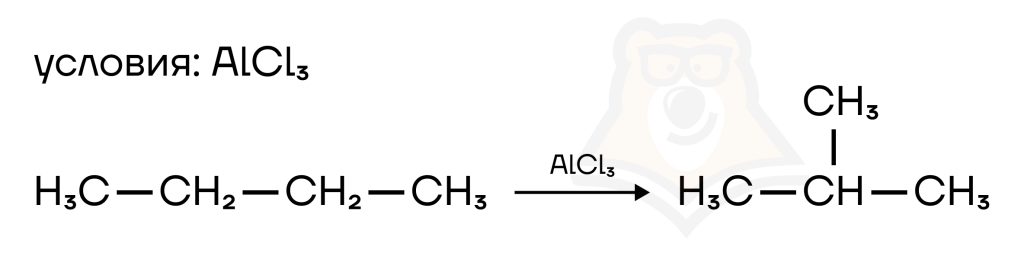
3. Реакции окисления:
- Горение. Как и вся органика, алканы горят с образованием углекислого газа и воды.
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При недостатке кислорода возможно образование угарного газа или сажи. Сажа — аморфный углерод (С), продукт неполного сгорания или термического разложения углеводородов в неконтролируемых условиях.
2C3H8 + 7O2 → 6CO + 8H2O
CH4 + O2 → C + 2H2O
- Каталитическое окисление. При каталитическом окислении метана возможно образование метанола CH3-OH, муравьиного альдегида CH2O или муравьиной кислоты HCOOH.
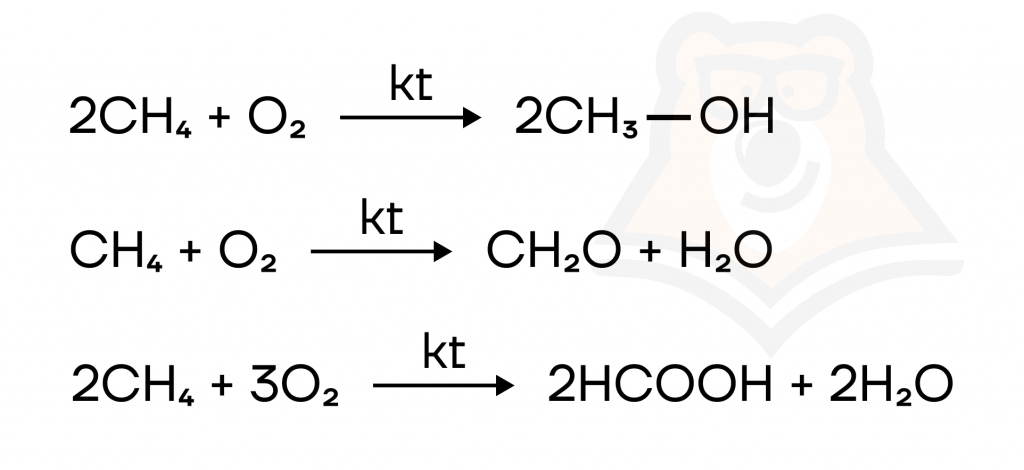
Каталитическое окисление бутана — способ получения уксусной кислоты CH₃COOH в промышленности.
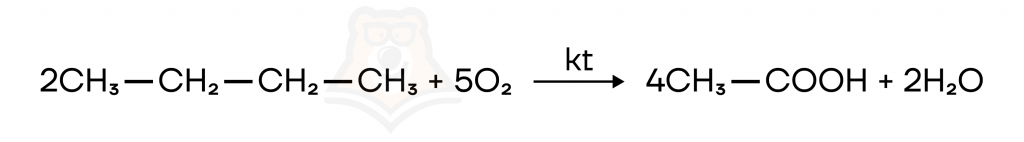
Важными в промышленности являются реакции конверсии метана с водяным паром и с углекислым газом, так как такой способ получения водорода является самым дешевым.
CH4 + H2O = CO + 3H2
CH4 + CO2 = 2CO + 2H2
Получение алканов
Главными источниками алканов являются нефть и природный газ, но их также получают и химическим синтезом.
В промышленности основными способами получения алканов являются:
- Синтез Кольбе.
Синтез Кольбе — электролиз солей карбоновых кислот.
На аноде выделяется алкан с удвоенным количеством атомов углерода по сравнению с углеводородным радикалом соли кислоты.
2RCOONa + 2H2O = 2NaOH + H2 + R-R + 2CO2
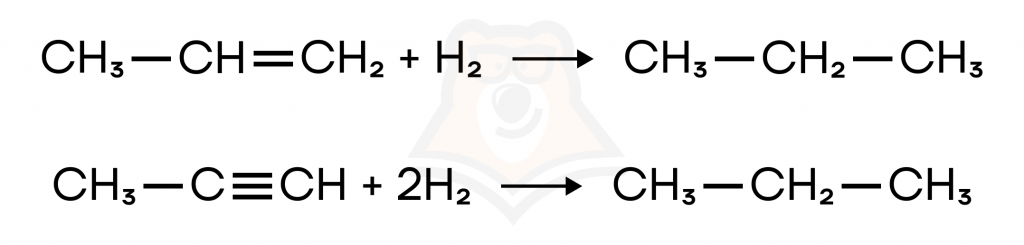
- Гидрирование непредельных углеводородов. Например, пропен и пропин превращаются в пропан.
- Реакция Дюма.
Реакция Дюма — сплавление солей карбоновых кислот со щелочами.
Образуются алканы, содержащие на один атом углерода меньше, чем в исходной соли. Например, получение метана из ацетата натрия.
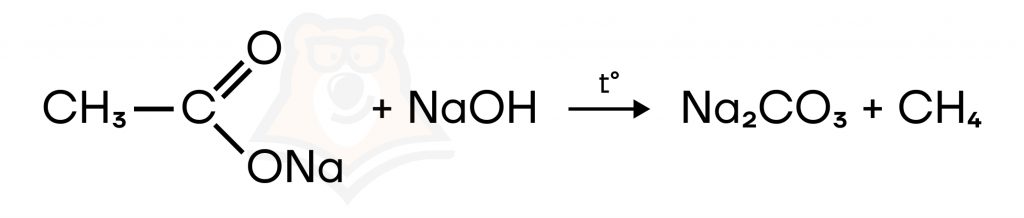
- Реакция Вюрца.
Реакция Вюрца — действие металлического натрия на галогенпроизводные.
При взаимодействии галогеналканов с натрием образуется новый алкан с удвоенным количеством атомов С. Например, из бромэтана получается бутан.
2CH3-CH2-Br + 2Na = 2NaBr + CH3-CH2-CH2-CH3
Реакция Вюрца может проходить и с двумя разными галогенпроизводными, тогда мы получаем алкан с количеством атомов C равным сумме атомов C в галогенпроизводных. Также строение итогового алкана зависит и от положения галогена в цепи:
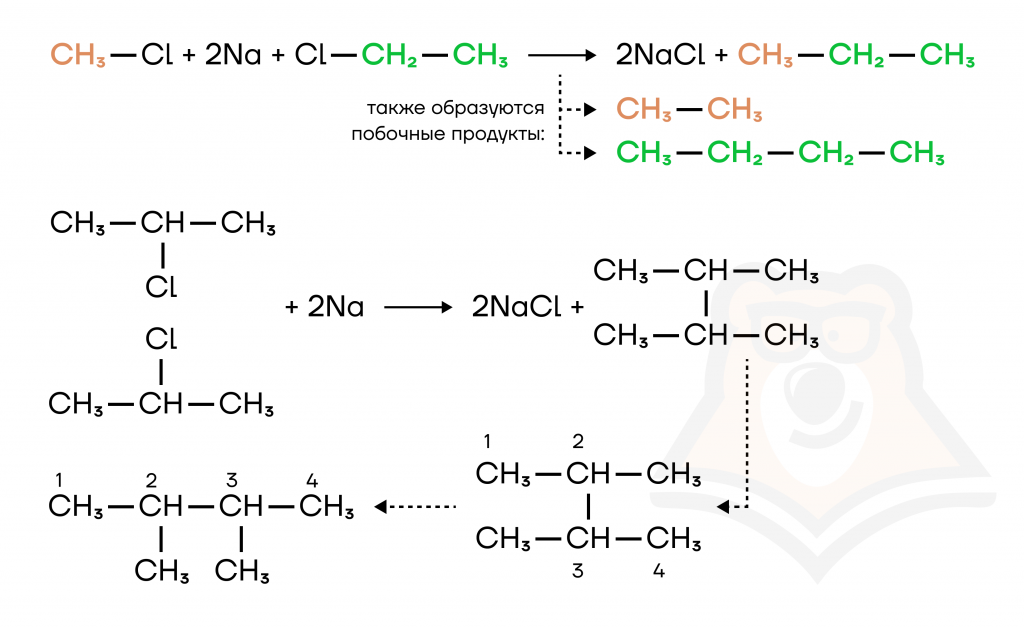
- Синтез из простых веществ.
C + 2H2 = CH4
А в лаборатории основным способом получения является гидролиз карбида алюминия:
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3.
Применение алканов
Алканы обладают очень широкой сферой применения. Мы ежедневно используем метан, когда готовим что-либо на газовой плите, алканы входят в состав нефти, перерабатывая которую человек получает бензин, керосин, мазут и другие виды моторного и ракетного топлива. Высшие алканы — основа для изготовления вазелина, свечей, мыла. В органическом синтезе алканы используются для получения уксусной кислоты и получения синтез-газа путем паровой конверсии метана.
Фактчек
- Алканы — углеводороды, в которых присутствуют только одинарные связи.
- Общая формула алканов CnH2n+2.
- Алканы могут быть в жидком, твердом и газообразном состояниях.
- Для алканов характерны реакции замещения, реакции разложения и реакции изомеризации.
Проверь себя
Задание 1.
Какая общая формула характерна для алканов?
- CnH2n+2
- CnH2n
- CnH2n-2
- CnHn
Задание 2.
Какие связи присутствуют в молекуле пропана?
- сигма- и пи- связи
- только сигма-связи
- только пи-связи
- только ионные связи
Задание 3.
При ароматизации н-гексана образуется:
- толуол
- гексен-1
- гексин-1
- бензол
Задание 4.
При каталитическом окислении н-бутана помимо воды образуется:
- муравьиная кислота
- уксусная кислота
- пропановая кислота
- углекислый газ
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.


 к списку статей
к списку статей





