Периодический закон и периодическая система химических элементов Д. И. Менделеева
На этой странице вы узнаете:
- Как «вес» элемента может сказаться на его «работе»?
- Как связаны снеговик и радиус атома?
- Есть ли среди элементов «правонарушители»?
Все в мире подчиняется тем или иным законам: яблоко падает с дерева под силой тяжести, мы переходим дорогу только на зеленый свет, и в мире химии тоже есть свои законы. Химические элементы — «законопослушные граждане»! Они подчиняются Периодическому закону, о котором сейчас пойдет речь.
Химический элемент и его свойства
В 1869 г. Д.И. Менделеев сформулировал периодический закон, современная формулировка которого звучит следующим образом:
Свойства химических элементов находятся в периодической зависимости от заряда ядра атомов химических элементов.
До того, как начать разговор о Периодической системе, давайте разберемся с тем, что же такое собственно химический элемент.
Химический элемент — совокупность (группа, сорт, вид) атомов, обладающих одинаковыми свойствами, с одним и тем же количеством протонов и нейтронов в ядре, электронов в электронной оболочке.
Свойства элементов можно распределить по нескольким группам:
- металлические/неметаллические свойства,
- окислительно-восстановительные свойства,
- радиус атома,
- электроотрицательность,
- валентность и степени окисления,
- энергия ионизации,
- энергия сродства к электрону.
Данные свойства во многом зависят от положения атома в таблице Менделеева и электронной конфигурации атома. Подробнее о влияние конфигурации на свойства атома можно прочитать в статье «Строение атомов и электронные конфигурации».
Также практически все химические элементы, в отличие от веществ:
- Могут образовывать ионы.
- Содержатся в различных органических и неорганических веществах.
- Могут образовывать аллотропные модификации (аллотропия — способность химического элемента образовывать несколько простых веществ). Например, атом кислорода может быть в виде соединения кислорода О2 и озона О3.
- Имеют изотопы — разновидности атомов химического элемента, имеющие одинаковое количество протонов и электронов, но разное количество нейтронов, следовательно, и разную атомную массу.
| Как «вес» элемента может сказаться на его «работе»? Мы упомянули, что изотопы имеют различную массу. Оказывается, «вес» элемента напрямую влияет на его свойства и применение. Самыми известными являются изотопы водорода: водород (масса равна 1), дейтерий (масса равна 2) и тритий (масса равна 3). Более тяжелые изотопы используются в атомной энергетике, для осуществления термоядерного синтеза и для создания водородных бомб. Изотопы имеет и углерод: углерод-12, углерод-13 и углерод-14 (цифра обозначает массу атома). Если первые два стабильны и встречаются повсеместно, то последний за счет своей массы менее стабилен — он хочет быстрее сбросить с себя лишние нейтроны путем распада. Данное качество сыграло решающую роль в применении углерода-14. Ученые рассчитали «время жизни» изотопа, благодаря чему при анализе органических веществ по количеству найденного углерода-14 можно сделать вывод о возрасте найденного объекта. Данный метод был назван радиоуглеродным анализом, сейчас он находит широкое применение при датировке (определении возраста) ископаемых. За это открытие в 1960 году Уилларду Либби была присуждена Нобелевская премия по химии. |

Теперь, когда мы разобрались в понятии и общих свойствах химических элементов, давайте разберем подробнее, как именно зависят их свойства от местонахождения в Периодической системе.
Изучить весь материал для ЕГЭ и ОГЭ и разобраться с темами любой сложности вы можете на курсах в онлайн-школе «Умскул»! Запишитесь на бесплатную консультацию и узнайте подробности про вебинары, платформу с домашками и пробниками и скидки:
Закономерности изменения химических свойств элементов
Для дальнейшей работы хорошо бы иметь под рукой таблицу Менделеева.
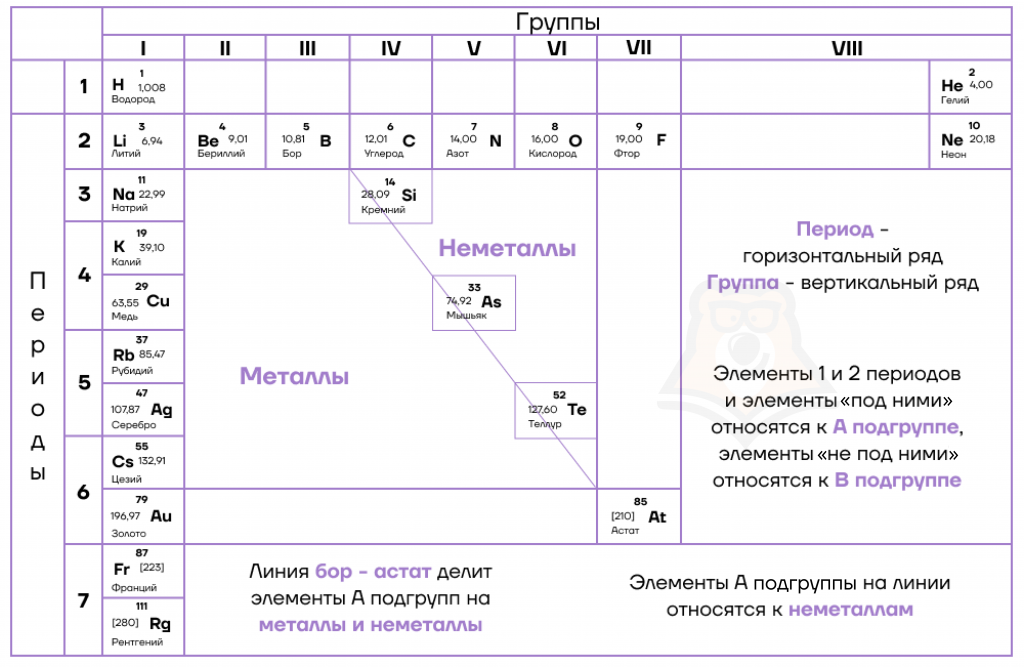
Разберем закономерности изменения свойств элементов в зависимости от положения в таблице.
Ориентир – франций
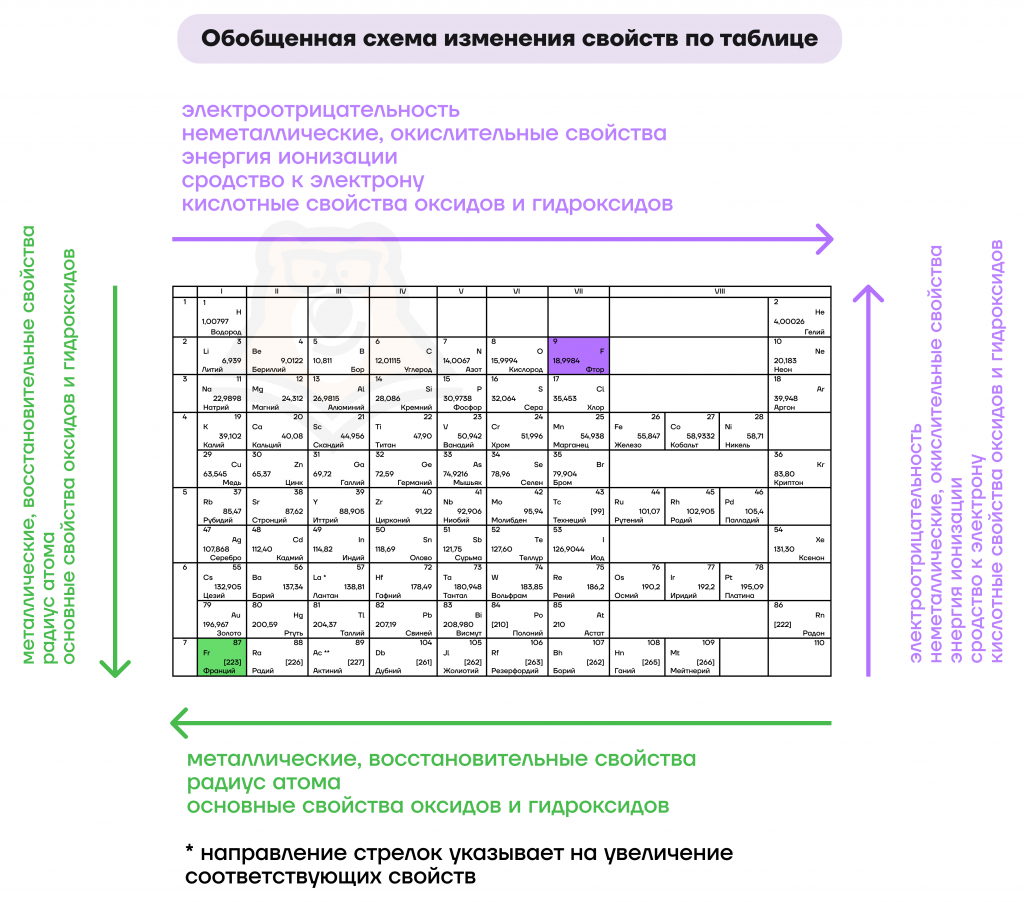
Для начала изучим свойства элементов, которые увеличиваются справа налево и сверху вниз при движении по таблице (т.е. при движении к францию – Fr).
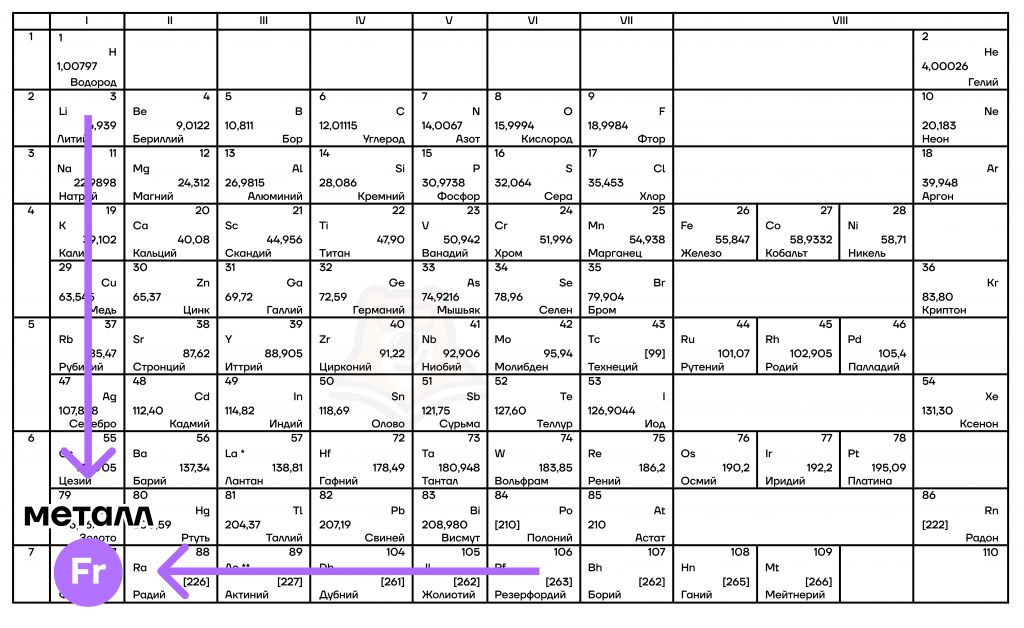
- Металлические/восстановительные свойства
Вообще, под металлическими свойствами подразумевают способность атомов отдавать электроны. Можно провести воображаемую линию, которая начинается у атома бора и заканчивается у атома астата. Так вот, все элементы, которые попадут в левую область таблицы будут являться металлами, а элементы главных подгрупп, которые попадут в правую часть — неметаллами. Поэтому металлические/восстановительные свойства в периодах увеличиваются справа налево, а в группах — сверху вниз.
- Радиус атома
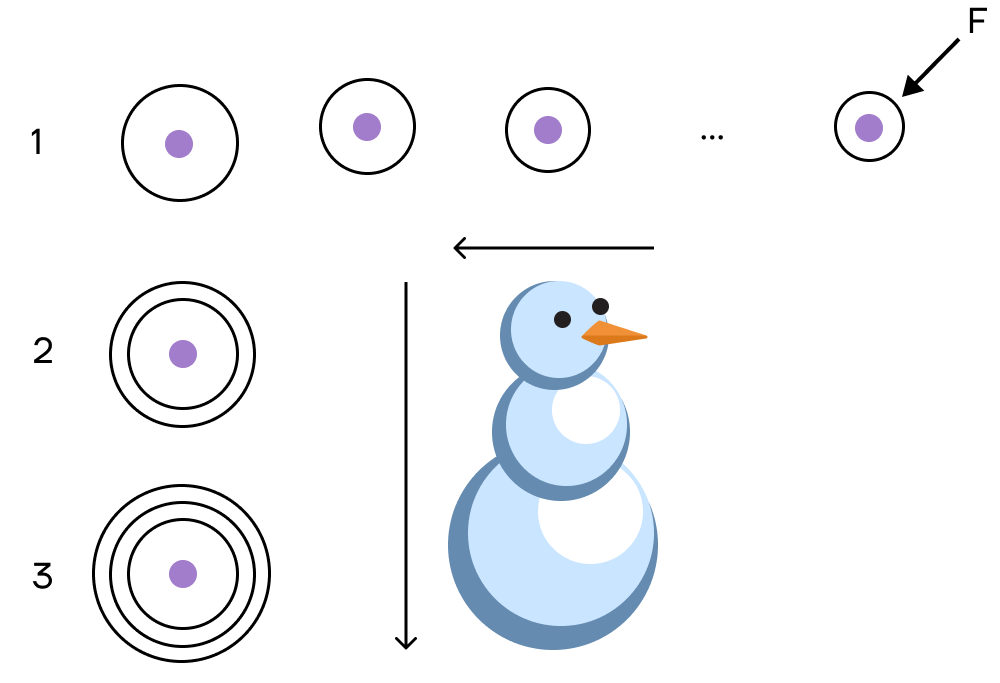
При движении по периоду увеличивается число электронов на соответствующем валентном уровне — электроны начинают сильнее притягиваться к положительному ядру, тем самым «сжимая» размер радиуса. Поэтому радиус атома уменьшается слева направо при движении по периоду.
При движении по группе сверху вниз увеличивается число электронных оболочек, атом становится «толще», поэтому сверху вниз по группе радиус атома увеличивается.
При сравнении элементов ориентируемся снова на франций: какой атом ближе к нему, у того радиус больше.
| Как связаны снеговик и радиус атома? С увеличением номера периода количество электронных слоев растет, а значит, увеличивается и радиус атома. Но так как к фтору увеличивается электроотрицательность, то электроны все ближе и ближе «прижимаются» к ядру атома: атомный радиус уменьшается. Проще всего это представить в виде снеговика, у которого самая «маленькая» голова и самое «большое» туловище. Именно так увеличивается радиус ядра атома по группе. |
- Основные свойства высших оксидов/гидроксидов
Основные свойства характеризуют способность соединений реагировать с кислотами, они зависят от металлических свойств и меняются точно так же: в периодах увеличиваются справа налево, а в группах — сверху вниз.
Ориентир – фтор
Перейдем к рассмотрению свойств, которые растут при движении по таблице слева направо и снизу вверх (т.е. при движении к фтору – F).
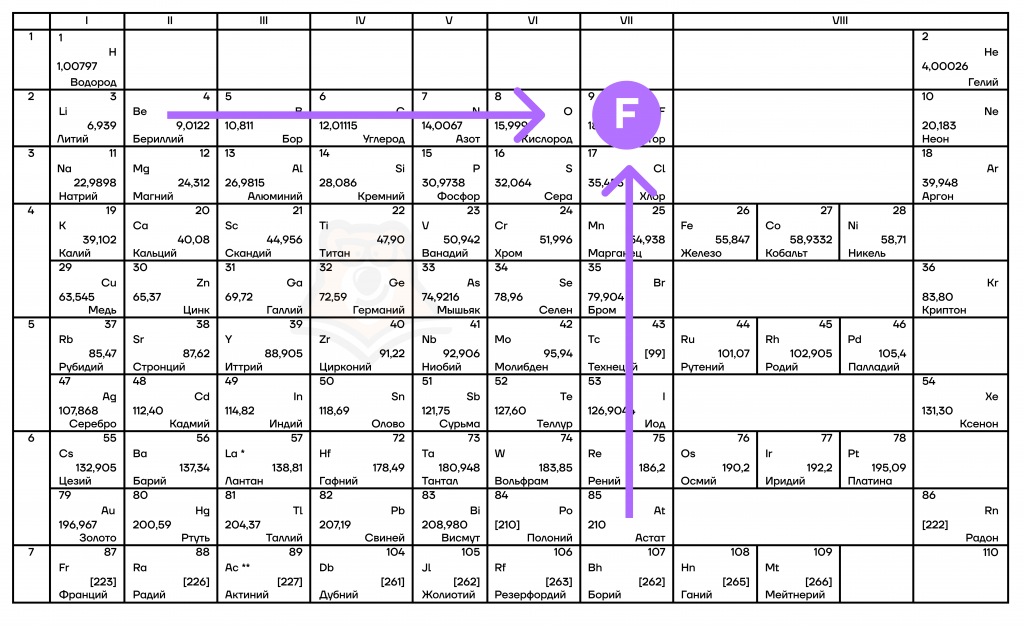
- Неметаллические/окислительные свойства
Здесь работает все с точностью до наоборот металлическим/восстановительным свойствам: неметаллические свойства будут увеличиваться слева направо в периодах, а в группах — снизу вверх.
- Электроотрицательность
Это способность атомов оттягивать на себя электроны других атомов в химической связи. Электроотрицательность увеличивается при движении в периодической системе слева направо и снизу вверх. Самым электроотрицательным элементом является фтор, это нужно запомнить!
- Кислотные свойства высших оксидов/гидроксидов
Кислотные свойства характеризуют способность соединений реагировать с основаниями и зависят уже от неметаллических свойств и меняются соответствующим образом — увеличиваются слева направо в периодах, а в группах — снизу вверх.
- Энергия ионизации
Это энергия, необходимая для отрыва одного электрона от нейтрального атома. В группах она увеличивается снизу вверх, в периодах — слева направо.
- Сродство к электрону
Это энергия, выделяющаяся при присоединении одного электрона к нейтральному атому. Она изменяется аналогично изменению энергии ионизации.
Остальные закономерности
Некоторые свойства атомов изменяются по правилам, отличным от вышеупомянутых. Разберем эти свойства.
- Кислотные и основные свойства водородных соединений
В группе кислотные свойства зависят от радиуса атома — чем больше атом, с которым связан водород, тем легче последнему отщепляться от него, поэтому в группе кислотные свойства усиливаются сверху вниз. Основные свойства противоположны кислотным, поэтому увеличение основных свойств в группе будет происходить снизу вверх. Разберемся на примере.
В ряду кислот HF — HCl — HBr — HI фтор имеет наименьший радиус атома, а йод — наибольший. Атому с наименьшим радиусом, то есть фтору, легче всего притянуть водород и сложнее отдать, поэтому его водородные свойства будут минимальными. С дальнейшим увеличением радиуса атома, соответственно, и кислотные свойства возрастают, иодоводород (HI) будет иметь максимальные кислотные свойства.
В периоде кислотные свойства зависят от неметаллических свойств — они увеличиваются слева направо, основные — наоборот, то есть справа налево.

- Высшая/низшая степень окисления (СО)
Для начала вспомним, что из себя представляет степень окисления.
Степень окисления — это условный заряд атома элемента, вычисленный на основе предположения, что все связи в данном соединении являются ионными (показывает, сколько электронов атом «притянул» или, наоборот, «отдал» при образовании химической связи).
Чтобы определить высшую/низшую степень окисления элемента, необходимо смотреть на номер группы, в которой находится элемент: высшая степень окисления равна номеру группы со знаком «плюс» (+N). Низшая СО определяется, как разность номера группы и восьми:
| высшая с.o. = N, низшая с.o. = N – 8, где N – номер группы, в которой располагается элемент |
В простых веществах степень окисления элемента будет равна 0.
Простое вещество — химическое вещество, состоящее исключительно из атомов одного химического элемента.
Простые вещества имеют определенный набор физических свойств:
- агрегатное состояние (твердое, жидкое, газообразное);
- твердость/хрупкость;
- плотность;
- кристаллическая решетка;
- цвет, запах, наличие блеска и др.
При взаимодействии двух простых веществ (неметалла с металлом или неметалла с другим неметаллом) образуются бинарные соединения.
Бинарные соединения — соединения, которые состоят из двух элементов: металла и неметалла или двух различных неметаллов.
- Высшая/низшая валентность.
Перед тем как изучать взаимосвязь валентности с положением элемента в таблице, дадим определение этому свойству.
Валентность — это способность атомов химических элементов образовывать
определенное число химических связей с атомами других химических элементов.
Для определения валентности используем следующие правила:
| высшая валентность = N, низшая валентность = 8 — N |
Подробнее о степени окисления и механизме образования валентностей в статье «Валентные возможности и степени окисления атомов химических элементов».
| Есть ли среди элементов «правонарушители»? Практически все элементы являются «законопослушными гражданами», однако и в мире химии есть свои «преступники». Исключением из правила о высшей валентности является азот (N). Можно поинтересоваться, а почему так? У азота есть только основное состояние атома, в котором три неспаренных электрона и неподеленная электронная пара. Возможности «рассорить» эту пару у азота попросту нет! Поэтому возможны следующие варианты: — один неспаренный электрон = валентность I; — два неспаренных электрона = валентность II; — три неспаренных электрона = валентность III; — три неспаренных электрона + неподеленная электронная пара = валентность IV. Аналогичные исключения действует для кислорода (O) и фтора (F), запоминаем их по аббревиатуре FON. Фтор, как самый электроотрицательный элемент, способен только принимать один электрон, поэтому его высшая валентность равна I. С кислородом ситуация сложнее: в озоне O3 валентности атомов кислорода будут равны I, II и III. Образование трех связей также происходит в угарном газе (СО), давайте подробнее разберем механизм образования этих связей: — За счет неспаренных электронов атомов углерода и кислорода образовано две связи (обменный механизм). — За счет вакантной орбитали атома углерода и спаренных электронов атома кислорода образована третья связь (донорно-акцепторный механизм). Таким образом, в молекуле СО тройная связь, причем две связи образованы по обменному механизму, а третья – по донорно-акцепторному. |

Ниже, для вашего удобства, графически представлена информация о «правонарушителях».
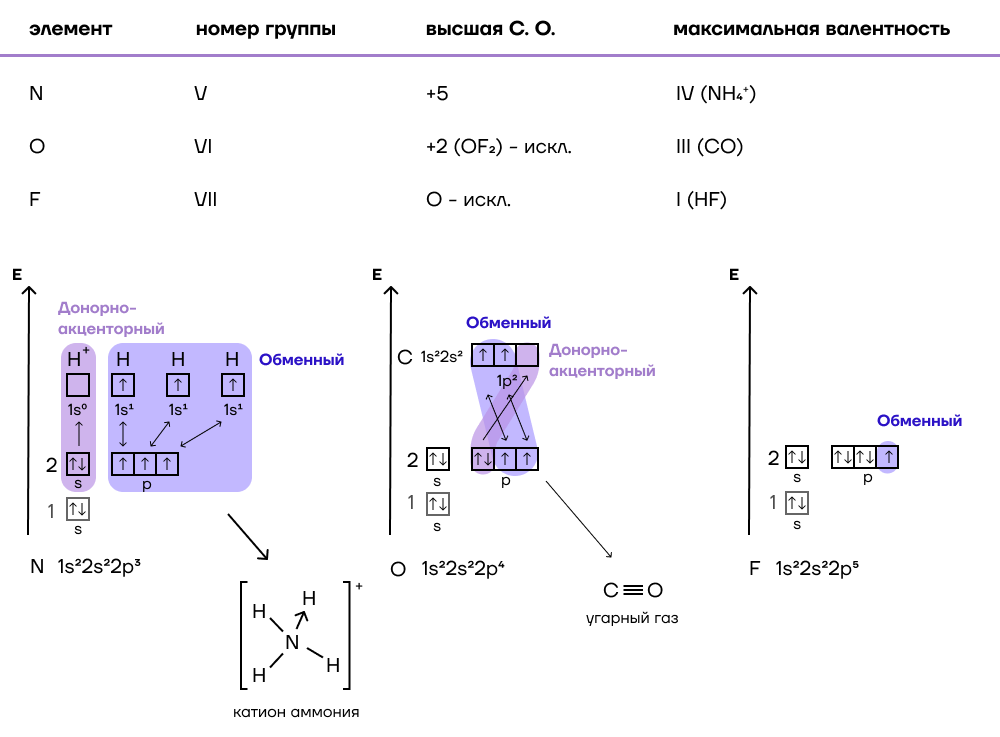
Сегодня мы подробнее изучили основы химии, а именно свойства химических элементов и закономерности изменения этих свойств в зависимости от изменения положения в таблице Менделеева. Обобщим полученный материал графически.
Наше изучение общей химии на этом заканчивается, но приключение по миру химии 一 нет. Настало время познакомиться с неорганической химией, а для этого предлагаем начать с изучения статьи «Металлы IA группы».
Термины
Металлы — вещества, обладающие металлическими свойствами, такими как высокие электро- и теплопроводность, высокая пластичность, ковкость и характерный металлический блеск. Они способны взаимодействовать с неметаллами, водой и некоторыми кислотами, а также могут вступать в окислительно-восстановительные реакции.
Неметаллы — вещества, не обладающие металлическими свойствами. Они способны взаимодействовать с металлами и некоторыми неметаллами, водой, щелочами и некоторыми кислотами, а также могут вступать в окислительно-восстановительные реакции.
Электронная конфигурация — это формула, отражающая распределение электронов по электронным оболочкам атома (энергетическим уровням).
Фактчек
- Химический элемент 一 особая группа элементов, обладающих определенными химическими свойствами. Данные свойства напрямую зависят от положения элемента в таблице Менделеева.
- Металлические и восстановительные свойства отражают способность атомов отдавать электроны, они увеличиваются при движении справа налево сверху вниз (к францию). Аналогично изменяются основные свойства оксидов и гидроксидов, а также радиус атома.
- Радиус атома увеличивается при увеличении числа электронных оболочек.
- Неметаллические и окислительные свойства отражают способность принимать электроны, они увеличиваются при движении слева направо снизу вверх (к фтору), аналогично изменяются кислотные свойства оксидов и гидроксидов. Фтор обладает наибольшей электроотрицательностью, поэтому чем ближе элемент находится к нему, тем выше его электроотрицательность, энергия ионизации и сродства к электрону.
- Некоторые свойства не зависят от близости элемента к францию или фтору, к таким свойствам относятся кислотные свойства водородных соединений, степень окисления и валентность.
- Высшая валентность для большинства элементов равна номеру группы, однако есть три элемента-исключения: азот (N), кислород (О) и фтор (F).
Проверь себя
Задание 1.
Какова высшая валентность алюминия?
- I
- II
- III
- IV
Задание 2.
Водородное соединение какого элемента обладает наибольшими основными свойствами?
- Азот
- Фосфор
- Сурьма
- Мышьяк
Задание 3.
Какой из перечисленных элементов является металлом?
- Кремний
- Франций
- Радон
- Астат
Задание 4.
Гидроксид какого элемента проявляет основные свойства?
- Серы
- Хлора
- Рубидия
- Фосфора
Ответы: 1. — 3 ; 2. — 1; 3. — 2; 4. — 3.


 к списку статей
к списку статей





