Соединения цинка и алюминия
На этой странице вы узнаете
- Почему алюминиевая ложка не растворяется в чае, если алюминий относят к активным металлам?
- Как гидроксид алюминия связан с медициной?
- Что общего у звезд и сульфида цинка?
Закройте глаза, и подумайте, что первое приходит вам на ум, если вы услышите слово «алюминий»? Наверное, самая простая алюминиевая ложка… ну, или максимум фольга… А знали ли вы, что драгоценный камень рубин – одно из соединений алюминия? И даже больше: сапфир и изумруд – тоже! Соединения цинка не менее интересны, но обо всем по порядку в нашей сегодняшней статье.
Оксиды алюминия и цинка
В статье «Амфотерные металлы: алюминий и цинк» мы уже узнали о поведении этих металлов в реакциях с различными соединениями. Но теперь нам было бы интересно обратиться к другой стороне вопроса — а как взаимодействуют с различными веществами производные от этих металлов? Начнем наше знакомство с соединениями алюминия и цинка, а для этого давайте сначала вспомним, что такое оксид.
Оксиды — это вещества, состоящие из атомов кислорода (О) в степени окисления -2 и атомов другого химического элемента.
Общая формула оксидов — X2On, где Х обозначает конкретный химический элемент, а n — цифра значения степени окисления этого элемента в оксиде.
Оксиды обладают специфическими свойствами, нехарактерными другим типам соединений:
- способны восстанавливаться до соответствующих металлов/неметаллов;
- могут взаимодействовать с водой с образованием соответствующих гидроксидов;
- способны окисляться кислородом или озоном до пероксидов и т.д.
| Почему алюминиевая ложка не растворяется в чае, если алюминий относят к активным металлам? Как мы все знаем, если обычную алюминиевую ложку поместить в чай, то с ней ничего не произойдет. Максимум — она нагреется. Но если мы предварительно снимем с ложки защитный слой и снова поместим в чай, то обнаружим, что она растворяется! Почему же так? Все дело в оксидной пленке, расположенной на поверхности металла и ограничивающей его реакционную способность (способность взаимодействовать с другими веществами), состоящей из наиболее устойчивого оксида металла Al2O3, который с водой не взаимодействует, в отличие от чистого металла. |

Оксиды алюминия и цинка по физическим свойствам представляют собой бесцветные порошки, нерастворимые в воде. На экзамене оксид алюминия может быть назван глиноземом или корундом, это его тривиальное название – неофициальное название, использующееся в обычной жизни.
Корунд — минерал, кристаллическая форма оксида алюминия Al2O3.
Искусственный корунд ранее использовался для создания игл в проигрывателях пластинок, а вот драгоценные камни, например, сапфир и рубин, как раз являются натуральными разновидностями корунда.
Также к минералам, содержащим в своем составе алюминий, относят изумруд, александрит и многие другие красивые и полезные вещества.

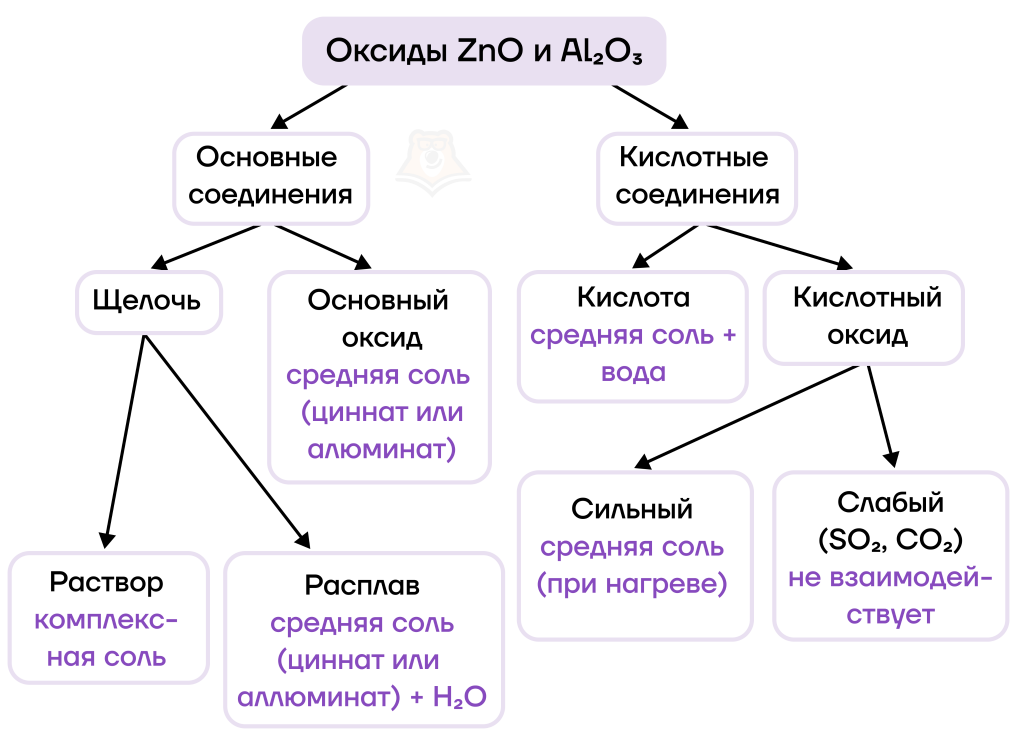
По химическим свойствам оксиды алюминия и цинка — типичные амфотерные оксиды, которые способны вступать в основно-кислотные взаимодействия как с основными соединениями, так и с соединениями, обладающими кислотными свойствами. Как и другие оксиды, они могут вступать в окислительно-восстановительные реакции с сильными восстановителями с восстановлением из них металла.
Реакции с водой
Оксидам алюминия и цинка соответствуют нерастворимые гидроксиды, то есть соединения металлов с ОН-группой, а не кислородом, Al(OH)3 и Zn(OH)2. С водой способны взаимодействовать только оксиды металлов, образующие растворимые гидроксиды (щелочи), поэтому сами оксиды цинка и алюминия с водой не взаимодействуют.
ZnO + H2O ≠
Al2O3 + H2O ≠
Амфотерные свойства оксидов
Благодаря своей амфотерности оксиды алюминия и цинка будут реагировать как с веществами, проявляющими основные свойства (основаниями, основными оксидами), так и с веществами, проявляющими кислотные свойства (кислотами, кислотными оксидами).
1. Рассмотрим для начала взаимодействие с основными соединениями.
В таких реакциях результат зависит от условий их проведения (в растворе или в расплаве они протекают).
- Взаимодействие оксидов ZnO и Al2O3 с раствором щелочи протекает по аналогии с реакциями взаимодействия самих металлов со щелочью (подробнее об этом можно прочитать в статье «Амфотерные металлы: алюминий и цинк»), единственное отличие — в данном случае не выделяется водород:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
- Взаимодействие оксидов ZnO и Al2O3 с твердой щелочью при сплавлении приводит к образованию средней соли (цинката или алюмината) и воды:
ZnO + NaOH = Na2ZnO2 +H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
- Взаимодействие же оксидов с другими основными оксидами при сплавлении приводит к образованию средней соли, как и в предыдущем случае, но здесь не выделяется вода, так как водороду в реакции неоткуда взяться:
ZnO + Na2O = Na2ZnO2
Al2O3 + Na2O = 2NaAlO2
После того, как мы изучили свойства оксидов алюминия и цинка, можем закрепить полученные знания, решив аналог задания№6 ЕГЭ. Именно в нем встречаются вопросы на понимание химических свойств веществ, в том числе солей.
Задание. В пробирку с твердым веществом Х добавили раствор щелочи, выделения газа не наблюдалось. Продуктом реакции является соль Y. Из предложенного перечня выберите вещества X и Y, которые могут вступать в указанную реакцию.
1) Al2O3
2) Al
3) H2O
4) NaAlO2
5) Na[Al(OH)4]
Решение. Твердые вещества в данном перечне: алюминий (Al), оксид алюминия (Al2O3), и алюминат натрия (NaAlO2), 一 они могут быть веществом Х.
Алюминат с щелочью не реагирует, а при реакции алюминия с щелочью выделяется газ водород (Н2), эти варианты нам не подойдут, поэтому вещество Х — оксид алюминия (Al2O3).
От условий протекания реакции оксида с щелочью зависят продукты реакции: с твердой щелочью получим алюминат натрия, а в растворе — комплексную соль (Na[Al(OH)4]).
Вода (H2O) будет принимать участие в реакции, однако твердым веществом она не является и взять ее мы не можем.
По условию нам дан раствор щелочи, запишем реакцию.
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Полученная соль Y — Na[Al(OH)4]
Ответ: 15
2. Реакции с основными соединениями мы разобрали, теперь рассмотрим, как взаимодействую амфотерные оксиды с кислотными соединениями.
Начнем с того, что оксиды ZnO и Al2O3, которые соответствуют нерастворимым гидроксидам алюминия и цинка, не будут взаимодействовать со «слабыми» кислотными оксидами, а вот с «сильными» при нагревании будут образовываться средние соли.
Небольшое пояснение: под «сильными» кислотными оксидами понимают оксиды сильных кислот, а под «слабыми», соответственно, — слабых кислот (ответ на вопрос «Что такое сильная или слабая кислота?» кроется в статье «Основные классы неорганических веществ»).
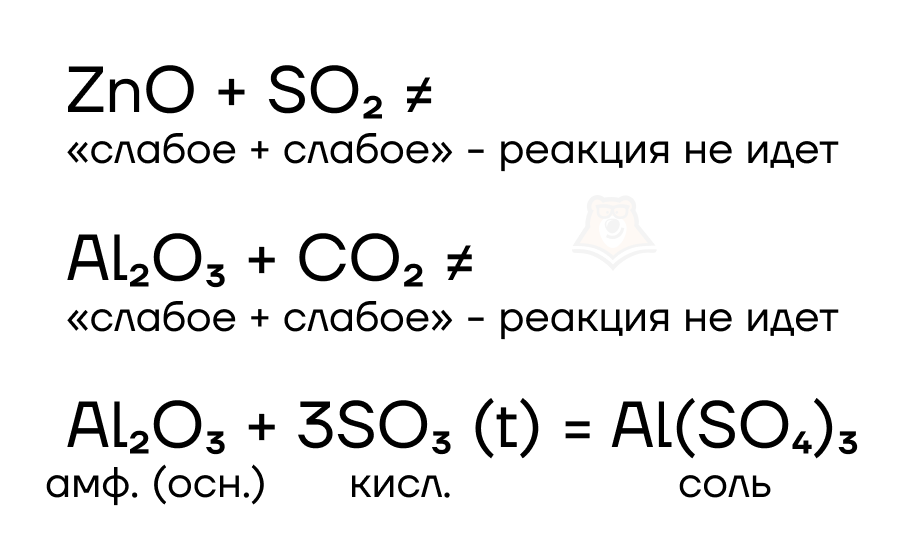
Растворение оксидов в кислотах приводит к образованию соответствующих средних солей и воды.
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Чтобы все это было легче запомнить, предлагаем взглянуть на эту схему:
Окислительно-восстановительные реакции с сильными восстановителями
Как и другие оксиды, оксиды цинка и алюминия могут вступать в окислительно-восстановительные реакции с сильными восстановителями (C, CO, H2, Al, Mg, Ca и т. д.) с восстановлением из них металла — металл в оксиде будет принимать электроны и понижать свою степень окисления.
ZnO + CO (t) = Zn + CO2
ZnO + Ca (t) = CaO + Zn
Однако, оксид алюминия, в отличие от многих других оксидов, реагирует с углеродом до карбида алюминия(Al4C3) и угарного (СО), а не углекислого (СО2), газа, поскольку образующийся в смеси алюминий сразу же вступает в реакцию с углеродом (С).
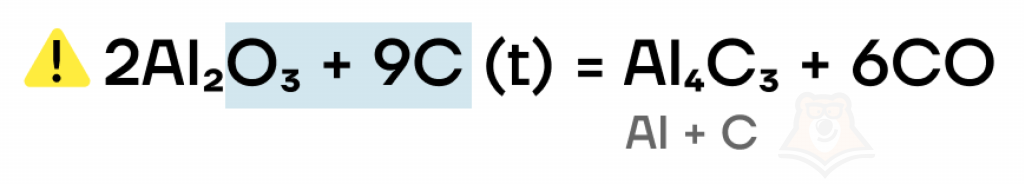
Познакомившись со свойствами оксидов, можем перейти к связанным с этим классом соединениям — гидроксидам.
Оксиды можно сравнить с обезвоженными людьми, которые хотят пить, а гидроксиды — с теми, кто попил водички.

Гидроксиды алюминия и цинка
Гидроксиды — это химические соединения, содержащие одну или несколько гидроксильных групп, их общая формула Me(OH)n.
Как и оксиды, они обладают рядом свойств, характерных только для этого класса соединений: реагируют с кислотами и разлагаются с образованием оксида и воды.
По физическим свойствам гидроксиды алюминия и цинка представляют собой белые порошкообразные вещества, не растворимые в воде. Все их химические свойства обусловлены тем, что они являются амфотерными гидроксидами и проявляют двойственные свойства.
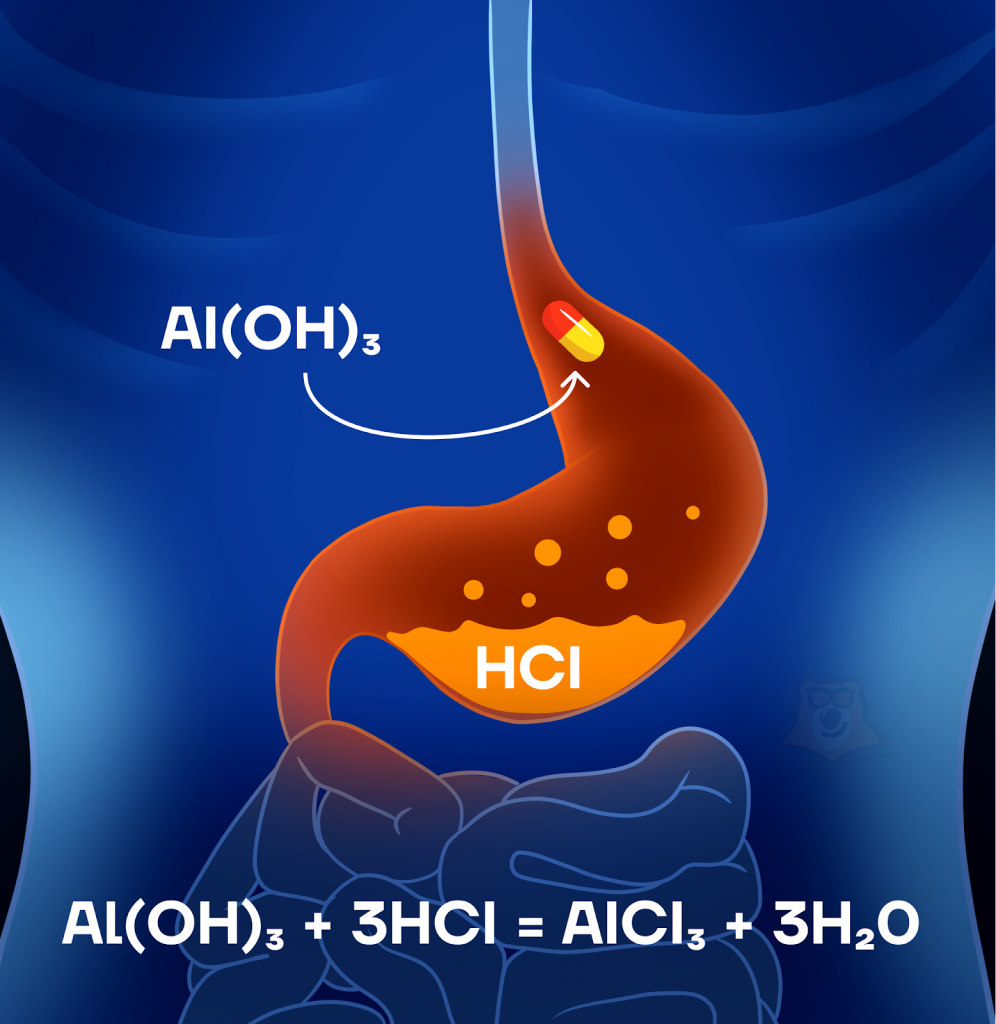
| Как гидроксид алюминия связан с медициной? Взрослые часто пугают тем, что от вредной пищи будет язва желудка и прочие ужасы. Но знали ли вы, что гидроксид алюминия предотвращает и даже лечит это заболевание? Он нейтрализует кислоту желудочного сока, обволакивает поверхность желудка и предотвращая раздражения желудка. |
Гидроксиды алюминия и цинка как амфотерные гидроксиды
Ввиду своей амфотерности, гидроксиды алюминия и цинка взаимодействуют как с соединениями, обладающими кислотными свойствами, так и с соединениями, обладающими основными свойствами.
- Рассмотрим взаимодействия с кислотными соединениями.
При взаимодействии амфотерных гидроксидов с кислотами протекает реакция нейтрализации с образованием воды и солей.
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Al(OH)3 + 3HCl = AlCl3 + 3H2O
- Когда мы говорим о реакциях с основными соединениями, нужно всегда помнить о том, в расплаве или растворе они протекают.
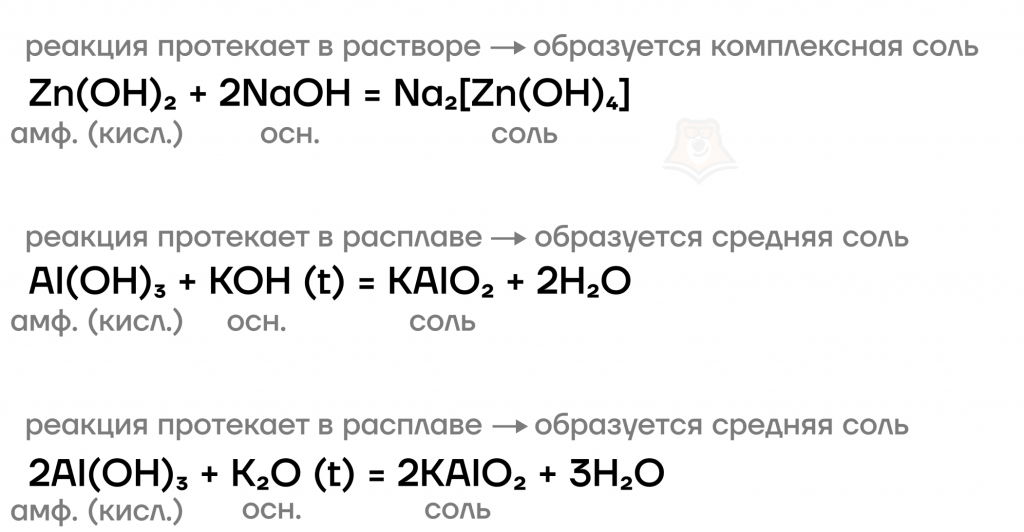
Термическое разложение гидроксидов
Подобно другим нерастворимым гидроксидам, Al(OH)3 и Zn(OH)2 способны разлагаться при нагревании на соответствующий оксид и воду.
Zn(OH)2 (t) = ZnO + H2O
2Al(OH)3 (t) = Al2O3 + 3H2O
Поговорили об амфотерных гидроксидах цинка и алюминия, теперь можем обсудить и их соли, поскольку они являются продуктом взаимодействия амфотерных гидроксидов и кислот.
Важнейшие химические свойства солей алюминия и цинка
Алюминий и цинк могут образовывать средние, комплексные, а также некоторые другие соли (основные и кислые). Чтобы лучше разобраться в классификации солей, рекомендуем прочитать статью «Основные классы неорганических веществ».
| Что общего у звезд и сульфида цинка? Все мы представляем себе светящиеся в темноте краски, палочки, звездное небо на потолке комнаты и многие другие предметы, но мало кто знает, что в состав этих удивительных вещей может входить сульфид цинка ZnS. Благодаря своей способности накапливать в кристаллах световую энергию и медленно освобождать ее в виде зеленого свечения, сульфид цинка нашел применение в красках, косметике, спортивном инвентаре и многих других отраслях. Как мы теперь знаем, сульфид цинка, как и звезды, способен светиться, вот только свечение сульфида зеленого цвета, а зеленых звезд на небе у нас нет. |

А теперь узнаем, в какие реакции способны вступать соли алюминия и цинка.
Реакции с растворами щелочей
Соли алюминия и цинка реагируют с растворами щелочей.
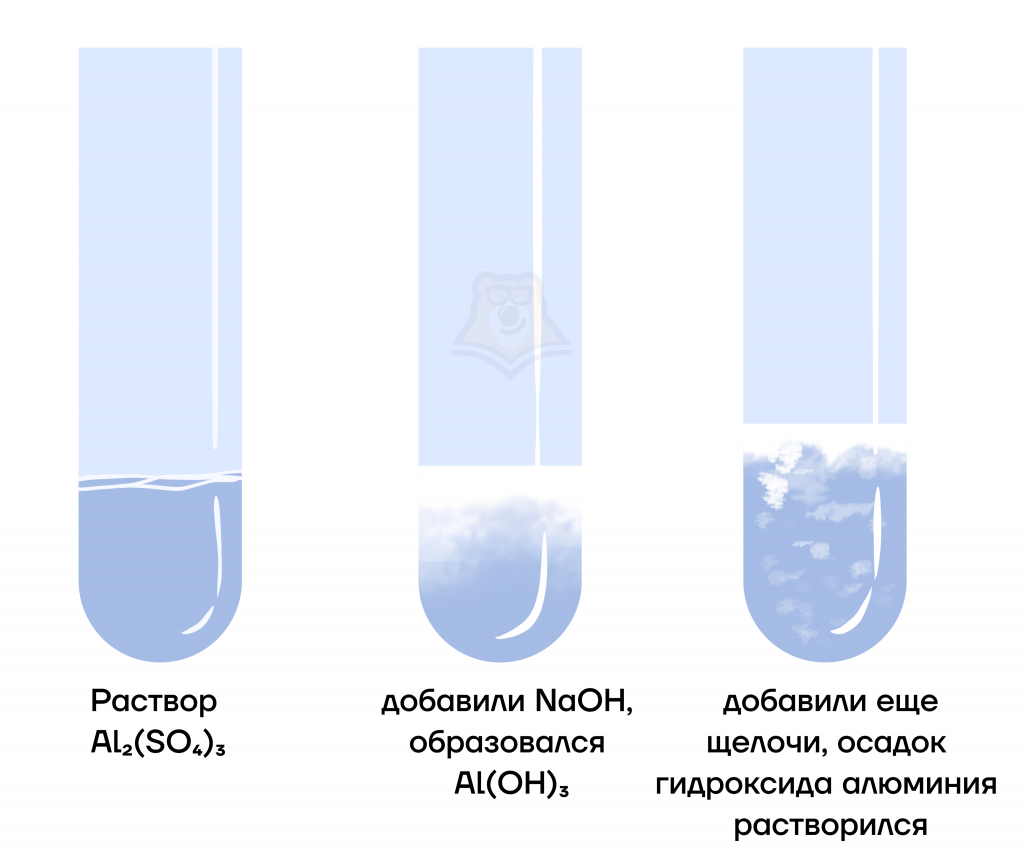
- В случае протекания реакции в недостатке щелочи будет выпадать белый осадок гидроксида алюминия:
AlBr3 + 3NaOH = Al(OH)3 + 3NaBr
- В избытке щелочи образующийся в результате ионного обмена гидроксид алюминия превращается в комплексную соль. При добавлении избытка щелочи белый осадок растворяется и раствор становится бесцветным. Давайте поэтапно разберем этот процесс.
- Сначала в реакции с щелочью мы получаем осадок гидроксида алюминия, реакция протекает один в один как при взаимодействии с недостатком щелочи.
- При дальнейшем добавлении щелочи образовавшийся амфотерный гидроксид реагирует с ней, и осадок растворяется:
Al(OH)3 + NaOH = Na[Al(OH)4]
- Объединив оба этапа, мы получаем следующую реакцию:
AlBr3 + 4NaOH (изб.) = Na[Al(OH)4] + 3NaBr
Данная реакция будет качественной (по ней мы можем определить ионы алюминия или цинка в растворе), поэтому очень важно ее понять и запомнить.
Разрушение комплексных солей и их аналогов кислотами
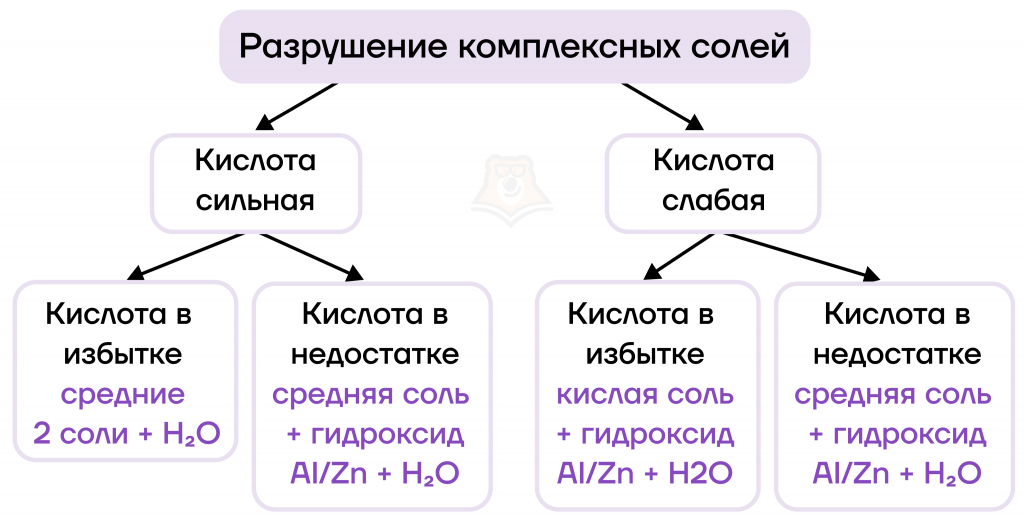
В зависимости от количества добавленной кислоты и ее силы реакция может протекать с образованием различных продуктов.
Сначала разберемся, что образуется при взаимодействии комплексных солей с сильными кислотами.
- Если сильная кислота находится в недостатке, ее хватает только для самого сильного металла (IA или IIA группы). В результате образуются соль сильного металла и амфотерный гидроксид, возможно также образование воды.
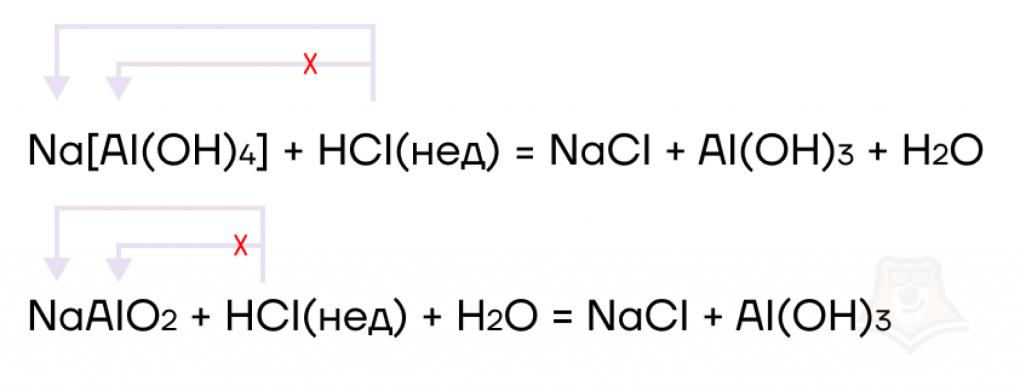
- Если сильная кислота находится в избытке, ее хватает на оба металла: образуются две соли и вода.
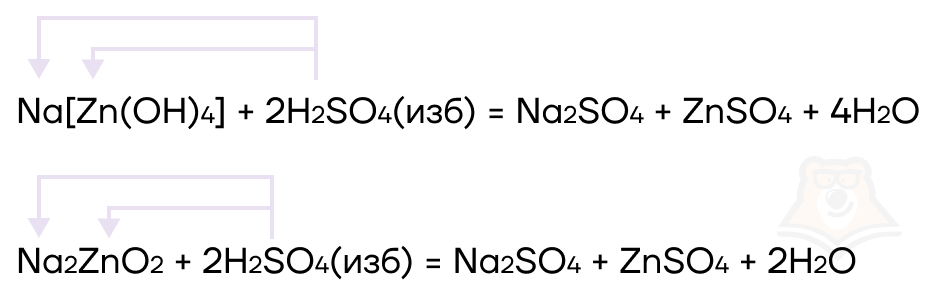
Со слабыми кислотами (угольной CO2 (р-р), сернистой SO2 (р-р), сероводородной H2S и др.) ситуация немного сложнее.
- Если слабая кислота находится в недостатке, ее также хватает только для самого сильного металла (щелочного или щелочноземельного).

- Если слабая кислота находится в избытке, в продуктах образуется кислая соль (из-за избытка кислотного) и амфотерный гидроксид. Со слабой кислотой он не взаимодействует, так как сам слабый.
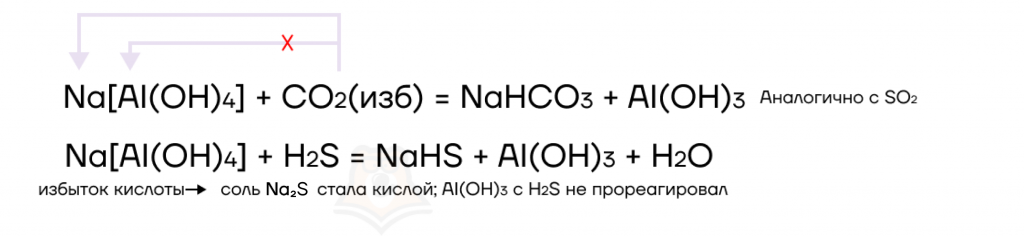
Обобщение об этих реакциях представлено на схеме:
После изучения свойств соединений алюминия и цинка, можем закрепить полученные знания, решив задание №8 ЕГЭ.
Задание. Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
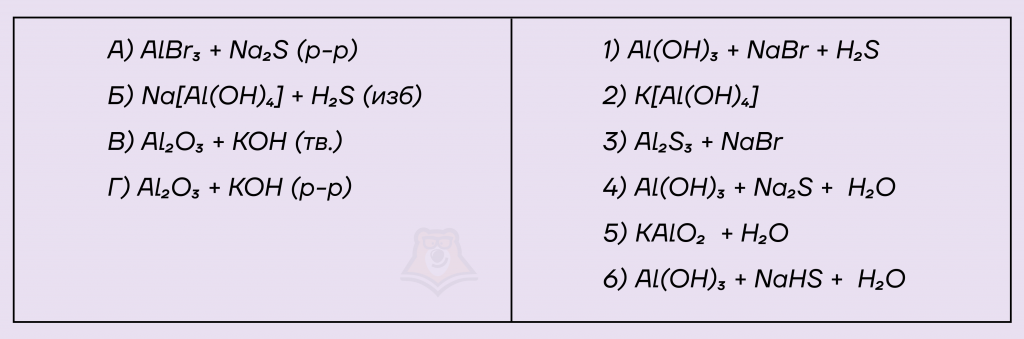
Решение.
А) Взаимодействие бромида алюминия (AlBr3) и сульфида натрия (Na2S) относится к реакциям ионного обмена, однако образующийся сульфид алюминия мгновенно гидролизуется в воде до гидроксида алюминия (Al(OH)3) и сероводорода (H2S).
Получим реакцию: 2AlBr3 + 3Na2S + 6H2O = 2Al(OH)3 + 6NaBr + 3H2S
Б) Слабая сероводородная кислота находится в избытке, поэтому в продуктах образуется кислая соль (NaHS) из-за избытка кислотного и амфотерный гидроксид алюминия Al(OH)3, так как слабое со слабым не реагирует.
Получим реакцию: Na[Al(OH)4] + Н2S (изб) = Al(OH)3 + NaHS + H2O
В) Сплавление оксида Al2O3 с твердой щелочью протекает с образованием средней соли и воды.
Получим реакцию: Al2O3 + 2NaOH = 2NaAlO2 + H2O
Г) Взаимодействие оксида Al2O3 с раствором щелочи протекает с образованием комплексной соли K[Al(OH)4].
Получим реакцию: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Ответ: 1652
Термическое разложение
При нагревании комплексной соли будет происходить выпаривание из нее воды. В анионе там, где нет воды (например, в расплаве), образуются средние соли с амфотерными металлами.
Na[Al(OH)4] (t) = NaAlO2 + 2H2O
Ba[Zn(OH)4] (t) = BaZnO2 + 2H2O
Реакции с солями
Самые «страшные» реакции с участием комплексных солей алюминия и цинка — их реакции с солями. Чтобы их правильно написать, можно для себя представить комплексную соль, как совокупность щелочи и амфотерного гидроксида.
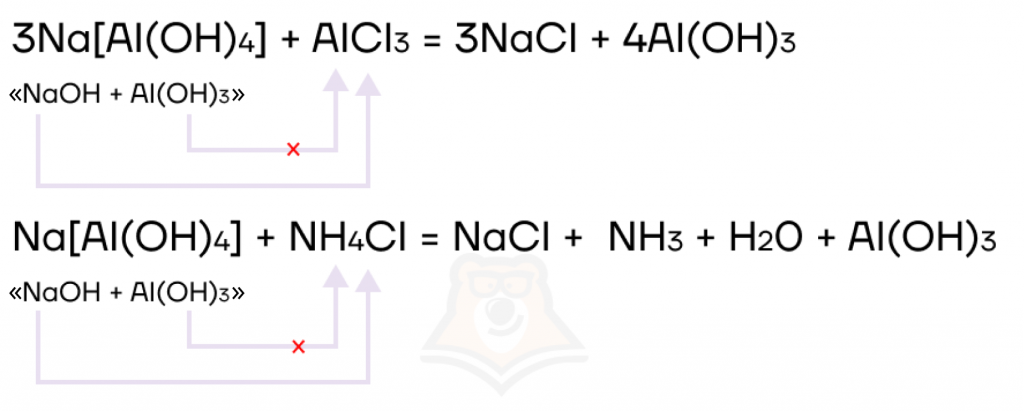
Как видите, реакции не такие уж и страшные, если в них разобраться.
Сегодня мы познакомились с соединениями, которые образуют алюминий и цинк и тем, как знания по этой теме применяются в реальной жизни. Эта тема очень важна в экзамене, поскольку на ее базе строятся многие задачи как из первой, так и из второй части, поэтому понимание ее основ необходимо для получения высоких баллов. А для более полного изучения свойств металлов рекомендуем прочитать статью «Переходные элементы: хром, железо, марганец».

Термины
Восстановители — соединения, отдающие электроны в окислительно-восстановительных реакциях, при этом повышающие свою степень окисления.
Оксидная пленка — это поверхностный слой, покрывающий металл и ограничивающий его активность в отношении других химических веществ. Оксидная пленка состоит из наиболее устойчивого оксида соответствующего металла (в случае алюминия — Al2O3).
Фактчек
- Оксиды алюминия и цинка способны вступать в окислительно-восстановительные реакции с сильными восстановителями с восстановлением металлов из их оксидов.
- Алюминий и цинк способны образовывать особый тип солей, называемых комплексными.
- Комплексные соли алюминия и цинка могут быть разрушены кислотами, при этом продукты реакции будут зависеть от силы кислоты и ее избытка/недостатка.
- При взаимодействии оксидов алюминия и цинка важно обращать внимание на условия протекания реакции: в растворе образуются комплексные соли, а в расплаве – средние.
- Оксиды и гидроксиды алюминия и цинка также обладают амфотерными свойствами, что определяет их химическое поведение в различных реакциях.
Проверь себя
Задание 1.
Какими свойствами обладают оксиды и гидроксиды алюминия и цинка?
- Основными свойствами
- Кислотными свойствами
- Амфотерными свойствами
- Нейтральными свойствами
Задание 2.
Какие продукты реакции образуется в результате взаимодействия оксида цинка с водой?
- Реакция не протекает
- Зависит от условий
- Гидрид цинка и кислород
- Гидроксид цинка и водород
Задание 3.
Что можно наблюдать при приливании раствора гидроксида натрия к раствору хлорида алюминия?
- Выделение газа
- Выпадение осадка
- Видимых изменений не наблюдается
- Выпадение осадка, а затем его растворение
Задание 4.
Что образуется при взаимодействии оксида цинка и сернистого газа?
- Сульфат цинка
- Сульфит цинка
- Сульфид цинка и кислород
- Реакция не идет
Задание 5.
Какие продукты реакции образуются при добавлении сероводорода к комплексной соли алюминия?
- Сульфид натрия и сульфид алюминия
- Гидросульфид натрия и сульфид цинка
- Гидросульфид натрия и гидроксид цинка
- Гидроксид натрия и сульфид цинка
Ответы: 1. – 3; 2. – 1; 3. – 4; 4. – 4; 5. – 3.


 к списку статей
к списку статей





