Строение атома и электронные конфигурации 1.0
На этой странице вы узнаете
- Можно ли увидеть атом?
- Чем атом похож на Солнечную систему?
- Как выглядит общежитие у электронов?
Атом можно представить как конструктор «Лего», который можно собрать из более простых (элементарных) частиц. У разных атомов число «деталек» может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
| Можно ли увидеть атом? Поскольку атомы невероятно малы по сравнению с длиной волны видимого света, их нельзя наблюдать даже с самым мощным в мире оптическим микроскопом. Вот почему ученые используют микроскоп другого типа, известный как сканирующий туннельный микроскоп. Он может обеспечить боковое разрешение 0,1 нм и разрешение по глубине 0,01 нм, что достаточно для изображения отдельных атомов в материалах. |
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы.
Можно провести аналогию: атом — это отдельный человек, а молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекулы — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки ученые-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē). В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
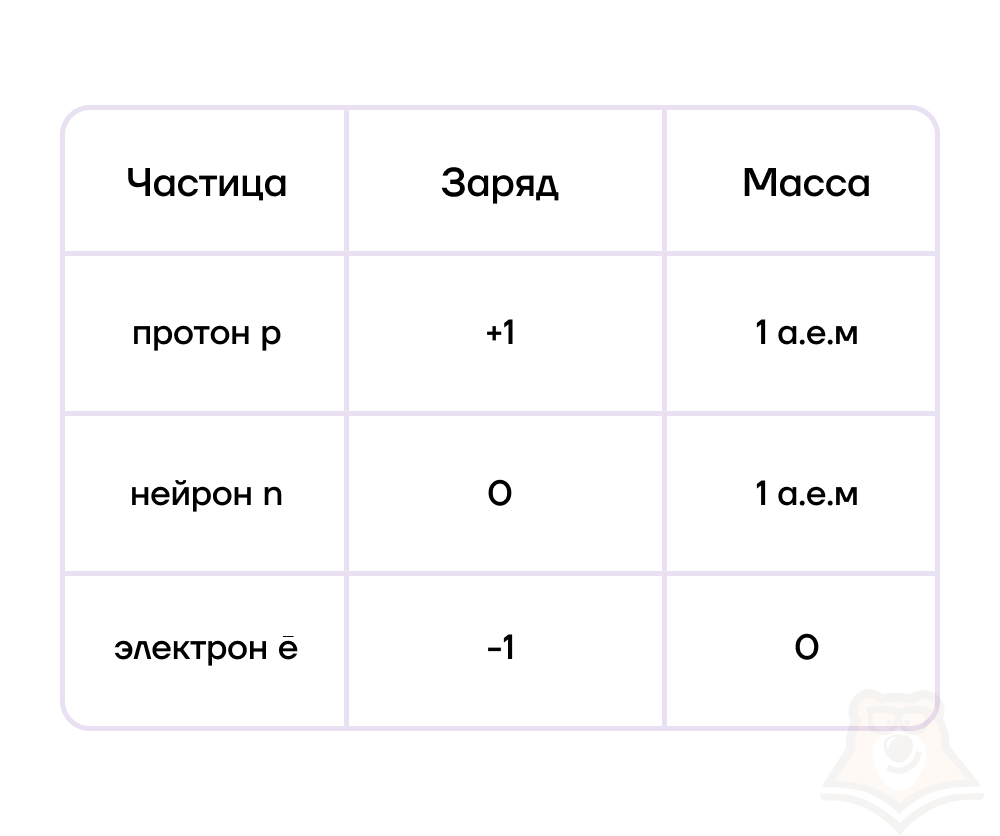
Электроны являются элементарными частицами, то есть неделимыми мельчайшими частицами. Протоны и нейтроны состоят из более мелких кварков, однако в рамках школьной программы кварки не рассматриваются, поэтому протоны и нейтроны мы также относим к элементарным частицам.
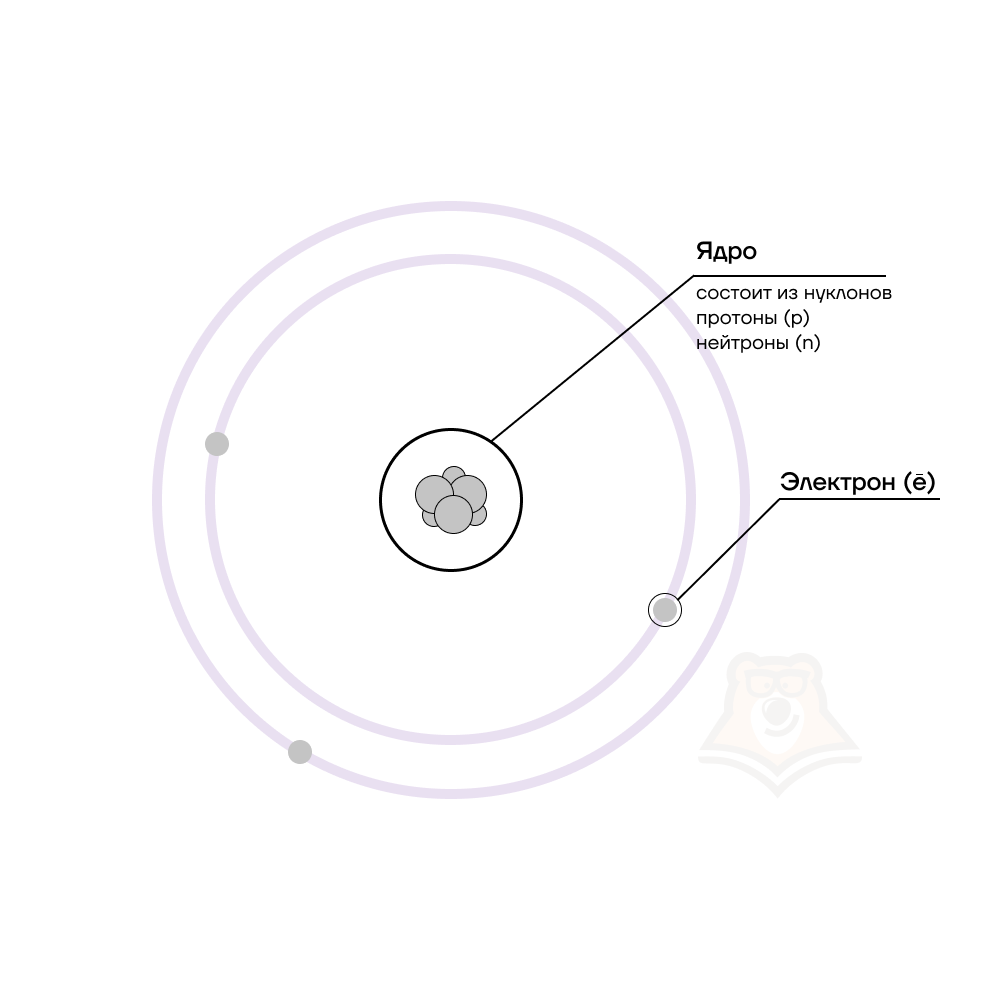
Каждая из элементарных частиц в атоме имеет свой заряд и массу.
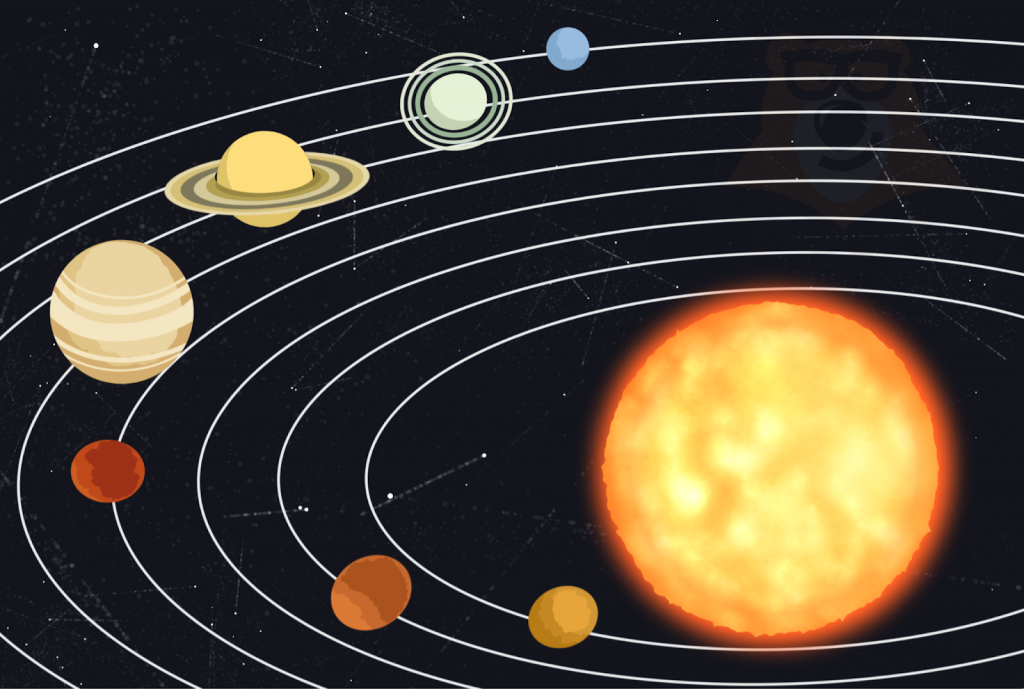
| Чем атом похож на Солнечную систему? Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. Планетарная модель наглядно описывает расположение элементарных частиц относительно друг друга, но не учитывает законы квантовой физики, а также не объясняет устойчивость атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться именно планетарным представлениями. |
Тогда более точно определение атома будет звучать так.
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Перейдем от теоретической информации к практической и научимся определять количество элементарных частиц в заданном атоме. Этот навык очень пригодится нам при решении заданий первой части!
Изучить весь материал для ЕГЭ и ОГЭ и разобраться с темами любой сложности вы можете на курсах в онлайн-школе «Умскул»! Запишитесь на бесплатную консультацию и узнайте подробности про вебинары, платформу с домашками и пробниками и скидки:
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д. И. Менделеева.
Давайте рассмотрим ячейку с углеродом в Периодической системе:
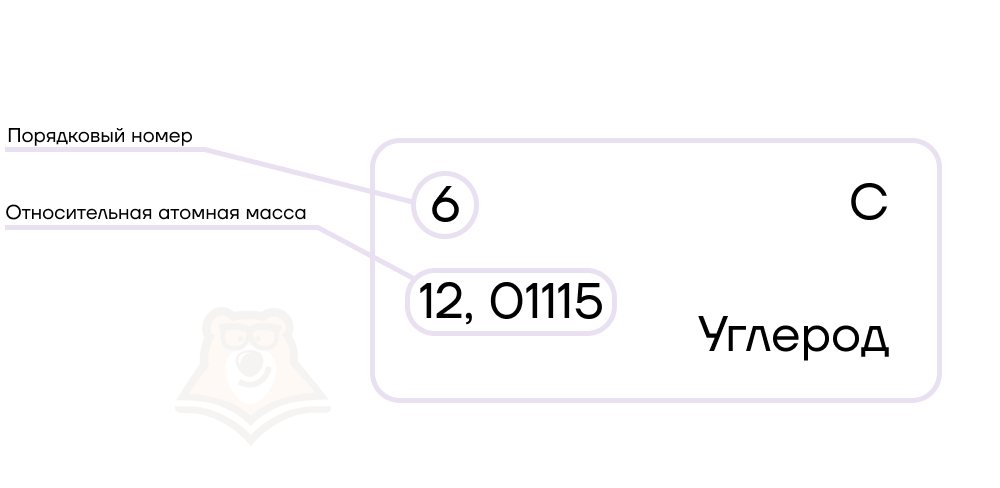
В верхней части ячейки располагается порядковый номер элемента (целое число) — номер элемента в таблице Менделеева по порядку.
Под ним располагается относительная атомная масса (нецелое число) — масса атома данного элемента, выраженная в атомных единицах массы (атомная единица массы (а. е. м.) равна 1/12 массы атома углерода). Относительная атомная масса, округленная до целого числа, называется массовым числом.
Все эти характеристики связаны с количеством элементарных частиц в атоме следующим образом.
- Порядковый номер элемента = число протонов в ядре = заряд ядра атома = число электронов в атоме
(№ элемента = p = Z = ē)
- Число нейтронов = массовое число – порядковый номер
(n = Ar — № элемента)
Разберем на примере углерода. Его порядковый номер — 6, значит, число протонов и электронов равно 6, заряд ядра +6.
Атомная масса равна 12,01115, округлим до 12 и получим массовое число. Тогда количество нейтронов будет равно 12 — 6 = 6.
| Элементарная частица | Как нашли? | Значение |
| Число электронов | Порядковый номер | 6 |
| Число протонов | Порядковый номер | 6 |
| Число нейтронов | Массовое число — порядковый номер | 6 = 12-6 |
Не всегда мы встречаемся только с атомами из таблицы Менделеева, иногда нам попадаются атомы элементов с заданной массой, отличной от табличной. Что это за атомы и как с ними работать? Сейчас узнаем.
Изотопы
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Такие разновидности атома называются изотопами.
Изотопы — атомы одного химического элемента с разной атомной массой, имеющие равное число электронов (е) и протонов (p), но разное число нейтронов (n).
Давайте рассмотрим это на примере атома водорода.
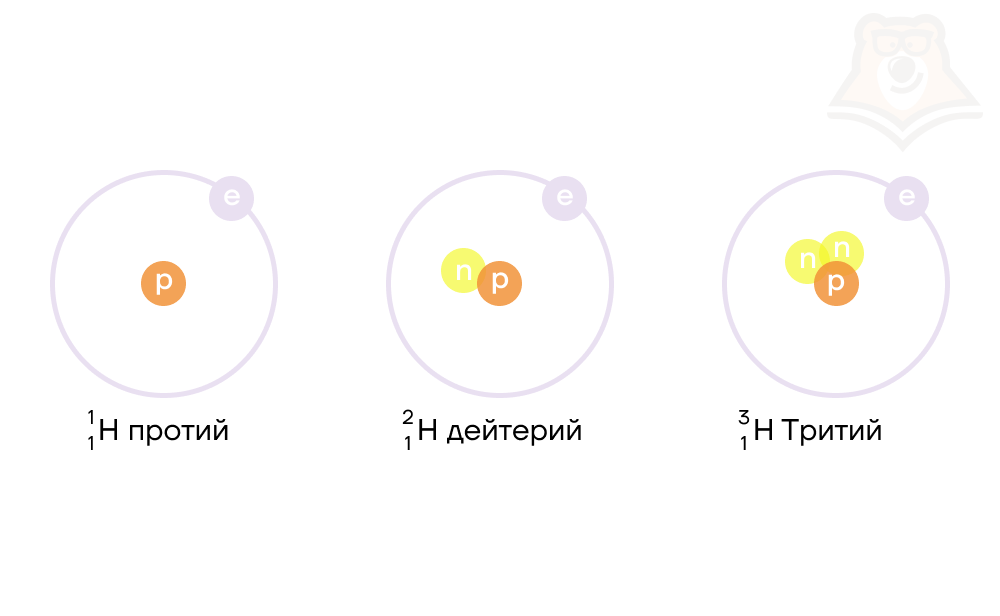
Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 атомная единица массы или а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Все три варианта водорода являются изотопами.
На главную сцену выходит электрон! Поговорим о его уникальных свойствах и разберем одну из самых трудных и интересных тем в химии.
Квантовые числа
У каждого взрослого человека есть жизненно важные документы: паспорт, СНИЛС, медицинский полис и другие. У электрона тоже есть свои важнейшие «документы» — набор квантовых чисел:
- главное квантовое число (n);
- орбитальное квантовое число (l);
- магнитное квантовое число (ml);
- спиновое квантовое число (ms).
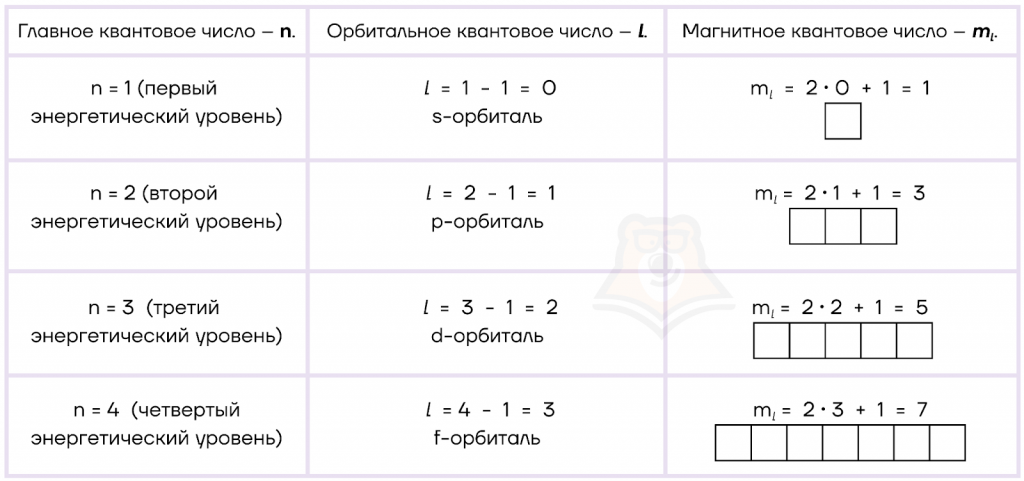
Главное квантовое число (n) характеризует номер энергетического уровня атома.
Главное квантовое число численно равно номеру периода.
Принимает значения: 1, 2, 3,….∞. Однако на сегодняшний день максимальным главным квантовым числом является 7, так как в таблице Менделеева всего 7 периодов. Например, главное квантовое число атома фосфора (P) равно трем, так как этот элемент находится в третьем периоде.
Орбитальное квантовое число (l), или его еще называют побочным квантовым числом, определяет форму атомных орбиталей (траекторий движения электрона).
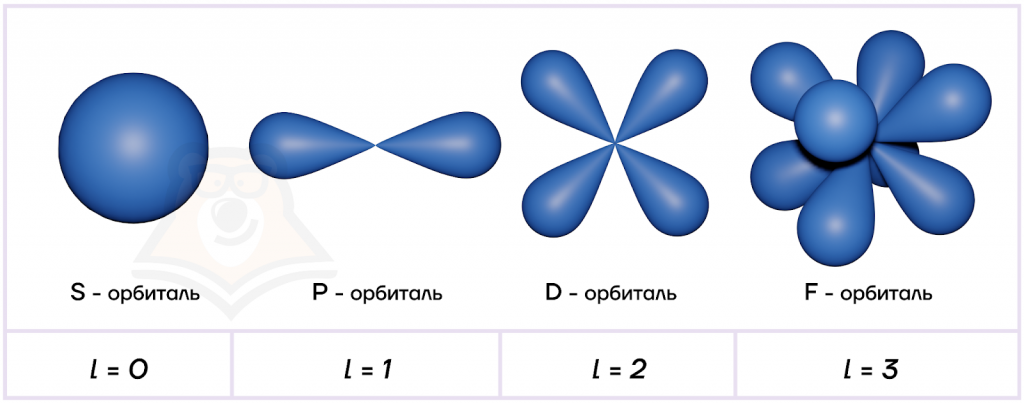
Определить l можно по формуле:
l=n-1, где
n — это главное квантовое число.
Максимально возможное орбитальное число всегда будет на единицу меньше главного квантового числа.

Важно помнить, что количество атомных орбиталей на каждом уровне равно номеру этого уровня.
Например, фосфор, находящийся в третьем периоде, имеет на первом энергетическом уровне одну атомную орбиталь (s), на втором — две (s и p), на третьем — три (s, p и d). То есть атом фосфора имеет три разных по энергии, но одинаковые по форме s-орбитали – на первом, втором и третьем энергетических уровнях.
Магнитное квантовое число (ml) определяет количество атомных орбиталей (ячеек).
Оно рассчитывается по формуле:
ml =2l+1, где
l – это орбитальное квантовое число.
Например, у атома фосфора главное квантовое число n=3; орбитальное квантовое число l=3-1=2 (d-орбиталь); магнитное квантовое число ml =2 · 2+1=5. Таким образом делаем вывод, что на третьем (n) энергетическом уровне у фосфора находится пять (ml) различных по энергии d-орбиталей (l).
Спиновое квантовое число (ms) характеризует собственное движение электрона — спин.
Как мы уже сказали, спиновое квантовое число характеризует движение электрона вокруг ядра атома. То есть атом может двигаться как по часовой, так и против часовой стрелки. Это очень напоминает спиннер (вращающаяся игрушка). Более того, понятия «спиновый» и «спиннер» созвучны, что позволяет без труда вспомнить смысл этого квантового числа.

Электроны на атомной орбитали мы схематично изображаем стрелками вверх (↑) и вниз (↓), обозначая, что они имеют различный спин: для ↑ ms = +½; для ↓ ms = -½. Например, для каждого неспаренного электрона атома фосфора на 3p орбитали ms = +½.
Расчеты главного, орбитального и магнитного квантовых чисел приведены в таблице.
Квантовые числа позволяют нам собрать информацию о строении атома химического элемента, о распределении его электронов, чтобы затем составить «паспорт».
Какой «паспорт» у атомов?
Знания о числе энергетических уровней, форме атомных орбиталей и их количестве изложены в «паспорте» атома. Речь идет о распределении электронов по энергетическим уровням. Такой «паспорт» называется электронной конфигурацией.

Электронная конфигурация — это формула, отражающая распределение электронов по электронным оболочкам атома (энергетическим уровням).
| Как выглядит общежитие у электронов? Пусть электрон — это студент. А где обычно живут студенты? В общаге! Давайте нарисуем общежитие для электронов: — В нем есть отдельные комнаты (орбитали) — максимум 2 электрона. — Блоки с общей кухней, в которые эти комнаты собираются — их мы назовем энергетическими подуровнями. — И целые этажи, в которые собираются отдельные блоки (энергетические уровни). |
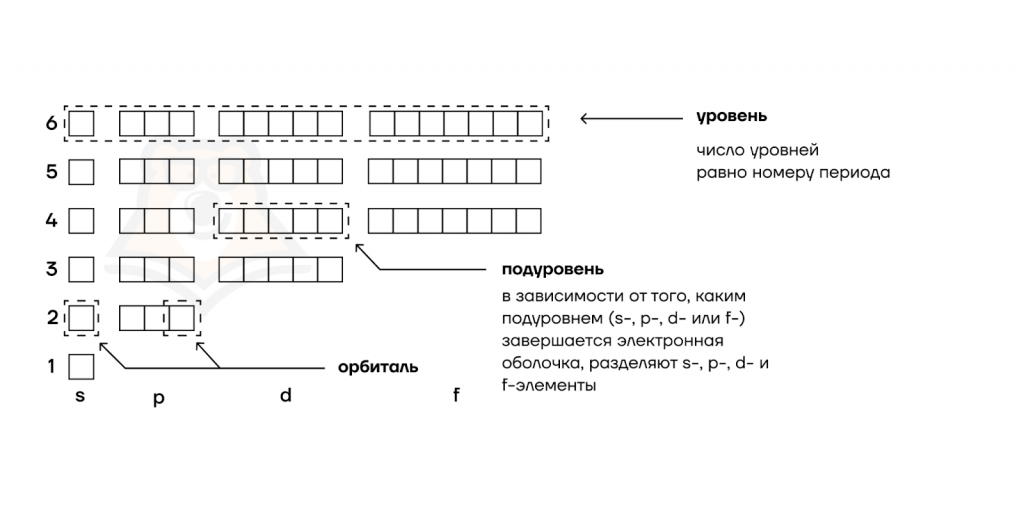
Заполнение орбиталей определяется принципом Паули.
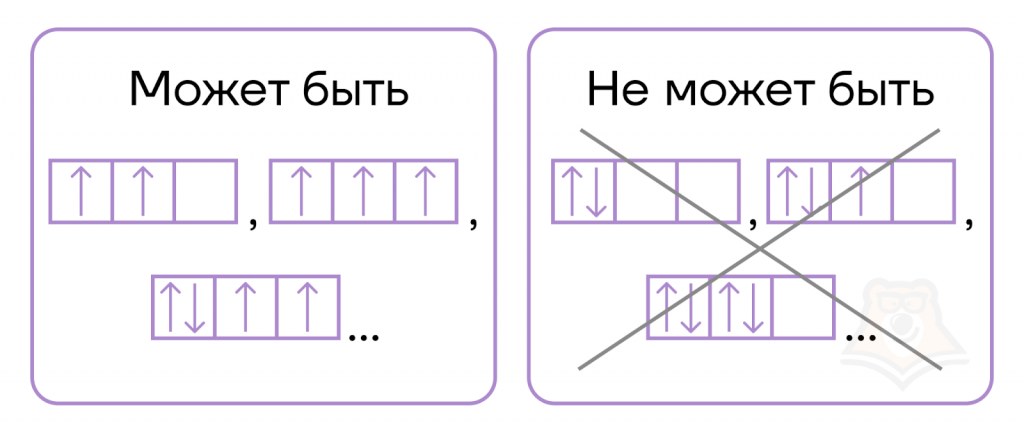
Принцип Паули гласит: «На любой орбитали может быть не более двух электронов, при этом их спины (и заряды) противоположны».
То есть при заполнении орбитали один электрон будет обозначаться ↑, а второй направлен противоположно и обозначается ↓, итого ячейка будет выглядеть вот так:

Заполнение подуровней тоже регулируется определенным образом, согласно правилу Гунда (Хунда):
«Суммарное значение спинового квантового числа электронов на подуровне должно быть максимальным».
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а второй электрон добавляется только после заполнения всех орбиталей хотя бы одним электроном.
Тут все как в общежитии — сначала каждому студенту дают собственную комнату, но если после этого кому-то еще не хватило места, то новый студент подселяется к кому-то со своей комнатой.
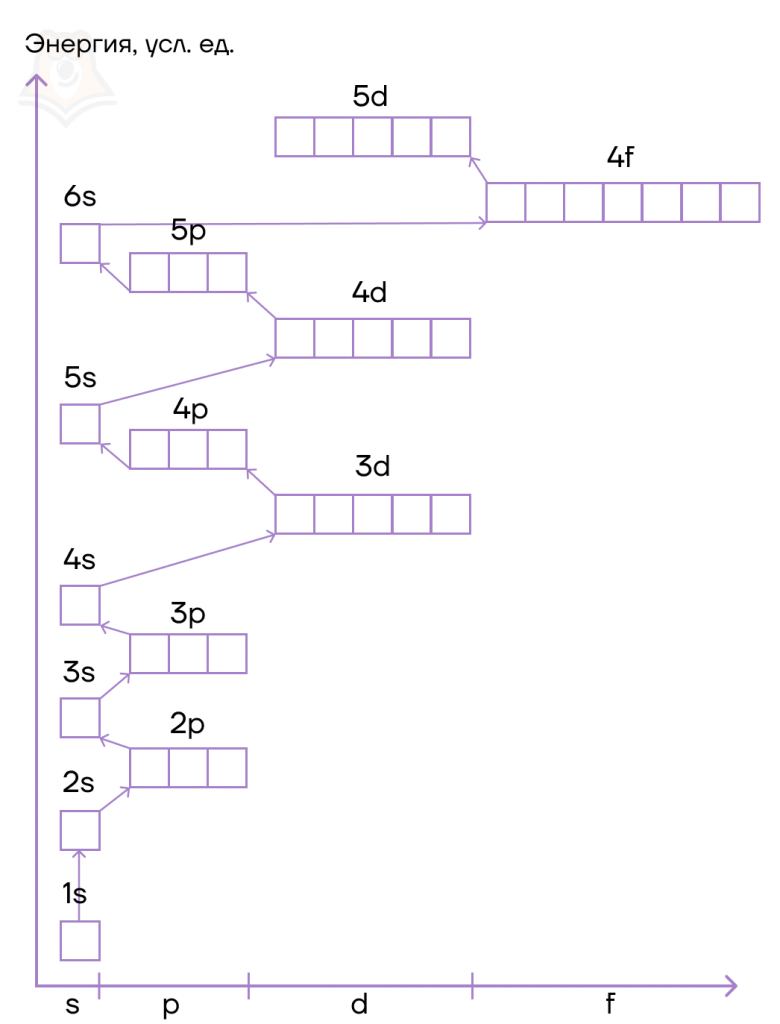
Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → …
Почему так? Данный порядок определяется правилом Клечковского.
- Заполнение электронами атомных орбиталей идет от орбиталей, обладающих меньшим значением суммы главного и орбитального квантового числа (n+l), к орбитали с большим значением суммы.
- Если сумма n+l одинакова, то электрон располагается на орбитали с меньшим значением n, то есть ближе к ядру.
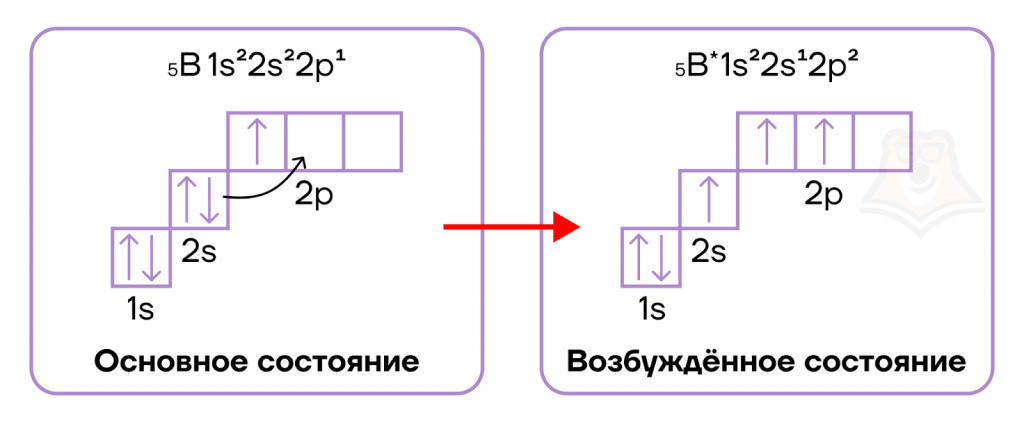
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как «веселое»: в атоме все спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом «поссориться» и «разъехаться» по разным орбиталям.
Тогда атом можно определить как «грустный»: электроны ссорятся, атом грустит. В химии это состояние и называется возбужденным. Такой «развод» возможен только в пределах одного энергетического уровня.
Теперь мы знаем, что такое «паспорт» атома химического элемента. Однако, как расписать электронную конфигурацию иона?
Ион — это заряженная частица, которая образуется в результате отдачи или присоединения электронов атомами или группой атомов.
Анион — отрицательно заряженный ион.
Катион — положительно заряженный ион.
Электронную конфигурацию ионов можно написать по тем же правилам, что и электронную конфигурацию атомов. Однако при этом нужно учесть количество электронов, которое отдает или принимает атом, чтобы верно определить конфигурацию внешнего (последнего) уровня.
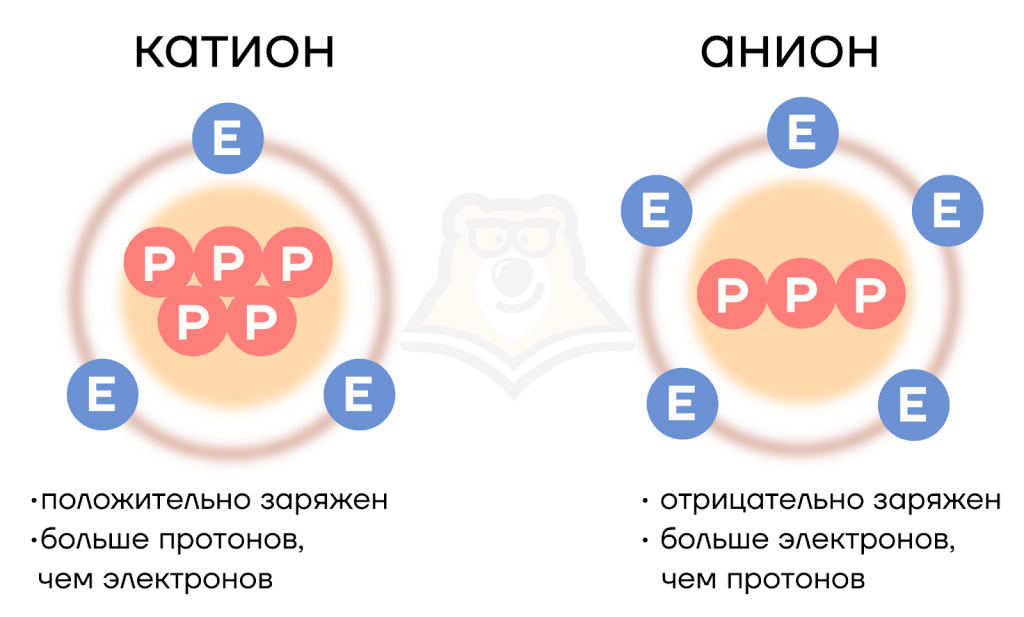
Чтобы легче было запомнить, рассмотрим следующую аналогию: анион своровал электроны, плохо поступил и стал отрицательным персонажем. Воруют, как правило, у кого-то. В данном случае у катиона. Он явно в этой ситуации является положительным персонажем.

Атом может отдать или принять электроны таким образом, чтобы внешний энергетический уровень был максимально заполнен, так как это энергетически выгодно.
Рассмотрим пример с образованием сульфид-аниона S2-.
- Третий энергетический уровень является внешним для атома серы, на нем располагается 6 электронов, 2 из которых являются неспаренными.
- К этим электронам могут добавиться два «соседа», благодаря которым p-подуровень заполняется полностью и обретает стабильную конфигурацию.
- Так как каждый из электронов имеет отрицательный заряд, равный единице, то суммарно после их присоединения к сере образуется сульфид-анион S2-.
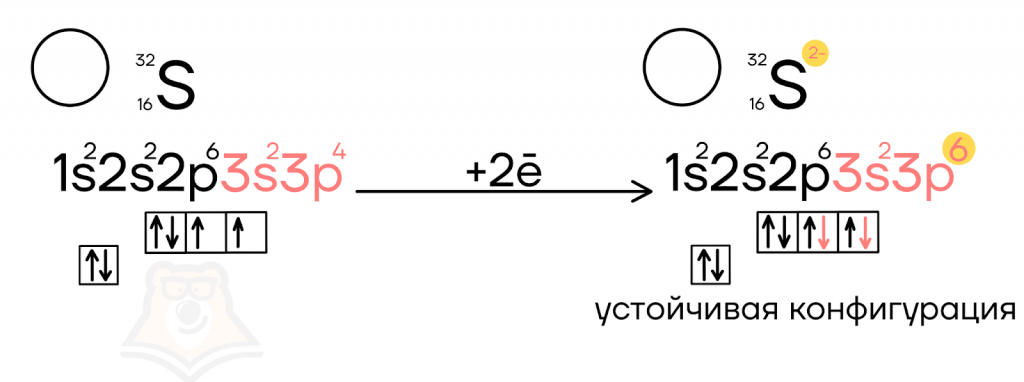
Полностью заполненный подуровень является очень устойчивым. Такую конфигурацию имеют все благородные газы, и к ней стремятся ионы. Однако не стоит забывать, что и полностью пустой подуровень является устойчивым.
Благородные газы — элементы, расположенные в VIIIA группе, имеющие на внешнем энергетическом уровне предельное число электронов — 8.
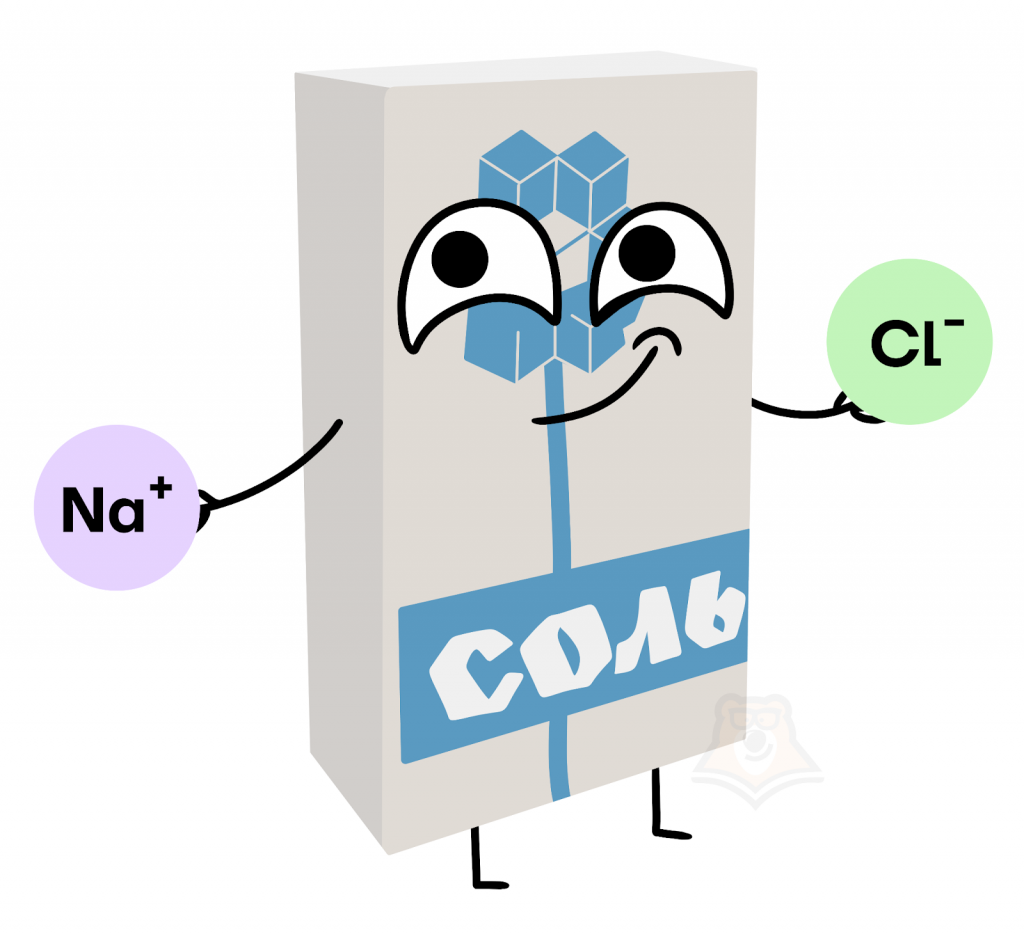
«Всем привет! Я молекула соли с формулой NaCl. Атомы в моем составе имеют заряд: Na+ и Cl–. Как же образовалась моя молекула? Хлору из VIIА группы не хватало всего одного электрона, чтобы стать более устойчивым (иметь на внешнем слое 8 электронов), в то время как у атома натрия из IA группы был лишний электрон, который он был не против отдать, чтобы тоже стать более устойчивым (не иметь электронов на внешнем слое). Передача электрона позволила обоим атомам иметь ту конфигурацию, о которой они мечтали, а также образоваться веществу, которое вы, люди, в обычной жизни зовете поваренной солью».
Почему химические элементы стремятся быть похожими на благородные газы?
Благородные газы, они же как настоящие королевские особы, отличаются от всех остальных атомов своей стабильностью. А стабильность им обеспечивает главное богатство всех атомов — предельное число электронов на внешнем уровне — 8 электронов. Благородные газы находятся в отдельной группе (VIIIA), как короли живут в замках, расположенных отдельно от обычных домов.

Вот мы и узнали, что предел мечтаний всех химических элементов иметь схожую с благородным газом электронную конфигурацию. А теперь можно и попрактиковаться.
Закрепим теорию, решив задание, которое может встретиться в №1 ЕГЭ по химии.
Задание. Из указанных в ряду химических элементов выберите два элемента, которые образуют устойчивый положительный ион, содержащий 10 электронов:
1) Na 2) K 3) N 4) O 5) Cl
Решение:
1) Атом натрия (Na) находится в таблице Менделеева под порядковым номером 11. Следовательно, число электронов равно 11. Чтобы образовать ион, содержащий 10 электронов, атому натрия необходимо отдать один электрон. Если атом отдает электроны, он становится положительно заряженным. Значит, этот вариант ответа подходит.
2) Атом калия (K) находится в таблице Менделеева под порядковым номером 19. Следовательно, число электронов равно 19. Чтобы образовать ион, содержащий 10 электронов, атому калия необходимо отдать девять электронов. Однако максимально атом может отдать только 7 электронов. Значит, этот вариант ответа не подходит.
3) Атом азота (N) находится в таблице Менделеева под порядковым номером 7. Следовательно, число электронов равно 7. Чтобы образовать ион, содержащий 10 электронов, атому азота необходимо принять три электрона. Если атом принимает электроны, он становится отрицательно заряженным. Значит, этот вариант ответа не подходит.
4) Атом кислорода (O) находится в таблице Менделеева под порядковым номером 8. Следовательно, число электронов равно 8. Чтобы образовать ион, содержащий 10 электронов, атому кислорода необходимо принять два электрона. Если атом принимает электроны, он становится отрицательно заряженным. Значит, этот вариант ответа не подходит.
5) Атом хлора (Cl) находится в таблице Менделеева под порядковым номером 17. Следовательно, число электронов равно 17. Чтобы образовать ион, содержащий 10 электронов, атому хлора необходимо отдать семь электронов. Если атом отдает электроны, он становится положительно заряженным. Значит, этот вариант ответа подходит.
Ответ: 15
Мы разобрались с тем, что элементы стремятся полностью заполнить внешний энергетический уровень, либо оставить его пустым. А что же такого особенного в этом внешнем слое? На внешнем энергетическом уровне располагаются особенные валентные электроны.
Валентные и неспаренные электроны
Валентные электроны — электроны, способные участвовать в образовании химических связей.
Представим вкусный большой многослойный ягодный торт. Каждый слой — своего рода уровень. На слоях располагаются ягоды, они же электроны. Но самые вкусные (валентные) всегда располагают сверху на торте. То есть валентные электроны могут быть как на внешнем (в качестве украшения торта), так и на предвнешнем (верхнем бисквитном слое) энергетическом уровне.
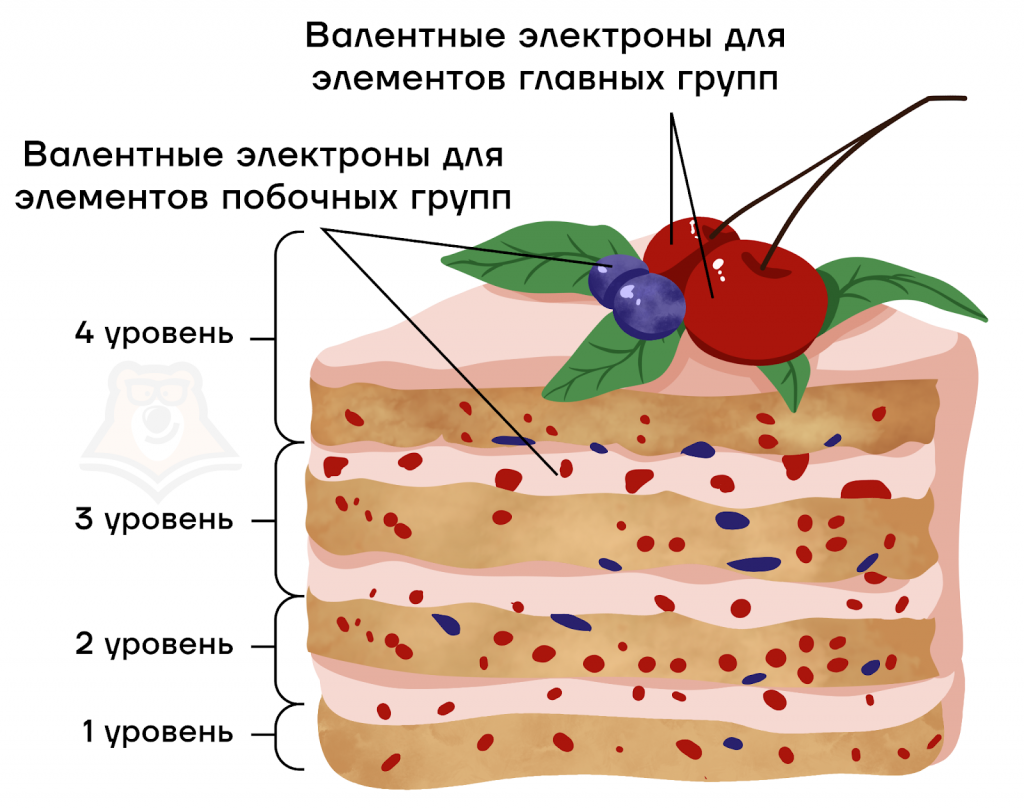
Поэтому важно научиться определять количество валентных электронов для различных элементов:
- для элементов главных подгрупп — это все электроны внешнего уровня;
- для элементов побочных подгрупп — это электроны внешнего слоя и предвнешнего d-подуровня.
Среди валентных электронов есть как спаренные электроны, так и неспаренные.
Неспаренными называют электроны, которые находятся поодиночке на орбитали атома, соответственно, спаренные — всегда вдвоем.
Например, у атома водорода один неспаренный электрон на внешнем энергетическом уровне, а вот у атома гелия неспаренных электронов уже нет, но так как оба они находятся на внешнем (и в данном случае единственном) энергетическом уровне, они будут валентными.

Запоминалка: существует последовательность чисел, которая позволяет определить количество неспаренных электронов для атомов главных подгрупп: 1-0-1-2-3-2-1-0.
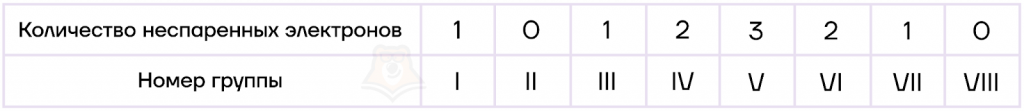
Таким образом, все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными.
Разберем еще один пример задания №1 ЕГЭ по химии.
Задание. Определите, атомы каких из указанных в ряду элементов имеют одинаковое количество неспаренных электронов.
1) Li 2) Ca 3) N 4) Ne 5) H
Решение. Чтобы решить задание, нужно вспомнить последовательность чисел, которая позволяет определить количество неспаренных электроновдля атомов главных подгрупп: 1-0-1-2-3-2-1-0.
Li — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.
Ca — элемент IIA группы (1-0-1-2-3-2-1-0), значит, у него нет неспаренных электронов.
N — элемент VA группы (1-0-1-2-3-2-1-0), значит, у него три неспаренных электрона.
Ne — элемент VIIIA группы (1-0-1-2-3-2-1-0), значит, у него нет неспаренных электронов.
H — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.
Ответ: 15
Строение атома — это тема, с которой всегда начинают познание химии, потому что приступать к изучению химических свойств веществ можно только с пониманием поведения элементарных частиц на атомарном уровне. Изучить тему подробнее и разобрать все ее тонкости поможет статья «Особенности строения электронных оболочек атомов переходных элементов».
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны характеризуются 4 квантовыми числами: n — главное квантовое число, l — орбитальное квантовое число, ml — магнитное квантовое число, ms — спиновое квантовое число.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Атом стремится обладать наиболее устойчивой электронной конфигурацией, при которой внешний энергетический уровень/подуровень является заполненным. Если к нейтральному атому добавить электроны, то он превращается в анион, если же у него отобрать электроны — образуется катион.
- Для элементов главных подгрупп валентными являются все электроны внешнего уровня. Для элементов побочных подгрупп — это электроны внешнего слоя и предвнешнего d-подуровня.
Проверь себя
Задание 1.
Из чего состоит ядро атома?
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
Количество каких элементарных частиц отличается у изотопов?
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Сколько электронов может максимально находиться на 3 энергетическом уровне?
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Задание 4.
Какой из энергетических уровней можно назвать внешним?
- Первый энергетический уровень
- Последний энергетический уровень
- Энергетический уровень с наименьшей энергией
- Любой энергетический уровень
Задание 5.
Чему равно количество валентных электронов для элементов главных подгрупп?
- Номеру группы
- Номеру периода
- Порядковому номеру элемента
- Массовому числу элемента
Ответы: 1. — 1; 2. — 2; 3. — 2; 4. — 2; 5. — 1


 к списку статей
к списку статей





