Теория строения органических соединений
На этой странице вы узнаете
- «Многоликие» изомеры — что это такое?
- Как ядовитые кислоты помогли науке?
Звезды на небе посчитать невозможно — их количество бесконечно, так и органических соединений — огромное множество. На данный момент очень сложно подсчитать их количество, известно больше 35 млн веществ, и постоянно открываются новые. Даже мы с вами на 34% состоим из органических веществ.
Почему так много? Атомы углерода способны: образовывать цепи абсолютно различной длины, образовывать циклы и создавать разветвленные цепи, между ними могут быть реализованы не только одинарные, но и двойные, и тройные связи. Чтобы не возникало путаницы во всем этом, уже более 150 лет существует теория строения органических соединений, о которой мы поговорим подробнее в этой статье.
Теория Бутлерова — фундамент для «стройки» органических молекул
С развитием химии у ученых во всем мире начали появляться вопросы. Почему всего несколько элементов способны образовать такое большое число веществ? И почему вещества с одинаковой формулой имеют разные свойства? Со временем вопросов стало так много, что появилась необходимость как-то их систематизировать и дать ответы.

Так, в 1861 году на химической секции Съезда немецких естествоиспытателей и врачей в Шпейере русский ученый А.М. Бутлеров впервые ввел понятие «химическое строение» и ввел положения для определения строения молекул. Эти положения вошли в историю как основа и фундамент для дальнейшего развития органической химии. Рассмотрим их подробнее.
1 положение
Атомы в молекулах веществ соединены согласно их валентности. Углерод в молекулах органических веществ всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя самые разнообразные цепи.
Вспомним, что валентность — это число химических связей, которые образует атом элемента в соединении. Например, валентность водорода всегда равна I, значит, он может присоединить к себе лишь один какой-нибудь атом. А валентность кислорода в большинстве случаев — II, соответственно, он может образовать общую связь с двумя другими атомами, или двойную связь с одним атомом.
Число связей, которые может образовывать атом, равно числу его неспаренных электронов, идущих на образование общих электронных пар. Атом углерода в органических веществах находится в возбужденном состоянии: электронная пара на 2s-подуровне распаривается, один из электронов «переезжает» в свободную орбиталь на 3p-подуровне, неспаренных электронов становится четыре. За счет этих четырех неспаренных электронов атом углерода и образует в органических веществах ВСЕГДА четыре химические связи:

Строение химического вещества в органике выражается структурной формулой.

Это пример развернутой структурной формулы молекулы пропана, где черточками показаны химические связи между всеми атомами. Здесь явно видно, что углерод может иметь ровно 4 связи, ни больше, ни меньше.
Но, так сказать, «в быту», при составлении уравнений реакций, решении задач мы используем сокращенные структурные формулы — просто записываем количество атомов водорода, соединенных с конкретным атомом углерода: CH3-CH2-CH3.
2 положение
Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекулах, то есть химическим строением вещества.
Изомеры — это вещества, которые имеют одинаковый качественный и количественный состав (то есть одинаковую молекулярную формулу), но разное химическое строение.
| «Многоликие» изомеры — что это такое? Органика уникальна тем, что по одной молекулярной формуле чаще всего мы не можем сказать, что это за вещество, предугадать его свойства и прочее. Под одной «маской» может скрываться десяток соединений. Такие соединения называются изомерами. Например, в разных изомерах двойная связь может находиться при любом атоме C, радикалы могут также находиться у разных атомов C, да и сама структура вещества может быть вообще зациклена. |
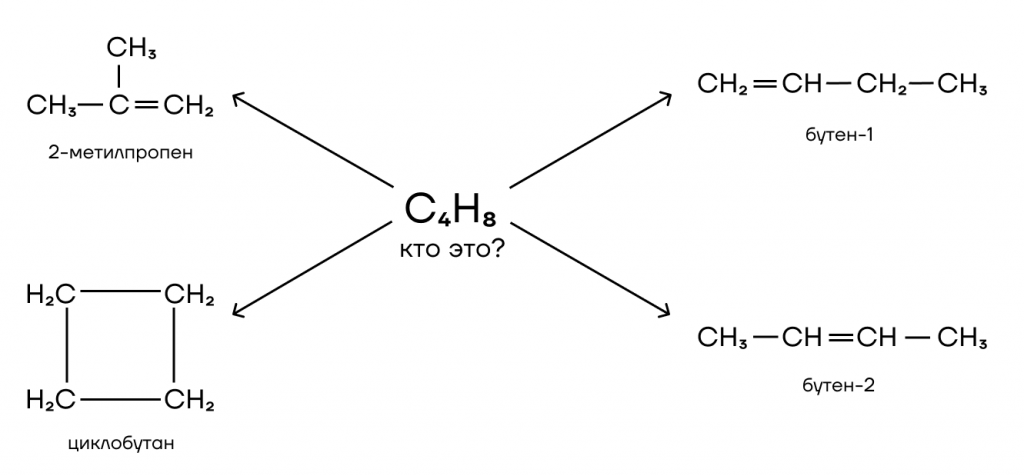
То есть формуле C4H8 соответствует целых 4 вещества с разными названиями. Это важно, ведь все эти вещества имеют разные химические свойства и относятся к разным группам веществ.
Существует несколько видов изомерии, каждый из которых мы рассмотрим ниже.
- Структурная изомерия основана на разном порядке соединения атомов углерода. Внутри структурной изомерии различают несколько видов:
- Изомерия углеродного скелета. Основой нашего организма является костный скелет, таким же образом и у органических веществ основой является скелет, только углеродный. Если все атомы C связаны не более чем с двумя другими атомами C, то такой скелет называется неразветвленным.
Если же атом C связан с тремя или четырьмя другими атомами C, то такой скелет называется разветвленным.

- Изомерия положения: кратной связи и функциональной группы.


- Межклассовая изомерия. Органические вещества постоянно пытаются нас запутать, изомерами могут быть даже вещества разных классов.
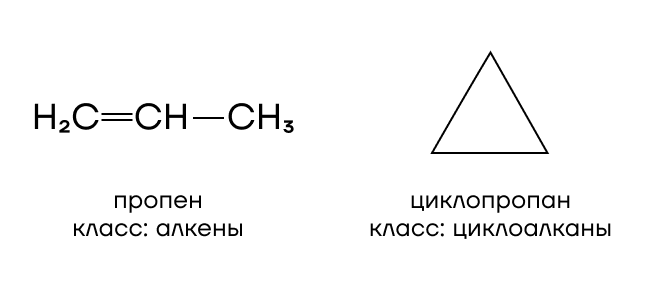
Список межклассовых изомеров:
CnH2n: алкены, циклоалканы;
CnH2n+2: алкины, алкадиены, циклоалкены;
CnH2n+2O: спирты, простые эфиры;
CnH2nO: альдегиды, кетоны;
CnH2nO2: карбоновые кислоты, сложные эфиры;
CnH2n+1NO2: аминокислоты, нитросоединения.
Важно! Алканы не имеют межклассовых изомеров.
- Пространственная изомерия основывается на положении атомов в пространстве. Различают также несколько видов:
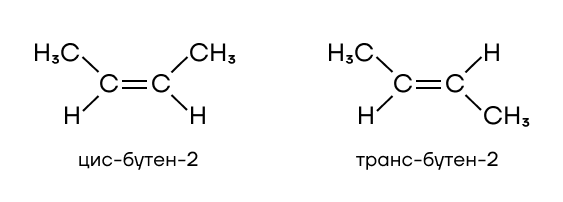
- Геометрическая изомерия. Характерна для соединений, которые содержат двойную связь. В цис-бутене-2 метильные группы находятся с одной стороны от двойной связи, а в транс — с разных.
- Оптическая изомерия. Характерна для веществ, где атом C имеет 4 разные функциональные группы (хиральный атом). Такие изомеры, словно наша левая и правая рука, являются зеркальными отражениями друг друга.

| Как ядовитые кислоты помогли науке? В XIX веке при исследовании ядовитой циановой кислоты HOCN и гремучей кислоты HCNO, ученые заметили, что они имеют разные химические свойства, но одинаковую молекулярную формулу, тогда и был предложен термин — изомерия. |
3 положение
Свойства органических веществ зависят не только от качественного и количественного состава и химического строения вещества (то есть порядка соединения атомов в молекуле), но еще и от взаимного влияния атомов и групп друг на друга.
Взаимное влияние заключается в смещении электронной плотности между химическими связями.
Электронные эффекты — смещение электронной плотности в молекуле, ионе или радикале под влиянием заместителей. Заместителем считается любой атом (кроме водорода) или группа атомов, связанные с атомом углерода.
Существуют два электронных эффекта: индуктивный эффект и мезомерный эффект.
Рассмотрим отдельно каждый из них.
- Индуктивный эффект — смещение электронной плотности в сторону более электроотрицательного атома вдоль сигма-связей.
- Заместители, вызывающие отрицательный индуктивный эффект, являются электроноакцепторами: -NO2, -CN, -COOH, -F, -Cl, -Br, -I, -COOR, -COR, -OR, -OH, -NH2, -Ar.
- Заместители, вызывающие положительный индуктивный эффект, являются электронодонорами: -CR3, -CHR2, -CH2R, -CH3.
Пример влияния индуктивного эффекта: присоединение галогеноводородов не по правилу Марковникова.
- Мезомерный же эффект действует в сопряженных системах, когда чередуются одинарные и кратные связи (как в молекуле бензола) уже вдоль пи-связей.
- Заместители, вызывающие отрицательный мезомерный эффект: -NO2, -CN, -COOH, -COOR, -CONH2.
- Заместители, вызывающие положительный мезомерный эффект: -NH2, -OH, -F, -Cl, -Br.
С мезомерным эффектом мы встречаемся, когда посылаем ориентанты 1 и 2 рода в соответствующие им положения в бензольном кольце.
Фактчек
- Органических соединений насчитывается более 35 млн. Для их описания была создана теория строения органических соединений.
- Первое положение гласит, что атомы в молекулах веществ соединены согласно их валентности, причем у углерода постоянная валентность IV.
- Второе положение гласит, что свойства веществ определяются порядком соединения атомов в молекулах.
- Существуют вещества, которые имеют одинаковый качественный и количественный состав, но разное химическое строение. Такие соединения называют изомерами.
- Третье положение гласит, что свойства органических веществ зависят не только от качественного и количественного состава и химического строения вещества, но и от взаимного влияния атомов и групп друг на друга.
Проверь себя
Задание 1.
Чему равна валентность углерода в органических соединениях?
- I
- II
- III
- IV
Задание 2.
Какая пара веществ является изомерами?
- метан и пропан
- бутан и изобутан
- этан и этилен
- 2-метилпентан и гептан
Задание 3.
Какой класс органических соединений не имеет межклассовых изомеров?
- алкины
- алкены
- алканы
- арены
Задание 4.
Сколько типов электронных эффектов существует?
- 1
- 2
- 3
- 4
Ответы: 1. — 4; 2. — 2; 3. — 3; 4. — 2.


 к списку статей
к списку статей





