Амфотерные металлы: цинк и алюминий
На этой странице вы узнаете
- Почему и как алюминий применяется в пищевой промышленности?
- Как цинк помогает нам жить?
- На вес золота: почему алюминий когда-то был ценнее драгоценных металлов?
Кто-то любит чай, кто-то любит кофе, а кто-то — и то, и другое. То же самое происходит и с амфотерными металлами — они реагируют как с кислотами, так и с основаниями. Таких металлов очень много. Сегодня мы с вами рассмотрим подробнее лишь два из них: алюминий и цинк. Наливайте себе чашечку любимого горячего напитка и будем начинать.

Характеристика амфотерных металлов
Итак, амфотерных металлов очень много. Их порядковые номера в периодической таблице: 4, 13, с 22 по 32, с 40 по 51, с 72 по 84, со 104 по 109. Как мы видим, «разброс» действительно очень большой. Что же между ними общего?
- Они все металлы, то есть химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
О том, что такое восстановительные свойства, можно прочитать в статье «Окислительно-восстановительные реакции». - Так как они металлы, значит, в виде простых веществ обладают характерными металлическими свойствами:
- высокие тепло- и электропроводность;
- высокая пластичность;
- ковкость;
- характерный металлический блеск.
Теперь нам важно вспомнить, что металлы в зависимости от валентности (способности составлять определенное число химических связей) могут образовывать разные соединения. Это — основные, амфотерные и кислотные оксиды. Предсказать свойства оксида металла поможет эта схема:

Основные свойства отражают способность вещества взаимодействовать с кислотами, кислотные — способность реагировать с основаниями.
А, как вы уже могли догадаться, с понятием амфотерности мы разберемся сегодня.
Амфотерность — это способность веществ взаимодействовать как с соединениями, проявляющими кислотные свойства, так и с соединениями, проявляющими основные свойства, в зависимости от условий и природы реагентов, участвующих в реакции.
Как и мы порой делаем сложный выбор, так и амфотерные металлы зачастую не могут сразу определиться.
Амфотерными также будут являться и соединения таких металлов: оксиды (соединения с кислородом в степени окисления -2) и гидроксиды (соединения с ОН-группой).
Список амфотерных металлов включает в себя множество наименований. Мы сегодня рассмотрим цинк и алюминий, которые чаще всего встречаются на экзамене. Они почти как двойники — имеют общие химические и физические свойства, но также обладают некоторыми отличиями.

Начнем с химических характеристик алюминия.
Химические характеристики алюминия
Алюминий:
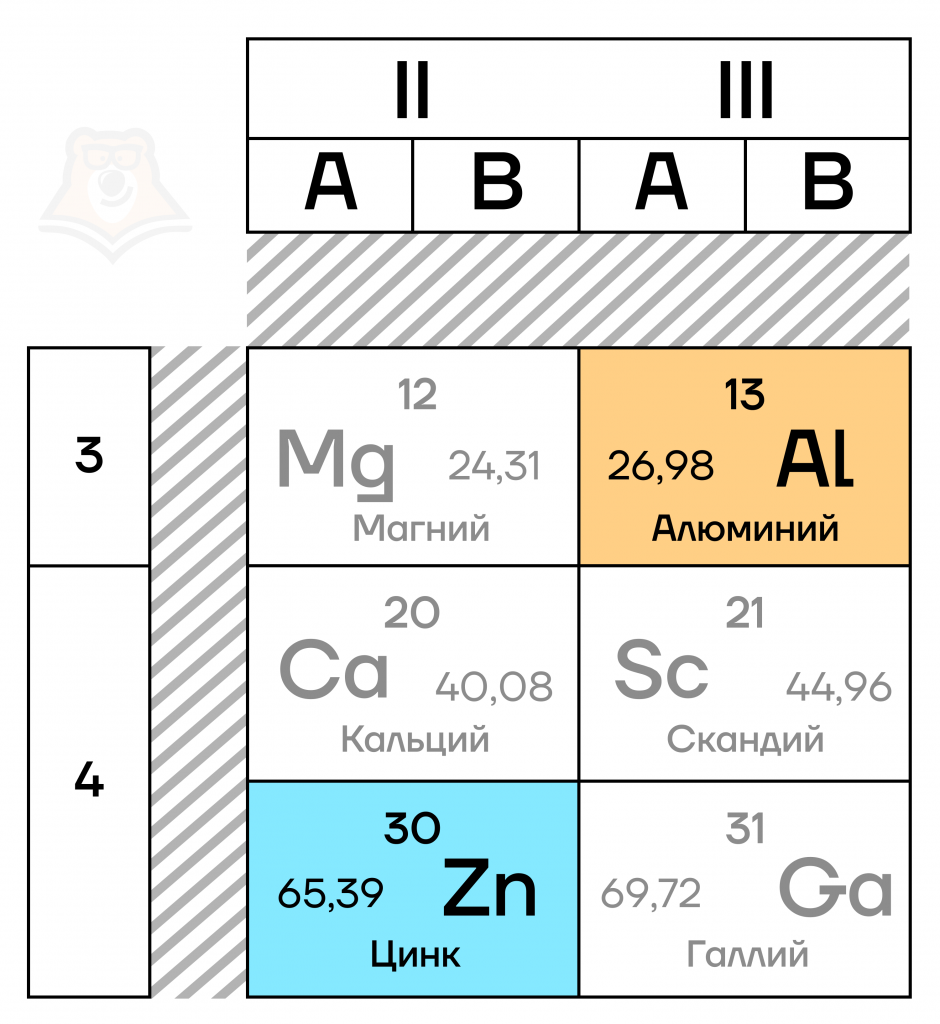
- Элемент IIIA группы третьего периода Периодической таблицы химических элементов Д.И. Менделеева (порядковый номер — 13).
- Относится к p-элементам – элементам, имеющим свободные электроны на p-подуровне, подробнее об этом можно прочитать в статье «Особенности строения электронных оболочек атомов переходных элементов».
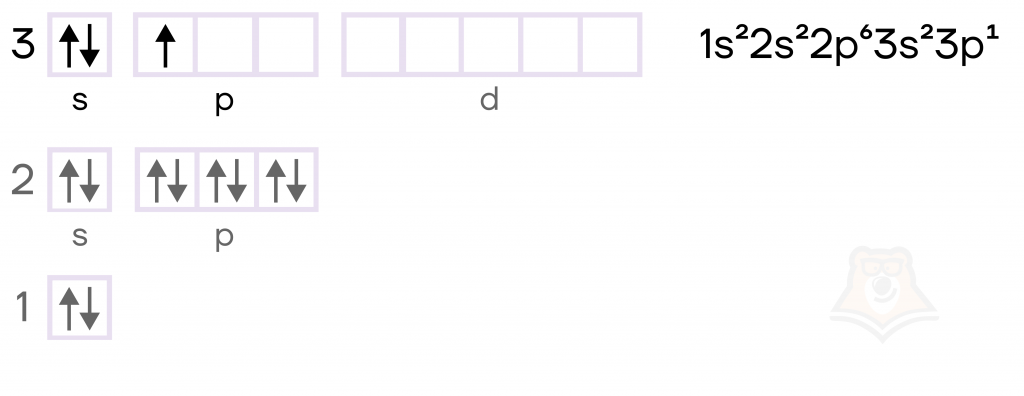
- Его электронная конфигурация, то есть порядок расположения электронов по различным электронным оболочкам атома, в основном состоянии имеет вид [Ne]3s23p1.
Уточним, что означает запись [Ne]3s23p1. Электронная конфигурация — это формула расположения электронов в атоме по электронным уровням. У каждого элемента она своя. Поскольку алюминий является элементом третьего периода, у него будут полностью заполнены 1 и 2 электронные уровни. И для того, чтобы каждый раз не писать электроны на этих уровнях, мы записываем вместо этого в квадратных скобках название ближайшего к элементу благородного газа (элемента VIIIА группы, у которого все электронные уровни полностью заполнены). Соответственно, для алюминия это неон — Ne.
А теперь давайте вспомним, что у атома любого химического элемента бывает два состояния: возбужденное и основное.
Возбужденное состояние — это нестабильное состояние атома, при котором некоторые электронные пары распариваются, и электроны переходят на более высокие энергетические уровни (в пустые клеточки при записи электронной конфигурации).
Основное состояние — это более стабильное состояние атома, при котором электроны образуют устойчивую конфигурацию (спокойно «сидят» на своих местах и никуда не перескакивают).
Основное состояние атома можно сравнить с тем, как человек лежит на кровати — когда мы лежим, мы не совершаем никакой работы, находимся в положении минимальной энергии. При этом, чтобы встать, нам нужно затратить какую-то энергию, задействовав наши мышцы, — это можно сравнить с возбужденным состоянием атома.
В возбужденном состоянии электронная пара на 3s-орбитали алюминия распаривается, то есть один электрон остается на s-подуровне, а второй переходит на свободную орбиталь p-подуровня. В результате образуются три неспаренных (валентных или свободных) электрона, которые с радостью готовы соединиться с каким-нибудь подходящим атомом. Поэтому у алюминия постоянная степень окисления +3 (условный заряд атома в соединении).
Для лучшего запоминания химических характеристик алюминия решим пример задания №1 ЕГЭ по химии, так как при его решении может пригодиться информация об электронной конфигурации и степени окисления алюминия.
Задание. Определите, какие два из указанных элементов образуют устойчивый катион, содержащий 10 электронов.
Ряд химических элементов: 1) Na 2) K 3) Al 4) N 5) Li
Решение.
Шаг 1. Для решения данного типа задания нужно записать электронные конфигурации атомов всех указанных элементов, где в верхних индексах как раз указываем количество электронов на каждом энергетическом подуровне:
1) Na: 1s2 2s2 2p6 3s1, всего 11 электронов.
2) K: 1s2 2s2 2p6 3s2 3p6 4s1, всего 19 электронов.
3) Al: 1s2 2s2 2p6 3s2 3p1, всего 13 электронов.
4) N: 1s2 2s2 2p3, всего 7 электронов.
5) Li: 1s2 2s1, всего 3 электрона.
Шаг 2. Вспомним, что катион — положительно заряженная частица. Чтобы им стать, химический элемент должен отдать электроны (отрицательно заряженные частицы) с внешнего энергетического уровня. Таким образом, атом приобретет положительный заряд, количество электронов на внешнем уровне будет уменьшаться, а степень окисления будет увеличиваться на количество отданных электронов.
Чтобы в итоговом катионе было 10 электронов, нужно, чтобы в самом атоме химического элемента было больше 10 электронов. Тогда:
— Варианты ответа (4) — азот, у которого всего 7 электронов, и (5) — литий с его 3-мя электронами отбрасываем сразу.
— У (2) — калия всего 19 электронов. Но на внешнем (валентном) уровне у него только один, который он способен отдать. Его катион содержит 19-1=18 электронов, а нам нужно ровно 10, поэтому мы взять его не можем.
Остаются (1) натрий и (3) алюминий.
Для натрия характерна степень окисления +1. Следовательно, для образования катиона он отдает 1 электрон, в результате чего у него остается 10 электронов, вариант подходит.
Алюминий имеет постоянную степень окисления +3, он может отдать три электрона, тогда его катион тоже будет содержать 10 электронов, поэтому он также подходит.
Ответ: 13

Разобрав химические характеристики алюминия, можем перейти к характеристикам его двойника — цинка, именно в этом разделе мы увидим первое различие между ними.
Химические характеристики цинка
Цинк:
- Элемент IIВ группы четвертого периода (порядковый номер — 30).
- Относится к d-элементам (элементам, имеющим электроны на d-подуровне), при этом атом цинка имеет полностью заполненные 3d– и 4s– электронные подуровни.
- Электронная конфигурация цинка в основном состоянии имеет вид [Ar]3d104s2.
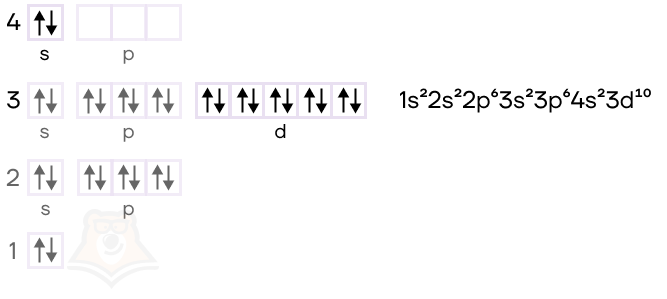
В возбужденном состоянии электроны с 4s-подуровня распариваются: электронная пара разделяется, и один электрон уходит на 4p-подуровень, а второй остается на 4s. Таким образом, мы получаем 2 неспаренных электрона, благодаря которым атом может образовывать связи. В соединениях цинк проявляет постоянную степень окисления +2.
На данный момент мы можем выделить следующие различия между алюминием и цинком:
- имеют различные электронные конфигурации,
- проявляют разные степени окисления.
Может показаться, что металлы не так уж и похожи, но чтобы лучше разобраться в их сходстве, изучим их физические свойства, а начнем опять с алюминия.
Физические свойства алюминия
Данный металл является самым распространенным в земной коре металлом, из него делают тысячи вещей, которые окружают нас в быту: от фольги на баночке йогурта до стильного корпуса смартфона. Благодаря чему же он такой востребованный?
- Легкий серебристо-белый металл, покрывающийся на воздухе оксидной пленкой из-за взаимодействия с кислородом: с одной стороны, оксидная пленка защищает алюминий от воздействия окружающей среды, но с другой стороны для использования самого металла ее необходимо снять.
- Обладает высокой электропроводностью — способностью проводить электрический ток.
- Легко плавится (переходит из твердого состояния в жидкое).
- Кроме всего вышеперечисленного, огромным плюсом является его экологичность.

| Почему и как алюминий применяется в пищевой промышленности? Данный металл полностью соответствует критериям экологичного материала: — Нетоксичный — не вредит живым организмам. — Практичный — легкий, устойчивый к коррозии и достаточно прочный. — Универсальный — благодаря вышеупомянутым свойствам может найти применение во всех отраслях. Алюминий находит свое применение не только в упаковке, но и в приготовлении пищи: например, формы для запекания, кастрюли и сковородки, пищевая фольга и многое другое тоже сделаны из алюминия. Использование алюминия в пищевой промышленности позволяет увеличить срок годности продуктов, защитить пищу от бактерий и окисления, уменьшить стоимость транспортировки и даже улучшить внешний вид, так как на фольгу хорошо наносится краска. А вот шапочка из фольги, несмотря на все уверения из интернета, вещь бесполезная, а иногда даже опасная… |
Продолжая наше сравнение, посмотрим на физические свойства цинка.
Физические свойства цинка
- Голубовато-белый металл.
- Используется в машиностроении, поскольку является устойчивым к коррозии (разрушению металла) — его используют при покрытии деталей для предотвращения их ржавления и порчи.
- Также цинк является микроэлементом, необходимым для нормального функционирования человеческого организма, поэтому его можно встретить и в сфере производства лекарств.

| Как цинк помогает нам жить? Цинк принимает участие во множестве процессов, происходящих в организме человека: — он поддерживает хорошее состояние кожи и сосудов; — улучшает рост и силу волос; — заживляет раны; — важен при лечении глазных заболеваний и диабета. Цинк также может спасти человека при отравлении тяжелыми металлами, поскольку он «связывается» с ними и выводит их из организма. При дефиците цинка наблюдается ломкость волос и ногтей, ухудшение общего самочувствия и многие другие неприятные симптомы. Лучшей профилактикой дефицита цинка является правильное питание, наибольшее количество цинка содержится в орехах, семенах и морепродуктах. |

Цинк и алюминий имеют схожие физические свойства, но эти два металла находят применение в различных отраслях:
- алюминий используется в пищевой промышленности, авиастроении и металлургии;
- цинк находит свое применение в фармацевтической отрасли и машиностроении.
С физическими свойствами мы познакомились, но остался нерешенным один вопрос — как же эти металлы получают? Каковы особенности этого процесса? Ответ кроется в следующем разделе.
Способы получения алюминия
Для начала вспомним, что в зависимости от степени активности металла могут применяться различные способы получения.
Для того, что понять, какой металл будет активным, а какой нет, вспомним, что такое ряд активности металлов.
Ряд активности металлов — это ряд, использующийся на практике для относительной оценки химической активности металлов в реакциях с водными растворами солей и кислот.
Таким образом, чем ближе металл к началу этого ряда, тем активнее он проявляет себя в упомянутых в определении реакциях.
Элементы этого ряда условно подразделяют на:
- активные металлы;
- металлы средней активности;
- неактивные металлы.

В зависимости от активности металла, способы получения будут различными:
- для активных металлов применяется электролиз расплава солей и некоторые иные реакции, используемые только для отдельных элементов, как, например, электролиз оксида алюминия в расплаве криолита;
- для металлов средней активности и неактивных используется электролиз растворов солей;
- для некоторых металлов возможно получение через реакции восстановления.
Для активных металлов, в том числе алюминия, при электролизе водного раствора солей идет электролиз воды с образованием водорода на катоде, сам металл не выделяется, поэтому электролиз раствора нам не подойдет. Обычно мы получаем активные металлы путем электролиза солей в расплаве, но для получения алюминия используется иной, особенный способ — электролиз оксида алюминия в расплаве криолита.
Криолит — это алюминийсодержащий минерал с формулой Na3[AlF6].
Если нам попадется задание на получение алюминия, то мы не задумываемся и всегда выбираем именно этот способ получения.
Для этой реакции необходимо нагревание и пропускание электрического тока:
2Al2O3 (t, эл. ток) = 4Al + 3O2
| На вес золота: почему алюминий когда-то был ценнее драгоценных металлов? В 19 веке цена на алюминий превышала стоимость золота. И все это из-за сложности получения металла без примесей. По приказу Наполеона III были изготовлены алюминиевые столовые приборы, которые подавались на торжественных обедах императору и самым почетным гостям. Остальные гости при этом пользовались приборами из иных драгоценных металлов вроде золота и серебра. В те времена каждая парижская модница непременно должна была иметь в своем наряде хотя бы одно украшение из алюминия — металла, ценившегося в то время выше серебра и золота. |
Способы получения цинка
- Электролиз раствора солей.
Со способом получения металлов средней и низкой активности путем электролиза растворов солей мы познакомились в статье «Электролиз расплавов и растворов (солей, щелочей, кислот)».
Цинк, в отличие от алюминия, относится к металлам средней активности, поэтому для его получения используют электролиз раствора соли, например, Zn(NO3)2.
Важно помнить, что для металлов средней активности, помимо электролиза соли, происходит еще и электролиз воды. Давайте подробнее разберем уравнение электролиза.
- На катоде у нас будет происходить восстановление металла и водорода из воды:
Zn2+ + 2ē = Zn
2Н2О + 2ē = 2H2 + OH—
- На аноде у нас также пойдет электролиз воды:
2H2O — 4ē ⟶ O2 + 4H+
- Часть катионов (положительно заряженных ионов) водорода прореагирует с гидроксогруппой (OH–) и даст нам воду (при уравнивании реакции она сократится), а часть присоединится к NO3–. В результате мы получаем два уравнения реакций:
2Zn(NO3)2 + 2H2O = 2Zn + O2 + 4HNO3
2Н2О = 2Н2 + О2

Обратим внимание, что если в задании на получение цинка дано нерастворимое соединение цинка, например, сульфид цинка (ZnS), то это соединение мы выбрать как правильный ответ никак не можем, так как электролизу подвергаются только растворы.
- Реакции восстановления.
Для цинка, как для менее активного металла, можно также использовать реакции восстановления (окислительно-восстановительные реакции, в ходе которых вещество принимает электроны и понижает степень окисления) оксида цинка сильными восстановителями, например:
2ZnO + C = 2Zn + CO2
3ZnO + 2Al = 3Zn + Al2O3

Отметим, что эти реакции протекают при нагревании.

Итак, мы видим, что несмотря на сходства физических свойств цинка и алюминия, способы их получения будут различными.
Мы посмотрели на химические элементы в чистом виде, теперь было бы интересно узнать, как они ведут себя в реакциях с кислотами, основаниями, какие окислительно-восстановительные свойства они проявляют. Например, почему алюминий наиболее распространен в металлотермии (о которой мы узнаем далее)? Давайте разберемся.
Химические свойства алюминия и цинка
Все химические свойства алюминия и цинка можно кратко объединить по нескольким группам:
- По химическим свойствам и алюминий, и цинк являются типичными восстановителями, а значит, они способны реагировать с окислителями.
- Как и другие металлы, алюминий и цинк будут взаимодействовать со своими противоположностями — неметаллами.
- Также они будут вступать в реакции замещения с водой, кислотами-неокислителями, щелочами и солями менее активных металлов.
Про все указанные классы веществ можно прочитать в статье «Основные классы неорганических веществ».
- С кислотами-окислителями будут вступать в окислительно-восстановительные реакции.
Давайте рассмотрим все эти реакции подробнее.
- Взаимодействие с окислителями.
Взаимодействие алюминия и цинка с окислителями подразумевает под собой реакции с оксидами. Но прежде чем перейти к непосредственному рассмотрению механизма реакции, давайте вспомним, что каждый элемент обладает определенной электроотрицательностью.
Электроотрицательность — это способность атома в соединениях смещать к себе общую электронную пару.
Электроотрицательность можно сравнить с игрой в перетягивание каната — более сильные люди (в нашем случае элементы, такие как некоторые неметаллы вроде фтора, кислорода) сильнее стягивают к себе условный центр каната, но при этом более слабые люди (в нашем случае это металлы и другие соединения) полностью канат не отпускают.
Ввиду низких значений электроотрицательности алюминий и цинк, как и другие металлы, являются отличными восстановителями. Настолько сильными, что они даже способны восстанавливать некоторые металлы и неметаллы из их оксидов. А такой процесс восстановления называется металлотермией.
Металлотермия применяется и в жизни — этот процесс используется для сварки рельс. Основа – это восстановительная реакция, протекающая между алюминием и окисью железа (Fe2O3). Смесь алюминия с оксидом железа(III) (Fe2O3) называют термитной, ее помещают в тигль (огнеупорный, как правило, свинцовый сосуд) и нагревают до 2000 градусов. Как результат — образуется восстановленное железо, которое затем заливают в огнеупорную форму, совпадающую с геометрией свариваемых рельс.
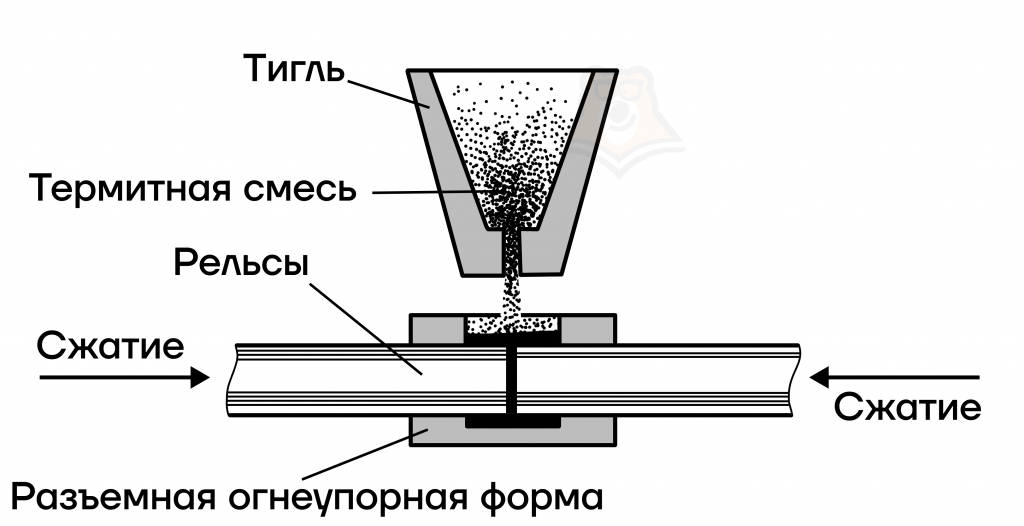
Активные металлы (стоящие до алюминия в ряду активности) получить путем восстановления из оксидов мы не можем.
- Реакции с неметаллами.
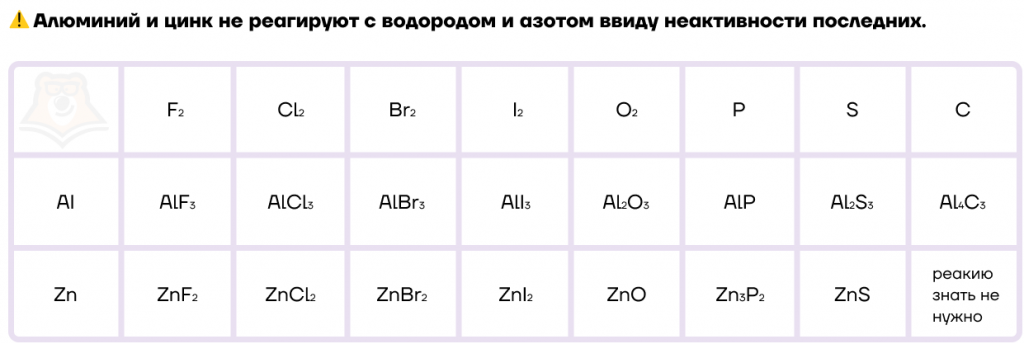
Как типичные металлы, алюминий и цинк способны вступать в реакции с неметаллами и образовывать различные бинарные соединения. Общая схема данной реакции будет выглядеть таким образом: Me + неMe = бинарное соединение.
- Реакции замещения.
- Реакции с водой.
Так как алюминий и цинк — металлы, стоящие в ряду активности левее водорода, они способны вытеснять водород из воды.
Как и другие активные металлы, при взаимодействии с водой алюминий образует гидроксид алюминия (Al(OH)3) и водород (H2). Но если взаимодействие с щелочными металлами у нас происходит активно без каких-либо условий, то для взаимодействия алюминия с водой необходимо нагревание.
2Al + 6H2O (t) = 2Al(OH)3 + 3H2
Цинк является уже менее активным металлом, поэтому нуждается в создании более жестких условий для реакции с водой. Он взаимодействует только с перегретым водяным паром и в таких жестких условиях вытесняет из воды оба атома водорода, превращаясь в оксид (ZnO).
Zn + H2O (пар) (t) = ZnO + H2
- Реакции с кислотами.
Алюминий и цинк также способны вытеснять водород не только из воды, но и из кислот-неокислителей.
2Al + 6HBr = 2AlBr3 + 3H2↑
Zn + 2HI = ZnI2 + H2↑
Когда мы уже изучили, как алюминий и цинк реагируют с водой и кислотами, мы можем закрепить полученные знания, решив задание№6 ЕГЭ. Именно в нем встречаются вопросы на понимание химических свойств веществ.
Задание. В пробирку с твердым веществом Х добавили раствор Y, нагреванию раствор не подвергался. В результате реакции наблюдали растворение твердого вещества и выделение газа.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в указанную реакцию.
1) H2O
2) Al
3) HCl
4) CuO
5) Cu
Решение. Твердые вещества в данном перечне: алюминий (Al), медь (Сu) и оксид меди(II) (CuO), они могут быть веществом Х. Так как вещество Y – раствор, то это может быть либо соляная кислота, либо вода.
Медь стоит в ряду активности металлов правее водорода, поэтому она не реагирует с водой и кислотами-неокислителями (в том числе с HCl), взять ее как вещество Х мы не можем.
Оксид меди(II) (4) с водой (H2O) не реагирует, а при взаимодействии кислоты (HCl) с оксидом меди(II) (4) не произойдет выделение газа (образуется вода и соль).
Поэтому вещество Х — алюминий.
Алюминий без нагревания не реагирует с водой (1), поэтому реакция пойдет с соляной кислотой (3).
Запишем реакцию:
2Al + 6HCl = 2AlCl3 + 3H2
Действительно, твердое вещество растворяется и выделяется газ – водород (H2).
Значит, Х — алюминий, а Y — HCl.
Ответ: 23
- Реакции со щелочами.
Амфотерные металлы реагируют с щелочами, причем продукты зависят от того, протекает ли реакция в водной среде и при нагревании:
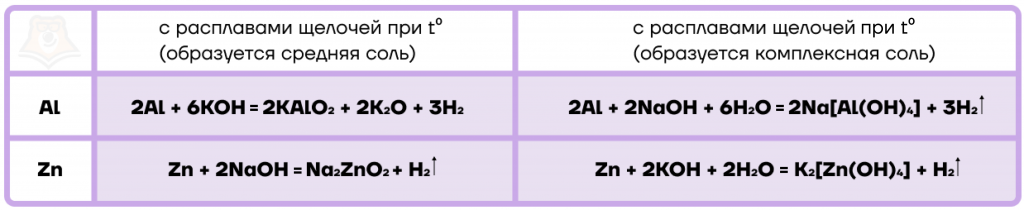
Запомнить связь может помочь мнемоническое правило: добавляя в смесь воды, получаем комплекс мы.
Таким образом, при проведении реакции в водной среде мы получаем комплексную соль — соль сложного строения, в состав которой входит катион и комплексный анион или анион и комплексный катион. Подробнее о том, что такое комплексная соль, можно прочитать в статье «Основные классы неорганических веществ».
Поскольку в процессе взаимодействия щелочи с металлом образуется очень активный атомарный водород (водород в виде свободных атомов, которые еще не объединились в молекулу простого вещества Н2), то эту реакцию можно использовать для восстановления соединений, содержащих атомы элементов в высоких положительных степенях окисления, например, нитратов.
Чтобы запомнить, как протекает эта реакция, ее можно мысленно разбить на две, протекающие последовательно:
- взаимодействие щелочи с металлом в водной среде — образуются комплексная соль и водород;
- водород взаимодействует с нитратом, восстанавливая его до аммиака (потому что в данном случае мы имеем дело с сильным восстановителем).
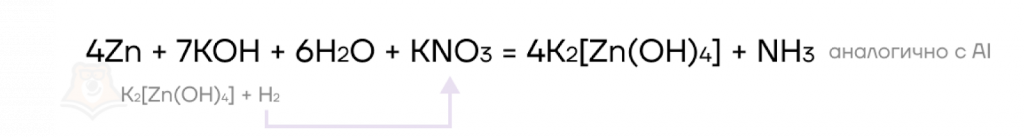
- Реакция с солями.
Как и другие металлы, алюминий и цинк способны вытеснять менее активные металлы из их солей.
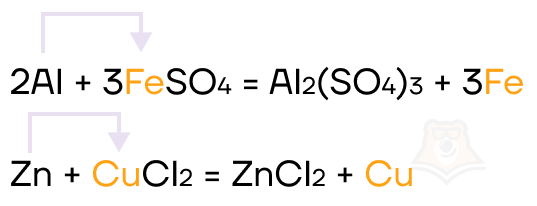
Также возможны такие интересные реакции, в которых алюминий прекрасно демонстрирует свои восстановительные свойства:
4Al + K2Cr2O7 = 2Cr + 2KAlO2 + Al2O3
2Al + 3Na2O2 = 2NaAlO2 + 2Na2O
- Окислительно-восстановительные реакции.
С кислотами-окислителями (азотной кислотой любой концентрации и концентрированной серной) протекают более сложные окислительно-восстановительные реакции.

Важно при этом помнить, что в холодных концентрированных растворах кислот-окислителей алюминий пассивируется (то есть не взаимодействует с кислотой) из-за наличия оксидной пленки на его поверхности, но реакция хорошо протекает при нагревании. С разбавленными и очень разбавленными растворами реакция протекает без нагревания.
Продукты реакции также зависят от концентрации кислоты.
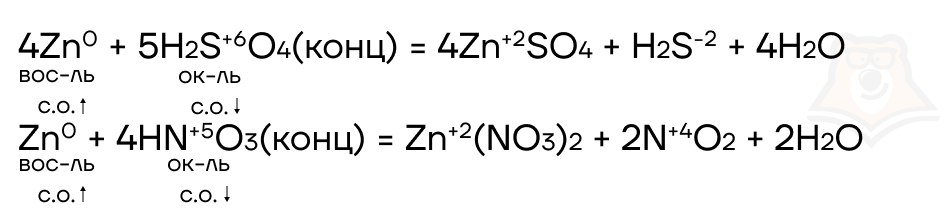

Сегодня мы познакомились с понятием амфотерности и свойствами наиболее часто встречающихся на экзамене амфотерных металлов — алюминия и цинка. С помощью этих знаний мы можем получить баллы как в первой, так и во второй части экзамена. А для полноценного понимания свойств не только самих металлов, но и их соединений рекомендуем ознакомиться со статьей «Соединения цинка и алюминия».
Термины
Бинарные соединения — соединения, которые состоят из двух элементов: металла и неметалла или двух неметаллов.
Восстановители — это соединения, отдающие электроны в окислительно-восстановительных реакциях, при этом сами они повышают свою степень окисления.
Кислоты — сложные вещества, состоящими из катиона водорода (H+) и аниона кислотного остатка.
Неметаллы — вещества, не обладающие металлическими свойствами. Они способны взаимодействовать с металлами и некоторыми неметаллами, водой, щелочами и некоторыми кислотами, а также могут вступать в окислительно-восстановительные реакции.
Окислители — это соединения, охотно принимающие электроны в окислительно-восстановительных реакциях, при этом сами они понижают свою степень окисления.
Основания — сложные вещества, состоящими из катиона металла (Ме+) или аммония (NH4+) и гидроксид-аниона (ОН—).
Электролиз — пропускание тока через раствор или расплав.
Фактчек
- Алюминий и цинк относятся к амфотерным металлам, то есть к таким, которые могут реагировать и с кислотами, и с щелочами в зависимости от природы реагирующих веществ.
- Алюминий может быть получен при расплаве оксида в криолите, а цинк путем электролиза раствора солей и восстановлением из соединений.
- Алюминий относится к p-элементам, его постоянная степень окисления +3; цинк относится к d-элементам, его постоянная степень окисления +2.
- Алюминий и цинк реагируют с рядом веществ: с неметаллами идет образование бинарных соединений, с оксидами идет реакция восстановления, с кислотами-окислителями ОВР, а с водой, кислотами-неокислителями, щелочами, солями идет реакция замещения.
Проверь себя
Задание 1.
Какими свойствами обладают алюминий, цинк и их оксиды и гидроксиды?
- Основными свойствами
- Кислотными свойствами
- Амфотерными свойствами
- Нейтральными свойствами
Задание 2.
Какие продукты реакции образуется в результате взаимодействия цинка с водой?
- Оксид цинка и водород
- Гидроксид цинка и водород
- Цинкат и водород
- Гидрид цинка и кислород
Задание 3.
Что будет образовываться в реакции между алюминием и раствором щелочи?
- Алюминат
- Вода
- Гидроксид алюминия
- Комплексная соль
Задание 4.
Какой продукт можно получить в результате протекания реакции между алюминием и концентрированной азотной кислотой при нормальных условиях?
- NO
- NH4NO3
- NO2
- Реакция не протекает
Задание 5.
Если нам встретится задание на получение алюминия, какой вариант ответа мы должны выбрать?
- Электролиз расплава AlCl3
- Взаимодействие с углеродом
- Электролиз оксида алюминия в криолите
- Электролиз раствора Al(NO3)3
Ответы:1. – 3; 2. – 1; 3. – 4; 4. – 4; 5. – 3.


 к списку статей
к списку статей





