Валентные возможности и степени окисления атомов химических элементов
На этой странице вы узнаете
- Действительно ли Менделееву приснилась его таблица?
- Что было предшественником валентности?
- Лайфхак для определения валентности: как легко узнать валентность элементов в бинарных соединениях?
Вещества реагируют друг с другом, превращаются из одного в другое — буквально волшебство! В этой статье мы будем разбираться, что кроется за этими превращениями и что определяет возможности элементов.
Периодическая система химических элементов Д. И. Менделеева — графическое отображение периодического закона
В 1869 г. Д.И. Менделеев сформулировал один из фундаментальных законов химической науки — периодический закон.
Формулировка периодического закона: «Свойства простых тел, также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.»
Периодический закон — величайшее достижение. После его открытия химия перестала быть просто описательной наукой о различных веществах, появилась почва для более глубокого исследования.

Позднее было установлено, что свойства элементов зависят от их электронной конфигурации. Это значит, что свойства простых веществ и соединений различных элементов находятся в периодической зависимости от порядкового номера (от величины заряда ядра их атомов).
Подробнее об электронной конфигурации можно прочитать в статье «Строение атома и электронные конфигурации».
Самым удобным и распространенным способом графического представления этого закона является таблица. Элементы, расположенные в порядке увеличения их атомного веса, имеют сходные свойства, при этом они повторяются периодически, а не следуют непосредственно друг за другом. Периодический закон объединяет свойства всех известных в настоящий момент химических элементов.

| Действительно ли Менделееву приснилась его таблица? Легенда о том, что периодическая таблица Менделееву однажды приснилась, и после пробуждения он в спешке записал ее на листке — всего лишь выдумка. Причем такая байка звучит даже несколько оскорбительно, она обесценивает труд ученого. Около двадцати лет Д.И. Менделеев размышлял над закономерностью в свойствах и строении химических элементов, пытался сформулировать законы периодичности, систематизировать полученные ранее знания о валентности, степени окисления и т.д. Сам Менделеев с иронией говорил: «Я над ней, может быть, двадцать лет думал, а вы говорите: сидел и вдруг… готово». |
Порядковый номер элемента, номер периода и группы, их физический смысл
Давайте рассмотрим Периодическую систему более внимательно:

Мы видим, что каждый элемент располагается строго на своем месте в зависимости от своей электронной конфигурации, которая определяет его свойства.
- Номер периода показывает число энергетических уровней, на которых вращаются электроны.
- Количество электронов в атоме совпадает с порядковым номером элемента.
- Наконец, номер группы указывает на высшую валентность.
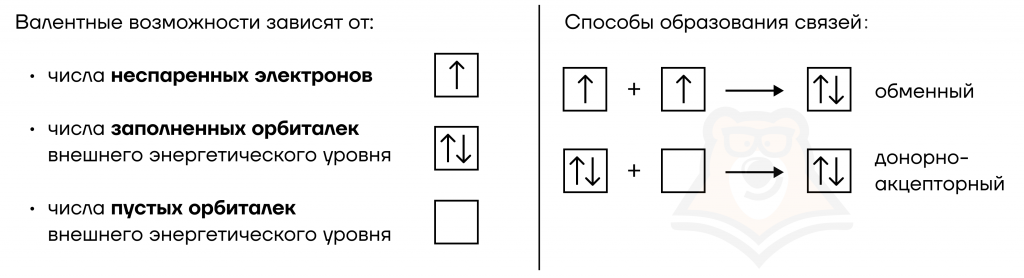
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
| Что было предшественником валентности? Впервые предпосылки для формулировки такого понятия, как валентность появились еще в 1779 году, когда ученые из разных стран начали выдвигать предположения о наличии связей между составными частями вещества. В 1857 году Фридрих Кекуле сделал важное открытие: он определил, что атом углерода может образовывать 4 связи. Позднее другие ученые проводили свои исследования и расширяли сведения о валентности. Первоначально валентность мерили таким химическим элементом, как водород. Валентность других элементов определялась количеством атомов водорода, которое может присоединить к себе элемент. |
Химические связи могут образовываться за счет неспаренных электронов на внешнем энергетическом уровне (ВЭУ), за счет неподеленных электронных пар и свободных орбиталей на ВЭУ. Также есть два основных способа формирования связей: обменный и донорно-акцепторный. В статье «Химическая связь» можно подробнее прочитать о том, как именно образуется химическая связь.
Связь между металлом и неметаллом не принято обозначать «черточкой», так как «черточка» — это ковалентная связь, а связь между металлом и неметаллом — ионная.


Можно представить, как два неметалла, распознав друг в друге родственную душу, протягивают руку, а их рукопожатие мы и видим как «черточку».

Большинство химических элементов проявляют переменную валентность:
- Высшая валентность равна номеру группы.
- Низшая валентность вычисляется как «8-№ группы».
- Промежуточная валентность находится между высшей и низшей.
Как определить валентность элемента? Нужно внимательно изучить расположение его электронов на орбиталях.
Высшая валентность соответствует числу неспаренных электронов на s- и p-орбиталях ВЭУ. Для элементов побочных групп это будут s- и d-орбитали.
В обычном (основном или стационарном) состоянии электроны занимают одно положение, которое закреплено в периодической системе. Но при переходе в возбужденное состояние электроны перераспределяются, меняют свое положение относительно энергетических уровней, из-за чего меняется и валентность атома. Отсюда и появляется вариативность, то есть способность принимать различные значения валентностей атомов.
Рассмотрим пример:
Атом фосфора в стационарном состоянии имеет электронную конфигурацию 1s22s22p63s23p3.
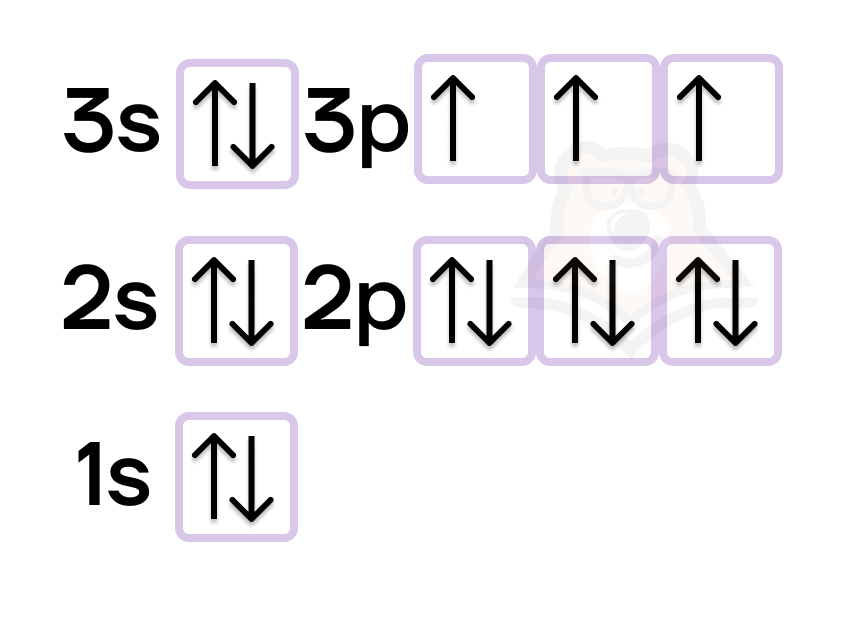
Все его 15 электронов расположены на трех энергетических уровнях. На внешнем энергетическом уровне у нас 5 электронов, из которых 3 неспаренных. Именно эти три электрона могут образовывать связи — валентность фосфора равна трем.
Но у фосфора есть еще и d-орбиталь, которая не заполнена электронами. При переходе в возбужденное состояние спаренные электроны s-подуровня перестают быть спаренными, и один электрон отправляется на d-подуровень.

Теперь мы видим, что на ВЭУ пять неспаренных электронов, и валентность фосфора уже равна пяти.
Но не все элементы способны переходить в возбужденное состояние, у некоторых нет вакантной (свободной) орбитали. Вот список элементов с постоянной валентностью:

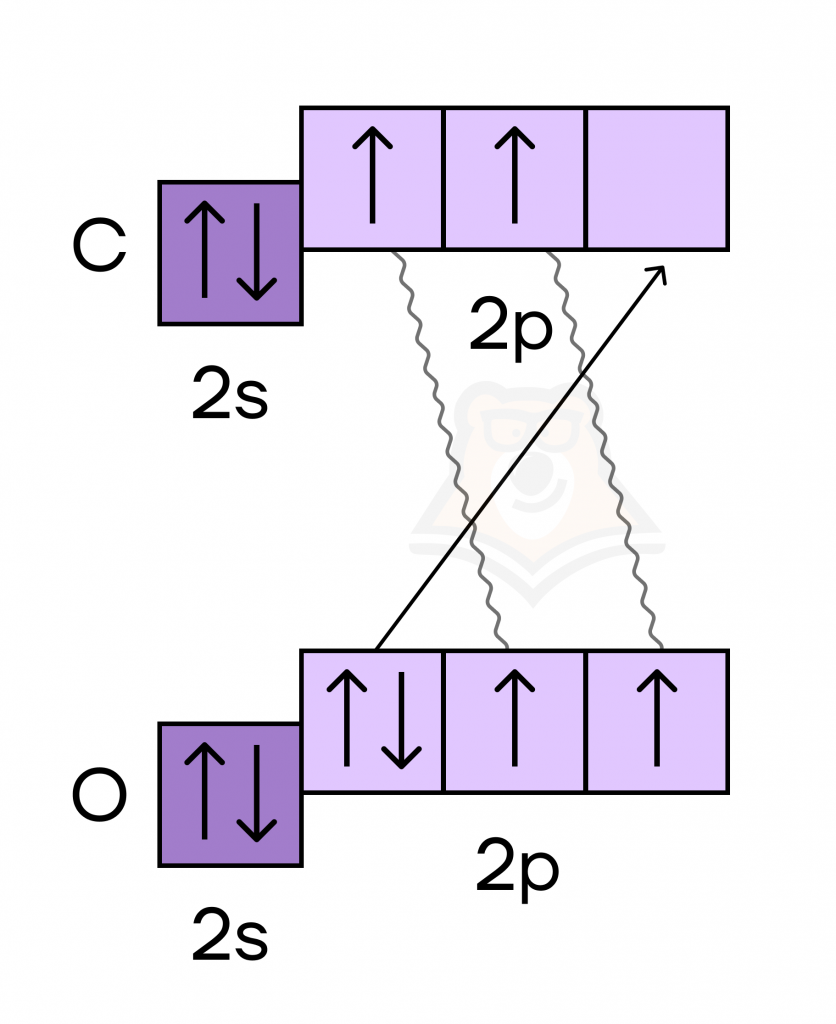
Разберем подробнее, каким образом кислород в соединениях образует 3 связи и почему его валентность может быть равна III. Для этого рассмотрим образование молекулы угарного газа (СО).
1) За счет неспаренных электронов атомов углерода и кислорода образовано две связи (обменный механизм).
2) За счет вакантной орбитали атома углерода и спаренных электронов атома кислорода образована третья связь (донорно-акцепторный механизм).
Таким образом, в молекуле СО тройная связь, причем две связи образованы по обменному механизму, а третья — по донорно-акцепторному.
Для закрепления полученной информации давайте попрактикуемся.
Решим пример задания №3 ЕГЭ по химии, так как при его решении может пригодиться информация о валентности или степени окисления атома.
Задание. Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную валентность, равную I. Запишите в поле ответа номера выбранных элементов.
Ряд химических элементов: 1) Na 2) Be 3) Al 4) Ba 5) Li
Решение.
Все данные элементы имеют постоянную валентность.
Валентность I имеют металлы IA группы, в задании это натрий (Na) и литий (Li).
Валентность II имеют металлы IIA группы, к ним будут относиться бериллий (Be) и барий (Ba).
Валентность III имеет алюминий (Al).
По условию задачи нам нужно выбрать, какие элементы имеют валентность, равную I, поэтому в ответ запишем 1 (Na) и 5 (Li).
Ответ: 15
Не всегда высшая валентность равна номеру группы — например, у азота максимальная валентность равна IV.
Возникает вопрос: а почему так? Ответ опять кроется в электронном строении атома. У азота есть только основное состояние атома, в котором три неспаренных электрона и неподеленная электронная пара. Возможности «рассорить» эту пару у азота попросту нет, ведь свободных электронных уровней он не имеет.
Поэтому возможны следующие варианты:
- один неспаренный электрон образует одну химическую связь = валентность I;
- два неспаренных электрона образуют две химических связи = валентность II;
- три неспаренных электрона образуют три химических связи = валентность III;
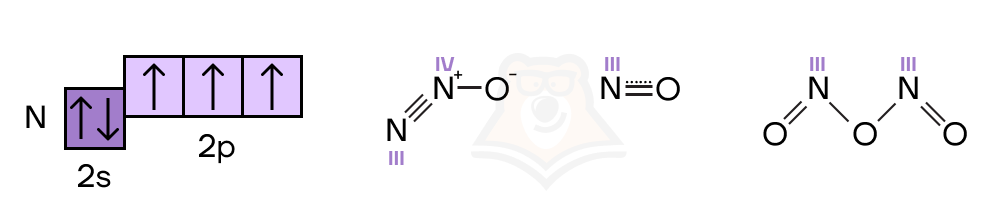
- три неспаренных электрона образовали три химических связи + одна неподеленная электронная пара образовала еще одну связь = валентность IV.
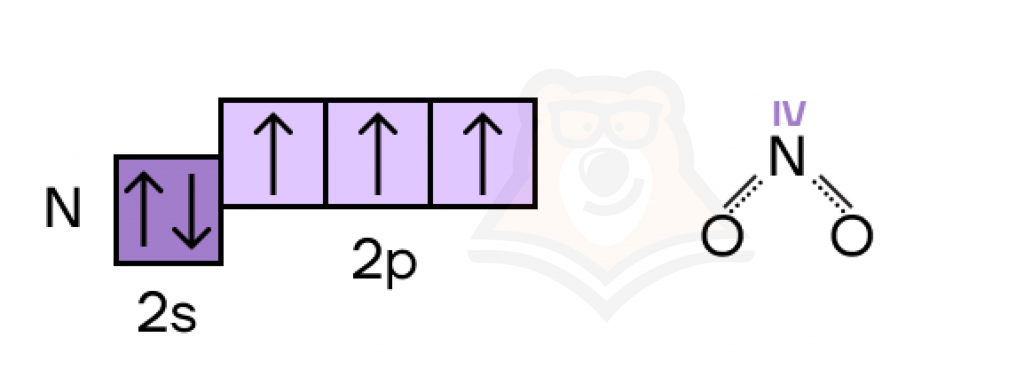
Также важно запомнить, что у азота в гидразине N2Н2 валентность равна III.
| Лайфхак для определения валентности: как легко узнать валентность элементов в бинарном соединении? Если химическое вещество состоит только из двух элементов, то валентность каждого из них можно узнать, руководствуясь этим правилом: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми. Например, в молекуле оксида алюминия Al2O3 сумма единиц валентности алюминия равна 3*2=6 и у кислорода 3*2=6. |
Изучив основные принципы образования химических связей, мы можем теперь узнать, как определить условный заряд атомов химических элементов в сложных соединениях.
Определение степени окисления элементов в сложных веществах
Перед тем как научиться определять степень окисления в веществах, давайте вспомним, что же это такое.
Степень окисления (СО) — это условный заряд атома элемента, вычисленный на основе предположения, что все связи в данном соединении являются ионными (показывает, сколько электронов атом «притянул» или, наоборот, «отдал» при образовании химической связи).

Степень окисления, как и валентность, может быть:
- высшая = номеру группы;
Исключения:
— элементы побочных подгрупп I и VIII групп;
— кислород (максимальная +2);
— фтор (максимальная 0). - промежуточная;
- низшая
для металлов = 0, а для неМе = 8 — номер группы.
Но каким образом определяется, какую степень окисления атом принимает в веществе? Давайте разберемся во всем по порядку, а начнем с основных правил.
Общие правила определения степени окисления:
- Атомы металлов способны проявлять только положительные степени окисления, атомы неметаллов — как положительные, так и отрицательные.
- В простом веществе СО атомов равна нулю.
- Если соединение состоит из двух элементов, то нахождение степени окисления полностью совпадает с нахождением валентности элементов в бинарном соединении.
- Если соединение состоит не из двух, а из трех и более элементов, определение степени окисления будет похоже на механизм определения валентности в бинарных соединениях, но есть и свои особенности.
О последнем пункте давайте поговорим подробнее.
Для определения степеней окисления важно запомнить постоянные степени окисления отдельных элементов:
- Металлы IA группы в соединениях всегда проявляют степень окисления +1, металлы IIA группы и цинк — степень окисления +2 (исключение — ртуть Hg), алюминий — степень окисления +3.
- В большинстве своих соединений кислород проявляет СО -2. К исключениям относится степень окисления в пероксидах (там -1), фторида кислорода (там +2), а также надпероксидов (супероксидов) (там -1/2).
- Фтор всегда проявляет степень окисления -1.
- Водород практически всегда проявляет степень окисления +1 (кроме гидридов металлов, там -1).
Остальные элементы имеют непостоянные (переменные) степени окисления. Для экзамена стоит запомнить перечень наиболее типичных степеней окисления:

Также важно помнить, что в виде простых веществ (содержащих в составе только один элемент) практически все элементы имеют степень окисления 0.
А теперь перейдем непосредственно к алгоритму определения степеней окисления в сложном веществе:
- Расставляем постоянные степени окисления.
- Принимаем искомую (неизвестную) степень окисления за «икс».
- Учитывая, что сумма СО всех элементов в сложном веществе равна нулю, составляем и решаем уравнение.
А сейчас мы на примере потренируемся расставлять степени окисления в сложных соединениях.
Необходимо расставить СО в сложном веществе: K2CrO4.
Постоянные степени окисления у калия (+1) и кислорода (-2), степень окисления хрома принимаем за «икс». Не забываем учитывать количество атомов того или иного вещества (нижний индекс). Сумма степеней окисления равна 0, тогда получим:
2 * (+1) + х + 4 * (-2) = 0
2 + х — 8 = 0
х — 6 = 0
х = 6
Таким образом, мы выяснили, что в данном соединении степень окисления хрома равна +6.
Если нам дано не сложное вещество, а ион, то приравниваем сумму степеней окисления не к 0, а к заряду иона. Перейдем к примеру.
Нам дан хромат-ион CrO42-, принимаем за Х степень окисления хрома, для кислорода СО постоянна и равна -2. Заряд иона 2-, но мы для удобства будем его записывать -2, это число будет стоять после знака равно.
х + 4 * (-2) = -2
х — 8 = -2
х = 8 — 2
х = 6
В данном ионе степень окисления хрома также равна +6.
Также есть второй способ. Если мы можем составить для иона вещество, то делаем это, а дальше возвращаемся к проверенной схеме. Подробнее о том, как формируются соединения, можно прочитать в статье «Химическая связь».
Например, если нам дан хромат-ион CrO42-, составим для него соединение — хромат калия (K2CrO4.), а дальше переходим к решению, записанному выше.
Для лучшего понимания механизма нахождения степени окисления решим пример задания №4 ОГЭ по химии.
Задание. Установите соответствие между формулой соединения и степенью окисления марганца в этом соединении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
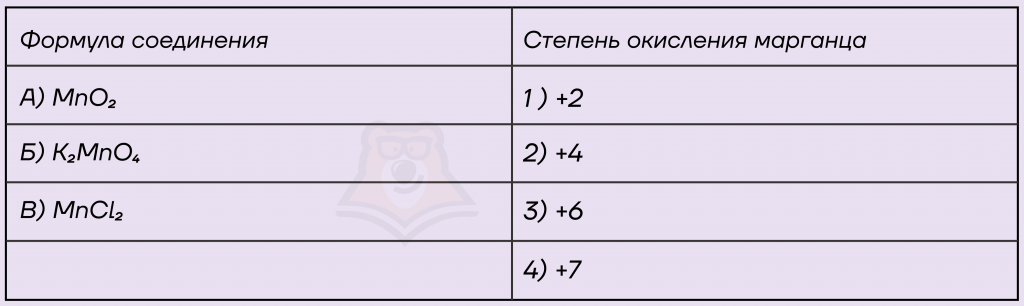
Решение.
А) Дан оксид марганца(IV), в оксиде степень окисления кислорода всегда равна -2, принимаем за Х степень окисления марганца и, зная, что сумма СО всех элементов в сложном веществе равна 0, записываем уравнение.
Х + 2 * (-2) = 0
Х — 4 = 0
Х = 4
Таким образом, степень окисления марганца +4, вариант ответа 2.
Б) Нам дана соль, разберемся, какие элементы в нее входят. Калий относится к металлам IА группы, его степень окисления всегда +1, дан кислород, его степень окисления будет равна -2. Снова принимаем за Х степень окисления марганца и записываем уравнение.
2 * (+1) + Х + 4 * (-2) = 0
2 + Х — 8 = 0
Х — 6 = 0
Х = 6
Степень окисления марганца +6, записываем в ответ 3.
В) Дан хлорид марганца(II), хлор, как более электроотрицательный элемент, забирает у марганца электроны и принимает минимальную степень окисления, которая равна -1. Принимаем степень окисления марганца за Х, записываем уравнение.
Х + 2 * (-1) = 0
Х — 2 = 0
Х = 2
В хлориде марганца(II) степень окисления марганца будет равна +2, вариант ответа 1.
Ответ: 231
Вот мы и научились определять валентные возможности и степени окисления атомов. Часто валентность совпадает с номером группы, а в остальных случаях ее легко можно определить по электронному строению. Для определения степени окисления в сложном веществе есть свой механизм, который позволяет с легкостью определить неизвестную СО в любом соединении.
А для более глубокого понимания взаимосвязи степени окисления, валентности и периодического закона, рекомендуем прочитать статью «Периодический закон и периодическая система химических элементов Д.И. Менделеева».
Термины
Бинарные соединения — соединения, которые состоят из двух элементов: металла и неметалла или двух неметаллов.
Электронная конфигурация — это формула, отражающая распределение электронов по электронным оболочкам атома (энергетическим уровням).
Фактчек
- Свойства химических элементов находятся в периодической зависимости от заряда ядра атомов химических элементов.
- Таблица Менделеева состоит из: столбцов, то есть групп, и строк, то есть периодов.
- Высшая валентность для большинства элементов равна номеру группы.
- Номер периода показывает число энергетических уровней, на которых вращаются электроны.
- Степень окисления отражает «отдачу» или «принятие» электрона атомом, она может быть высшей, промежуточной и низшей.
- Некоторые элементы имеют постоянную степень окисления, а для элементов, имеющих промежуточные степени окисления, определить ее в веществе можно путем составления уравнения.
Проверь себя
Задание 1.
От чего зависят свойства химических элементов?
- от заряда ядра атомов
- от количества электронных слоев
- от формы атомных орбиталей
Задание 2.
Чему равна высшая валентность атома углерода?
- II
- III
- IV
- V
Задание 3.
Чему равно число энергетических уровней у атома лития?
- 1
- 2
- 3
- 4
Задание 4.
Чему равна низшая степень окисления хлора?
- +1
- +7
- -7
- -1
Задание 5.
Чему равна степень окисления марганца в KMnO4?
- -2
- +4
- +6
- +7
Ответы: 1. — 1; 2. — 3; 3. — 2; 4. — 4; 5. — 4.


 к списку статей
к списку статей






