Алкины
На этой странице вы узнаете
- Какие братья есть у алкинов?
- Какую воду любят алкины?
- Ацетилен светится?
Сегодня мы познакомимся с новым классом углеводородов, представители которого используются в качестве исходного сырья для получения многих органических веществ, применяемых при приготовлении пищи и не только. Именно поэтому нам просто необходимо поскорее разобраться с алкинами.
Общая характеристика алкинов
Алкины — непредельные ациклические углеводородные соединения, которые содержат одну тройную связь.
Общая формула алкинов выглядит так: СnH2n−2.
| Какие братья есть у алкинов? Братья — люди из одной семьи, они часто очень похожи внешне, но отличаются по характеру. Тоже самое с алкинами, алкадиенами и циклоалкенами: их роднит одинаковая общая формула (внешний вид) — СnH2n−2, но при этом строение и, как следствие, химические свойства у них различаются. |
Рассмотрим строение алкинов на примере молекулы ацетилена.
Атомы углерода, участвующие в образовании тройной связи (одна связь — сигма, две остальные — пи), находятся в состоянии sp-гибридизации. Подробнее про кратные связи и гибридизацию можно почитать в статье «Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа».
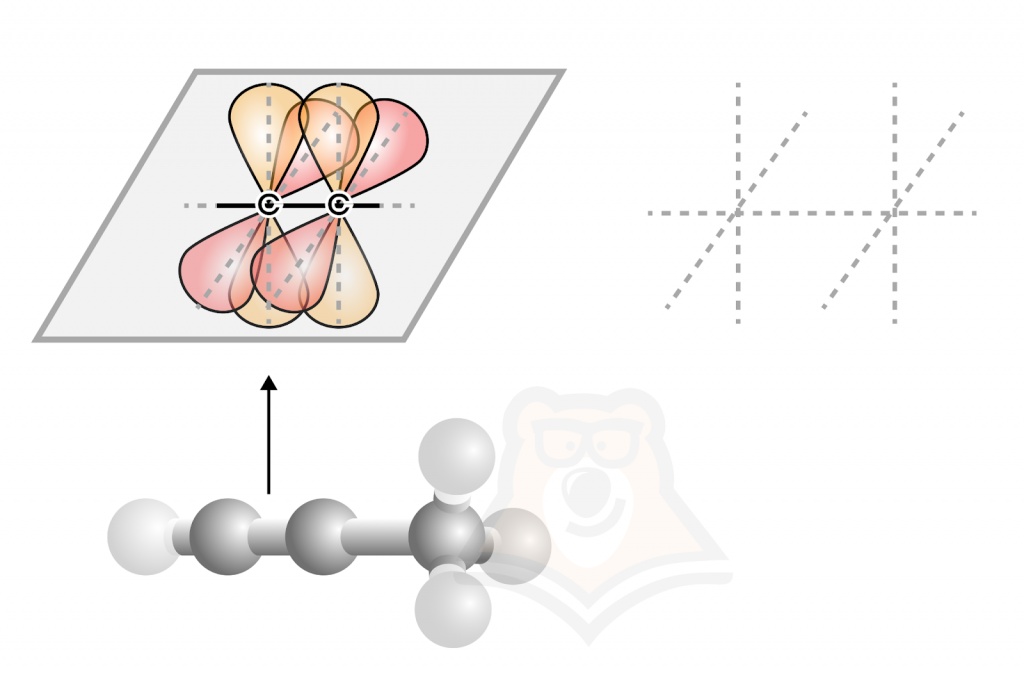
По иллюстрации выше (шаростержневая модель ацетилена) видно, что форма молекулы линейная. А чему равен валентный угол и длина связи? 180° и 0,120 нм соответственно.
Угол запомнить очень легко! Так как форма молекул линейная, значит, молекулы располагаются по горизонтали, а изображение угла в 180 градусов выглядит как прямая.
Гомологами алкинов будут алкины, имеющие сходное строение (положение тройной связи и заместителей (при наличии)), но отличающиеся на одну или несколько групп -CH2-.
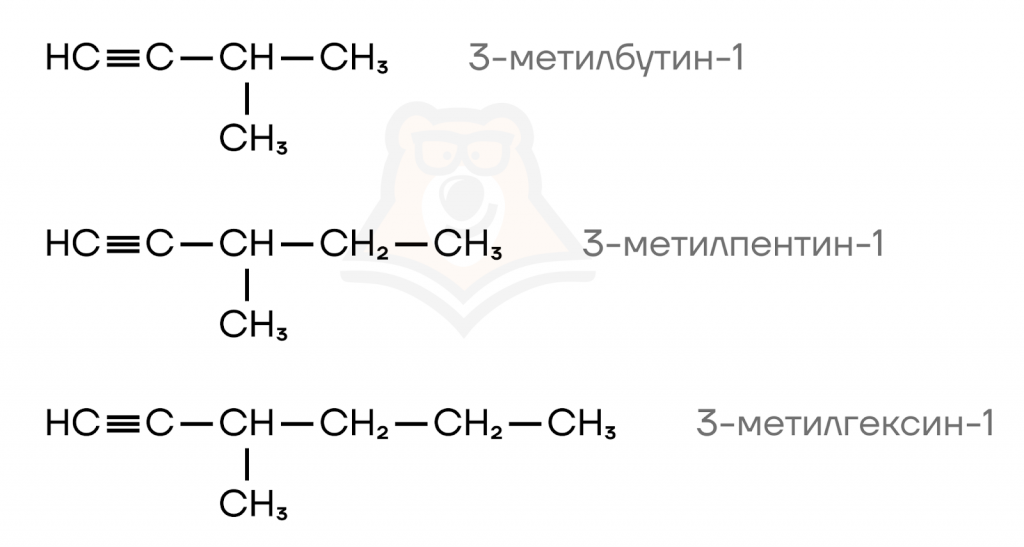
Номенклатура алкинов
По номенклатуре органических соединений ИЮПАК (IUPAC: International Union of Pure and Applied Chemistry) названия алкинов образуются от названий алканов заменой суффикса -ан на -ин. Самым первым представителем алкинов является этин (C2H2). Однако он имеет и другое название «ацетилен», которое является тривиальным.
Тривиальные названия веществ — это названия, которые не отражают структуру вещества, а закрепились за ним исторически, больше связаны с происхождением вещества или его свойствами.
Давайте познакомимся с первыми представителями алкинов и их названиями. А если вы забыли алгоритм составления названия химического соединения, то вспомнить его можно в нашей статье: «Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)».
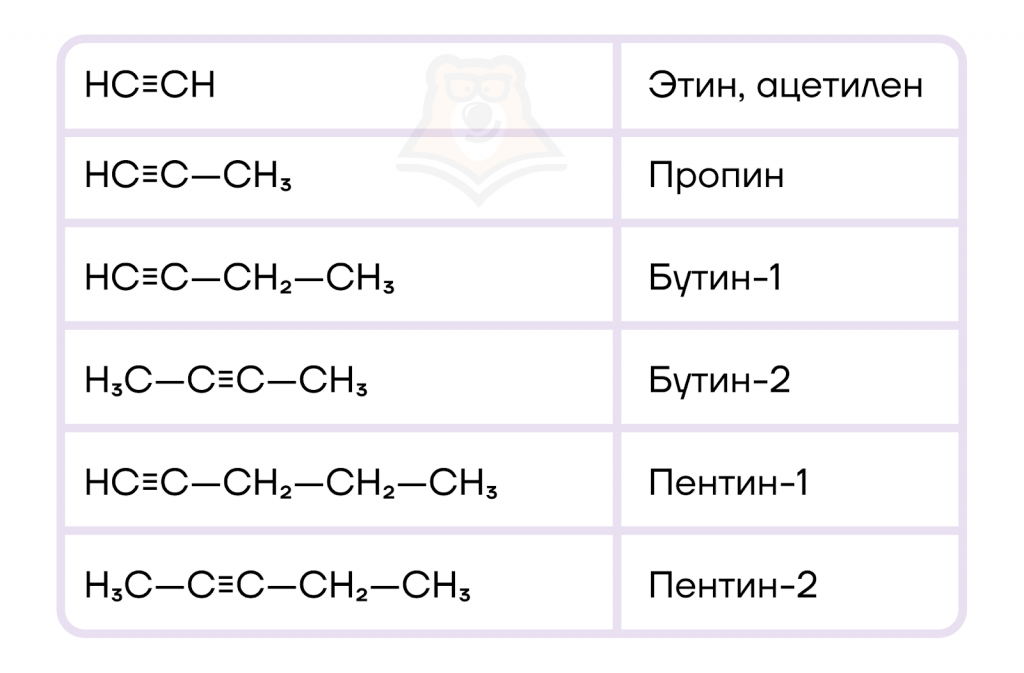
Не забывайте, что углеродная цепь алкина всегда нумеруется так, чтобы тройная связь получила наименьшую цифру.

В номенклатуре алкинов нет ничего сложного, поэтому давайте перейдем к следующему более прикладному разделу.
Физические свойства алкинов
Алкины очень похожи по физическим свойствам на другие углеводороды. К примеру, алкины подобно алкадиенам и иным углеводородам с возрастанием углеродной цепи переходят от газообразного состояния в жидкое, а затем в твердое.
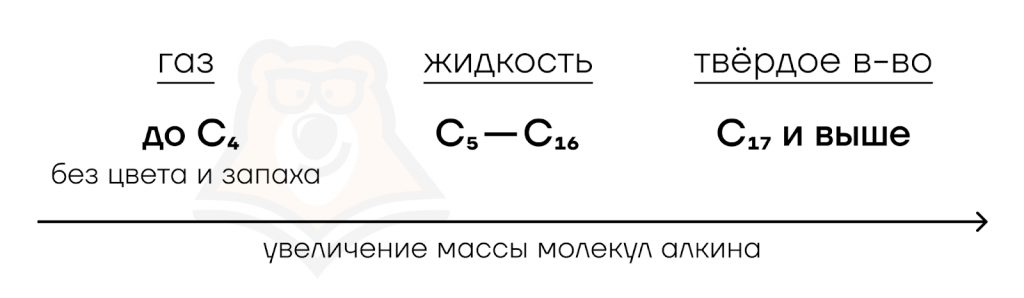
Алкины напоминают соответствующие алкены и алканы, но имеют более высокие температуры кипения и плавления. Они плохо растворяются в воде, лучше — в органических неполярных растворителях. Не забывайте, что ацетилен взрывоопасен.
Для алкинов характерны три вида изомерии. Давайте вспомним, что это такое.
Изомерия — это явление существования веществ, имеющих одинаковый качественный и количественный состав (то есть одинаковую молекулярную формулу), но разное химическое строение.
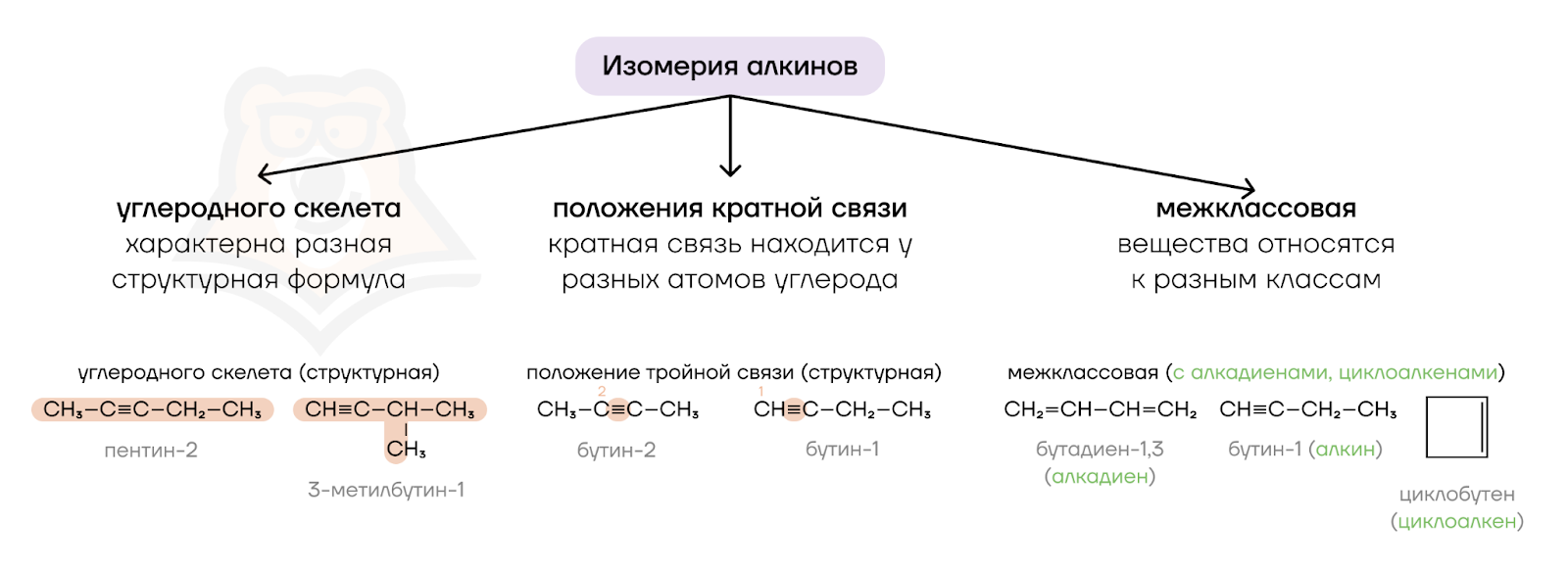
Изомерия углеродного скелета связана с перестройкой связей С-С, появлением и перестановкой заместителей. Изомерия положения кратной связи определяется положением кратной связи в углеродной цепи. Межклассовая изомерия связана с одинаковой общей формулой гомологического ряда у разных классов органических соединений.

Не забывайте, что изомеры всегда должны иметь одинаковый качественный и количественный состав.
А теперь давайте закрепим полученные знания об изомерии алкинов в задании №11 ЕГЭ по химии.
Задание. Из предложенного перечня выберите два вещества, которые являются межклассовыми изомерами по отношению друг к другу.
1) пропадиен
2) пропин
3) ацетилен
4) пропан
5) пропанон
Решение. Межклассовые изомеры имеют одинаковую молекулярную формулу, но относятся к разным классам органических веществ.
1) Пропадиен (CH2=C=CH2) — это алкадиен. Молекулярная формула: C3H4.
2) Пропин (CH3–C≡CH) — это алкин. Молекулярная формула: C3H4.
3) Ацетилен (CH≡CH) — это алкин. Молекулярная формула: C2H2.
4) Пропан (CH3–CH2–CH3) — это алкан. Молекулярная формула: C3H8.
5) Пропанон (CH3–CO–CH3) — это кетон. Молекулярная формула: C3H6.
Имеют одинаковую молекулярную формулу (C3H4), но относятся к разным классам пропадиен (1) и пропин (2).
Ответ: 12
Химические свойства алкинов
Алкины являются непредельными углеводородами, поэтому они с радостью вступают в реакции присоединения за счет разрыва пи-связей, а также в реакции окисления.
- Галогенирование (присоединение молекулы галогена). Галоген присоединяется по месту разрыва кратной связи. Вначале рвется только одна связь, но если добавить избыток галогена, то разрушаются все кратные связи.
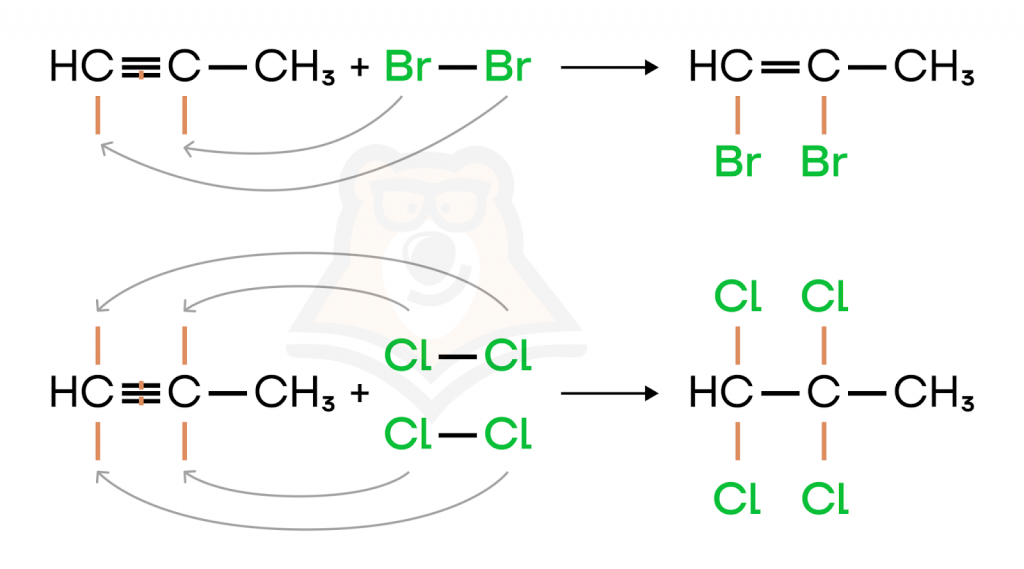
Первая реакция, изображенная выше, показывает присоединение только одной молекулы брома к пропину с образованием 1,2-дибромпропена. Во второй реакции одновременное присоединение двух молекул хлора ведет к разрыву двух связей из трех с образованием 1,1,2,2-тетрахлорпропана.
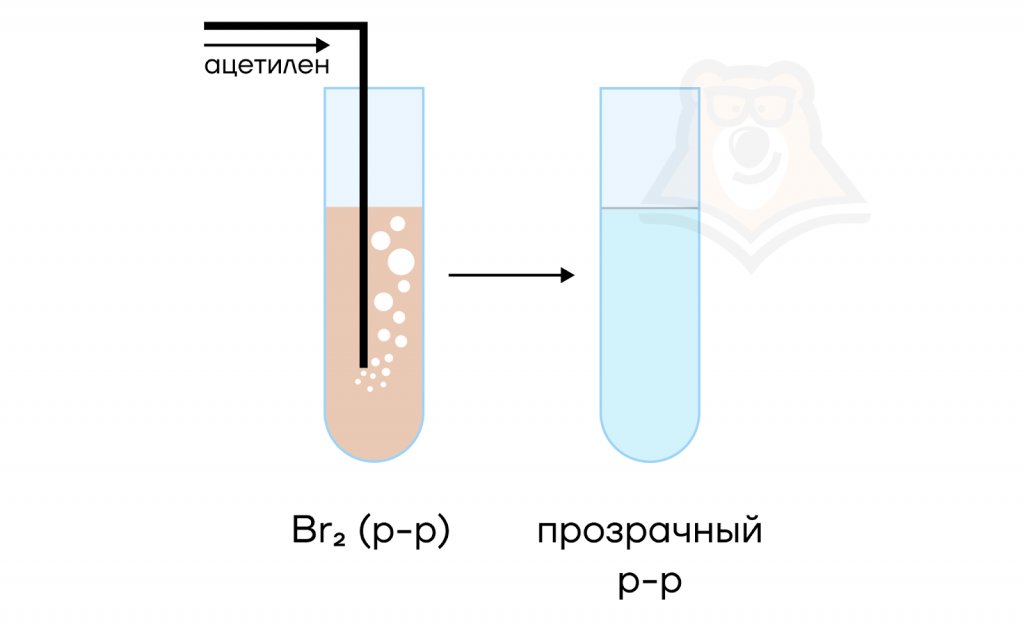
Реакция с бромной водой считается качественной, так как происходит обесцвечивание раствора. Напомним, что качественными являются те реакции, при проведении которых мы можем наблюдать различные признаки, помогающие нам обнаружить вещества (или ионы) в присутствии других веществ в смеси.
| Какую воду любят алкины? Некоторые люди любят газированную воду, некоторые фильтрованную, а кто-то минеральную. Теперь мы знаем, что алкинам нравится бромная вода. Причем алкины настолько любят «пить» такую воду, что после их взаимодействия бромная вода теряет свой желто-оранжевый цвет и становится бесцветной. Такое обесцвечивание раствора позволяет нам сразу идентифицировать алкин. |

- Гидрирование (присоединение молекулы водорода). Молекулу водорода для удобства можно расписать, тогда будет наглядно видно, к какому атому углерода пойдет каждый атом водорода.
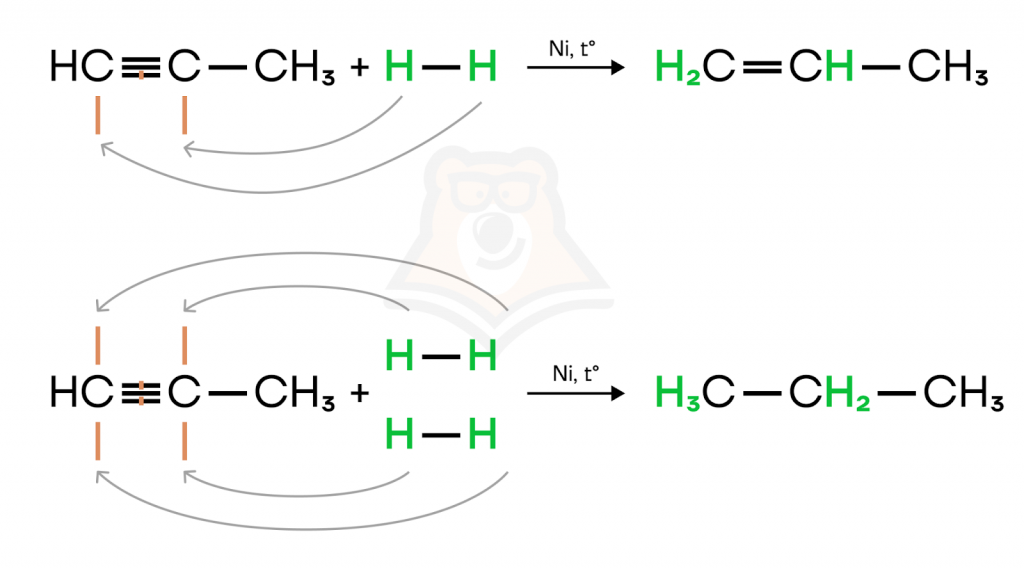
В первой реакции мы можем наблюдать присоединение только одной молекулы водорода к пропину с образованием пропена. Во второй реакции присоединение двух молекул водорода ведет к образованию пропана.
- Гидрогалогенирование (присоединение молекулы галогеноводорода). Галогеноводород тоже можно расписать на два атома — галоген и водород, тогда будет намного проще верно записать продукты такой реакции.
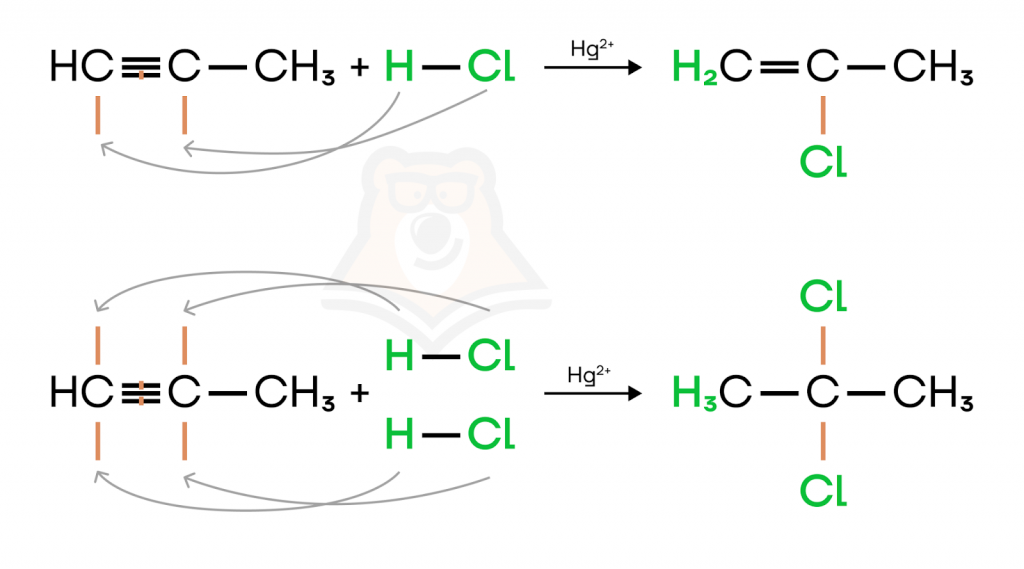
Первая реакция иллюстрирует присоединение одной молекулы хлороводорода к пропину по правилу Марковникова с образованием 2-хлорпропена. Во второй реакции присоединение двух молекул хлороводорода сразу приводит к образованию 2,2-дихлорпропана. Вспомнить правило Марковникова вы можете в нашей статье «Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии».
- Гидратация (присоединение молекулы воды). Реакция протекает в присутствии кислоты и солей Hg2+. Воду можно расписать на водород (H+) и гидроксильную группу (OH–).
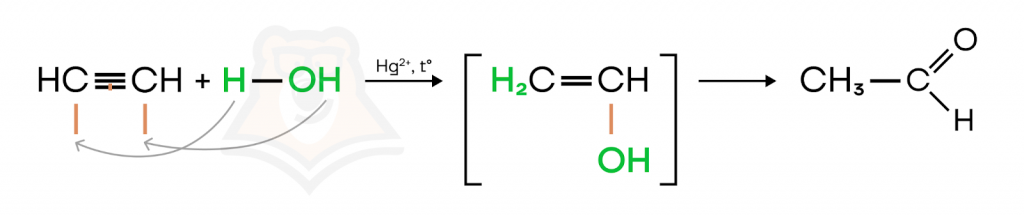
Водород пойдет к атому углерода, при котором находится наибольшее число атомов водорода — присоединится к своим собратьям согласно правилу Марковникова. А гидроксильная группа пойдет к другому атому углерода, находящемуся при разорвавшейся тройной связи. В результате мы получаем енол (в данном случае — виниловый спирт) — крайне неустойчивое соединение (на схеме оно в квадратных скобках), которое сразу же перестраивается в более устойчивую форму — соответствующее карбонильное соединение. Соединение в квадратных скобках мы в реакции не записываем, так как это промежуточный продукт.
Обращаем ваше внимание, что при гидратации ацетилена образуется ацетальдегид, а при гидратации остальных алкинов — кетоны. О тех и других можно почитать в нашей статье «Альдегиды и кетоны».
Рассмотрим реакции гидратации пропина и бутина-2.

В первой реакции, присоединяя молекулу воды к пропину, можно получить пропанон (ацетон). Во второй реакции уже получается бутанон.
- Полимеризация (объединение молекул мономера (исходного вещества с кратной связью) с образованием длинных цепочек полимера).
Данные реакции, как уже было сказано, характерны для соединений с кратными связями, поэтому они нам встречались в химических свойствах алкенов, алкадиенов. Реакция протекает по схеме:
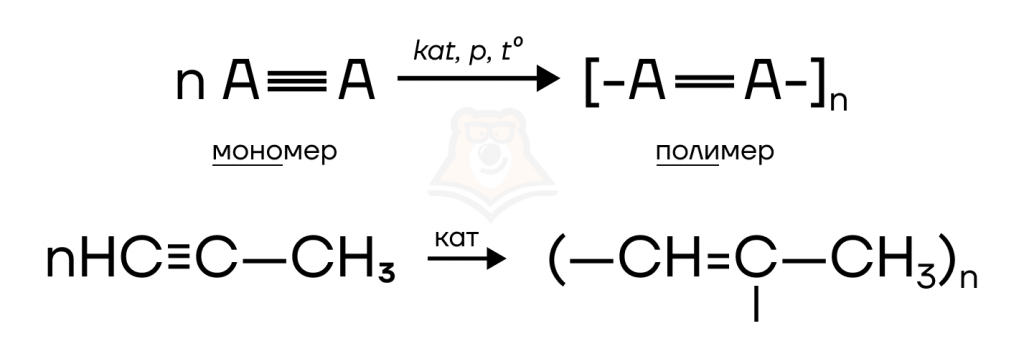
Например, при полимеризации пропина (реакция выше) одна из пи-связей разрывается, образуя мономер, который соединяется с таким же мономерным звеном несколько раз. В результате реакции образуется полипропин.
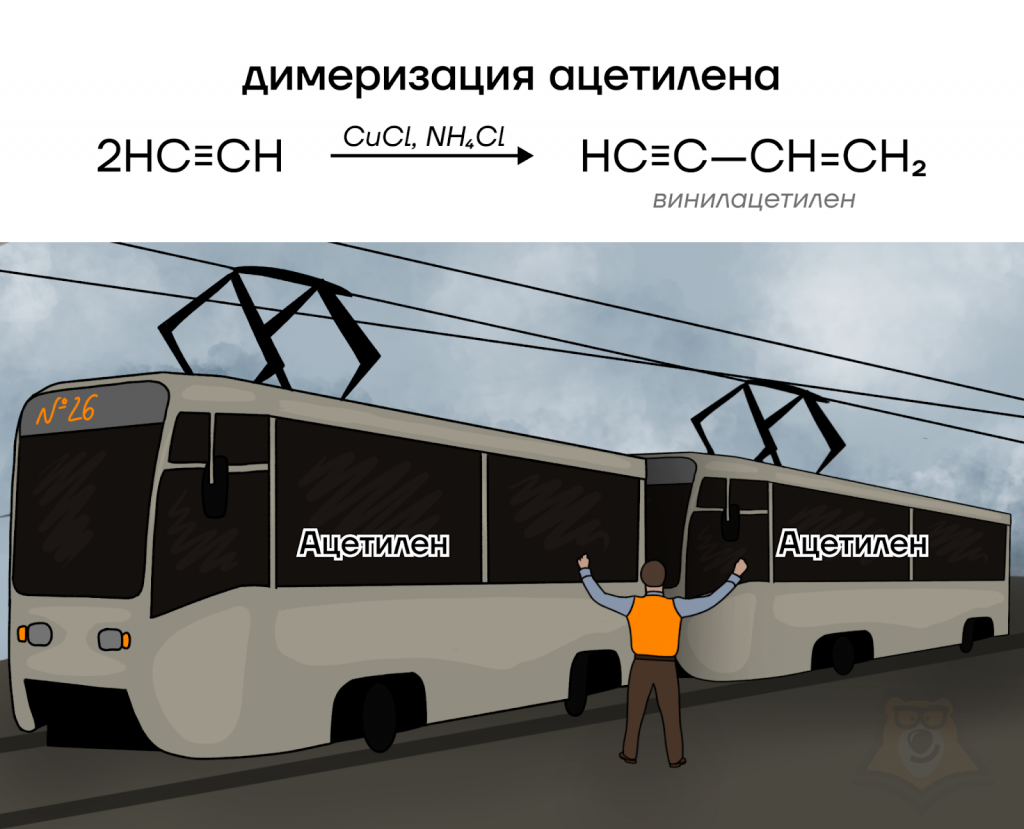
Для алкинов характерны еще два вида полимеризации: ди— и тримеризация!
Димеризация означает, что надо взять именно две молекулы ацетилена — как два вагончика трамвая — из него можем получить винилацетилен.
Тримеризация — берем три молекулы ацетилена (иногда встречаются трамвайчики из трех вагонов) и их превращаем в бензол.
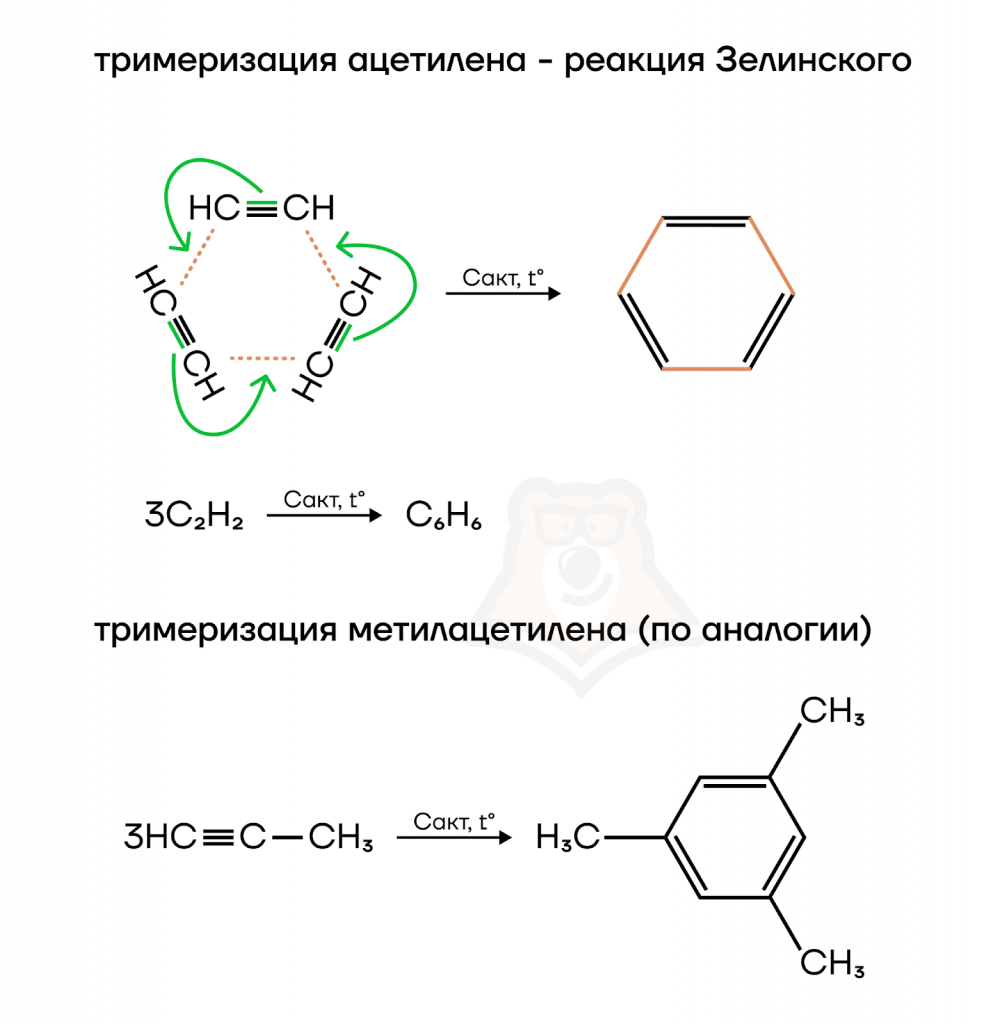
А если взять пропин, то тоже образуется бензольное кольцо, но от каждого второго атома углерода еще будет отходить метильный радикал. В результате реакции образуется 1,3,5-триметилбензол (мезитилен).
- Окисление (повышение степени окисления углерода при тройной связи).
а) Мягкое окисление проводят обычно с использованием холодного водного раствора перманганата калия, при этом рвутся только пи-связи.
Мягкое окисление не приводит к разрыву углеродного скелета. Оно «заботливо» оставляет основу соединения, лишь слегка изменив его структуру. То есть как было до реакции одно органическое соединение, так оно и осталось. Мягко окислить можно только ацетилен.
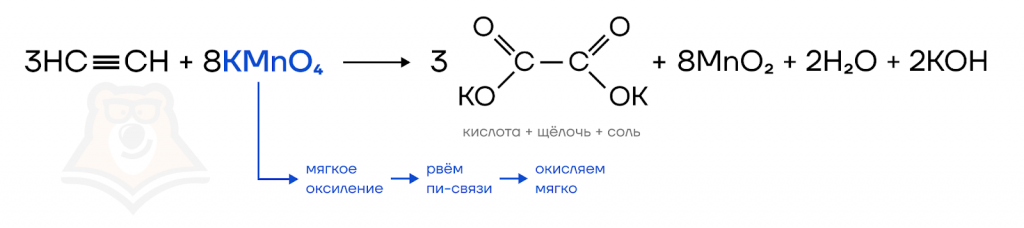
При окислении ацетилена перманганатом калия образуется оксалат калия (соль дикарбоновой кислоты).
б) Жесткое окисление проходит с участием сильных окислителей (KMnO4, K2Cr2O7) в кислой или щелочной средах, а также в нейтральной среде при нагревании, при этом рвутся и пи- и сигма-связи.
Жесткое окисление рубит на корню все, что видит. В итоге это приводит к разрыву углеродного скелета и образованию нескольких органических веществ с меньшим числом атомов углерода в цепи.
Давайте разберемся, какие продукты реакции образуются в разных средах.
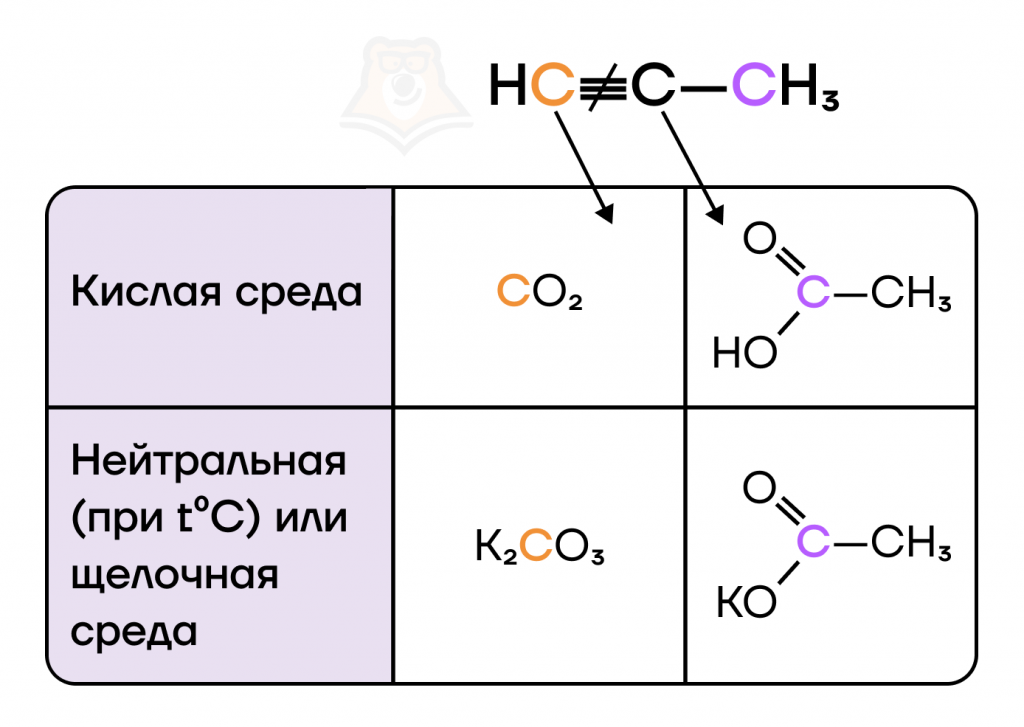
В реакции ниже сернокислый раствор перманганата калия окисляет пропин.
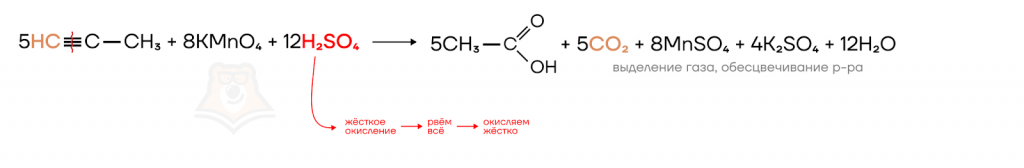
При разрыве тройной связи образуются углекислый газ и уксусная кислота. При этом обесцвечивается раствор перманганата калия.
Однако, если в реакцию со щелочным раствором перманганата калия вступает бутин-2 (симметричная относительно тройной связи молекула), то образуется всего один органический продукт — ацетат калия.
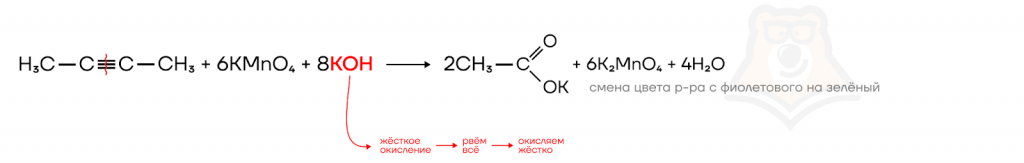
Раствор меняет цвет с фиолетового (KMnO4) на зеленый (K2MnO4).
При окислении алкинов сильными окислителями в нейтральной среде образующиеся органические продукты (кислота, углекислый газ) будут реагировать с образующейся в растворе щелочью. Например, окисление того же бутина-2 водным раствором перманганата калия при нагревании протекает в соответствии с реакцией ниже:
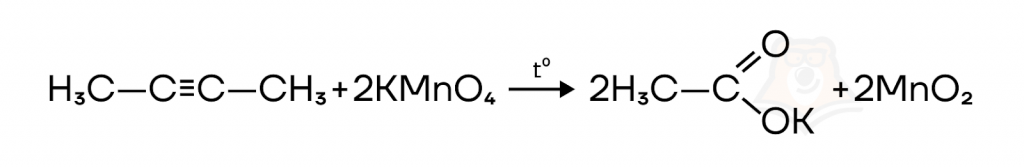
Вместо уксусной кислоты образуется ацетат калия, а побочным продуктом восстановления перманганата калия будет оксид марганца(IV) бурого цвета.
- Замещение. В реакциях замещения участвуют только терминальные алкины — алкины, на концах которых находится тройная связь. Такие алкины проявляют слабые кислотные свойства: атом водорода, который находится при концевой тройной связи, может замещаться на металл.
а) В такие реакции вступают щелочные металлы, их гидриды и амиды.

В реакции ацетилена с натрием образуется ацетиленид натрия и выделяется водород.
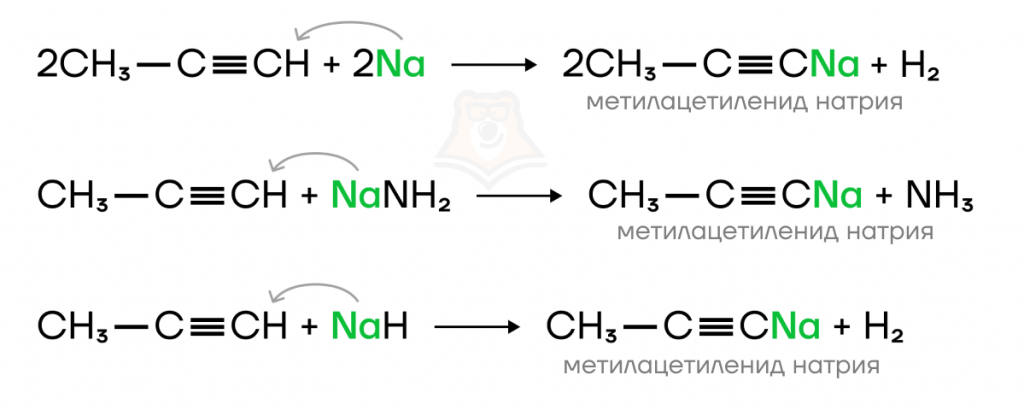
Пропин при взаимодействии с натрием, амидом или гидридом натрия превращается в метилацетиленид натрия.
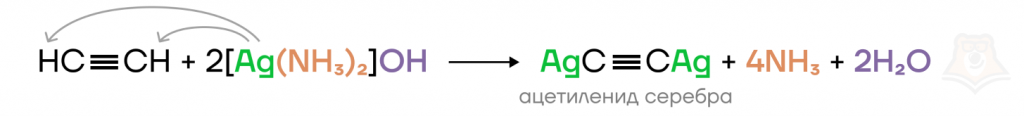
б) Также с алкинами могут взаимодействовать: аммиачный раствор оксида серебра(I), хлорида и гидроксида меди(I). В таких реакциях образуются ацетилениды.
Например, при взаимодействии ацетилена с аммиачным раствором оксида серебра(I) образуется белый осадок ацетиленида серебра(I).
А при взаимодействии с аммиачным раствором гидроксида меди(I): красный осадок ацетиленида меди(I).

Аналогично протекают реакции с другими терминальными алкинами, с которыми вы можете ознакомиться ниже.

При замещении водорода в пропине на металл под действием аммиачного раствора оксида серебра(I), хлорида или гидроксида меди(II) образуется метилацетиленид соответствующего металла.
Еще раз отметим, что все перечисленные в этом пункте взаимодействия характерны именно для терминальных алкинов, другие представители этого класса в подобные реакции не вступают.
- Горение. Здесь все просто — все углеводороды горят до углекислого газа и воды. И алкины не исключение. Только горят они, в большинстве случаев, коптящим пламенем, вследствие высокого отношения числа атомов углерода к числу атомов водорода.

Коптящее пламя означает, что процесс горения отрегулирован плохо и часть несгоревшего углерода улетает вместе с дымом. Если дать избыточное количество воздуха, чтобы более полноценно сжечь топливо, то выделение черного дыма прекратится. Но потери тепла могут возрасти за счет подогрева дополнительного количества воздуха, который, уходя горячим в трубу, будет уносить часть тепла.
При горении ацетилена (первый представитель алкинов) выделяется очень много тепла, поэтому его используют для сварки (той самой, на которую нельзя смотреть) и резки металлов.
Давайте подведем итог: с чем реагируют алкины? Нам поможет схема.
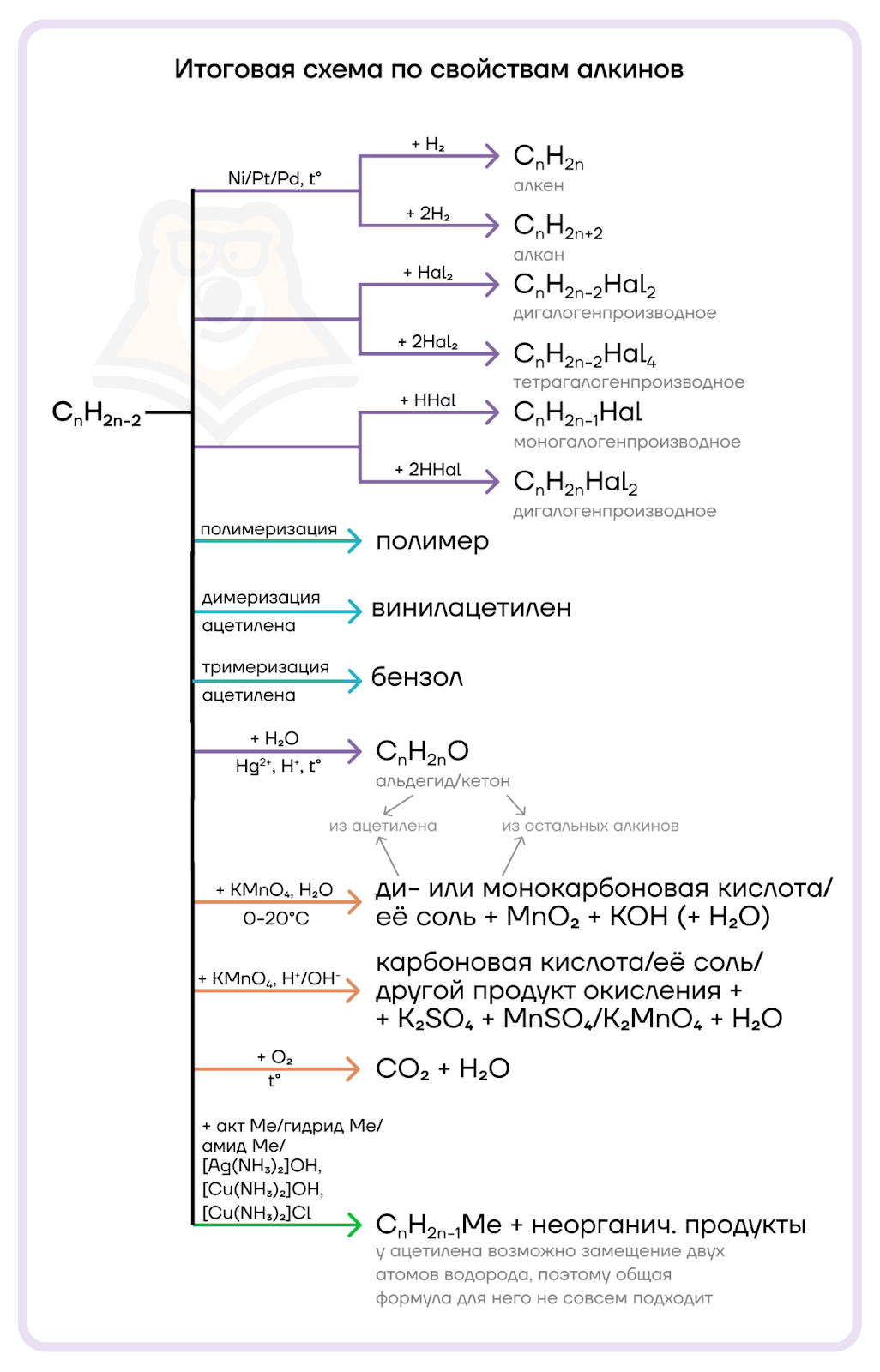
Мы изучили все химические свойства алкинов, которые могут нам встретиться на экзамене, поэтому можем закрепить полученные знания, решив задание №12 ЕГЭ по химии.
Задание. Из предложенного перечня выберите два углеводорода, которые реагируют с аммиачным раствором оксида серебра(I).
1) ацетилен
2) этилен
3) пропен
4) бутин-2
5) пропин
Решение. В реакцию с аммиачным раствором оксида серебра(I) могут вступать терминальные алкины — алкины, на концах которых находится тройная связь. Алкены в такую реакцию не вступают.
1) Ацетилен (CH≡CH) — это терминальный алкин.
CH≡CH + 2[Ag(NH3)2]OH → Ag–C≡C–Ag + 4NH3 + 2H2O
2) Этилен (CH2=CH2) — это алкен.
3) Пропен (CH3–CH=CH2) — это алкен.
4) Бутин-2 (CH3–C≡C–CH3) — это не терминальный алкин.5) Пропин (CH3–C≡CH) — это терминальный алкин.
CH3–С≡CH + [Ag(NH3)2]OH → CH3–C≡C–Ag + 2NH3 + H2O
Ответ: 15
Химические свойства алкинов очень разнообразны. Из них можно синтезировать многие другие классы органических веществ. А сейчас давайте узнаем, как можно синтезировать сами алкины.
Получение алкинов
Алкины необходимы человечеству, ведь из них получают клей ПВА, различные спирты, каучуки, кислоты, альдегиды, а также их используют в качестве растворителя в парфюмерии.
Есть несколько способов получения алкинов.
- Пиролиз (разложение при нагревании) метана при 1200-1500°C — получение ацетилена (C2H2).
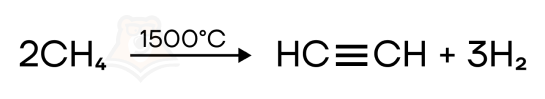
- Гидролиз (разложение под действием воды) карбида кальция — получение ацетилена.
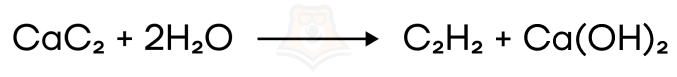
| Ацетилен светится? Ацетиленовый фонарь — это источник света, работа которого основана на реакции получения ацетилена из карбида кальция (реакция выше) и последующем его сгорании в кислороде. Такие фонари пользовались популярностью в XX веке. Их производство началось после открытия Анри Муассаном в 1894 году реакции сплавления древесного угля (C) и извести (CaO) в усовершенствованной им электродуговой печи, что позволило удешевить производство карбида кальция. 3C + CaO → CaC2 + CO Как работает фонарь? Для первой реакции нам нужен карбид кальция и вода, а для второй – горелка. Образующийся газ ацетилен (C2H2) сгорает с выделением огромного количества тепла (об этом мы говорили в его химических свойствах) и света! Так как в его молекуле углерода по массе 14/15, его частички перед горением раскаляются добела, создавая яркое белое пламя. В чем плюсы такого фонаря? Создаваемый свет очень близок к солнечному, он является естественным, и ацетилен менее ядовит, чем светильный газ (смесь водорода, метана, угарного газа и др.) |

Также ацетилен можно получить и в реакции кислотного гидролиза карбида кальция. Отличие этой реакции заключается во взаимодействии с кислотой и образовании хлорида кальция.
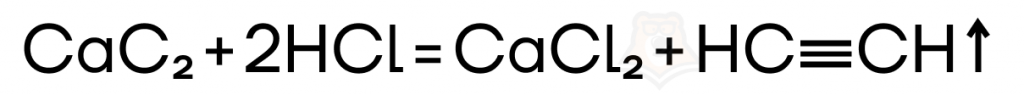
- Взаимодействие ацетиленидов с галогеналканами. В результате данной реакции удлиняется углеводородная цепочка, образуется «удлиненный» алкин и галогенид металла.

- Дегидрирование (отщепление молекулы водорода) алкенов и алканов. Реакция протекает при нагревании с использованием катализатора (Ni, Pt, Pd или Cr2O3).
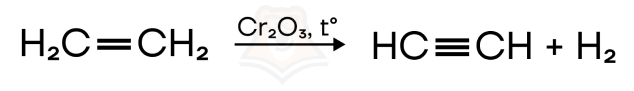
- Дегидрогалогенирование (отщепление молекулы галогеноводорода) дигалогеналканов спиртовым раствором щелочи. При этом атомы галогена должны находиться у одного или у соседних атомов углерода, чтобы тройная связь замкнулась.
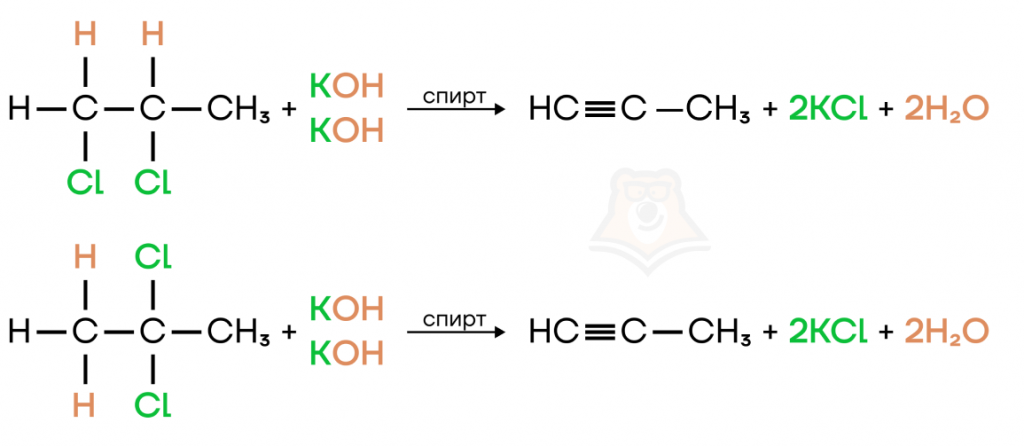
- Дегалогенирование (отщепление молекулы галогена) дигалогеналканов цинком или магнием. Чтобы мы могли получить тройную связь, пары атомов галогена также должны находиться у соседних атомов углерода.
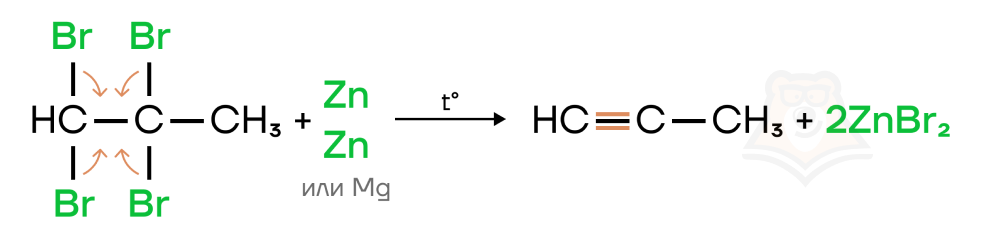
Применение алкинов
Хоть класс алкинов и включает в себя огромное количество производных, но все-таки одним из самых ярких представителей этого класса является ацетилен.
Как уже было сказано, ацетилен сгорает в кислороде с выделением большого количества тепла и применяется для сварки и резки металлов.
Помимо этого ацетилен является сырьем для получения уксусного альдегида (1 реакция) и винилхлорида (2 реакция).
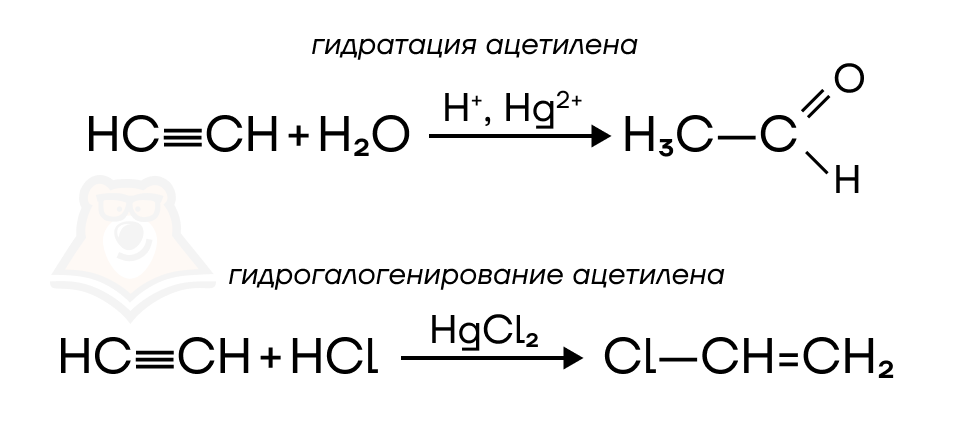
В дальнейшем из уксусного альдегида получают уксусную кислоту (CH3COOH) и ПВХ (поливинилхлорид).
Помимо этого реакцией димеризации ацетилена получают винилацетилен, из которого уже можно получить хлоропрен и 1,3-бутадиен — исходное сырье в получении синтетического каучука.
Более подробно с применением ацетилена можно ознакомиться на схеме ниже.
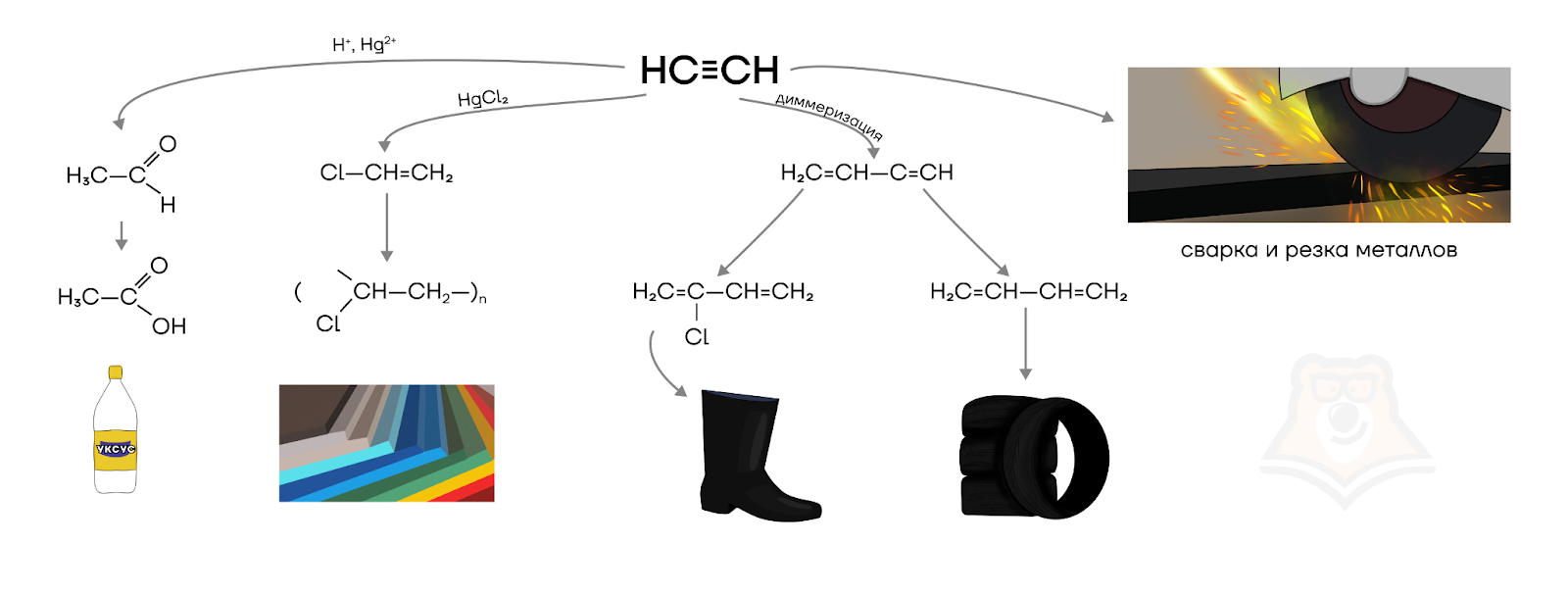
Другие алкины в основном аналогично ацетилену являются сырьем для производства других органических соединений.
Мы изучили алкины — один из интереснейших классов органических соединений. Чего только стоит количество сфер жизни, в которых алкины находят свое применение. Но на них все не заканчивается. И впереди нас ждут много других занимательных статей по не менее интересным классам органических веществ, например, «Арены. Бензол как представитель ароматических углеводородов».
Термины
Ацетилениды — это соли ацетилена или его производных, в которых один или два атома водорода при тройной связи замещены на атомы металлов.
Органический растворитель — это жидкое органическое вещество, которое способно растворять другие соединения.
Фактчек
- Алкины — непредельные (есть кратные связи — двойные или тройные) ациклические углеводородные соединения, которые содержат одну тройную связь.
- Общая формула алкинов выглядит так: СnH2n-2.
- Атомы углерода, участвующие в образовании тройной связи (одна связь — сигма, две остальные — пи), находятся в состоянии sp-гибридизации.
- Валентный угол и длина связи равны 180° и 0,120 нм соответственно.
- Гомологами алкинов будут алкины, имеющие сходное строение (положение тройной связи и заместителей (при наличии)), но отличаются на одну или несколько групп -CH2-.
- С увеличением числа атомов углерода в углеродной цепи происходит переход сначала от газообразных алкинов к жидким, а затем к твердым.
- Для всех алкинов характерны реакции с галогенами, водородом, галогеноводородами, водой, кислородом, а также полимеризация, мягкое и жесткое окисление. Для терминальных алкинов также характерны реакции замещения.
Проверь себя
Задание 1.
Что является алкином?
- Дивинил
- Ацетилен
- Пропан
- Пропилен
Задание 2.
С чем не реагируют алкины?
- С бромом
- С кислородом
- С фосфором
- С хлором
Задание 3.
С чем реагирует ацетилен?
- С метанолом
- С муравьиной кислотой
- С перманганатом калия
- С пропином
Задание 4.
Где не применяют ацетилен?
- В синтезе каучуков
- При производстве резины
- В резке металлов
- В консервировании
Задание 5.
С чем реагирует пропин?
- С натрием
- С серебром
- С медью
- С золотом
Ответы: 1. — 2; 2. — 3; 3. — 3; 4. — 4; 5. — 1.


 к списку статей
к списку статей






