Типы кристаллических решеток
На этой странице вы узнаете
- Кто скрывается за решеткой в химическом мире, и удалось ли кому-то этого избежать?
- Что объединяет любителей шоколада и украшений?
- Почему углерод может быть и драгоценным камнем, и ключевой деталью пишущей принадлежности?
В человеческом мире за решеткой находятся преступники. Но решетки бывают разные. За одними сидят особо опасные преступники, за другими менее опасные. В химическом мире тоже есть «преступники», которые скрываются за разными типами решеток. С видами таких решеток нам предстоит сегодня познакомиться.
Кристаллическая решетка
Кристаллическая решетка — это схема, показывающая, как расположены частицы (атомы, молекулы, ионы) в кристалле.
По расположению частиц выделяют аморфные и кристаллические вещества.
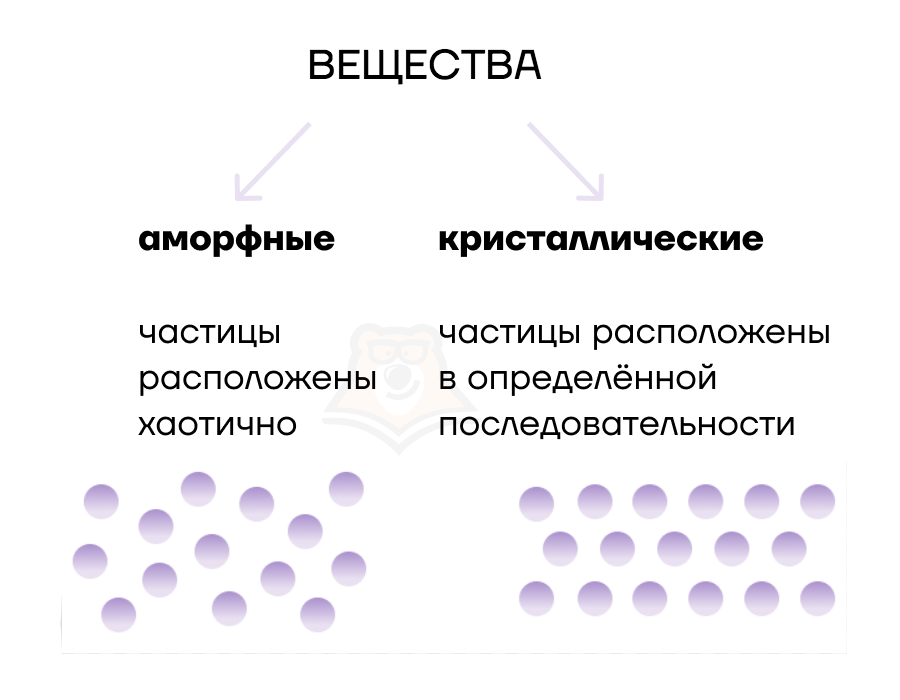
| Кто скрывается за решеткой в химическом мире, и удалось ли кому-то этого избежать? Теперь мы понимаем, что аморфным веществам удалось избежать строгого тюремного режима, поэтому их частицы располагаются так, как хотят — хаотично. Кристаллическим веществам повезло не так сильно, потому что им приказывают строиться в строгой последовательности. |
Аморфные вещества
Для начала определимся, что же такое аморфные вещества.
Аморфные вещества — вещества, не имеющие кристаллической решетки, в которых частицы расположены хаотично.
Стабильно-аморфные вещества не затвердевают с образованием кристаллических граней. И обладают изотропией свойств, то есть не обнаруживают различия свойств в разных направлениях. Такая конструкция не является устойчивой и, постепенно видоизменяясь, имеет склонность к переходу в кристаллическую.
| Что объединяет любителей шоколада и украшений? По сути, и те и другие любят аморфные вещества. Потому что они входят в состав и шоколада, и украшений с жемчугом, например. А также аморфные соединения можно встретить в: — воске; — янтаре; — полиэтилене; — стекле и т.д. |
Состав кристаллических решеток
У каждой кристаллической решетки (КР) есть узлы, именно в них и находятся частицы кристаллических веществ. То есть узлы решетки — места расположения частиц.
Что зависит от частиц? От них зависит тип кристаллической решетки.
Какие бывают типы кристаллических решеток?
- атомная;
- молекулярная;
- ионная;
- металлическая.
Типы кристаллических решеток
Но для начала важно понять, как не путаться во всех типах решеток? Как запомнить все их свойства?
Достаточно вспомнить по одному представителю от каждой кристаллической решетки и тогда все сразу станет понятно.
Например, типичный представитель ионной решетки — NaCl. Это поваренная соль, которая есть почти у каждого в доме.

- Вспоминаем, какая она на ощупь? Твердая, прочная.
- А куда мы ее добавляем? Например, в суп. Что она там делает? Растворяется. Значит, у веществ с ионной кристаллической решеткой хорошая растворимость в воде.
- А что мы почувствуем, если понюхаем соль? Почти ничего. Значит, запах отсутствует.
Вот и все, не так уж и сложно, согласитесь?
Атомная решетка
Что для нее характерно?
- Самая высокая твердость, прочность, а также t° плавления и кипения = тугоплавкость. Запоминаем, что все «самое лучшее» забирает себе атомная решетка.
- Нерастворимость, нелетучесть, нет запаха. Вспомним песок, который имеет атомную КР. Он не растворяется в воде, иначе пляжа бы не существовало бы. Песок не летуч, у него нет запаха, вот и все, ничего даже учить не придется.
- Отсутствие электропроводности и желания с кем-то реагировать (химически инертны).
Что находится в узлах решетки?
Все очень логично: в узлах атомной решетки находятся атомы, связанные прочными ковалентными связями.
Какие есть примеры веществ с атомной кристаллической решеткой?
- Кремнезем = песок = кварц = горный хрусталь (SiO₂), карборунд = карбид кремния (SiC), графит и алмаз (С).
- Красный и черный фосфор (Р).
- Оксид бора B₂O₃, нитрид бора BN.
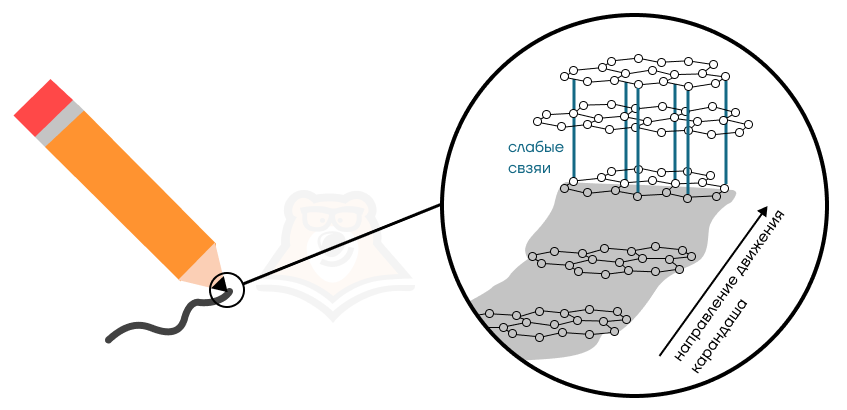
Молекулярная решетка
Что для нее характерно?

- Малая твердость и прочность => хрупкость.
- Самые низкие t° плавления и кипения. Молекулярную кристаллическую решетку имеют газы, для которых характерны как раз самые низкие температуры плавления и кипения, все логично.
- Плохая растворимость и электропроводность. Исключения: растворы аминов, NH₃ — аммиака и кислот.
- Летучесть, способность к возгонке, то есть переходу из твердого состояния в газообразное, минуя жидкое. Так, вода при особых условиях может изо льда превратиться сразу в газ, минуя стадию воды.
- Легкоплавкость.
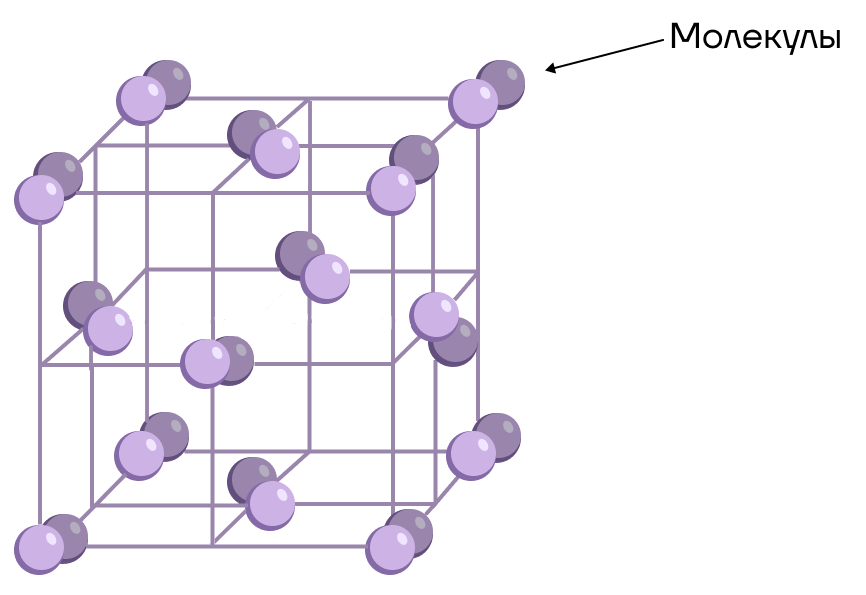
Что находится в узлах решетки?
И снова все очень логично: в узлах молекулярной решетки находятся молекулы, внутри которых связи прочные, а между ними прочность связи слабая.
Какие есть примеры веществ с молекулярной решеткой?
- Все вещества с ковалентными связями, то есть газы, жидкости, кислоты.
- Белый фосфор (Р₄), оксид фосфора (V) P₂O₅.
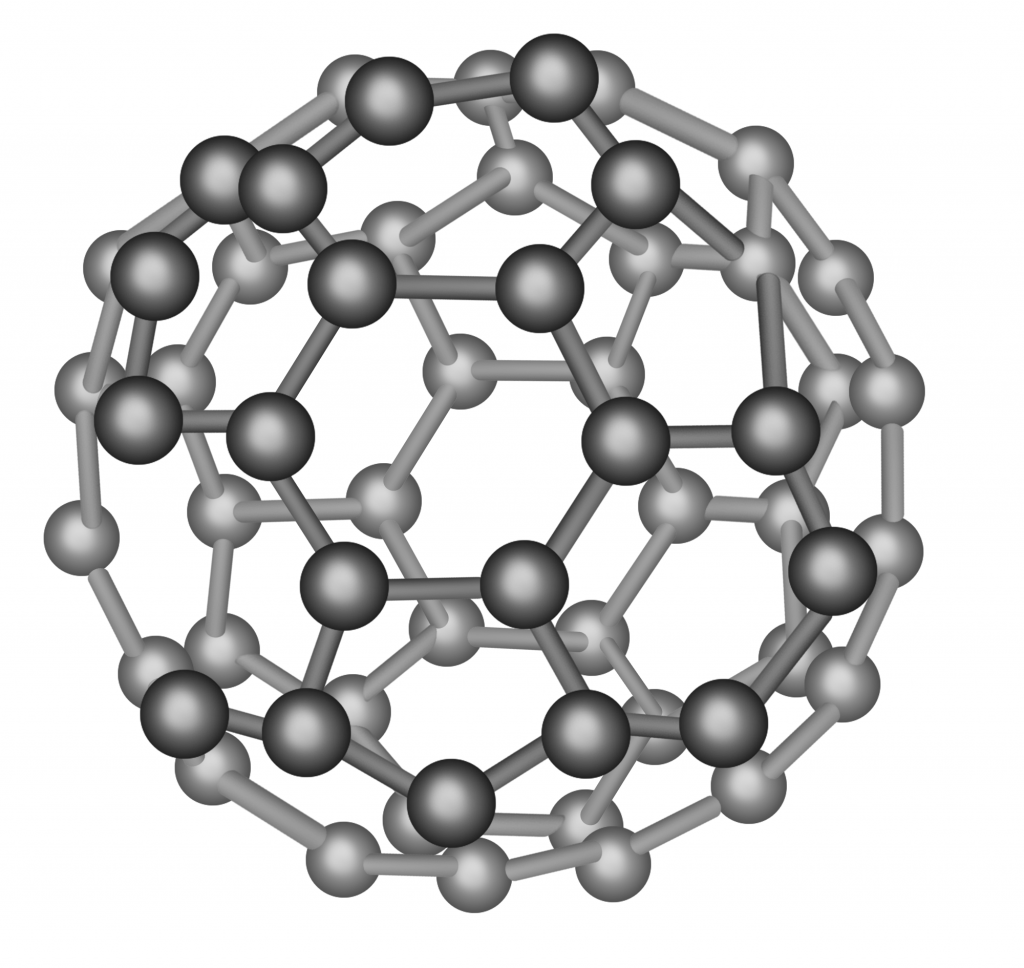
- Фуллерен (C₆₀), пероксид водорода H₂O₂.
- Хлорид кремния (IV) SiCl₄, cилан SiH₄.
Ионная решетка
Что для нее характерно?

- Твердость, но хрупкость.
- Высокие t° плавления и кипения.
- Хорошая растворимость в воде. Снова вспоминаем поваренную соль, она легко растворяется в воде.
- Малая летучесть и отсутствие запаха. Опять же поваренная соль не летуча и не имеет никакого характерного запаха.
- Проводят ток. Только растворы и расплавы за счет диссоциации — распада на ионы.
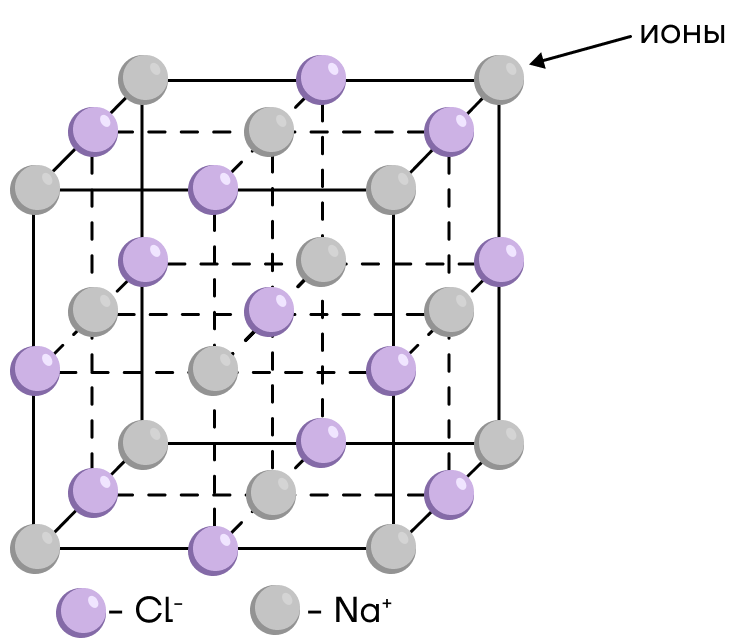
Что находится в узлах решетки?
В узлах ионной решетки находятся ионы, соединенные ионными связями.
Какие есть примеры веществ с атомной кристаллической решеткой?
- Неорганические соли (NaCl, K₂SO₄).
- Некоторые органические соли: соли карбоновых кислот — CН3COOK, соли аммония — NН4Cl, соли аминов — CH3NH3Br.
- Оксиды и гидроксиды металлов (Ме + неМе).
Металлическая решетка
Что для нее характерно?
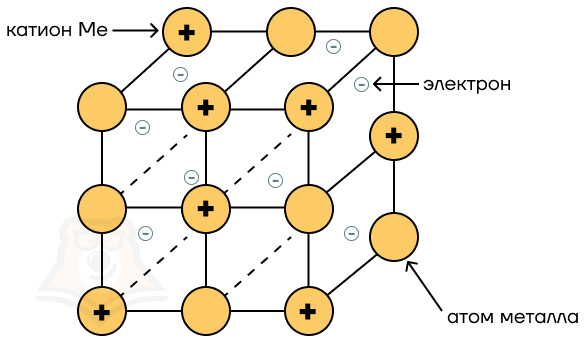
- Высокая твердость, прочность, t° плавления и кипения.
- Нерастворимость в воде.
- Металлический блеск, пластичность, ковкость. Вспоминаем золотые сережки и понимаем, что все эти свойства подходят для них.
- Тепло— и электропроводность.

Что находится в узлах решетки?
Здесь уже чуть посложнее: в узлах металлической решетки находятся металлы (атомы) и их положительно заряженные катионы (ионы металлов), а между ними блуждают электроны.
Какие есть примеры веществ с атомной кристаллической решеткой?
- Все металлы — Na, Mg, Ca и т.д.
- Сплавы металлов — бронза, латунь, сталь и др.
Мы рассмотрели все типы кристаллических решеток. Но у некоторых химических веществ есть суперспособность — менять свои химические и физические свойства в зависимости от расположения атомов в кристаллической решетке.
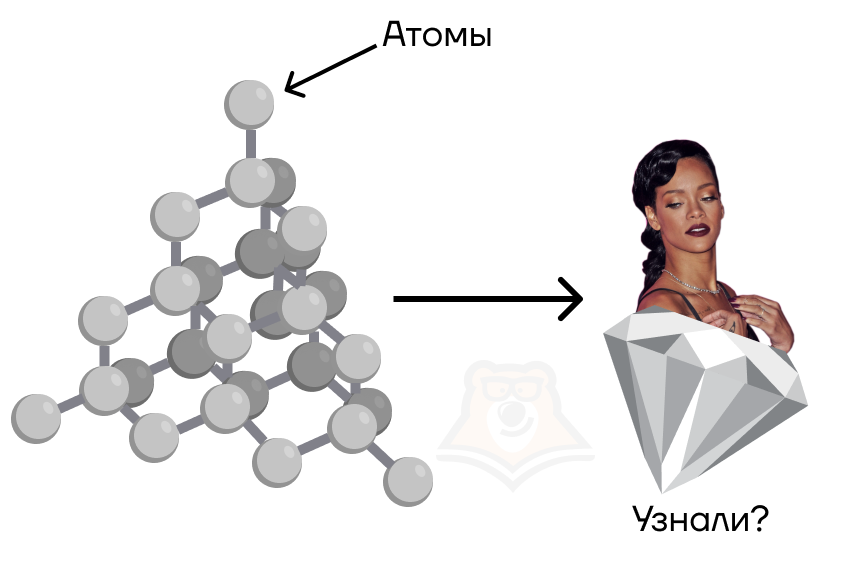
| Почему углерод может быть и драгоценным камнем, и ключевой деталью пишущей принадлежности? Все дело в аллотропии. Что это за слово? У человека это называется раздвоением личности, а у веществ аллотропией. Это значит, что один и тот же элемент может образовывать два и более вида простых веществ. Алмаз (драгоценный камень) и графит (стержень простого карандаша) образованы одним и тем же элементом — углеродом. Поэтому в зависимости от расположения частиц в кристаллической решетке углерод будет либо алмазом, либо графитом. |
Что еще скрывает от нас углерод. Оказывается, у него есть еще третья личность — фуллерен (С60). Кстати, он применяется в изготовлении косметики и лекарств.
Все, больше у углерода не осталось секретов.
Еще один многоликий хитрец — фосфор.
У фосфора тоже есть три личности: красный, белый и черный.
- Красный фосфор самый распространенный. Он применяется в производстве спичек, взрывчатых веществ.
- Черный фосфор используется в полупроводниках.
- Белый фосфор используется для изготовления снарядов, которые светятся в темноте.
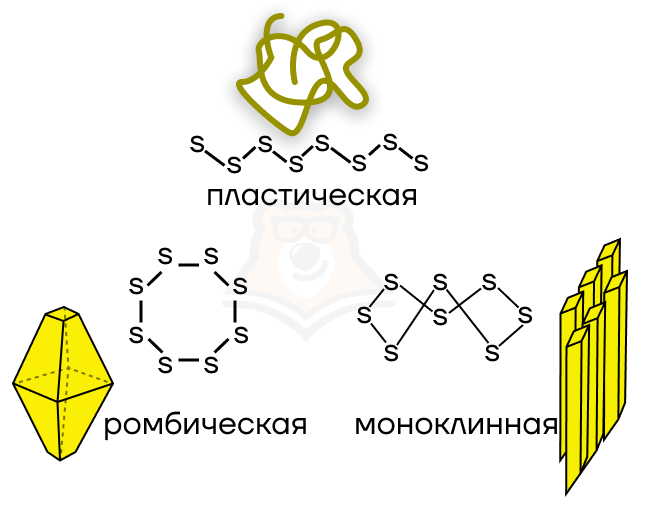
Оказывается, что и у серы есть от нас секретики: она бывает ромбическая, пластическая и моноклинная. Используется в производстве резины, красителей и спичек.
И последний элемент, чьи секреты мы сейчас узнаем — это кислород. У него есть только две личности: кислород (О2) и озон (О3), который образует озоновый слой.
| Кислород (О2) | Озон (О3) |
| Газ без цвета, вкуса, запаха. | Газ без цвета, с сильным характерным запахом. |
| Мало растворим в воде. | Хорошо растворим в воде. |
| Жидкий — светло-голубой, твердый — синий. | Жидкий — синий, твердый — темно-фиолетовый. |
Современные представления о веществах
А теперь поговорим о современных представлениях о строении твердых, жидких и газообразных веществ. Все, что нужно знать об их отличиях видно в сравнительной таблице, приведенной ниже.
| Твердое тело | Жидкость | Газ | |
| Строение | |||
| Расстояния между молекулами | Сравнимо с размером молекул | Чуть больше, чем в твердом теле | Многократно превышает размеры молекул |
| Характер движения | Колебательное | Скачкообразное | Хаотическое |
| Скорости молекул | Малы | Скорее малы | Огромны |
| Взаимодействие между молекулами | Наибольшее | Меньше, чем у твердых тел | Наименьшее |
В 1861 году Александр Михайлович Бутлеров предложил миру свою Теорию химического строения веществ. Она господствует в химии до сих пор. Главные положения этой теории следующие:
- Атомы в молекулах веществ соединены друг с другом согласно их валентности, порядок распределения связей в молекуле называется химическим строением.
- Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
- Свойства веществ зависят не только от их качественного и количественного состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
- Атомы в молекулах оказывают влияние друг на друга, и это влияние приводит к химическим изменениям поведения атома.
- Определить состав и строение химического вещества можно по продуктам химических превращений.
Фактчек
- Кристаллическая решетка — это то, как расположены частицы (атомы, молекулы, ионы) в кристалле.
- Выделяют четыре типа кристаллических решеток: молекулярную, атомную ионную и металлическую.
- Молекулярная КР содержит в узлах решетки — молекулы, атомная — атомы, ионная — ионы, металлическая — атомы и ионы металлов.
- Не все вещества имеют КР. Например, аморфные вещества (воск, стекло, шоколад) КР не имеют.
- Чтобы не приходилось заучивать очень длинные списки веществ для каждого типа решетки, запоминаем, что металлическую КР имеют все металлы, их сплавы и все; молекулярную — почти вся органика, большинство газов и жидкостей, ионную — соли; атомную — остальное.
Проверь себя
Задание 1.
Какая кристаллическая решетка у хлорида калия?
- молекулярная
- атомная
- ионная
- металлическая
Задание 2.
Какая кристаллическая решетка у хлора?
- молекулярная
- атомная
- ионная
- металлическая
Задание 3.
Какая кристаллическая решетка у меди?
- молекулярная
- атомная
- ионная
- металлическая
Задание 4.
Какая кристаллическая решетка алмаза?
- молекулярная
- атомная
- ионная
- металлическая
Ответы: 1. — 3; 2. — 1; 3. — 4; 4. — 2.


 к списку статей
к списку статей