Скорость химической реакции
Вещества, как и люди, могут передвигаться пешком, а могут ездить на такси. О том, как это происходит, расскажем в этой статье.
На этой странице вы узнаете
- Катализатор – ваш лучший друг?
- Что общего у реагентов и продавцов-консультантов из магазина одежды?
- Можно ли пантеру превратить в черепаху?
Химические реакции на ускорении
Скорость химической реакции – быстрота её протекания. То есть она показывает, насколько быстро расходуются реагенты и образуются продукты.
Важно понять, от чего может зависеть скорость химической реакции. Есть шесть основных факторов:
- наличие катализатора,
- температура,
- концентрация реагентов,
- давление,
- площадь соприкосновения реагентов,
- природа реагентов.
От чего зависит скорость реакции
- От наличия катализатора (k)
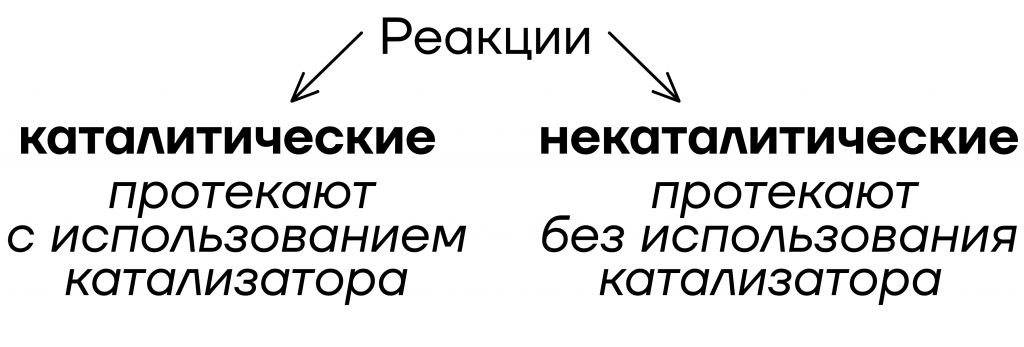
Всё понятно, кроме одного: что же такое катализатор?
Катализатор – вещество, которое ускоряет реакцию, но не расходуется в процессе.
| Катализатор – ваш лучший друг? Представьте, что вы пришли на вечеринку, где никого не знаете. Как вы себя чувствуете? Наверное, немного неловко. Вы решили вспомнить и рассказать несколько анекдотов. Общаться будет намного проще, то есть юмор послужил ускорителем вашего разговора с кем-то. Но запас шуток имеет свойство заканчиваться, поэтому назвать его катализатором мы не можем! Теперь давайте представим, что на вечеринке вы встретили лучшего друга. Вдвоём легче знакомиться, не так страшно, согласитесь. Получается, что друг – катализатор вашего общения с кем-то, ведь он не расходуется в процессе в отличие от запаса анекдотов! |
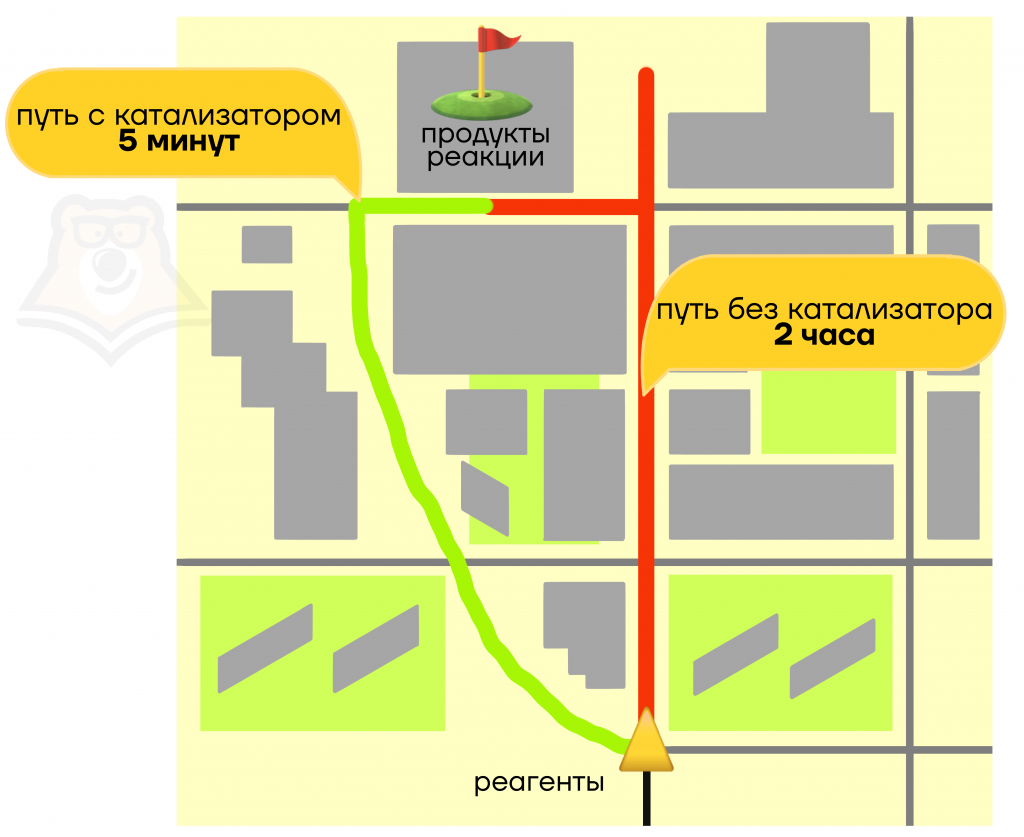
У катализатора есть своя реакция, которую он вызывает. Каталитическая реакция – это реакция которая протекает быстрее обычной за счет использования катализатора.
Если перевести это на человеческий язык, то люди пешком (без катализатора) идут медленнее, чем едут на такси (с катализатором).
У катализатора есть двойник с абсолютно обратными характеристиками – ингибитор. Раз катализатор увеличивает скорость реакции, значит, ингибитор будет её уменьшать.
Каким же образом работает катализатор? Тут в игру вступает энергия активации.
Энергия активации — энергия, которая требуется для достижения системой переходного состояния активного комплекса, после которого образование продукта идет уже самопроизвольно.
Катализатор уменьшает энергию активации, а чем меньше энергия — тем быстрее протекает реакция.
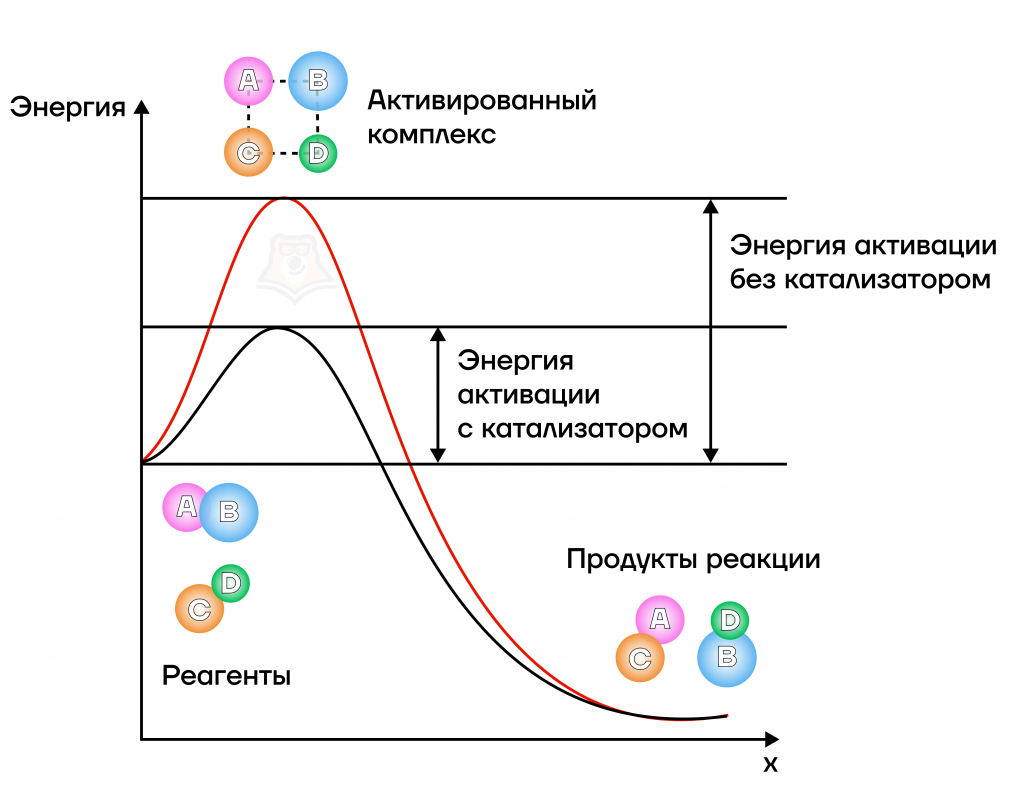

Важно помнить — если реакция некаталитическая, то добавление катализатора не будет влиять на скорость реакции. Почему так? Как мы уже говорили, катализатор влияет на энергию активации, то есть он ускоряет наступление переходного состояния. Но для некаталитических реакций самопроизвольное образование продукта характерно и без промежуточного этапа, поэтому влиять попросту не на что.
Можно сравнить это с поездкой на такси — чем раньше мы закажем машину и сядем в нее, тем быстрее приедем в нужное место.
У катализатора есть двойник с абсолютно обратными характеристиками – ингибитор. Раз катализатор увеличивает скорость реакции, значит, ингибитор будет её уменьшать.
- От температуры (t)

Важно понимать, что молекулы/частицы при нагревании начинают быстрее двигаться и чаще сталкиваться.
Представим, что мы лежим на пляже. Если погода облачная, то нам тепло, а если погода ясная, нам становится жарче (увеличивается температура тела), и тем быстрее мы загораем или обгораем (скорость реакции увеличивается).
- От концентрации реагентов
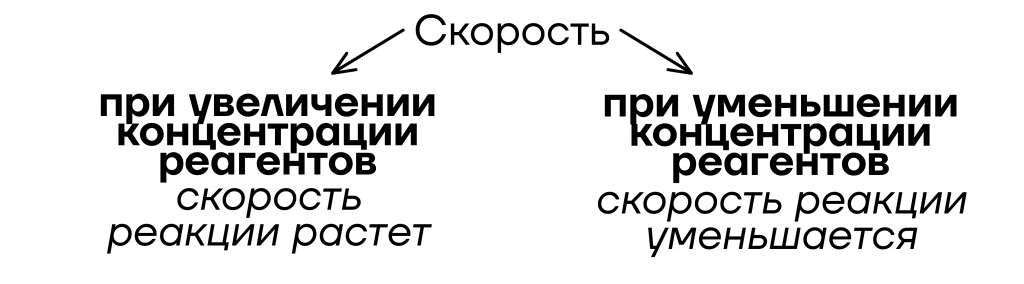
Уточнение: только для жидкостей и газов
| Важно! Понятие концентрации распространяется только на газы и жидкости, то есть добавление твердого вещества обычно не влияет на скорость реакции. |
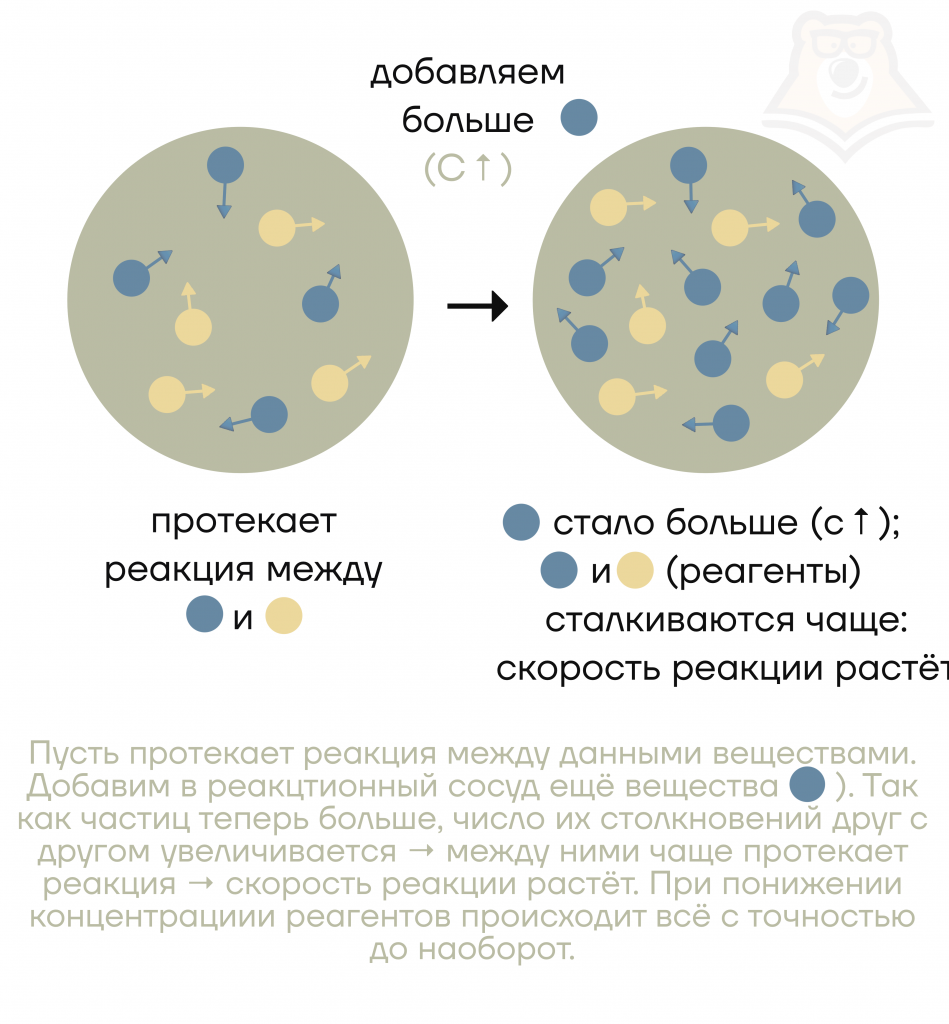
Почему добавление твердого вещества чаще всего не влияет на скорость реакции?
Потому что при добавлении твердого вещества увеличение концентрации реагента не произойдет. А без реагентов реакция не захочет разогнаться и скорость останется неизменной.
- От давления
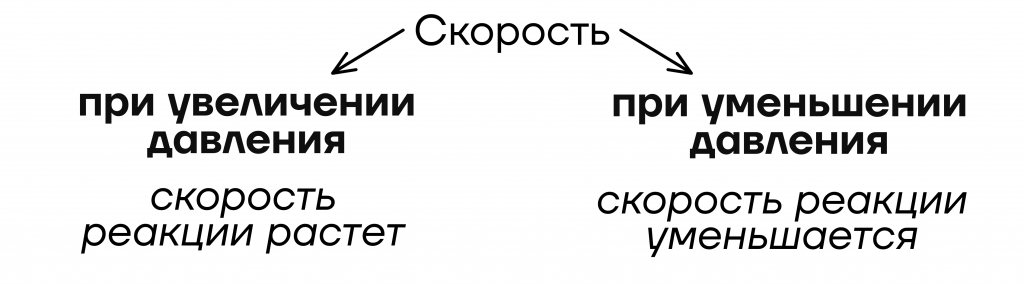
Уточнение: только для газов
| Важно! Так как газы – это единственные по агрегатному состоянию вещества, которые способны распределяться по всему объему реакционного сосуда, то изменение давления будет влиять только на них. |
Значит, если в реагентах есть хотя бы один газ – изменение давления будет влиять на скорость реакции.
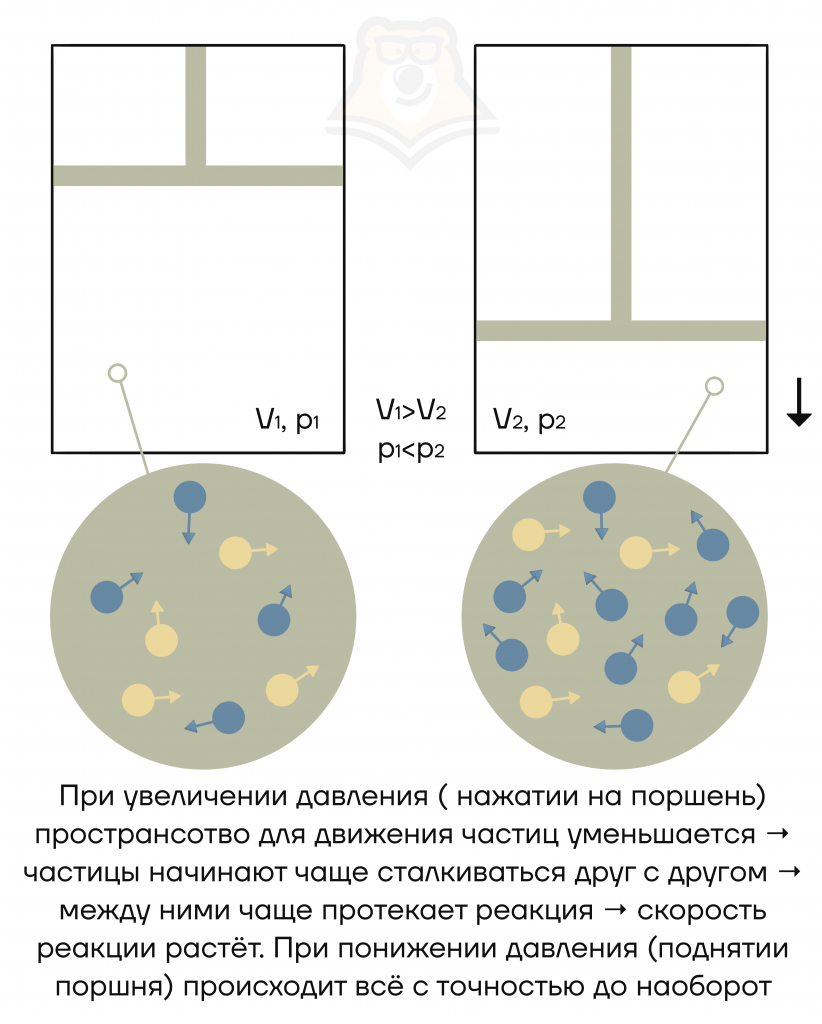
Как связаны между собой давление и объем?
Это две противоположные величины:
- увеличение давления = уменьшение объема;
- уменьшение давления = увеличение объема.
Как это запомнить? Специально для этого мы приготовили простую картинку. Просто уделите ей минутку внимания, и всё уложится в голове.
- От площади соприкосновения реагентов = степени измельчения
Уточнение: только если в реагентах есть хотя бы одно твердое вещество
Давайте наглядно посмотрим на реакцию между цинком и соляной кислотой. В первом стакане будет протекать медленнее, чем во втором.
| Что общего у реагентов и магазина одежды? Чтобы понять реакцию, вернемся ненадолго в человеческий мир. Представим, что мы попали на распродажу в магазин одежды. Сотня людей (много молекул кислоты) пришла за новой одеждой. А в этом центре работает только один продавец-консультант (кусок цинка). Люди будут очень долго ждать своей очереди и возможности задать вопрос, попросить нужный размер, примерить одежду. Это будет очень медленно. Если же в этом же центре будет работать 40 специалистов (порошок цинка, состоящий из 40 мелких частиц), то люди (соляная кислота) намного быстрее получат помощь! |
Перемешивание веществ тоже увеличит скорость реакции за счет увеличения скорости соприкосновения веществ.
Чтобы это понять, достаточно представить чай. Если туда добавить ложку сахара и не перемешивать его, равномерное распределение сахара по стакану будет происходить очень медленно. Однако если размешать его ложкой, то скорость возрастет!
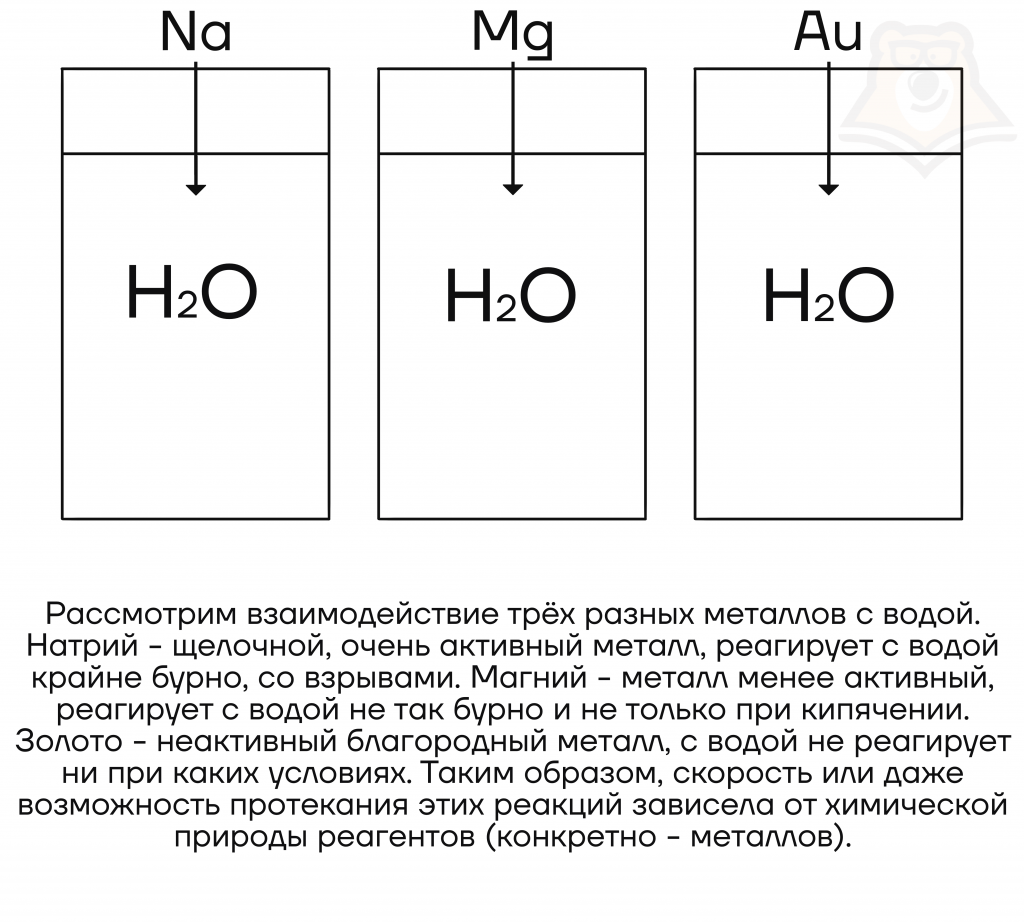
- От природы реагентов
При реакции воды с металлами скорость реакции уменьшается с уменьшением активности металла. То есть активнее всего с водой будут реагировать именно щелочные металлы.
У людей всё также. Скорость поиска друзей или работы зависит от активности человека. Чем более активный человек, тем быстрее он достигнет цели.
Еще нужно помнить, что быстрее всего протекают реакции между газами и между растворами.
| А можно ли пантеру превратить в черепаху при помощи химии? Можно, и это даже не магия. Для этого всего лишь нужно замедлить скорость реакции. Это можно сделать путем добавления ингибитора, уменьшения температуры, концентрации реагентов, давления, площади соприкосновения веществ, а также снижения активности реагентов. |
Фактчек
- Скорость химической реакции – быстрота её протекания. То есть она показывает, насколько быстро расходуются реагенты и образуются продукты.
- Скорость абсолютно всех реакций зависит от температуры и от природы реагентов.
- Скорость некоторых реакций зависит ещё от нескольких факторов:
- газы зависят от давления и объема реакционного сосуда;
- катализатор применим только для каталитических реакций;
- концентрация вещества влияет чаще всего только на жидкости и газы;
- площадь соприкосновения реагентов – только на те реакции, где есть хотя бы один твердый реагент.
Проверь себя
Задание 1.
Что произойдет со скоростью реакции при увеличении концентрации водорода в следующей реакции: H2 + Cl2 = 2HCl
- Увеличится
- Уменьшится
- Не изменится
Задание 2.
Какой фактор не влияет на скорость реакции: 6Li +N2 = 2Li3N
- Давление
- Добавление катализатора
- Температура
- Площадь поверхности соприкосновения веществ
Задание 3.
Какой фактор влияет на скорость реакции: NaOH + HCl = NaCl + H2O
- Давление
- Разбавление смеси водой
- Добавление катализатора
- Площадь поверхности соприкосновения веществ
Ответы: 1. — 1; 2. — 2; 3. — 2.


 к списку статей
к списку статей





