Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
На этой странице вы узнаете
- Чем радикалы в жизни схожи с радикалами в химии?
- Каким атомам свойственно быть жадными и не делиться электронами?
- Как Марковников завоевал органическую химию?
Практически все, что нас окружает, будь то вирусы, часы или экономические циклы, работает по строгим механизмам. Химические органические реакции не являются исключением — им также присуще протекать по определенным правилам. Давайте разберемся, по каким законам протекают такие реакции и как их можно классифицировать.
Механизмы реакций в органической химии
Органические реакции очень разнообразны. Некоторые протекают при температуре 1000℃, а другие в условиях сильного охлаждения. В одних случаях реакции протекают молниеносно, а в других мы ждем несколько часов, чтобы увидеть какие-то изменения в пробирке. Откуда такое разнообразие? Все из-за разных механизмов реакций. В ходе органических реакций разрывается и образуется много новых химических связей (или по-другому «коннекшнс»). И происходит это, конечно же, не просто так, а по определенным механизмам, правилам и исключениям.
Выделяют радикальный и ионный механизмы реакций. Их отличие заключается в разрыве разных типов связей. Принципы этих механизмов необходимо знать для того, чтобы понимать, как именно протекают химические реакции, знать «внутреннюю кухню» химических превращений. Рассмотрим каждый из механизмов подробнее.
Радикальный механизм
Это механизм, в основе которого лежит образование радикалов в ходе разрыва малополярных ковалентных связей. Вспомнить понятие ковалентной связи можно в нашей статье «Химическая связь». Реакции радикального механизма проходят в газовой среде с большой скоростью и иногда даже со взрывом.
| Чем радикалы в жизни схожи с радикалами в химии? И те, и другие — очень активные и «буйные». Радикалы среди людей — сторонники крайних, решительных действий. Радикалы в химии сильно стремятся образовать химический «коннекшн», даже когда второй атом не особо этого хочет. Это происходит из-за наличия у них неспаренных электронов. |

Образуются эти самые «буйные» радикалы в ходе гомолитического разрыва связи.
Гомолитический разрыв связи — разрыв, при котором каждый атом получает по одному электрону из общей электронной пары при разрушении связи.
То есть каждому атому достается «половина пирога».

Графически это можно представить на примере молекулы хлора (Cl2):
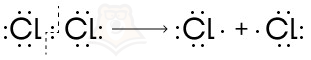
Атомы хлора поровну делят между собой пару электронов. При этом образуются особые частицы — свободные радикалы.
Свободные радикалы — это частицы, которые содержат один или несколько неспаренных электронов во внешнем электронном слое.
Если в результате реакции образовались радикалы, то говорят, что такое взаимодействие протекает по радикально-цепному механизму. На примере хлорирования метана рассмотрим этапы этого процесса.
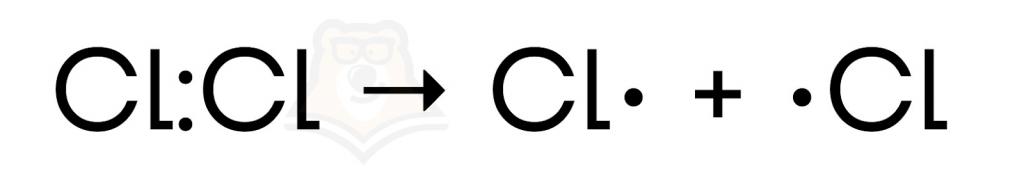
- Инициирование цепи. Чтобы радикалы образовались, нужно подействовать на молекулу дополнительной энергией. Это может быть облучение светом или просто нагревание:
- Развитие цепи. Образованный радикал стремится распространить свои «идеи» на другие атомы, то есть взаимодействует с молекулой, которая сама становится в последующем радикалом:
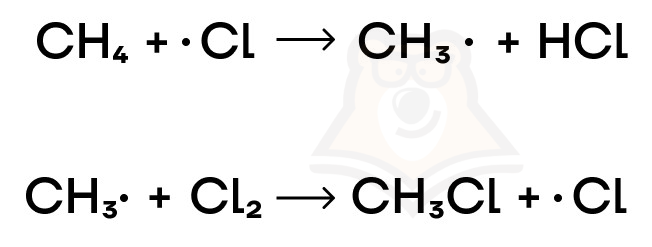
- Обрыв цепи. Когда радикалов становится слишком много, их «встреча» друг с другом неизбежна. И тогда они понимают, что им больше никто не нужен, при этом образуются молекулы и, тем самым, прерывается радикальный процесс:
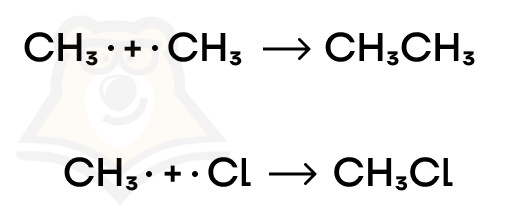
Таким образом, можно сделать вывод, что радикальные реакции проходят в среде неполярного растворителя под действием света или УФ-излучения (ультрафиолетового излучения), либо же при высокой температуре.
Закрепим теорию, решив задачу, которая может встретиться в №17 ЕГЭ по химии.
Задание. Из предложенного перечня выберите все схемы реакций, протекающих по механизму радикального замещения.
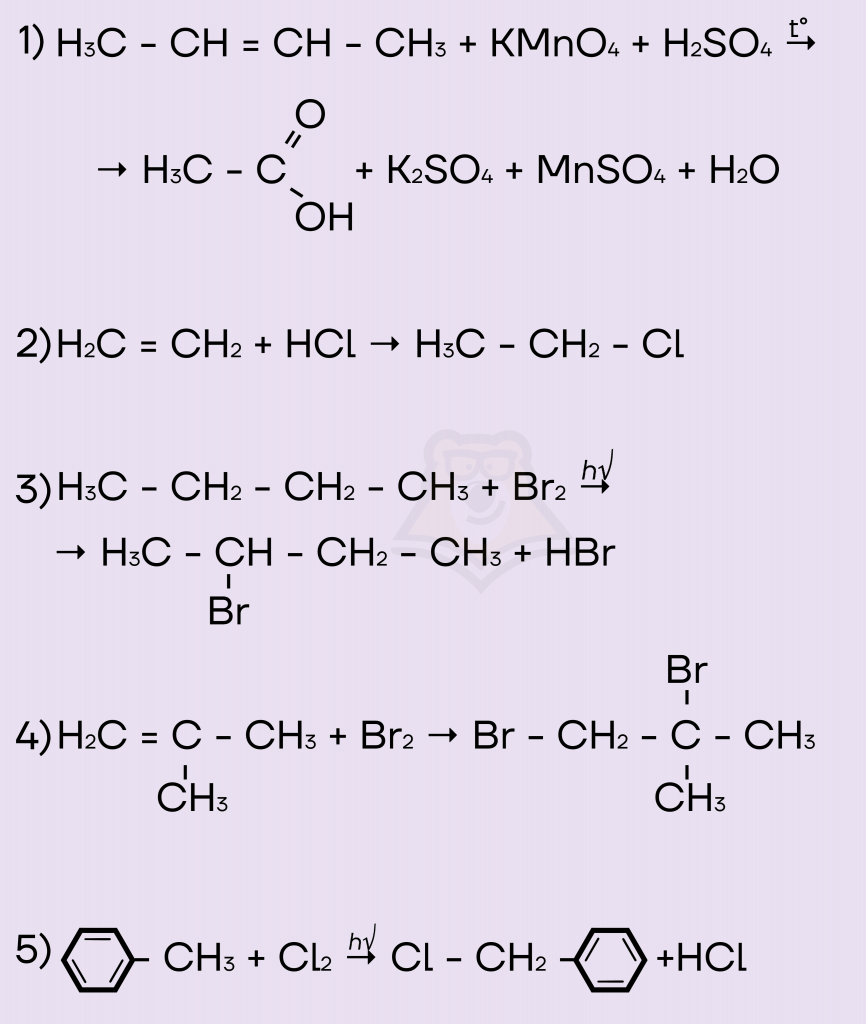
Запишите номера выбранных ответов в порядке возрастания.
Решение. Как мы уже выяснили, в ходе реакций радикального замещения образуется несколько продуктов реакции, следовательно, мы сразу можем сказать, что схемы реакций под номерами 2 и 4 точно таковыми не являются. Это реакции присоединения.
В схеме реакции под номером 1 и несколько исходных веществ, и несколько продуктов, однако мы не видим, чтобы в структуре органического вещества атом водорода заместился на другой атом или функциональную группу. Вещество просто разорвалось под действием сильного окислителя, а его кусочки окислились до уксусной кислоты.
Остались схемы реакций 3 и 5.
— В схеме реакции 3 видим, что атом водорода в структуре бутана заместился на атом брома, в продуктах реакции все по классике реакций замещения — 2-бромбутан и бромоводород (органическое + неорганическое).
— В схеме реакции 5 видим, что атом водорода в структуре метилбензола (толуола) заместился на атом хлора, продуктами являются типичные для реакций замещения галогенопроизводное толуола и галогеноводород — α-хлортолуол и хлороводород соответственно.
Ответ: 35
Радикальный механизм безусловно интересен и своеобразен. Однако предлагаем вам перейти к следующему не менее занимательному механизму органических реакций.
Ионный механизм
В случае реализации ионного механизма в химической реакции происходит образование ионов в ходе гетеролитического разрыва связи.
Гетеролитический разрыв связи — разрыв, при котором один из атомов забирает электронную пару себе, оставляя другой атом «ни с чем».
То есть один из атомов настолько «жадный», что не делится и кусочком пирога с другим.

| Каким атомам свойственно быть жадными и не делиться электронами? Когда происходит разрыв связи между двумя атомами, то встает вопрос: как поделить нажитое имущество в виде электронной пары? В случае радикального механизма атомы договариваются и делят все поровну: каждому по электрону. Однако в случае ионного механизма как правило «выигрывает дело» и забирает пару себе самый электроотрицательный элемент. Напомним, что электроотрицательность увеличивается при движении в периодической системе слева направо и снизу вверх. Самым электроотрицательным элементом является фтор. |
При этом у другого атома остается вакантная (свободная) орбиталь без электронов:
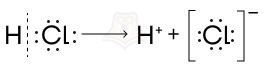
Обе частицы имеют свои названия, так как обладают разными свойствами: электрофил и нуклеофил.
Нуклеофил — частица, которая имеет пару электронов на своем внешнем энергетическом уровне.
Нуклеофилами являются все отрицательно заряженные частицы (Br–, CN–, Cl–, I– и др.), а также соединения с неподеленной электронной парой или π-связями (H2O, спирты, простые эфиры, альдегиды, аммиак и др.). Вспомнить, что такое π-связь, можно в нашей статье «Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа».
Электрофил — частица или молекула, которая имеет незаполненную электронную орбиталь на внешнем энергетическом уровне.
Электрофилами являются все положительно заряженные частицы (H+, NO2+ и др.), в том числе и карбокатионы (частицы с положительным зарядом на атоме углерода: R3C+), а также галогениды металлов IIA и IIIA групп таблицы Менделеева (AlCl3, BF3 и др.). Чтобы образовать ковалентную связь, электрофил делится своими свободными орбиталями с нуклеофилом.
В результате реакций, протекающих по ионному механизму, образуются ионы: катион (положительно заряженный) и анион (отрицательно заряженный). Реакции такого типа проходят с небольшой скоростью под действием катализатора, при невысокой температуре.

Этот механизм характерен для реакций присоединения к органическим веществам с кратными связями. Давайте рассмотрим механизм более подробно на примере реакции этилена и бромоводорода.
- На первом этапе катион водорода (который является электрофилом) атакует двойную связь этилена, в результате чего образуется карбокатион.
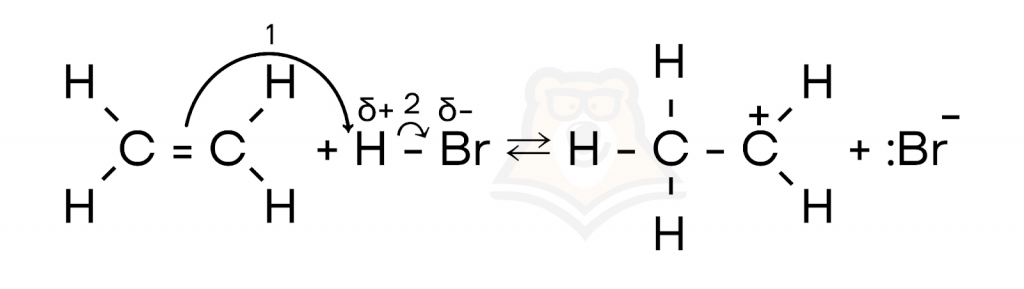
- На втором этапе бромид-анион взаимодействует с карбокатионом, в результате чего образуется бромэтан.
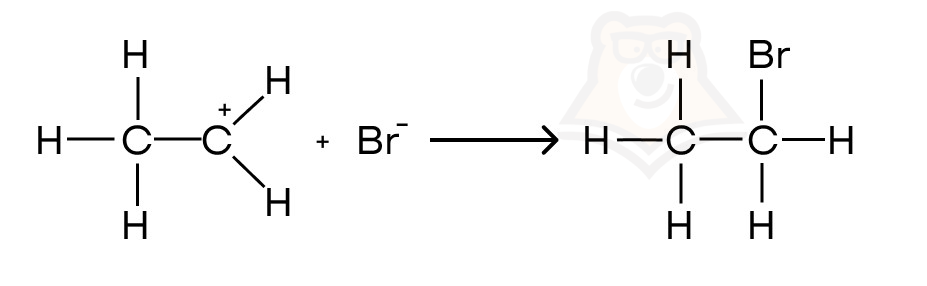
Ионный механизм реакции в целом основан на взаимодействии плюса (электрофила) с минусом (нуклеофилом). Это и является его преимуществом перед радикальным, так как мы еще с уроков физики помним, что разноименные заряды притягиваются. Но все ли так однозначно в этих механизмах, или есть какие-то исключения?
Правило В.В. Марковникова
На примере реакции этилена с бромоводородом мы рассмотрели механизм присоединения к алкену с симметрично гидрированными атомами углерода при двойной связи. То есть для нас нет различия в том, к какому атому углерода при двойной связи присоединился H+ на первом этапе. Но что делать, если в алкене атомы углерода при двойной связи гидрированы несимметрично?
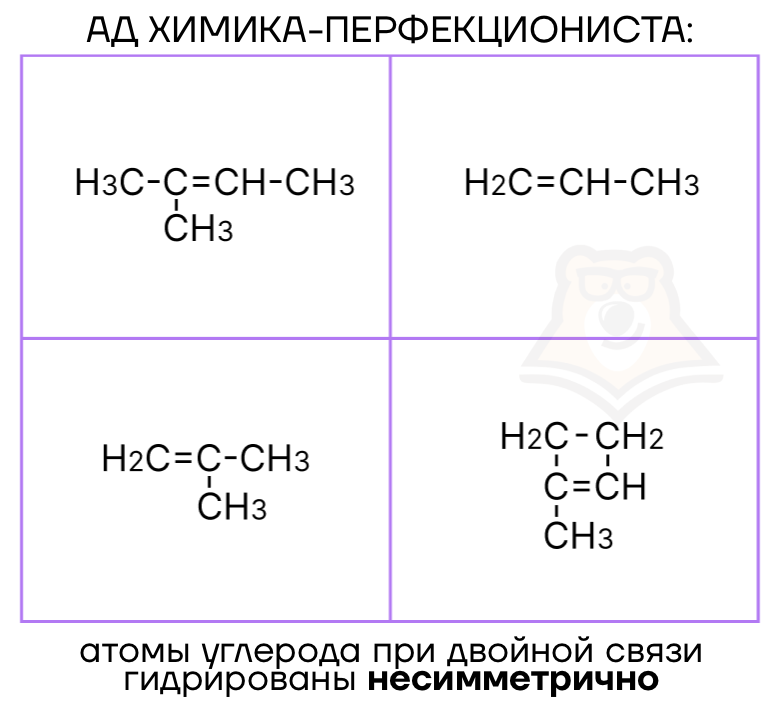
Для этого мы пользуемся правилом Марковникова.
Правило Марковникова: атом водорода преимущественно присоединяется к более гидрированному атому углерода при двойной связи, то есть к тому атому углерода, который связан с большим числом атомов водорода.
Давайте рассмотрим присоединение бромоводорода к пропену. Возможны два варианта с образованием 1-бромпропана и 2-бромпропана. Так как наиболее гидрированным атомом углерода при двойной связи является концевой атом С, то водород преимущественно пойдет именно туда. Поэтому здесь образуется 2-бромпропан (изопропилбромид).
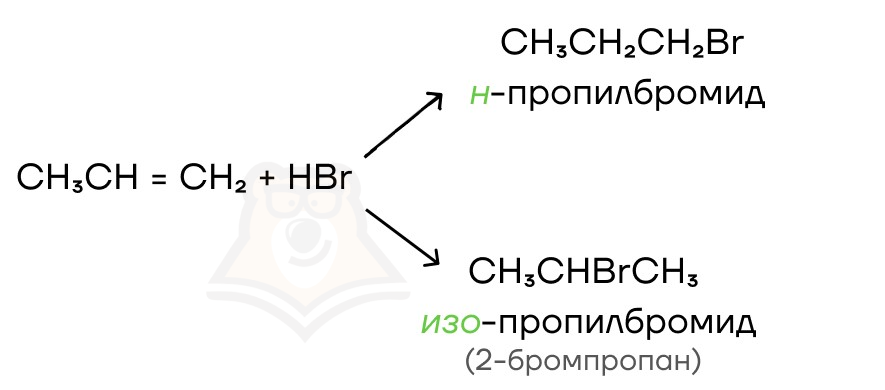
Но! Из этого правила есть исключения, при которых водород присоединяется, наоборот, к менее гидрированному атому С. Здесь все так же, только мы присоединяем атом H к тому атому С при двойной связи, где меньше атомов водорода.
Это происходит в двух случаях:
- Когда в молекуле есть электроноакцепторный заместитель (например, –Cl, –F, –COOH), который оттягивает на себя электронную плотность двойной связи. Примером такого взаимодействия является реакция 3-хлорпропена-1 с хлороводородом:
Cl–CH2–CH=CH2 +HCl → Cl–CH2–CH2–CH2–Cl
- Когда в реакционной смеси присутствуют перекиси (H2O2 или R2O2), они являются источниками свободных радикалов, и реакция будет протекать по радикальному механизму против правила Марковникова. Например, присоединение бромоводорода к пропилену в присутствии перекиси водорода:
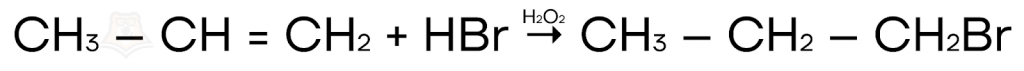
Легко запомнить правило Марковникова поможет следующее четверостишие:
Найдешь ли справедливость тут,
Где действуют двойные связи:
Где много водорода — так еще дадут,
(Где мало — так отнимут сразу!)*
*(в последней строке идет речь о правиле Зайцева, с которым можно ознакомиться в нашей статье «Алкены»)
| Как Марковников завоевал органическую химию? Первые формулировки — пока что только гипотезы, а не правила В.В. Марковникова, — были опубликованы в 1870 году в немецком научном журнале. Долгое время на эту закономерность вообще никто не обращал внимания. Строчки с наблюдениями о присоединении атомов были расположены в конце статьи, в многостраничном приложении к основному тексту. Подтвердить это правило и точно определить, какие продукты выделяются было сложно. В те времена не было условий для проведения полностью контролируемых химических реакций. Лишь в XX веке Моррис Хараш и его ученик Фрэнк Майо в работе, посвященной присоединению к кратным связям бромоводорода, процитировали Марковникова как правило и выделили моменты, когда реакция идет не по-Марковникову. |
Формулировка правила Марковникова помогла сделать важный шаг к пониманию механизмов в органической химии. Реакции, идущие по правилу Марковникова, используются в промышленности при производстве различных смесей, химического сырья и топлива, каучука, полимеров.
Разберем еще один пример задания №17 ЕГЭ по химии.
Задание. Из предложенного перечня выберите все вещества, присоединение молекул которых к пропену будет идти в соответствии с правилом Марковникова.
1) H2O
2) H2
3) HCl
4) HBr
5) Br2
Запишите номера выбранных ответов в порядке возрастания.
Решение. По правилу Марковникова присоединяются полярные молекулы, например, молекулы воды (1) и галогеноводородов (3,4):
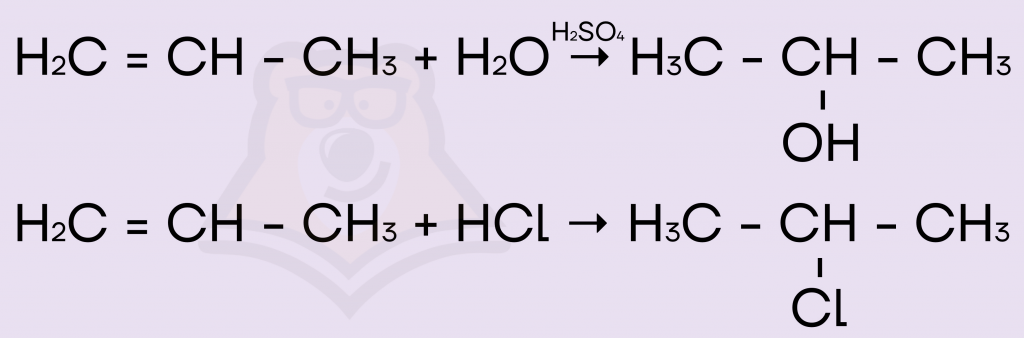
Молекулы водорода (2) и брома (5) не являются полярными, они просто присоединяются к пропену с разрывом π-связи, и, как их ни присоединим, в итоге получим одно и то же вещество.
Пример присоединения молекулы брома к пропену:
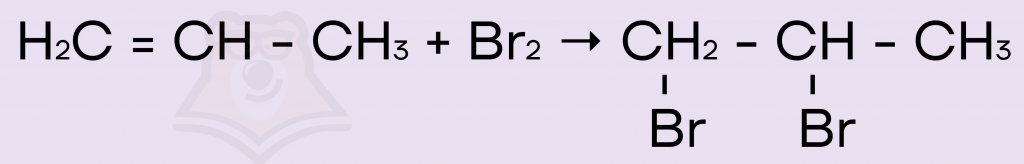
Ответ: 134
Вот мы и изучили два механизма органических реакций. Но когда мы пишем реакцию в тетради, сложно сразу понять, по какому механизму она протекает. Поэтому давайте ознакомимся с конкретными реакциями замещения и присоединения в органической химии, протекающими по этим двум механизмам.
Реакции замещения и их механизмы
Реакциями замещения называются такие взаимодействия, при которых происходит замещение атома или группы атомов в органическом веществе.
- Реакции замещения, протекающие по радикальному механизму.
В ходе реакции протекают все этапы радикального механизма: инициирование, развитие и обрыв цепи (вспоминаем пример с хлорированием метана).
- Галогенирование (взаимодействие с галогеном) алканов на свету (hν).
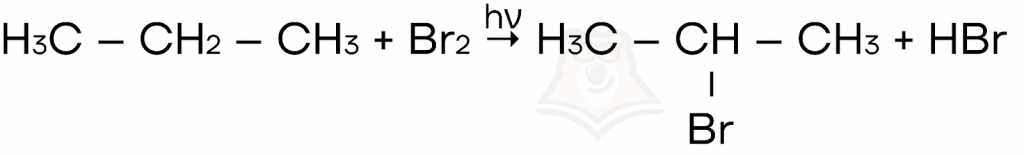
- Реакция Коновалова — взаимодействие алканов с разбавленной азотной кислотой (HNO3) при нагревании.
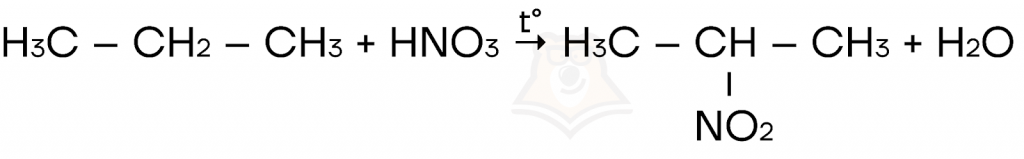
- Реакция Львова — замещение водорода хлором у соседнего с двойной связью атома углерода.

- Галогенирование гомологов бензола на свету.
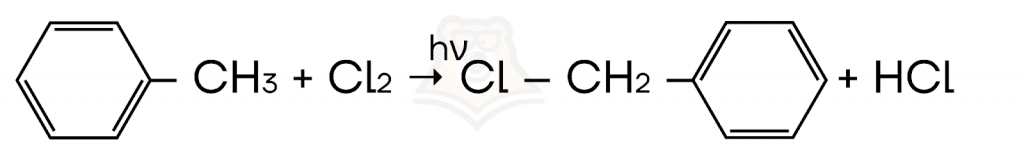
- Реакции замещения, протекающие по ионному механизму, когда в реакции атакующей частицей является электрофил.
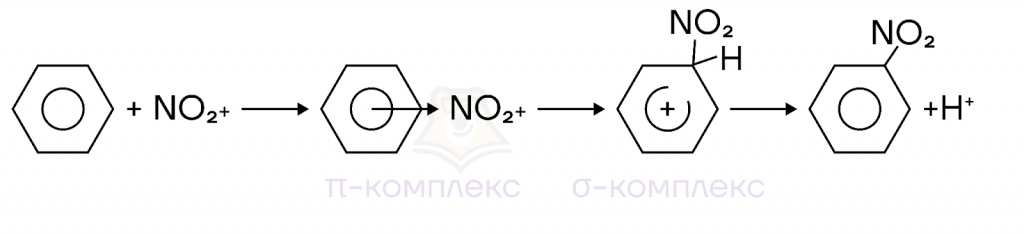
В ходе реакции электрофильного замещения электрофил образует общую связь с молекулой органического соединения, а старая группа, на которую направлен электрофил, полностью или частично отщепляется от молекулы.
I этап — образование пи-комплекса: электрофильная частица притягивается к π-электронному облаку бензольного кольца и образует с ним π-комплекс.
II этап — образование сигма-комплекса: на этом этапе образуется карбокатион, при этом ароматичность системы нарушается, т.к. в кольце остается только четыре пи-электрона, распределенные между пятью атомами углерода (сигма-комплекс).
III этап — отрыв протона и образование продукта реакции: для сохранения ароматичности сигма-комплекс выбрасывает протон, оставшиеся электроны образуют пи-систему.
- Галогенирование бензола и его гомологов в присутствии галогенида металла IIA и IIIA групп таблицы Менделеева.
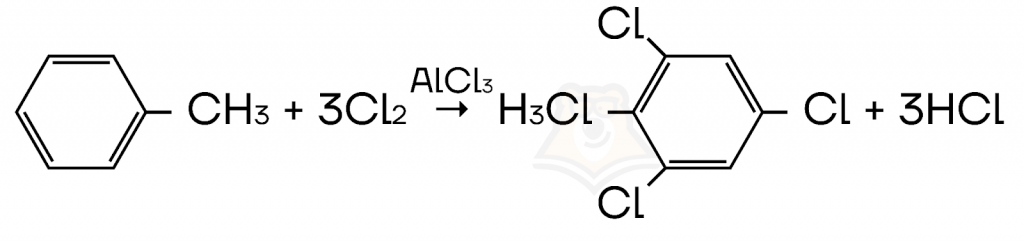
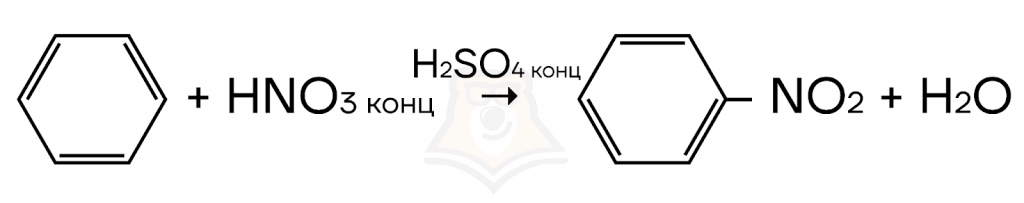
- Нитрование (взаимодействие с азотной кислотой в присутствии концентрированной серной кислоты) бензола и его гомологов.
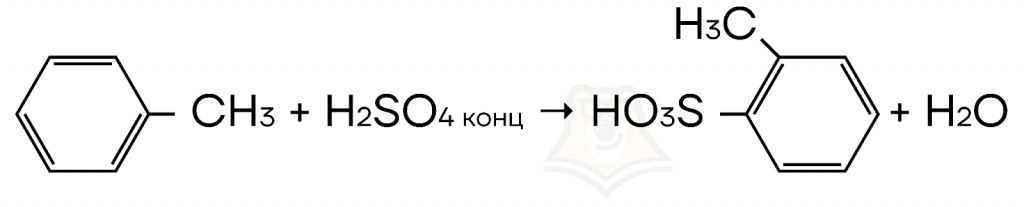
- Cульфирование (взаимодействие с концентрированной серной кислотой) бензола и его гомологов.
- Реакции замещения, протекающие по ионному механизму, когда в реакции атакующей частицей является нуклеофил.
- Взаимодействие водного раствора щелочи с галогенпроизводным.
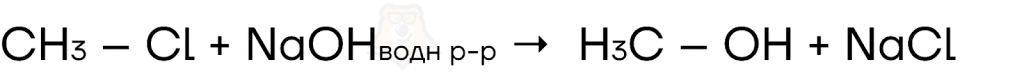
Реакции присоединения и их механизмы
Реакциями присоединения называются такие взаимодействия, при которых происходит присоединение реагента к молекуле исходного вещества по кратным связям.
- Реакции присоединения, протекающие по радикальному механизму.
- Реакции полимеризации — реакции, в которых происходит объединение молекул мономера (исходного вещества) с образованием длинных цепочек полимера. При этом молекула исходного вещества «раскрывает» кратную связь и присоединяется к такой же молекуле.
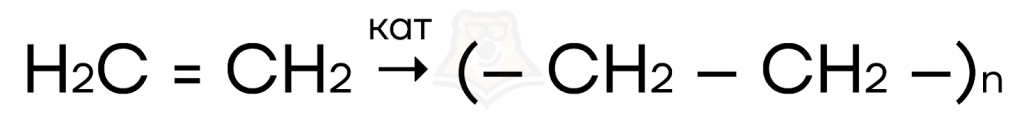
- Реакции присоединения, протекающие против правила Марковникова (в присутствии перекисей). Например, гидрогалогенирование (присоединение галогеноводорода) в присутствии пероксида водорода.
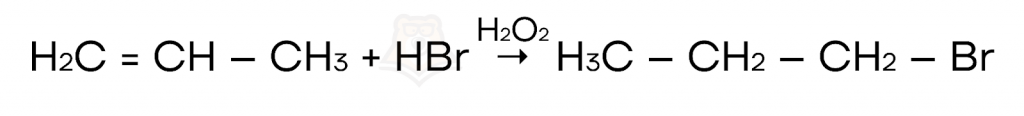
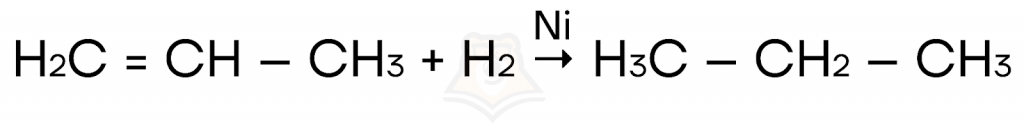
- Реакции присоединения, протекающие по ионному механизму, когда в реакции участвует электрофил:
- Гидрирование (присоединение водорода) соединений с кратной связью.
- Галогенирование соединений с кратной связью.
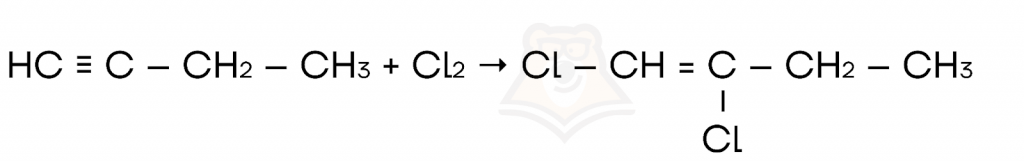
- Гидратация (присоединение молекулы воды) соединений с кратной связью.
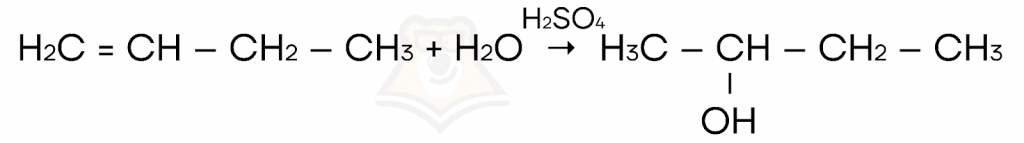
- Гидрогалогенирование соединений с кратной связью.

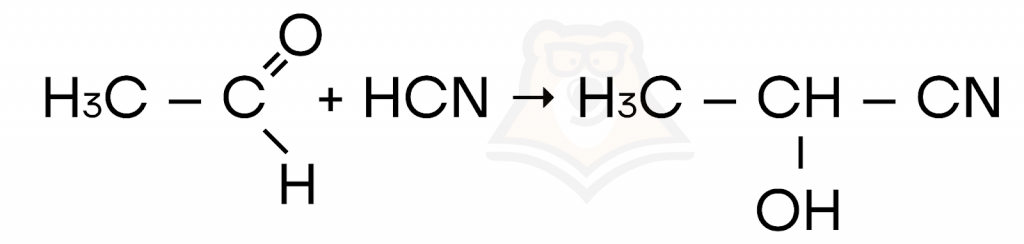
- Реакции присоединения, протекающие по ионному механизму, когда в реакции участвует нуклеофил.
- Присоединение синильной кислоты (HCN) или спирта.
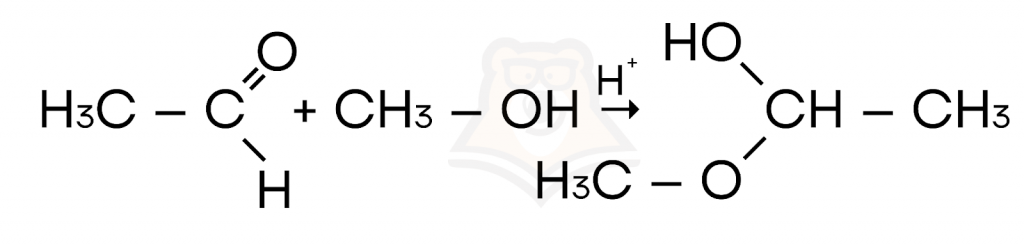
А для чего нам все-таки нужны эти механизмы реакций? Они позволяют не только определить, как именно взаимодействуют вещества, но и верно указать продукты их реакции. Разбирая поэтапно какие-то привычные нам взаимодействия, например, хлора с метаном, мы в будущем можем предсказать механизм другой похожей реакции. Ну а узнать, с кем же еще реагирует метан, вы можете в нашей статье: «Алканы».
Термины
Катализатор — вещество, ускоряющее химическую реакцию.
Кратная связь — это двойная или тройная связь.
Электронная плотность — область пространства, в которой вероятность нахождения электрона максимальна.
Электроотрицательность — это способность атома принимать электроны.
Фактчек
- Механизм реакции — это пошаговый процесс образования продуктов реакции из исходных веществ.
- Различают два типа разрыва химических связей: гомолитический и гетеролитический.
- Когда происходит гомолитический разрыв связи, образуются свободные радикалы, и реакция идет по радикально-цепному механизму.
- Когда происходит гетеролитический разрыв связи, образуются карбокатионы и карбоанионы. Он характерен для реакций присоединения галогеноводородов к кратным связям.
- Чтобы определить продукт реакции присоединения, мы пользуемся правилом Марковникова: водород присоединяется к наиболее гидрированному атому углерода при двойной связи.
Проверь себя
Задание 1.
По какому механизму протекает реакция между бромом и пропаном на свету?
- По ионному механизму
- По электронному механизму
- По правилу Марковникова
- По радикальному механизму
Задание 2.
Какая из перечисленных частиц является электрофилом?
- Бромид-анион
- Кислород
- Катион водорода
- Сульфат-ион
Задание 3.
Какой продукт преимущественно образуется при реакции бутена-1 и хлороводорода?
- 2-хлорбутан
- 1-хлорбутан
- 3-хлорбутан
- 1,2-дихлорбутан
Задание 4.
Какой продукт преимущественно образуется при реакции пентена-1 с бромоводородом в присутствии H2O2?
- 1-бромпентан
- 2-бромпентан
- 3-бромпентан
- 1,3-дибромпентан
Ответы: 1. — 4; 2. — 3; 3. — 1; 4. — 1.


 к списку статей
к списку статей





