Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
На этой странице вы узнаете
- «Ровные ребята» — что такое гибридизация орбиталей?
- Как гибридизация способна менять облик углерода?
Мир органических веществ довольно непростой. Атомы углерода постоянно «суетятся» и взаимодействуют друг с другом. В ходе таких взаимодействий образуются химические связи. Они имеют самые различные характеристики, разную форму, механизм образования и даже стараются быть похожими друг на друга. В этой статье мы разберемся, какие особенности есть у образования связей в молекулах органических веществ.
Гибридизация атомных орбиталей углерода
Практически все органические вещества имеют молекулярное строение, а при таком типе строения атомы связываются друг с другом с помощью ковалентных связей, то есть «собирают» вместе часть своих внешних электронов.
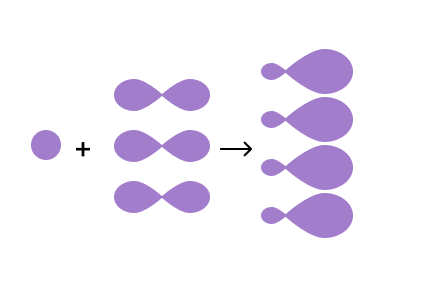
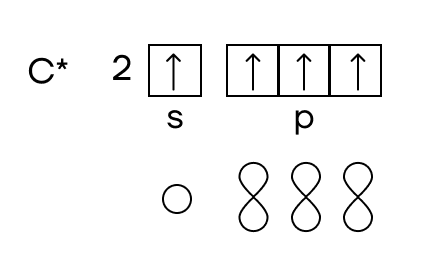
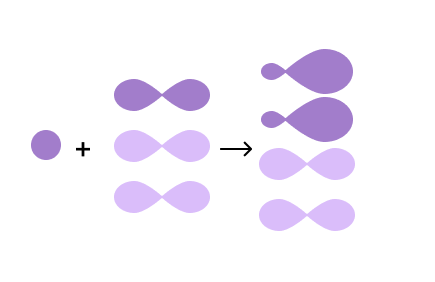
Атом углерода в органических соединениях всегда находится в возбужденном состоянии и имеет 1 электрон на s-орбитали и 3 электрона на p-орбиталях. При этом s-орбиталь имеет форму шара, а p- — форму гантели:
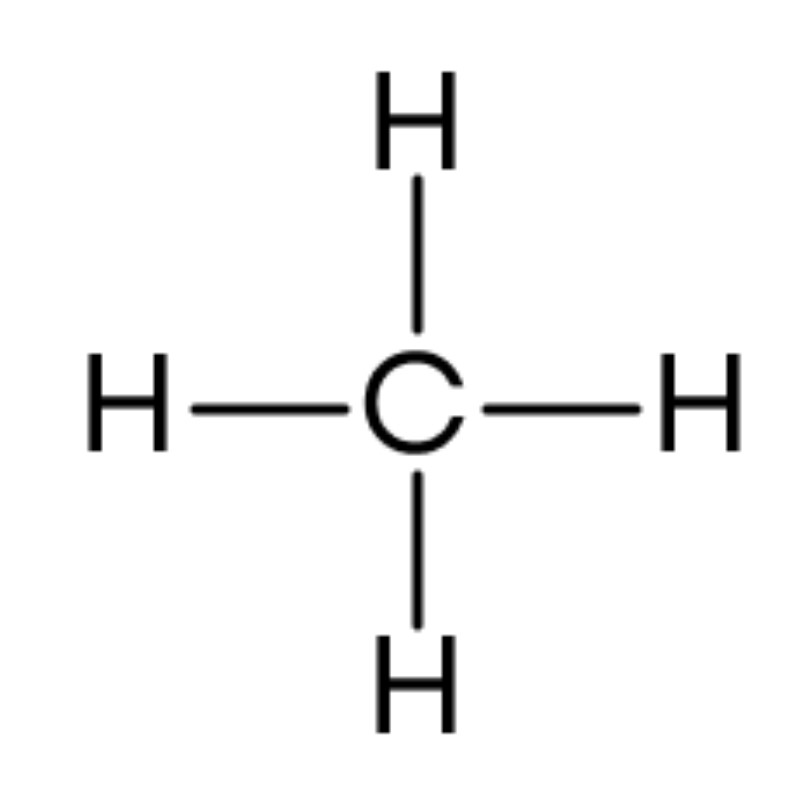
Из-за разной формы орбиталей, логично предположить, что химические связи, образованные электронами углерода, будут отличаться друг от друга. Но это не так, ведь при изучении молекулы метана CH4 было установлено, что все его 4 связи одинаковые. В чем загвоздка?
На самом деле, для орбиталей атома углерода характерно такое явление, как гибридизация.
| «Ровные ребята» — что такое гибридизация орбиталей? Вспомним уроки физкультуры, где весь класс выстраивается в линейку, ровно-ровно, чтобы все стояли на одной линии. Атомы углерода тоже «ровные ребята», они стремятся выровнять свои атомные орбитали. Гибридизация атомных орбиталей — это смешивание орбиталей с целью выравнивания их по форме и энергии. |
Различают три вида гибридизации атомов углерода:
- sp3-гибридизация
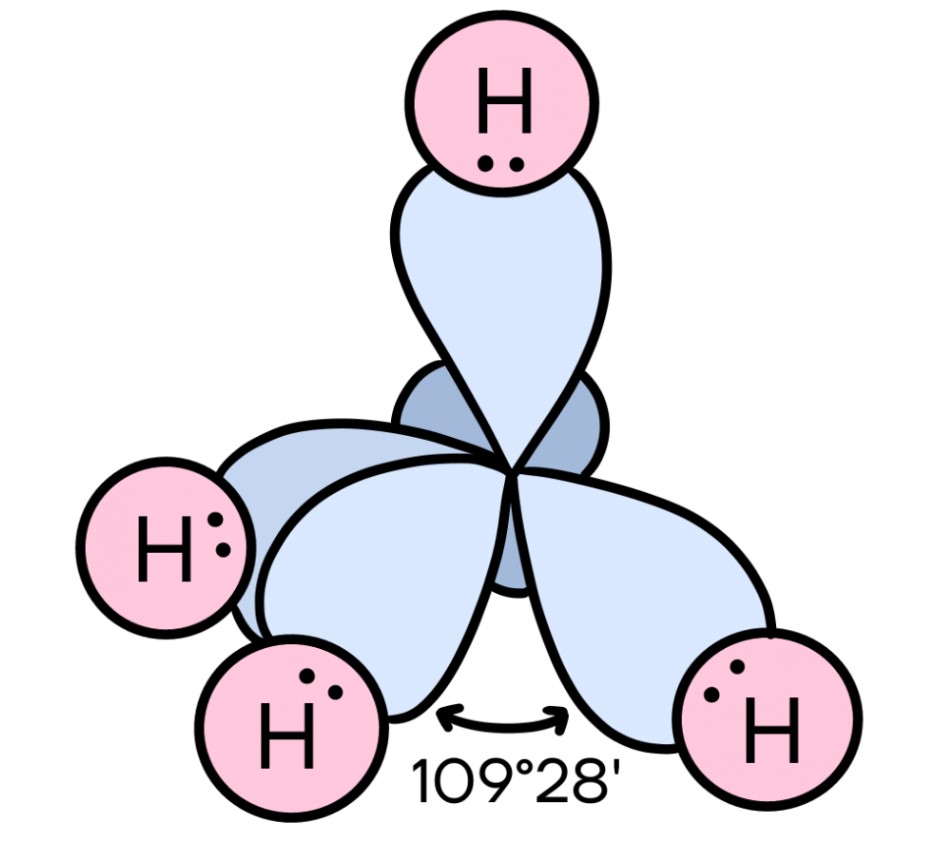
В процессе sp3 гибридизации смешиваются одна s- и три p-орбитали, и в итоге образуются четыре одинаковые гибридные орбитали в форме знака бесконечности. Эти орбитали располагаются в пространстве в виде объемной фигуры — например, тетраэдра у метана CH4 — так, чтобы угол между ними был равен 109°28’. Этот вид гибридизации образует одинарные связи.
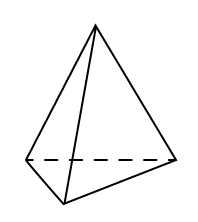
- sp2-гибридизация
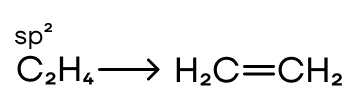
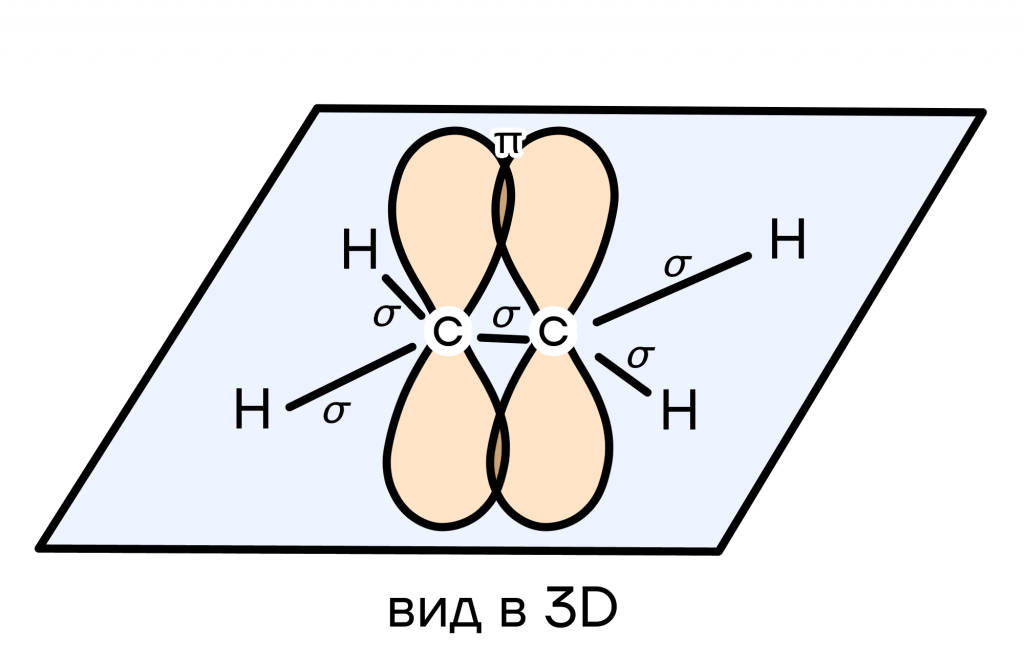
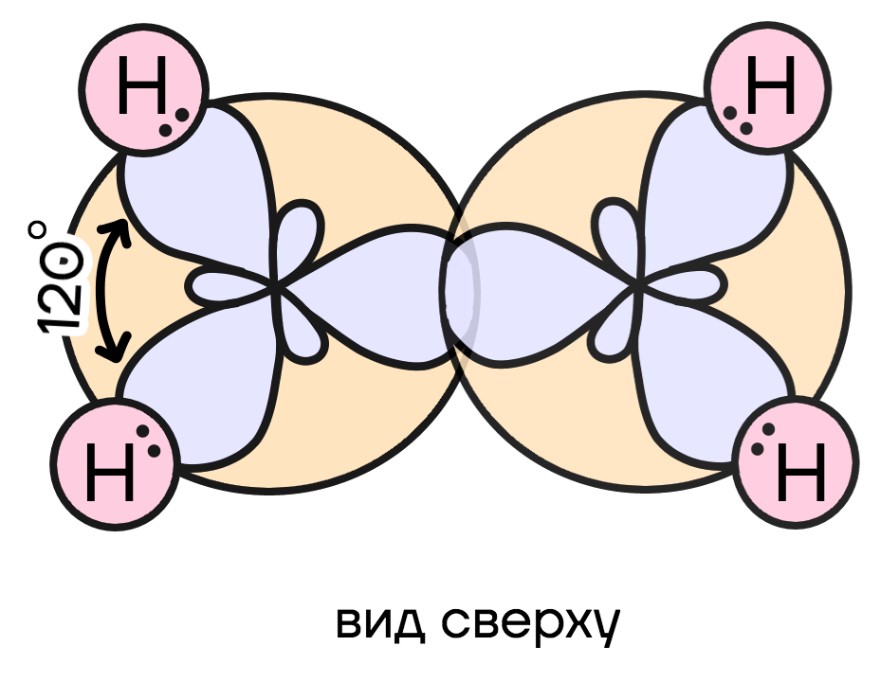
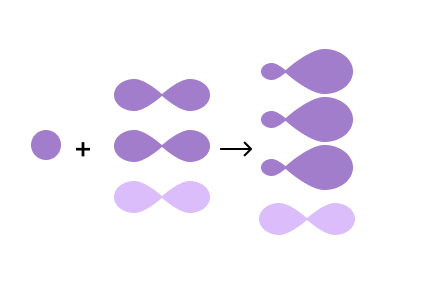
Здесь смешиваются одна s- и две p-орбитали. Гибридные орбитали располагаются уже в одной плоскости под углом 120° и образуют двойные связи. Для примера можно взять молекулу этилена.
- sp-гибридизация
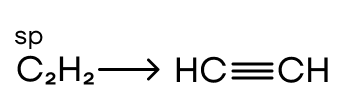
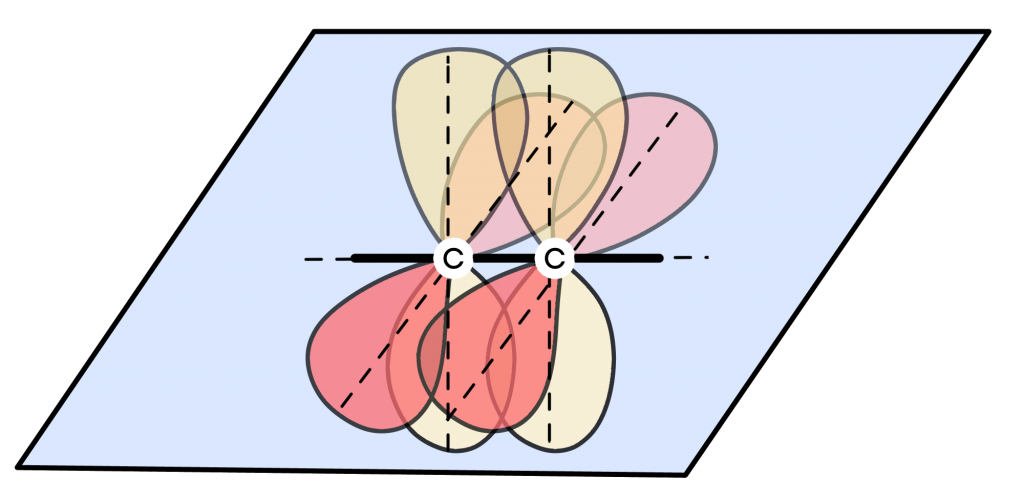
Смешивается одна s- и одна p-орбиталь. Получаются две гибридные орбитали, лежащие на одной линии под углом, соответственно, 180° и образующие тройные связи. Как пример рассмотрим строение молекулы ацетилена.
Как мы видим, по типу гибридизации можно понять какие связи — одинарные, двойные или тройные — образует данный атом углерода, какое пространственное строение имеет связь и наоборот.
| Как гибридизация способна менять облик углерода? Аллотропные модификации углерода зависят от гибридизации между атомами углерода в простом веществе. Так, алмаз имеет sp3-гибридизацию, а графит — sp2, при этом графит и алмаз обладают совершенно разными физическими свойствами. В 2015 году американским ученым удалось «скрестить» алмаз и графит и получить Q-углерод, модификацию, которая имеет в себе как sp3-, так и sp2-гибридизацию. Такой углерод обладает еще и магнитными свойствами. Эксперименты с различными типами гибридизации лежат в основе разработки инновационных материалов. |
Типы связей по способу перекрывания орбиталей
Пара электронов, связывающих два атома, находится в области перекрывания их атомных орбиталей. Разная форма электронных орбиталей несет за собой и разные способы их перекрывания:
- СИГМА (σ)
Осевое перекрывание — область перекрывания орбиталей находится на одной прямой с ядрами атомов. Так как ось (прямая, которая проходит через ядра атомов и перекрывание орбиталей) только одна, σ-связь между атомами может быть только одна.
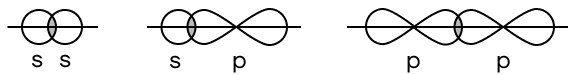
- ПИ (π)
Боковое перекрывание — перекрывание орбиталей не находится на одной прямой с ядрами атомов. Когда между атомами уже есть σ-связь (то есть ось/прямая, проходящая через ядра атомов, уже занята), образуются π-связи, лежащие не на одной прямой с ядрами атомов.
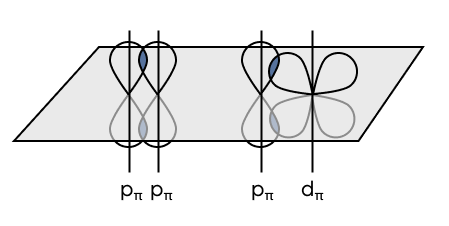
Как определить, где в молекуле σ-, а где π-связи? Одинарная связь в любом случае всегда является σ-связью. А если связь кратная, то помимо σ-связи присутствуют еще π-связи.
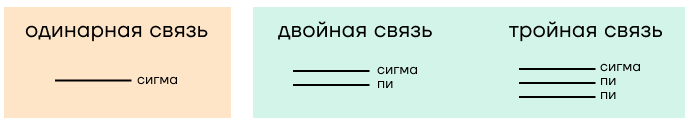
| Лайфхак по быстрому определению количества σ-связей. — Для нециклических соединений: «количество σ-связей = сумма индексов − 1». — Для циклических соединений: «количество σ-связей = сумма индексов». |
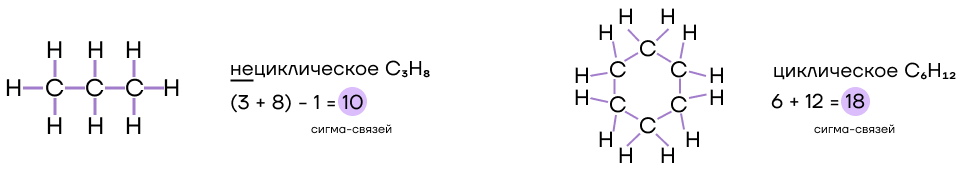
Ковалентная химическая связь
Среди органических веществ преобладают ковалентные связи. Это связи, которые образованы за счет общих электронных пар.
Именно ковалентная связь имеет такие характеристики, как тип перекрывания электронных орбиталей (σ- и π-связи) и кратность связи — ковалентные связи могут быть одинарными, двойными и тройными.
При протекании химических взаимодействий эти связи разрываются, и за счет этого образуются новые вещества.
Различают два вида разрыва ковалентной связи:
- Гомолитический.
В гомолитическом разрыве участвуют малополярные молекулы — атомы в них почти или вообще не отличаются по электроотрицательности. В результате такого разрыва связи образуются частицы, имеющие один неспаренный электрон — свободные радикалы.
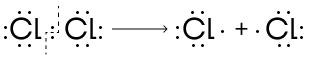
Образовавшиеся радикалы обладают очень высокой реакционной способностью, поэтому реакции с гомолитическим разрывом ковалентной связи проходят быстро, часто с образованием набора нескольких продуктов.
Гомолитический разрыв характерен, например, для реакции галогенирования метана.
- Гетеролитический.
Так разрываются связи между атомами, которые значительно отличаются по своей электроотрицательности. В результате гетеролитического разрыва связи образуются две отличающиеся друг от друга частицы: катион — положительно заряженный и анион — отрицательно заряженный.
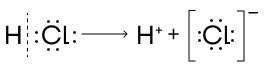
Реакции ионного механизма проходят с небольшой скоростью под действием катализатора, при невысокой температуре, иногда с использованием растворителя.
Этот механизм характерен для реакций присоединения органических веществ с кратными связями.
Радикалы и функциональные группы
Практически любое органическое соединение можно разбить на две части: на углеводородный радикал (R) и функциональную группу.
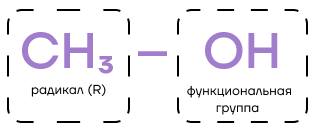
Проще говоря, углеводородный радикал — остаток молекулы углеводорода без одного атома H. Сравним: метан CH4 и метил CH3-, пропан CH3-CH2-CH3 и пропил CH3-CH2-CH2-.
Наиболее распространенные радикалы представлены на изображении:
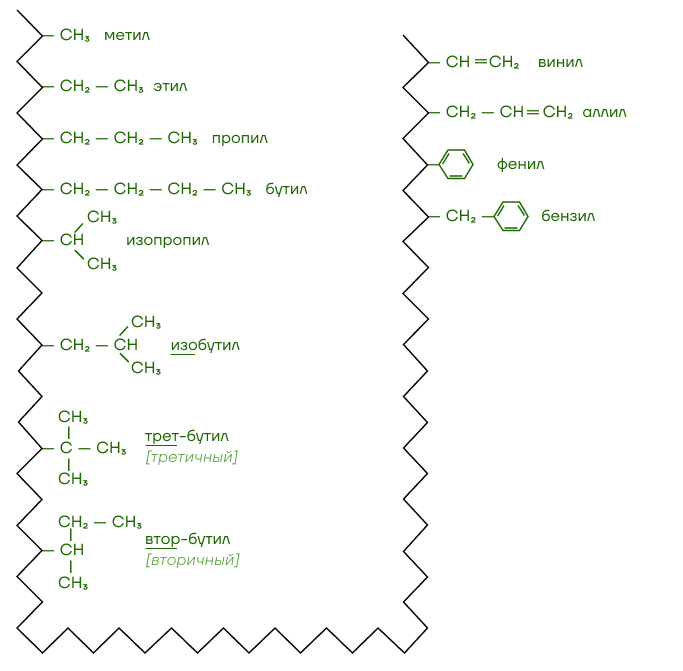
Функциональная группа — это атом или группа атомов, которые определяют класс вещества и его химические свойства.
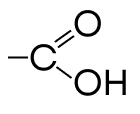 | Карбоксильная | Карбоновые кислоты |
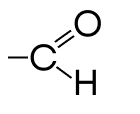 | Альдегидная | Альдегиды |
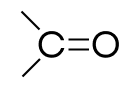 | Карбонильная | Кетоны |
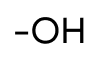 | Гидроксильная | Спирты и фенолы |
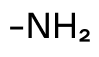 | Аминогруппа | Амины |
 | Нитрогруппа | Нитросоединения |
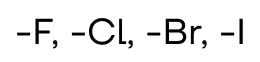 | Фтор, хлор, бром, иод | Галогенпроизводные |
Фактчек
- Для атомов углерода в органической химии характерна гибридизация атомных орбиталей, то есть их выравнивание по форме и энергии.
- Различают три вида гибридизации атомов углерода: sp3-, sp2— и sp-гибридизацию.
- Одинарная связь всегда является сигма-связью, двойная — сигма + пи-связь, тройная — сигма + 2 пи-связи.
- Органическое соединение можно разбить на углеводородный радикал и функциональную группу.
Проверь себя
Задание 1.
Какую форму имеют s-орбитали?
- шара
- гантелей
- пары гантелей
- квадрата
Задание 2.
Сколько орбиталей участвует в образовании sp2-гибридной орбитали?
- 1 орбиталь
- 2 орбитали
- 3 орбитали
- 4 орбитали
Задание 3.
Какие связи присутствуют в тройной связи?
- 2 сигма-связи и 1 пи-связь
- 1 сигма-связь и 2 пи-связи
- 3 сигма-связи
- 3 пи-связи
Задание 4.
Сколько функциональных групп содержит 2-хлорпропановая кислота?
- 0
- 1
- 2
- 3
Ответы: 1. — 1; 2. — 3; 3. — 2; 4. — 3.


 к списку статей
к списку статей