Основные классы неорганических веществ
На этой странице вы узнаете
- На какое свойство щелочей указывает нам сцена из фильма «Бойцовский клуб»?
- Способен ли желудочный сок растворить металл?
- Как сульфат меди(II) помогает противостоять акулам?
Сегодня мы познакомимся с основными классами неорганических соединений. В этой статье мы поговорим о таких веществах, как основания, кислоты (и про амфотерные гидроксиды не забудем) и соли, узнаем их классификацию, химические свойства и другие интересные особенности.
Классы неорганических веществ
Слово «соль» вызывает у нас ассоциацию с кухней, и, в принципе, правильно. Ведь на любой кухне можно найти примеры всех классов неорганических соединений. Щелочи входят в состав множества моющих средств. Соль в солонке говорит сама за себя. Уксусная кислота в бутылочке с надписью от мамы «не трогать ни в коем случае, это НЕ вода» — самый простой пример представителей класса кислот.
Все неорганические соединения можно поделить на два типа: простые вещества и вещества сложные.
Простые вещества — вещества, состоящие из атомов одного элемента.
К простым вещества можно отнести, например, озон (О3), гелий (He), хлор (Cl2), натрий (Na) и другие.
Сложные вещества — вещества, состоящие из атомов разных химических элементов.
Примерами сложных веществ являются хлорид натрия (NaCl), гидроксид кальция (Ca(OH)2), азотная кислота (HNO3) и другие.
Среди сложных веществ выделяют четыре наиболее важных класса: основания, кислоты, амфотерные гидроксиды и соли, также обычно отдельно выделяют оксиды, о них мы уже поговорили в статье «Общая характеристика оксидов». Эта классификация основана на том, что все соединения, относящиеся к тому или иному классу, проявляют ряд общих свойств. Познакомимся с каждым классом поближе.
Кислоты
Кислоты — электролиты, при диссоциации которых образуются катионы одного типа — катионы водорода H+.
К кислотам относят.
- Ковалентные гидроксиды (кислородсодержащие кислоты) — гидроксиды неметаллов и гидроксиды металлов в степенях окисления +5 и выше.
Примерами таких соединений являются H2SO4, HNO3, HMnO4, H2CrO4.
- Водные растворы некоторых водородных соединений неметаллов (бескислородные кислоты).
Например, галогеноводородов (HF, HCl, HBr, HI) и сероводорода (H2S).
Кислоты принято классифицировать по различным признакам, к важнейшим способам классификации можно отнести следующие.
- По количеству атомов водорода, способных замещаться на металл. Здесь выделяют одноосновные кислоты (замещаться на металл может 1 атом водорода), двухосновные кислоты (замещаться могут 2 атома водорода) и т.д.
HNO3, HCl — одноосновные кислоты
H2SO4, H2S — двухосновные кислоты
H3PO4 — трехосновная кислота
- По силе. Здесь выделяют сильные и слабые кислоты.
Кроме того, кислоты можно делить по летучести и термической устойчивости.
Наиболее важные моменты, связанные с классификацией кислот, обобщим в таблице.
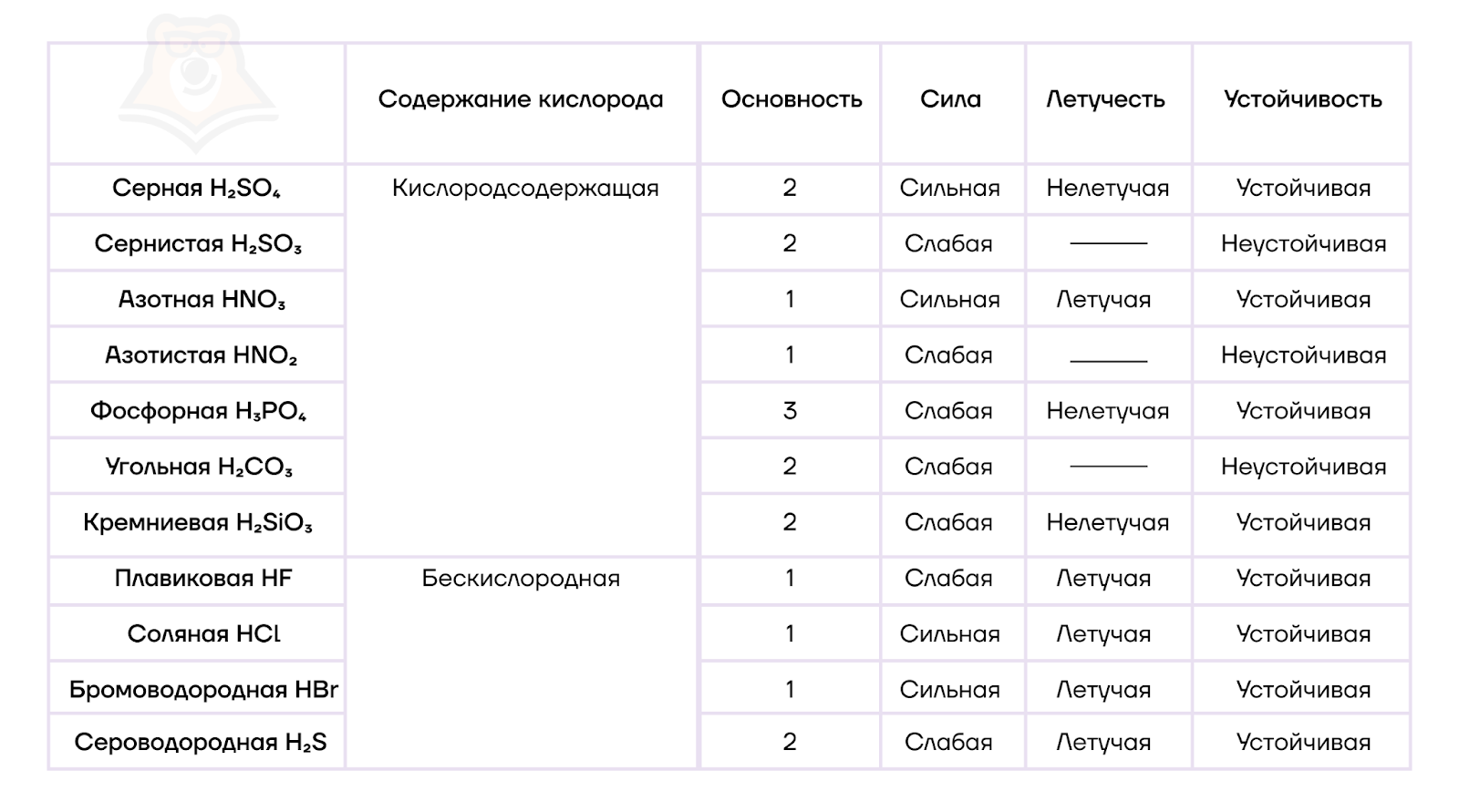
Кстати, можно отметить, что большинство неорганических кислот растворимы. Редким исключением, относящимся к нерастворимым кислотам, является, например, кремниевая кислота (H2SiO3).
Номенклатура кислот
В состав кислот входят атомы водорода и кислотные остатки, так что формулы кислот имеют вид:
HxY, где Y — кислотный остаток
Названия кислот строятся из двух слов, собственного названия и слова «кислота».
Собственное название кислородсодержащих кислот состоит из русского названия элемента и постфикса, указывающего на степень окисления атома элемента, образующего кислоту.
- -ная(вая) — указывает на высшую степень окисления.
HCl+7O4 (хлорная)
H2S+6O4 (серная)
H3P+5O4 (фосфорная)
- -оватая — указывает на промежуточную степень окисления +5.
HCl+5O3 (хлорноватая)
- -истая — указывает на промежуточную степень окисления +3/+4.
HCl+3O2 (хлористая)
H2S+4O3 (сернистая)
H3P+3O3 (фосфористая)
- -оватистая — указывает на промежуточную степень окисления +1.
HCl+1O1 (хлорноватистая)
H3P+1O2 (фосфорноватистая)
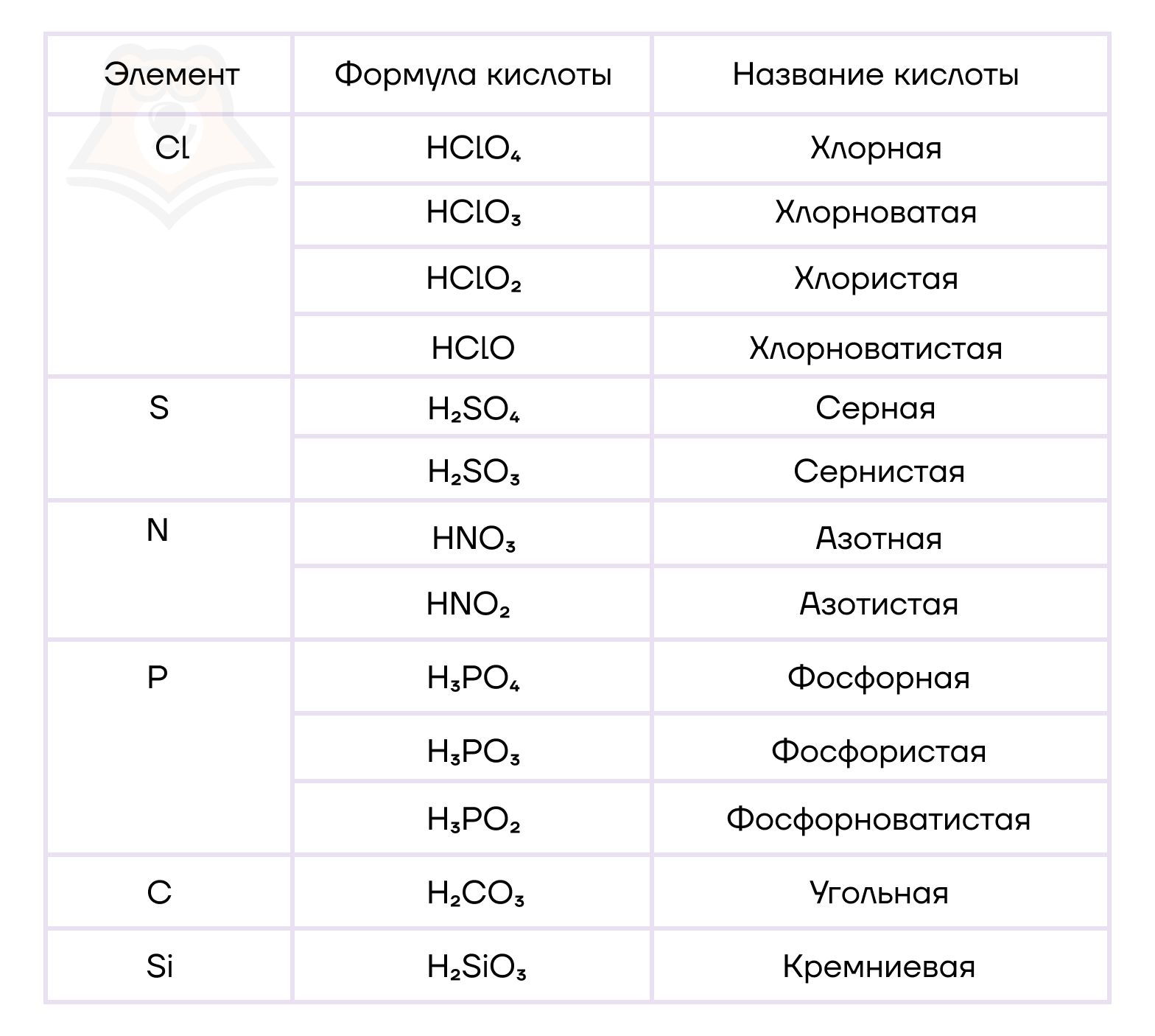
Названия бескислородных кислот (растворов некоторых водородных соединений неметаллов) образуются от названия соответствующего водородного соединения, однако некоторые имеют также тривиальное название.
| Формула кислоты | Название кислоты |
| HF | Фтороводородная (плавиковая) |
| HCl | Хлороводородная (соляная) |
| HBr | Бромоводородная |
| HI | Иодоводородная |
| H2S | Сероводородная |
Способы получения кислот
Одним из способов получения кислородсодержащих кислот является взаимодействие кислотных оксидов с водой. Соответствие оксида и кислоты устанавливается на основании степени окисления центрального атома, она должна быть одинаковой.
S+6O3 + H2O → H2S+6O4
Водородные соединения неметаллов можно получить прямым синтезом.
H2 + S → H2S
Химические свойства кислот
Важнейшим химическим свойством кислот является их способность вступать в реакцию нейтрализации с основаниями (и амфотерными гидроксидами). Это реакция ионного обмена, в ходе которой образуются соль и вода.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Аналогично протекает реакция с основными (и амфотерными) оксидами.
H2SO4 + Na2O → Na2SO4 + H2O
Для кислот также характерны реакции ионного обмена с солями, если выполняются условия их протекания:
- образование газа;
Na2S + 2HCl → 2NaCl + H2S↑
- выпадение осадка;
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
- образование слабого электролита (например, воды или слабой кислоты).
CH3COONa + H2SO4 → NaHSO4 + CH3COOH
Стоит отметить, что не все нерастворимые соли могут вступать в реакцию с кислотами, даже при выполнении вышеуказанных условий. Например, с сильными кислотами не реагируют:
PbS, CuS, HgS, Ag2S
А вот нерастворимые соли неустойчивых кислот легко реагируют с растворами других кислот:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
BaSO3 + 2HCl → BaCl2 + SO2↑ + H2O
Для разбавленных кислот характерно взаимодействие с металлами, представляющее собой окислительно-восстановительными реакции, в ходе которых образуются соль и водород. Условием протекания реакции является достаточная активность металла — с растворами кислот реагируют металлы, расположенные в ряду активности металлов до водорода (активные металлы и металлы средней активности).

Zn + 2HCl → ZnCl2 + H2
Cu + HCl -/→

| Способен ли желудочный сок растворить металл? Желудочный сок содержит около 0,5% хлороводорода, т.е. по сути является, хоть и разбавленным, но раствором кислоты. Теоретически взаимодействие, а следовательно и растворение металла в желудочном соке возможно, однако из-за низкой концентрации кислоты для растворения даже небольшого кусочка металла потребуется много времени. |
Неустойчивые кислоты разлагаются даже при нормальных условиях:
H2CO3 → CO2 + H2O
H2SO3 → SO2 + H2O
Кремниевая кислота разлагается при умеренном нагревании:
H2SiO3 → SiO2 + H2O
Химические свойства кислот могут быть проверены в задании №6 ЕГЭ по химии. Посмотрим на пример.
Задание. В пробирку с твердым веществом X прилили соляную кислоту, при этом отметили выделение бесцветного газа, не имеющего запаха. При добавлении раствора этой же кислоты в пробирку с твердым веществом Y выделился газ с характерным неприятным запахом.Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) Na2S
2) Cu
3) CaSO4
4) Zn
5) NH4NO3
В ответ запишите номера выбранных ответов в порядке, соответствующем XY.
Решение. При взаимодействии соляной кислоты и цинка (4) образуется бесцветный газ без запаха — водород.Zn + 2HCl →
ZnCl2 + H2↑
Газ с неприятным запахом — сероводород — образуется при взаимодействии соляной кислоты с сульфидом натрия (1).
Na2S + 2HCl → 2NaCl + H2S↑
Ответ: 41
Основания и амфотерные гидроксиды
Основания — электролиты, при диссоциации которых образуются анионы одного вида — гидроксид-анионы ОН—.
При обычных условиях основания и амфотерные гидроксиды — твердые вещества. Их окраска зависит от металла, входящего в состав гидроксида, гидроксиды металлов главных подгрупп бесцветны, а побочных — часто оказываются окрашены.
К основаниям относят:
- Ионные гидроксиды металлов.
К таким гидроксидам относится большинство гидроксидов металлов в степенях окисления +1 и +2. Например: NaOH, Ca(OH)2, Cu(OH)2.
Среди оснований выделяют щелочи — сильные растворимые основания, образованные щелочными и щелочноземельными металлами (металлы IА группы, а также кальций, стронций, барий). Остальные металлы образует нерастворимые основания.
Исключениями здесь являются: Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2, они относятся к амфотерным гидроксидам.
Нерастворимые гидроксиды металлов в степенях окисления +3 и +4 также относят к амфотерным гидроксидам. Например: Al(OH)3, Cr(OH)3.
- Некоторые соединения, не содержащие атомов металлов, которые в растворе диссоциируют с образованием гидроксид-анионов.
Примером такого основания является гидрат аммиака NH3⋅H2O.
Кроме деления оснований по признакам, указанным выше, их также можно разделить по количеству гидроксильных групп в составе:
- однокислотные основания содержат одну OH-группу;
- двухкислотные основания содержат две OH-группы и т.д.
Номенклатура оснований и амфотерных гидроксидов
Составить формулу гидроксида металла совсем нетрудно, для этого достаточно посмотреть на заряд иона металла и дописать к нему соответствующее количество OH-групп, поскольку гидроксильный анион имеет заряд 1-. Например, катион кальция Ca2+ имеет заряд 2+, значит соответствующее основание имеет формулу Ca(OH)2.
Несложно образуются и названия оснований (и амфотерных гидроксидов). Название состоит из двух слов: из слова «гидроксид» и названия элемента в родительном падеже, если элемент способен проявлять несколько различных степеней окисления в соединении, то ее необходимо указать с помощью римской цифры в круглых скобках, например:
Fe(OH)2 — гидроксид железа(II).
Некоторые гидроксиды металлов имеют тривиальные названия:
- NaOH — едкий натр;
- KOH — едкое кали;
- Ca(OH)2 — гашеная известь.
Способы получения оснований и амфотерных гидроксидов
Наиболее общими способами получения щелочей являются реакции взаимодействия металлов и соответствующих оксидов с водой.
- При взаимодействии щелочного или щелочноземельного металла с водой образуется щелочь и выделяется водород:
2Na + 2H2O → 2NaOH + H2
- Оксиды щелочных и щелочноземельных металлов при взаимодействии с водой образуют щелочи:
Na2O + H2O → 2NaOH
Нерастворимые основания нельзя получить в ходе аналогичных реакций, так что их обычно получают при действии растворов щелочей на растворимые соли. В ходе протекающей реакции ионного обмена образуются нерастворимое основание и новая соль:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
В ходе такой реакции нельзя получить гидроксид серебра(I), так как он неустойчив и разлагается:
2AgNO3 + 2NaOH → Ag2O↓ + 2NaNO3 + H2O
| На какое свойство щелочей указывает нам сцена из фильма «Бойцовский клуб»? В фильме «Бойцовский клуб» есть сцена, в которой Тайлер оставляет Рассказчику влажный поцелуй на руке, а потом присыпает щелочью, что приводит к химическому ожогу. При этом он говорит, что лучше не пытаться смыть щелочь водой, так как это только усилит реакцию и ухудшит последствия. Действительно, стоит помнить, что растворы щелочей очень едкие, при попадании на кожу они могут вызвать сильные поражения: язву, экзему. При попадании щелочи на руку следует промыть пораженный участок проточной водой, а затем нейтрализовать остатки щелочи разбавленным раствором слабой кислоты, например уксусной. |
Химические свойства оснований
Среди свойств оснований особое место занимают кислотно-основные взаимодействия. Основания способны реагировать с кислотами и кислотными оксидами, в таких реакциях образуются соль и вода:
NaOH + HCl → NaCl + H2O
2NaOH + N2O5 → 2NaNO3 + 2H2O
Реакция оснований с кислотами относится к реакциям ионного обмена и называется реакцией нейтрализации.
Также основания способны вступать в реакции ионного обмена с солями. В такие реакции вступают только щелочи и растворимые соли. Для протекания реакции необходимо выполнение хотя бы одного из условий:
- образование осадка:
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓
- выделение газа. Важнейшей реакцией с выделением газа является взаимодействие солей аммония со щелочами:
NH4Cl + NaOH → NH3↑ + H2O + NaCl
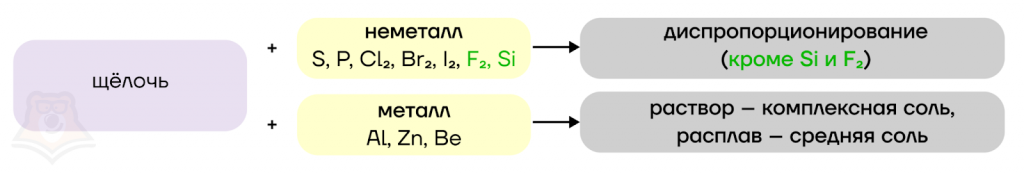
Щелочи, помимо реакций ионного обмена, способны вступать в окислительно-восстановительные реакции с простыми веществами.
Такие неметаллы как S, P, Cl2, Br2 и I2 диспропорционируют в растворах щелочей.
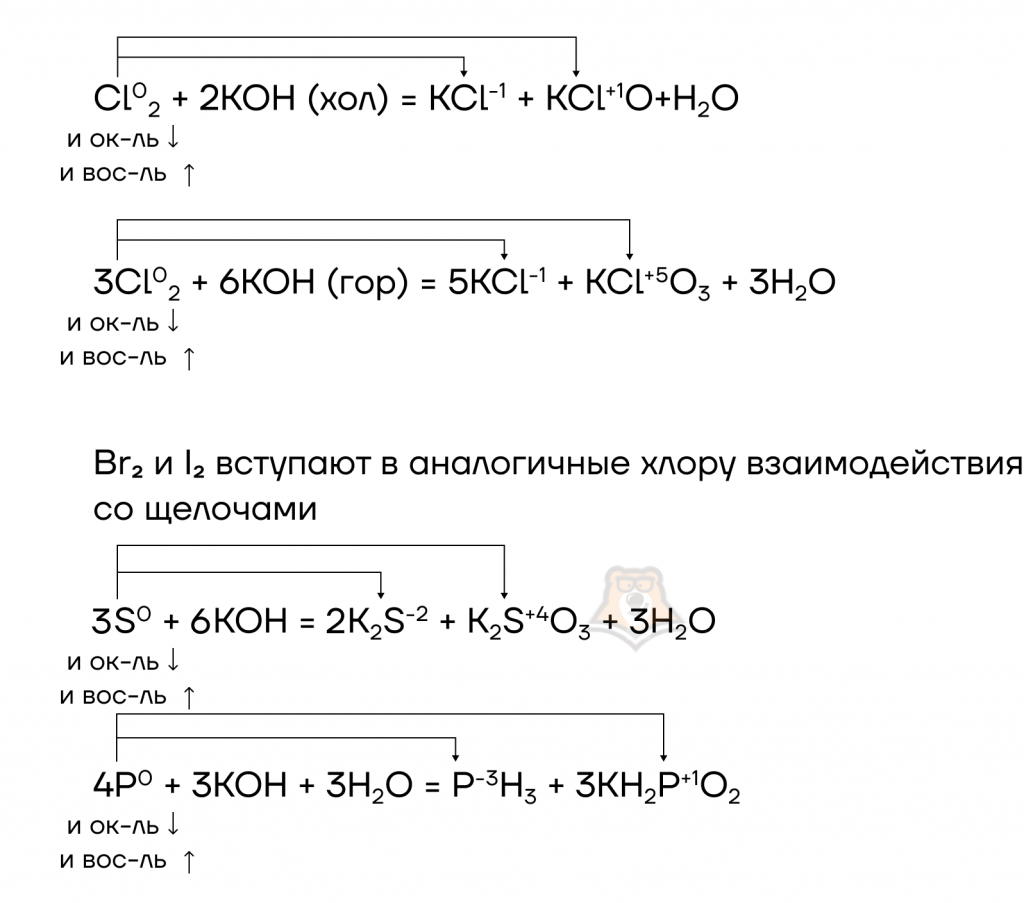
Кремний растворами щелочей окисляется.
2NaOH + Si0 + H2+O → Na2Si+4O3 + 2H20
Некоторые металлы, гидроксиды которых обладают амфотерными свойствами, также окисляются растворами щелочей, образуя при этом комплексные соли, если же реакция протекает в расплаве, то образуются средние соли.
2Al + 6NaOH+1 → 2NaAl+3O2 + 2Na2O + 3H02
2Al0 + 2NaOH + 6H2+O → 2Na[Al+3(OH)₄] + 3H20
Нерастворимые основания термически неустойчивы и при нагревании разлагаются на соответствующий оксид и воду.
Cu(OH)2 → CuO + H2O
Химические свойства амфотерных гидроксидов
Амфотерные гидроксиды являются одновременно слабыми основаниями и слабыми кислотами. Их основные свойства проявляются при взаимодействии с кислотами, а кислотные — при взаимодействии с основаниями.
Взаимодействие амфотерных гидроксидов возможно только с растворимыми кислотами и кислотными оксидами, которым соответствуют сильные кислоты. Реакции, в целом, не отличаются от аналогичных для основных гидроксидов.
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
2Al(OH)3 + 3SO3 → Al2(SO4)3 + 3H2O
Cr(OH)3 + CO2 -/→
При взаимодействии амфотерных гидроксидов со щелочами и с основными оксидами щелочных и щелочноземельных металлов также образуются соли, но элемент, входящий в состав амфотерного гидроксида, оказывается в составе аниона соли.
При взаимодействии с растворами щелочей образуются комплексные соли:
Al(OH)3 + NaOH(р-р) → Na[Al(OH)4]
| Амфотерных гидроксид | Комплексный анион |
| Be(OH)2 | [Be(OH)4]2- |
| Zn(OH)2 | [Zn(OH)4]2- |
| Sn(OH)2 | [Sn(OH)4]2- |
| Pb(OH)2 | [Pb(OH)4]2- |
| Al(OH)3 | [Al(OH)4]— |
| Cr(OH)3 | [Cr(OH)6]3- |
При взаимодействии с расплавами щелочей или основными оксидами при нагревании образуются «обычные» соли:
Al(OH)3 + NaOH(распл.) → NaAlO2 + 2H2O
Al(OH)3 + Na2O → NaAlO2 + H2O
| Амфотерных гидроксид | Анион |
| Be(OH)2 | BeO22- |
| Zn(OH)2 | ZnO22- |
| Sn(OH)2 | SnO22- |
| Pb(OH)2 | PbO22- |
| Al(OH)3 | AlO2— |
| Cr(OH)3 | CrO2— |
Соли
Соли — электролиты, состоящие из катиона и аниона. Как правило, катионом является катион металла Me+ или аммония NH4+, а анионом — кислотный остаток.
Выделяют следующие классы солей.
- Средние соли. Продукт полного замещения атомов водорода кислоты на катионы или гидроксильных групп основания на кислотный остаток.
Например, NaCl, CuSO4, KNO3.
- Кислые соли. Продукты неполного замещения атомов водорода кислоты (которые могут быть замещены) на катионы.
Например, Ca(HCO3)2, Na2HPO4.
- Основные соли. Продукты неполного замещения гидроксильных групп основания на кислотный остаток.
Например, MgOHCl, Fe(OH)2NO3.
- Комплексные соли. Соединения сложного строения, содержащие комплексный катион или анион. Комплексный ион, как правило, состоит из иона металла связанного с лигандами — молекулами или другими ионами.
Например, Na[Al(OH)₄], [Cu(NH3)4]SO4.
Кроме выделения таких типов солей можно отдельно выделить бескислородные соли — бинарные соединения металлов и неметаллов (NaCl, CaS и т.д.) и кислородсодержащие соли — производные кислородсодержащих кислот (Na2SO4, KNO3 и т.д.)
Номенклатура солей
Формулы солей составляют из формул катиона и аниона, взятых в таком отношении, чтобы суммарный заряд был равен 0. Например, соль, составленная из катиона алюминия Al3+ и сульфатного аниона SO42-, будет иметь вид Al2(SO4)3.
Названия солей, в свою очередь, образуются из названий аниона и катиона в указанном порядке. В конце, если это необходимо, римскими цифрами в круглых скобках указывается степень окисления металла в катионе.
[анион] [катион](ст.окисл.)
Названия бескислородных анионов построены из латинского названия элемента с постфиксом -ид.
FeCl3
хлорид железа(III)
Названия кислородсодержащих анионов построены из латинского названия элемента, а также префикса и постфикса, указывающих на степень окисления центрального атома.
- Пер-…-ат — используется для высшей степени окисления, если элемент образует кислородсодержащие анионы в четырех различных степенях окисления.
NaCl+7O4
перхлорат натрия
- …-ат — используется для высшей степени окисления, если элемент образует кислородсодержащие анионы меньше, чем в четырех различных положительных степени окисления. Также используется для второй по величине степени окисления в случае четырех различных.
Na2S+6O4
сульфат натрия
NaCl+5O3
хлорат натрия
Следующие префиксы и постфиксы идут в порядке уменьшения степени окисления.
- …-ит
Na2S+4O3
сульфит натрия
NaCl+3O2
хлорит натрия
- Гипо-…-ит
NaCl+1O
гипохлорит натрия
Формулы и названия наиболее важных кислотных остатков представлены в таблице.
| Формула кислотного остатка | Название кислотного остатка |
| ClO4— | Перхлорат |
| ClO3— | Хлорат |
| ClO2— | Хлорит |
| ClO— | Гипохлорит |
| SO42- | Сульфат |
| SO32- | Сульфит |
| NO3— | Нитрат |
| NO2— | Нитрит |
| PO43- | Фосфат |
| CO32- | Карбонат |
| SiO32- | Силикат |
Названия кислых солей образуются от названия средней соли путем добавления приставки гидро- (и греческого числительного, если это необходимо).
Na2HPO4
гидрофосфат натрия
NaH2PO4
дигидрофосфат натрия
Названия кислых солей образуются от названия средней соли путем добавления приставки гидроксо- (и греческого числительного, если это необходимо).
CaOHCl
гидроксохлорид кальция
Al(OH)2NO3
дигидроксонитрат алюминия
Изучение полных правил номенклатуры комплексных соединений заняло бы у нас слишком много времени, посмотрим на номенклатуру наиболее важных в рамках подготовки к ЕГЭ комплексных соединений — гидроксокомплексов.
Название таких соединений, в целом, строится так же, как название солей, особенности имеются только в названии комплексного аниона. Рассмотрим на примере:
Na[Al(OH)4]
Называем анион:
- Смотрим на количество гидроксильных групп, их четыре, так что пишем «тетра-».
- Указываем на гидроксогруппы с помощью слова «гидроксо».
- Далее идет латинское название центрального атома с постфиксом -ат (и его степень окисления, если это необходимо) — «алюминат»
- Наконец, называем катион — «натрия».
Na[Al(OH)4]
тетрагидроксоалюминат натрия

Способы получения солей
С получением солей все просто — соли получаются в реакциях между основаниями и кислотами, основными и кислотными оксидами, кислотами и металлами и т.д. Получение кислот из различных классов неорганических соединений отражено на схеме.
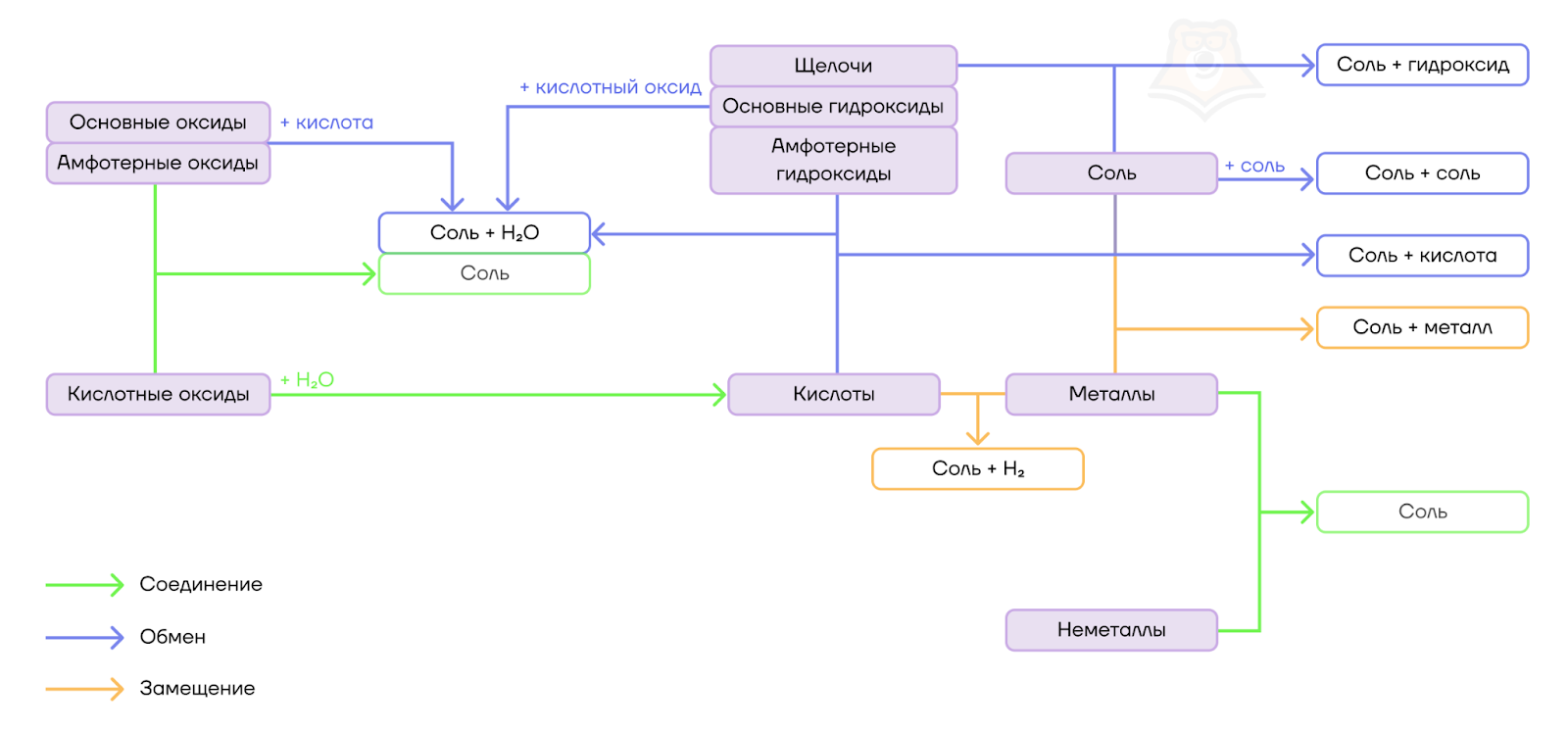
Кислые соли можно получить из основных (амфотерных) оксидов, оснований (амфотерных гидроксидов) и избытка кислоты или при действии кислот на соответствующие средние соли.
NaOH + H2SO4 (изб.) → NaHSO4 + H2O
Na2SO4 + H2SO4 → 2NaHSO4
Основные соли можно получить аналогичным образом, но с использованием оснований.
HCl + Ca(OH)2 (изб.) → CaOHCl + H2O
CaCl2 + Ca(OH)2 → 2CaOHCl
Гидроксокомплексы можно получить при действии щелочей на амфотерные оксиды и гидроксиды или соответствующие металлы.
Al(OH)3 + NaOH (р-р) → Na[Al(OH)4]
2Al + 2NaOH + 6H2O → 2Na[Al(OH)₄] + 3H2
Химические свойства солей
Важнейшим типом реакций для солей являются реакции ионного обмена с кислотами, основаниями и другими солями, если выполняются условия протекания реакций ионного обмена.
- Выделение газа:
Na2S + 2HCl → 2NaCl + H2S↑
- Образование осадка:
Ca(NO3)2 + Na2CO3 = CaCO3↓ + 2NaNO3
- Образование слабого электролита:
CH3COONa + HCl → CH3COOH + NaCl
Подробнее об этом можно почитать в статье «Реакции ионного обмена».
Для солей металлов характерен и один вид окислительно-восстановительных реакций. Более активные металлы способны вытеснять менее активные из растворов их солей.

Железо «сильнее» меди, вытесняет ее из соли.
Fe + Cu(NO3)2 = Fe(NO3)2 + Cu
А вот металлический никель вытеснить натрий из раствора соли не способен.
NaCl + Ni -/→
Знания классификации и номенклатуры важнейших неорганических веществ проверяются в задании №5 ЕГЭ по химии. Разберемся на примере.
Задание. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) кислой соли; Б) кислотного гидроксида; В) комплексной соли.
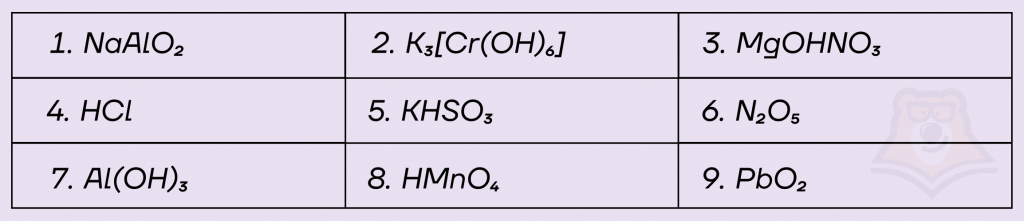
В ответ запишите номера выбранных ответов в порядке соответствующем АБВ.
Решение.
А) Кислая соль должна содержать кислотный остаток, в котором не все атомы водорода замещены на металл — ответ 5 — KHSO3.
Б) Кислотные гидроксиды — это кислородсодержащие кислоты, кислотой является HMnO4. Ответ 8.
В) Комплексные соли — соли, содержащие комплексный катион или анион. При записи формулы комплексный ион выделяется с помощью квадратных скобок. Комплексной солью является вещество под номером 2 — K3[Cr(OH)6].
Ответ: 582
Вот и все, мы вспомнили и обобщили свойства важнейших классов неорганических соединений. Свойства кислот, оснований, амфотерных гидроксидов и солей достаточно похожи, все они вступают в реакции ионного обмена и у каждого есть «свой» вид ОВР. Главное — не забывать, что не все реакции идут, обязательно проверять реагенты и продукты на растворимость, а также не забывать смотреть на ряд активности металлов. Кстати, у солей есть еще одно интересное свойство, про которое мы сегодня не поговорили, но о котором можно узнать в статье «Гидролиз солей».
Фактчек
- Основания — электролиты, при диссоциации которых образуются анионы одного типа — гидроксильные анионы OH—.
- Амфотерные гидроксиды — гидроксиды металлов в степенях окисления +3 и +4, а также: Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2.
- Кислоты — электролиты, при диссоциации которых образуются катионы одного типа — катионы водорода H+.
- Соли — сложные вещества, которые состоят из металла и кислотного остатка.
- Свойства кислот, оснований и солей достаточно похожи. Главное — не забывать, что не все реакции идут, обязательно сверять реагенты и продукты на растворимость, а также не забывать смотреть на ряд активности металлов.
- Важнейшие классы неорганических соединений связаны друг с другом генетической связью.
Проверь себя
Задание 1.
С каким из веществ вступает в реакцию гидроксид натрия?
- Галогенами
- Натрием
- Медью
- Оксидом кальция
Задание 2.
С каким типом веществ вступают в реакцию нерастворимые карбонаты?
- Нерастворимыми основаниями
- С растворимыми сильными кислотами
- С неметаллами
- Со щелочами
Задание 3.
В ходе какого взаимодействия можно получить комплексную соль?
- Щелочи и амфотерного гидроксида
- Кислоты и амфотерного оксида
- Амфотерного оксида и воды
- Основного оксида и воды
Задание 4.
Какое взаимодействие относится к реакциям нейтрализации?
- Гидроксида алюминия и гидроксида натрия
- Гидроксида кальция и серной кислоты
- Карбоната кальция и раствора углекислого газа
- Соляной кислоты и цинка
Ответы:1. — 1; 2. — 2; 3. — 1; 4. — 2.


 к списку статей
к списку статей





