Химические реакции по тепловому эффекту
На этой странице вы узнаете
- Что нужно для того, чтобы стать учителем будущего императора?
- Связан ли как-то гипс с энергией, которая необходима для протекания реакции?
- Неужели для протекания реакции не всегда достаточно наличия реагирующих веществ?
Может вы слышали, что зимой рекомендуют есть сало и другие жирные продукты? Из них легко получить энергию, которую организм тратит, в частности, на выработку теплоты, чтобы согреться зимой. Либо мы можем согреться с помощью обогревателя, но ему тоже нужна энергия, чтобы вырабатывать теплоту, правда немного другая. В любом случае мы с вами видим, что понятия «энергия» и «теплота» часто связаны друг с другом. И вот сегодня мы с вами узнаем, как связаны теплота и энергия в химических реакциях.
Тепловой эффект химической реакции
Если мы после проведения реакции поднесем руку к пробирке или колбе, то сможем почувствовать, что внутри емкости теплее или холоднее, чем в окружающей среде. Почему же температура различна? Связано это с тем, что в ходе реакции выделяется или поглощается теплота. Можно сказать, что теплота — это физическая величина, а тепло — то, что мы ощущаем, то есть это характеристика окружающей среды, но четкой разницы между словами обычно нет и понятия взаимозаменяемые.
Тепловой эффект химической реакции — это количество теплоты, которое выделяется или поглощается при протекании реакции. Обозначается как Q.
Перед тем, как мы подробнее поговорим о тепловом эффекте реакции, введем базовые термины, без которых невозможно говорить о сегодняшней теме.
Термодинамическая система — тело или группа тел, мысленно выделенных из окружающей среды и находящихся во взаимодействии между собой и с окружающей средой.
Термодинамическая система характеризуется определенными параметрами: энергией, давлением, объемом и температурой.
А теперь, когда у нас есть все базовые понятия, вернемся к тепловому эффекту химической реакции.
По тепловому эффекту реакции делятся на экзотермические и эндотермические:
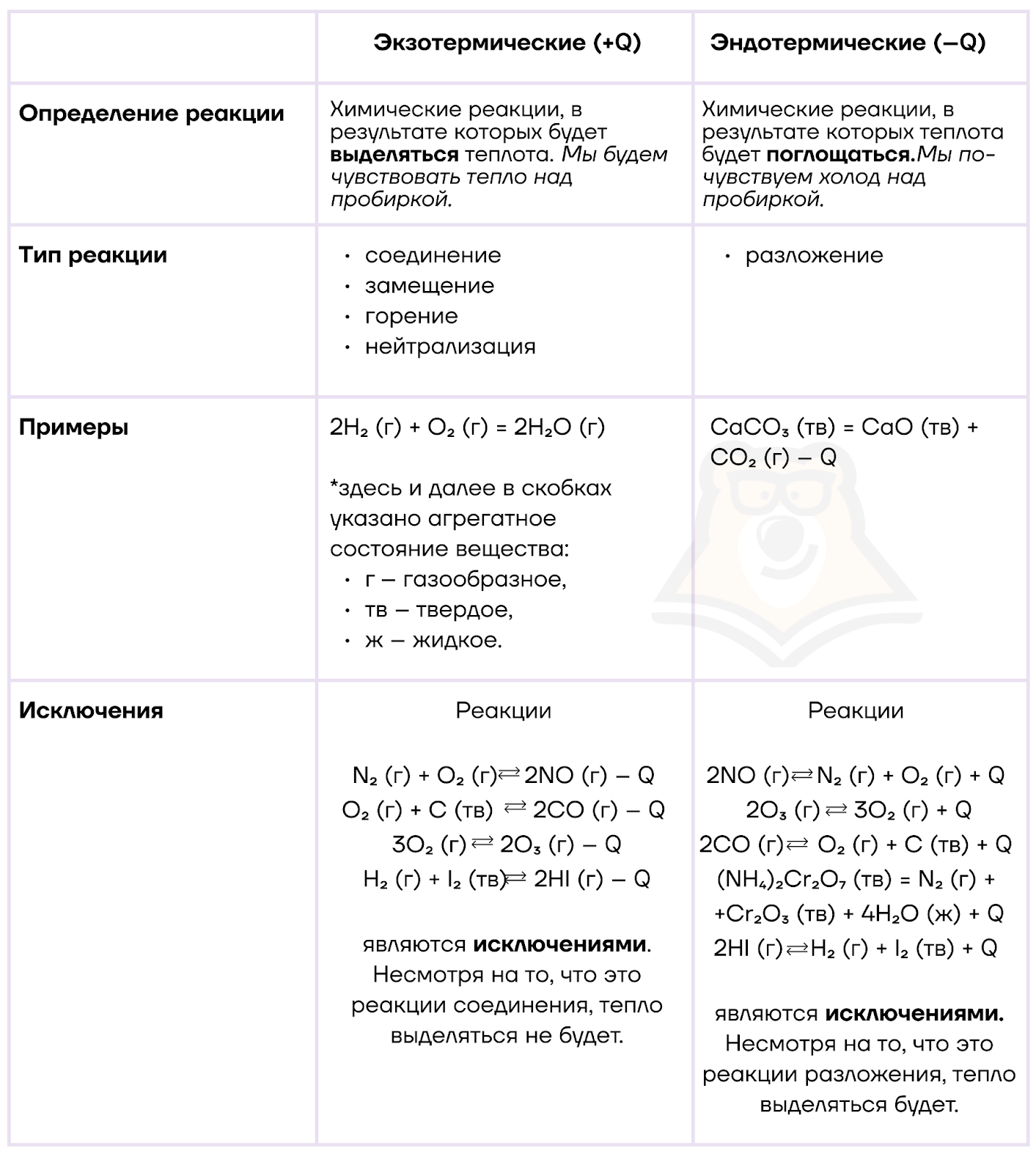
Рассмотрим пример экзо- и эндотермических реакций в жизни.
Представьте, что вы поехали на природу, наловили рыбы и решили сварить уху. Вы разводите костер и вешаете над ним котелок, в котором варится уха. В костре будет экзотермическая реакция, так как при сгорании дров выделяется очень много теплоты. А в котелке будут протекать эндотермические реакции. Теплота, выделяемое костром, тратится на приготовление пищи. Чтобы в котелке сварилась уха, теплота, которую дает огонь, должна поглотиться.

И чтобы окончательно разобраться в экзо- и эндотермических реакциях, предлагаем запомнить вот такого кота.
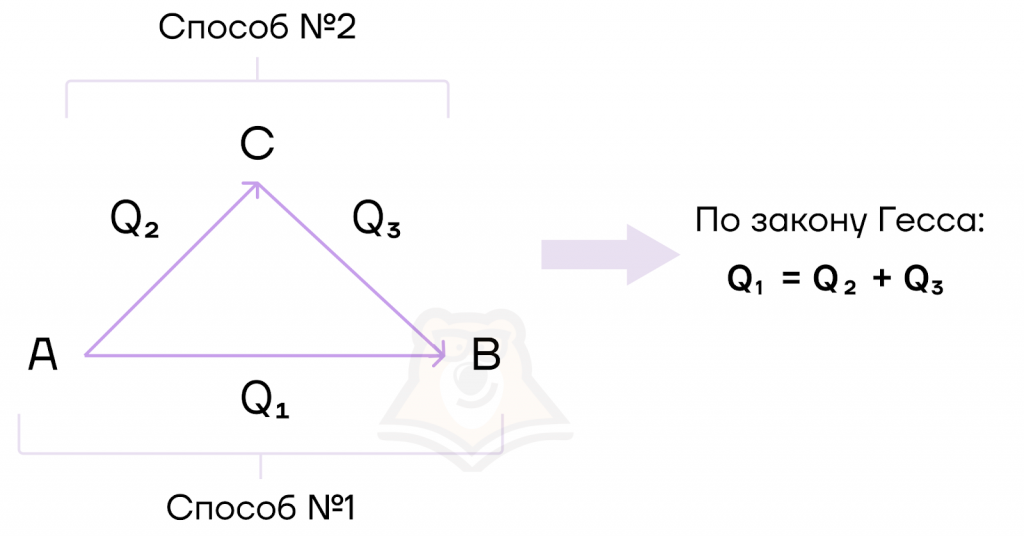
Существуют различные способы определения теплового эффекта реакции, но наиболее удобный способ — это закон Гесса, который был установлен русским ученым Гессом и носящий его же имя.
| Что нужно для того, чтобы стать учителем будущего императора? Герман Гесс внес огромный вклад не только в изучение термохимии, но и в систему образования России. Благодаря своей любви к науке и желанию передать эту любовь другим Гесс обучал основам химических знаний цесаревича Александра, будущего императора Александра II. Сам ученый говорил: «У меня нет иного желания, кроме как добиться хорошей репутации в России посредством проведения обширных химических работ в различных направлениях.» Герман Гесс был академиком Петербургской Академии наук и инспектором частных школ и пансионов Петербурга. Всю жизнь он пытался распространять химию как науку в России, много времени уделял методике преподавания дисциплины и написал учебник «Основания чистой химии», который в дальнейшем был доработан Менделеевым. |
Закон Гесса: тепловой эффект химической реакции не зависит от пути ее протекания, а зависит только от начального и конечного состояния системы.
То есть тепловой эффект реакции не зависит от ее промежуточных стадий.
Например, нас интересует исходное количество чая в пачке и сахара в сахарнице, а также результат (продукт) — готовый вкусный сладкий чай. Нас не интересует, сколько раз мы будем докладывать сахар, перемешивать его, подсыпать чай.
Рассмотрим, как это работает. Допустим, мы можем из вещества А получить вещество В двумя способами:
1) через одну реакцию;
2) через две последовательные реакции (с промежуточным веществом С).
Но по закону Гесса тепловой эффект реакции будет одинаков вне зависимости от выбранного пути получения.
Таким образом, суммарно, этот процесс можно записать так:
Q1 = Q2 + Q3
Немного потренируемся.
Нам дана реакция CO + H2O = CO2 + H2, тепловой эффект которой мы не знаем.
Зато мы знаем тепловые эффекты других реакций:
1) 2CO + O2 = 2CO2 + Q1
2) 2H2 + O2 = 2H2O + Q2
Чтобы привести две данные нам реакции к исходной, нам нужно сложить первую с перевернутой второй или, как было бы правильнее сказать, вычесть из первой реакции вторую:
2CO + O2 — 2H2 — O2 = 2CO2 — 2H2O + Q1 — Q2, кислород сократится;
2CO — 2H2= 2CO2 — 2H2O + Q1 — Q2, перенесем все вещества с минусом в другую часть со сменой знака, все как в математике;
2CO + 2H2O = 2CO2 + 2H2 + Q1 — Q2, поделим все на 2;
CO + H2O = CO2 + H2 + 0,5Q1 — 0,5Q2
Таким образом, тепловой эффект исходной реакции будет равен 0,5(Q1 — Q2)
Закон Гесса имеет два следствия.
- Тепловой эффект реакции равен разности сумм теплот сгорания реагентов и сумм теплот сгорания продуктов с учетом их коэффициентов.
Теплота сгорания — теплота, которая выделяется или поглощается при сгорании вещества до устойчивого соединения или оксида.
Реагенты — исходные вещества, вступающие в реакцию.
Продукты — конечные вещества, которые образуются в ходе реакции.
Для реакции 2Na + Cl2 = 2NaCl тепловой эффект реакции будет равен сумме двух теплот сгорания Na и одной теплоты сгорания Cl2 минус две теплоты сгорания NaCl.
- Тепловой эффект реакции равен разности сумм теплот образования реагентов и сумм теплот образования продуктов с учетом их коэффициентов.
Теплота образования — теплота, которая выделяется или поглощается при образовании сложного вещества из простых веществ.
Для реакции Na2O + CO2 = Na2CO3 тепловой эффект равен теплоте образования Na2CO3 минус сумма теплот образования Na2O и СО2.
Теперь мы знаем, что такое тепловой эффект реакции, но как его «показать»? В этом нам помогут термохимические уравнения.
Чем отличается химическое уравнение от термохимического?
Мы уже привыкли видеть химические уравнения, но что же такое термохимическое уравнение? Подсказка кроется в самом названии.
Термохимическое уравнение — это уравнение реакции, в которой помимо реагентов и продуктов (помимо химической реакции) записан тепловой (термо-) эффект реакции.
В обычном химическом уравнении мы пишем только продукты и реагенты, например:
2H2 (г) + O2 (г) = 2H2O (г)
В термохимическом уравнении еще указываем количество теплоты:
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж
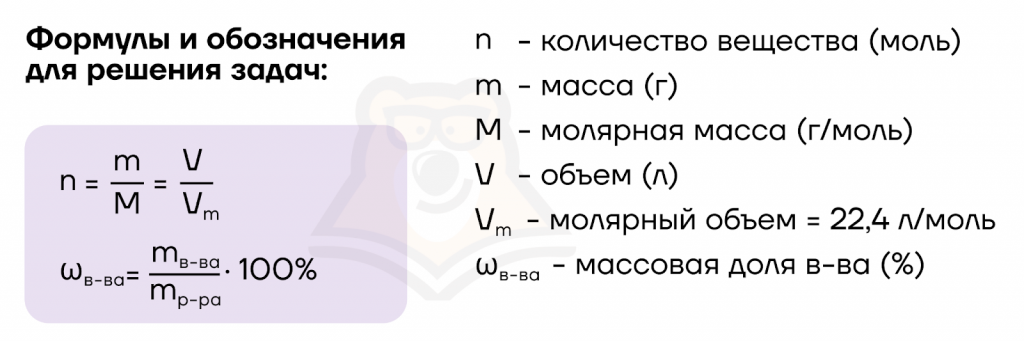
Прежде чем двигаться дальше, разберем пару задач №27 экзаменационного типа по этой теме. Для этого нам понадобится освежить в памяти основные расчетные формулы и обозначения.
Для начала кратко разберем, по какому механизму решать подобные задачи.
- Первым делом найдем количества вещества для соединения, данного нам по условиям задачи. Если нам не дана масса соединения, принимаем ее за х, тогда количество вещества будет равно n = m/M = x/M моль.
- Далее составляем пропорцию.
В зависимости от того, что нам дано и что нужно найти, принимаем искомую величину за х (если не сделали этого раньше) и подставляем все в пропорцию:
- количество вещества известного соединения — количество теплоты, выделившееся в ходе реакции;
- теоретическое количество данного вещества (коэффициент в реакции) — теплота, указанная в уравнении реакции.
- Записываем ответ в единицах измерения, указанных в задании, и с установленной в задании точностью.
В задании №27 ЕГЭ может встретиться задача на поиск количества теплоты.
Задание. Через сосуд с оксидом марганца(IV) пропускали водород. В результате реакции полного восстановления образовалось 11 г металла и выделилось 7,89 кДж теплоты. Найдите теплоту, выделяющуюся в ходе реакции, уравнение которой имеет вид:
MnO2 + 2H2 = Mn + 2H2O + Q
Ответ округлите до сотых.
Решение.
Шаг 1. Сперва найдем количество вещества (n) марганца (Mn): для этого разделим массу (m = 11 г по условию) на молярную массу (M) металла (берем ее из таблицы Менделеева — для марганца это значение составляет 55 г/моль):
n(Mn) = m(Mn) / M(Mn) = 11 / 55 = 0,2 моль.
То есть 7,89 кДж теплоты выделяется при образовании 0,2 моль марганца.
Шаг 2. Теперь, исходя из уравнения реакции, где марганца образовалось 1 моль, составим пропорцию:
0,2 моль Mn — 7,89 кДж
1 моль Mn — х кДж
Отсюда х = 7,89 * 1 / 0,2 = 39,45 кДж.
Ответ: 39,45
Разберем еще один пример решения задач на тепловой эффект. В данном случае по известной реакции и количеству выделившейся теплоты мы находим массу неизвестного реагента. Посмотрим, как это делается.
В том же задании №27 ЕГЭ бывают задачи на поиск массы какого-либо реагента по термохимическому уравнению.
Задание. В результате реакции, термохимическое уравнение которой
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж
выделилось 1479 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). Ответ округлите до целых.
Решение. Чтобы вычислить массу образовавшейся воды, надо знать количество вещества воды (n) и ее молярную массу (М).
Для определения количества вещества надо составить пропорцию — за х обозначим количество вещества воды, реально образовавшейся в ходе реакции. Тогда по уравнению реакции при образовании 2 моль (коэффициент перед водой в уравнении реакции — 2)воды выделяется 484 кДж энергии, а при образовании х моль воды — 1479 кДж.
Можно записать так:
2 моль H2O — 484 кДж
х моль H2O — 1479 кДж
Отсюда, путем нехитрых арифметических преобразований, выводим, что:
х = 1479 * 2 / 484 = 6,11 моль — количество вещества образовавшейся воды (n).
Далее находим массу вещества как произведение количества вещества (n) воды на ее молярную массу (M):
m(H2O) = n * M = 6,11 моль * 18 г/моль = 110 г.
Ответ: 110
Правда несложно? Пара действий и ответ готов. Главное — внимательно все считать, не забывать про коэффициенты перед веществами в уравнениях химических реакций, и тогда все точно получится!
Теперь познакомимся с новыми терминами: энтальпия и энтропия, которые нам понадобятся для описания тепловых реакций.
Энтальпия
Мы уже говорили, что термодинамическая система характеризуется определенными параметрами, в том числе энергией.
Энергия системы определяется первым законом термодинамики.
«Энергия, переданная системе, расходуется на изменение внутренней энергии и на изменение объема системы»
E = ΔU + РΔV, где
E — энергия,
ΔU — изменение внутренней энергии,
Р — давление,
ΔV — изменение объема.
В данном случае значок ∆ (греческое «дельта») обозначает изменение параметра в ходе реакции — показывает разность между конечным и начальным значениями параметров в системе.
Энтальпия — это энергия реакции при постоянном давлении. Ее изменение — ∆H — характеризует тепловой эффект реакции. Теплота, выделяющаяся или поглощающаяся в ходе реакции, находится с изменением энтальпии в следующем соотношении: Q = —∆H.
Разберем на банальном примере, что представляет собой изменение энтальпии и как оно связано с тепловым эффектом реакции.
Допустим, мы решили приготовить сладкий чай. Энтальпия чая без сахара равна 100, а энтальпия сладкого чая — 110. Итого имеем:
- 110 – 100 = 10 – это изменение энтальпии при добавлении сахара в кружку (∆H = 10 );
- Так как Q = – ∆H, то теплота реакции Q = -10 — столько теплоты мы потеряли при добавлении сахара, следовательно, реакция эндотермическая, после добавления сахара чай лучше подогреть.
Пример, конечно, очень условный, но для наглядности нам подходит.
Запомним:

- ∆H < 0, то есть значение ее отрицательное, числовое значение будет со знаком минус — экзотермический процесс.
- ∆H > 0, значение положительное — эндотермический процесс.
| Эндотермическая реакция | Экзотермическая реакция | |
| Теплота (Q) | Поглощается (-Q) | Выделяется (+Q) |
| Изменение энтальпии (∆Н) | Положительное (+∆Н) | Отрицательное (-∆Н) |
Итак, мы разобрались с тем, что же такое энтальпия. Но достаточно ли только ее одной для описания термодинамических систем? Увы, но нет — помимо энтальпии нам понадобится и другая величина, известная как энтропия.
Энтропия
Было бы просто описать мир, если бы все вокруг идеально подчинялось законам. Но наш мир немного сложнее и в нем есть место хаосу.
Вспомним наш пример с чаем — во время приготовления часть сахара может рассыпаться, часть чая пролиться и много других неожиданных отклонений от изначального идеального плана могут произойти. Это и будет хаос.
Упорядоченность — порядок размещения элементов/веществ в системе. В идеально упорядоченной системе все элементы/вещества занимают свои места и не изменяют своего положения во времени, находятся в состоянии покоя.
Тогда как в идеально неупорядоченной системе все элементы/вещества находятся в постоянном беспорядочном движении (хаос).
Энтропия (S) — это мера неупорядоченности (хаоса) системы.
Величина энтропии зависит от агрегатного состояния вещества, которое бывает твердым, жидким и газообразным. Каждое из них имеет свою кристаллическую решетку (пространственное расположение атомов в веществе). Чем сложнее она устроена и чем меньше у молекул возможностей двигаться, тем меньше энтропия. Энтропия для каждого агрегатного состояния отражена в следующей схеме:
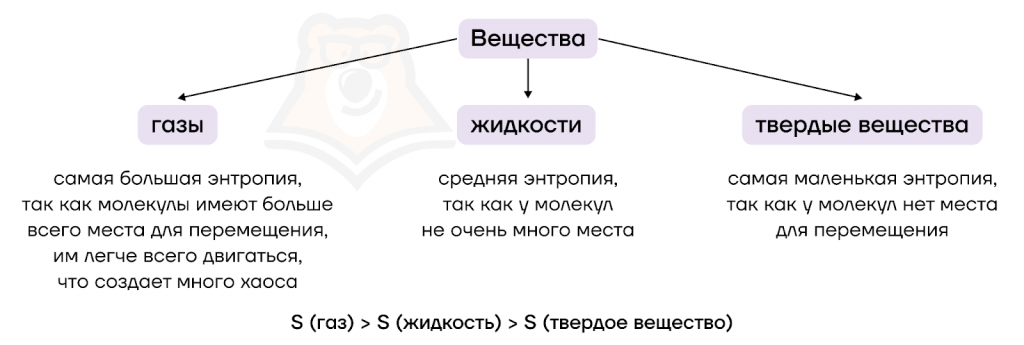
Есть два варианта развития событий.
- Энтропия растет с увеличением возможностей для движения молекул. Такое происходит:
- при испарении — система переходит из относительно упорядоченного жидкого состояния в неупорядоченный газ;
- при плавлении — из совсем упорядоченного твердого состояния система переходит в чуть менее упорядоченное жидкое;
- при сублимации (возгонке) — происходит скачок из упорядоченного твердого в неупорядоченное состояние газа.
- Энтропия уменьшается при переходе системы из менее упорядоченного состояния в более упорядоченное. Это происходит при обратных процессах:
- при конденсации (обратна испарению);
- при кристаллизации (обратна плавлению);
- при десублимации (обратна сублимации).
Представим себе, к примеру, автобус — пока он едет от остановки до остановки, его энтропия постоянна, система находится в равновесии. Разберем две ситуации, которые могут произойти за время следования автобуса по маршруту.
1) На первой остановке в автобус зашло столько пассажиров, что они заняли все сидения. На данном этапе система упорядочена и ее энтропия постоянна.
На второй остановке вошли другие пассажиры и начали «бродить» по салону автобуса. Кто-то из сидящих в автобусе начал уступать места вошедшим, внутри автобуса постоянно происходит перемещение пассажиров, следовательно, изменение энтропии (∆S) системы «автобус» будет положительно, так как система пришла в движение, произошло ее разупорядочение.
2) На третьей остановке некоторые пассажиры вышли, в системе «автобус» их осталось ровно столько, сколько и сидений. Все пассажиры спокойно сидят на своих местах, система стала более упорядоченной, при этом изменение энтропии (∆S) будет отрицательно.
С веществами все аналогично — чем более неупорядоченным является вещество, тем больше его энтропия.
Значение энтропии, как и значение энтальпии, не зависит от пути протекания реакции, а зависит только от начального и конечного состояния системы. Это значит, что изменение энтропии (∆S) в ходе реакции можно найти как разность ее конечного и начального значений.
| Связан ли как-то гипс с энергией, которая необходима для протекания реакции? Гипс никак не связан, а вот Гиббс очень сильно связан! Хотя разница всего лишь в паре букв. Итак, кто такой Гиббс? Гиббс — ученый, который ввел в термодинамику новую величину, характеризующую возможность протекания химических реакций. Как и любую другую форму энергии, ее измеряют в Джоулях и килоДжоулях. Эта величина впоследствии получила имя автора — энергия Гиббса. |

Изменение энергии Гиббса (∆G) связано с изменениями энтальпии (∆H) и энтропии (∆S) через формулу:
∆G = ∆H — T*∆S
где Т — абсолютная температура среды (по шкале Кельвина).
Энергия Гиббса является критерием самопроизвольного протекания процесса при постоянном давлении.
- При ∆G < 0 реакция идет самопроизвольно, без дополнительной энергии извне.
- При ∆G > 0 для протекания химической реакции необходимо приложить определенные внешние усилия.
- При ∆G = 0 в системе наступает химическое равновесие, то есть реакция прекращается.
| Неужели для протекания реакции не всегда достаточно наличия реагирующих веществ? Действительно, это так. Часто необходимы дополнительные условия — определенная температура, освещение, а самое главное, чтобы была энергия! Например, хлорирование алканов. Реакция может протекать только при нагревании или в присутствии ультрафиолетового излучения. В противном случае реакция просто не пойдет. |

Термохимия является одним из важных разделов химии, дающих понять, как химические реакции связаны с физикой, в частности, с разделом молекулярной физики. Знания, полученные в этой статье, пригодятся при дальнейшем изучении физической химии в вузе, а также при выполнении олимпиадных заданий.
И, конечно же, важно разобраться в этой теме, чтобы получить за выполнение задания №27 из КИМ ЕГЭ заветный балл. Также в этом вам может помочь статья «Расчеты по химическим формулам и уравнениям реакции».

Термины
Испарение — процесс перехода вещества из жидкого состояния в парообразное или газообразное, происходящий на поверхности вещества.
Плавление — процесс перехода вещества из твердого состояния (кристаллического) в жидкое.
Шкала Кельвина — термодинамическая шкала температуры, в которой 0°K = –273,16°C.
Фактчек
- По тепловому эффекту выделяют следующие типы реакций: экзотермические и эндотермические.
- Экзотермические реакции протекают с выделением тепла, а эндотермические — с поглощением тепла.
- Энтальпия — это потенциальная энергия реакции.
- Энтропия — это мера неупорядоченности (хаоса) системы.
- Закон Гесса: изменение энтальпии химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
- По изменению энергии Гиббса можно судить о возможности протекания реакции; само ∆G можно найти, зная изменения энтропии и энтальпии реакции.
Проверь себя
Задание 1.
К какому типу химической реакции относится реакция 2HI ⇄ Н2 + I2?
- Экзотермическая
- Эндотермическая
- Замещение
- Обмен
Задание 2.
К какому типу химической реакции относится реакция N2 + O2 ⇄ 2NO?
- Разложение
- Экзотермическая
- Эндотермическая
- Нейтрализация
Задание 3.
Чему равен тепловой эффект реакции?
Реакция: С + О2 = СО2 + Q1
Количество теплоты, выделяемое на промежуточных стадиях:
С + СО2 = 2СО + 110 кДж
2СО + О2 = 2СО2 + 284 кДж.
- 284 кДж
- 394 кДж
- 110 кДж
- 484 кДж
Задание 4.
При каком порядке преобразования веществ будет наблюдаться уменьшение энтропии?
- алмаз – раствор соляной кислоты – водород
- водород – раствор соляной кислоты – алмаз
- водород – алмаз – раствор соляной кислоты
- алмаз – водород – раствор соляной кислоты
Ответы:1. — 1; 2. — 3; 3. — 2; 4. — 2.


 к списку статей
к списку статей





