Электролитическая диссоциация электролитов в водных растворах
На этой странице вы узнаете
- Как зажечь лампочку от воды?
- Существует ли универсальный растворитель?
- Кто связал между собой физику, химию и биологию?
В недавнем прошлом люди ставили банки с водой перед телевизором, а известные маги сообщали воде волшебный заряд. В настоящее время мы бы со скепсисом отнеслись к подобного рода магам, ведь химики давно нашли способ, как «зарядить» воду без всякого волшебства. Каким же образом тогда происходит этот чудесный процесс и можем ли мы осуществить его самостоятельно? Сегодня мы подробно во всем разберемся.

Электролитическая диссоциация
В способах получения различных элементов, а также в рамках изучения общей химии мы знакомились с понятием электролиза.
Электролиз — это окислительно-восстановительная реакция (ОВР), протекающая при прохождении электрического тока через раствор или расплав электролита.
Подробнее об электролизе можно прочитать в статье «Электролиз расплавов и растворов (солей, щелочей, кислот)».
Но ведь для того, чтобы через вещество протекал ток, в нем должны быть заряженные частицы! Откуда же они берутся и почему одни вещества подходят для электролиза, а другие нет?
В начале XIX века физик и химик Майкл Фарадей установил, что некоторые вещества способны проводить электрический ток. Такие вещества были названы электролитами.
Электролит — это вещество, расплав или раствор которого способен проводить электрический ток.
К электролитам относится, например, поваренная соль (хлорид натрия NaCl).
| Как зажечь лампочку от воды? Вода сама по себе не проводит электрический ток: если мы погрузим провода, отходящие от лампочки в дистиллированную воду, то чуда не произойдет. Однако, если мы добавим в воду немного поваренной соли, то в растворе появится электролит, благодаря этому станет возможным проведение тока через раствор. При повторном погружении лампочки мы увидим свечение. |
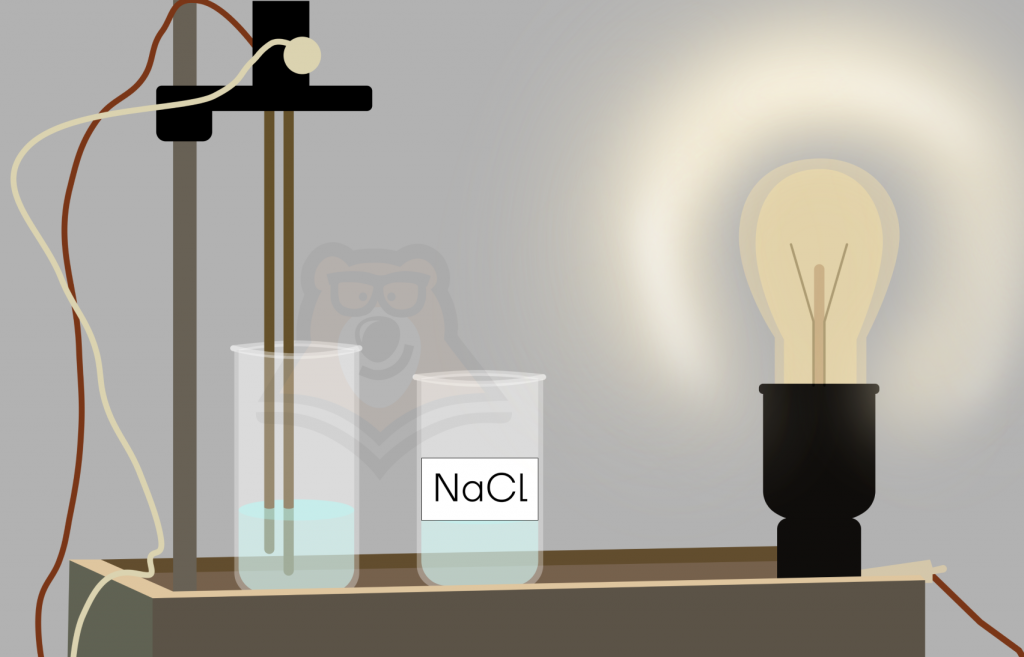
Вещества, которые не способны проводить ток, были названы неэлектролитами.
Неэлектролит — это вещество, раствор или расплав которого не проводит электрический ток.
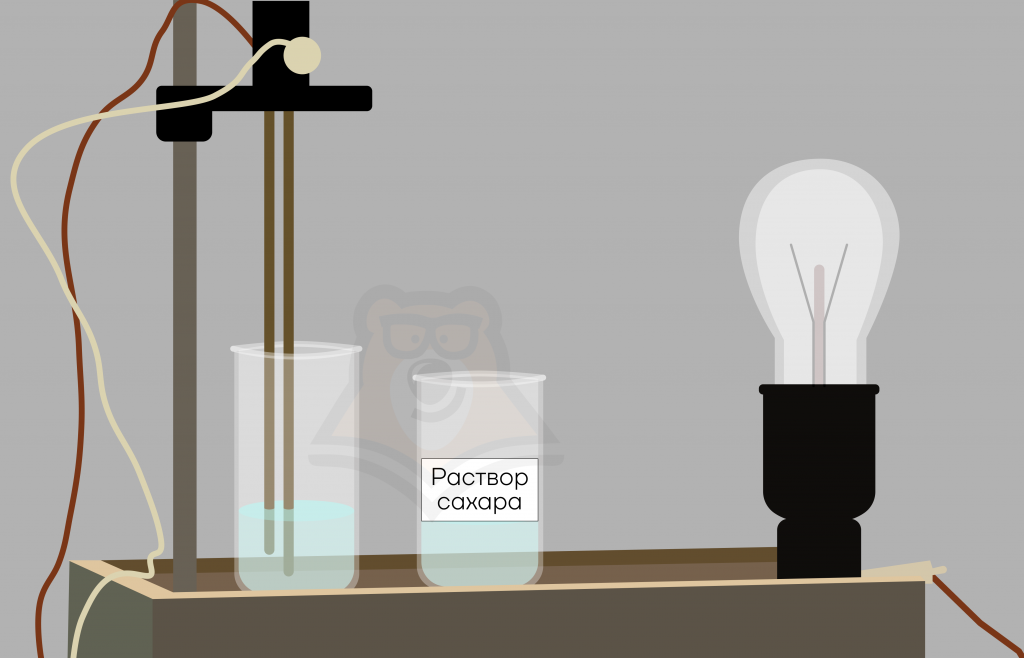
К неэлектролитам будет относиться, например, сахароза.
Вернемся к нашему эксперименту с лампочкой. Если вместо раствора поваренной соли мы внесем в воду сахар (сахарозу), то свет исходить от лампочки не будет, так как сахароза относится к неэлектролитам и, соответственно, проводить ток не будет.
Спустя полвека другой ученый-химик Сванте Август Аррениус обнаружил, что растворы, проводящие электрический ток, содержат больше частиц, чем можно было предположить, исходя из состава раствора. Это открытие и послужило толчком к возникновению теории электролитической диссоциации.
Электролитическая диссоциация — это процесс распада вещества на ионы, то есть заряженные частицы, в растворе или расплаве.
Важно отметить, что диссоциация — явление обратимое, то есть реакция протекает и в прямом, и в обратном направлении.
Если мы взглянем на таблицу растворимости веществ, то сможем увидеть все заряженные частицы и величину их заряда. В строчке сверху записаны катионы (обозначены в таблице голубым цветом), а в столбце слева — анионы (обозначены розовым цветом).
Катион — положительно заряженный ион.
Анион — отрицательно заряженный ион.

Для закрепления изученного материала давайте попрактикуемся.
Решим пример 13 задания из ОГЭ по химии, в котором может встретиться информация о катионах и анионах.
Задание. В каком ряду указаны только анионы?
1. OH—, Na+;
2. SO32-, NO3—;
3. Ba2+, Н+;
4. Li+, HCO3—;
5. F—, HPO42-.
Решение. Анионы — отрицательно заряженные частицы, в третьем ряду у нас только положительно заряженные частицы (катионы), поэтому этот вариант ответа сразу отметаем.
В первом и четвертом рядах у нас есть как отрицательно, так и положительно заряженные частицы, а по условию задания нам нужны только анионы.
В рядах под номерами 2 и 5 как раз даны только анионы, берем эти числа в ответ.
Ответ: 25
Когда мы уже знаем, что одни вещества способны проводить ток, а другие — нет, нам было бы интересно узнать, какие классы веществ относят к электролитам.
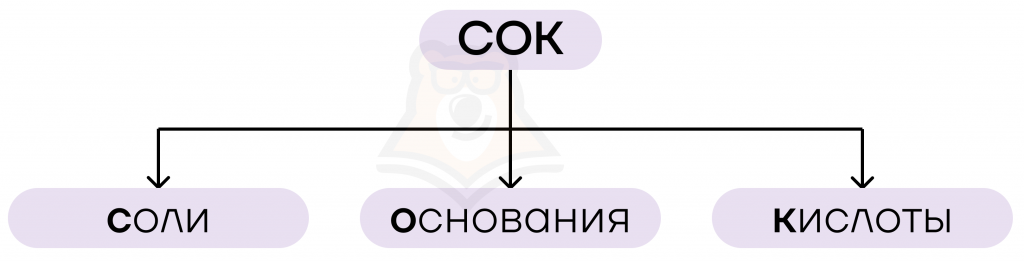
Запоминаем классы веществ по первым буквам, из этих букв и складывается кодовое слово «СОК»:
Диссоциация может проходить как в растворах, так и в расплавах. Давайте сначала разберемся, в чем основное различие этих двух состояний вещества.
О растворах и расплавах
Для начала определим, при каких условиях образуются растворы, а при каких расплавы, а для этого дадим определения этим состояниям.
Расплав — твердое вещество, которое нагрели до очень высоких температур (температуры плавления), и оно стало жидким.
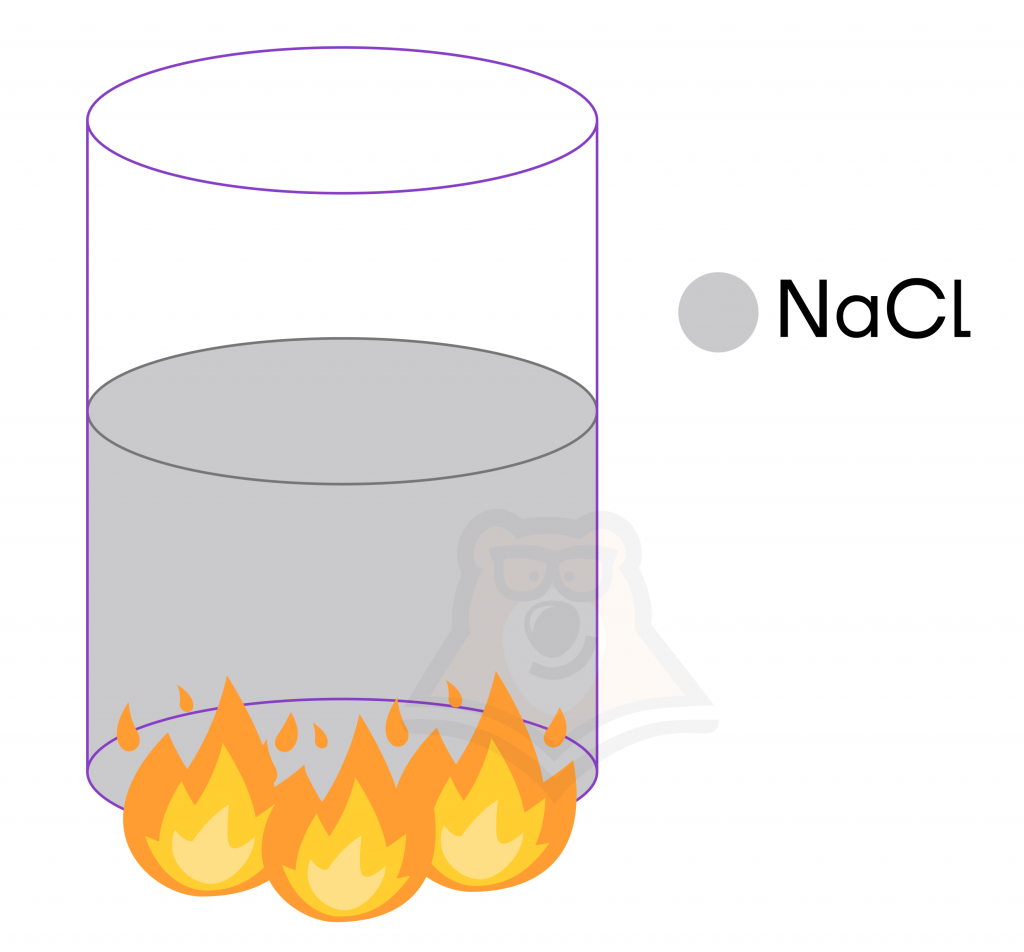
Образование заряженных частиц в расплавах происходит под действием разрушения кристаллической решетки при нагревании.
Тяжело представить нашу жизнь без растворов: утренняя кружка кофе или чая, свежий лимонад в жаркий летний день или даже бульон, на котором мы готовим суп, — без всего этого наши будни не были бы такими радостными. Но растворы окружают нас не только при приеме пищи, они буквально повсюду. Что же такое раствор?
Раствор — однородная система, состоящая из нескольких веществ: растворенного вещества вещества и растворителя (чаще всего воды).
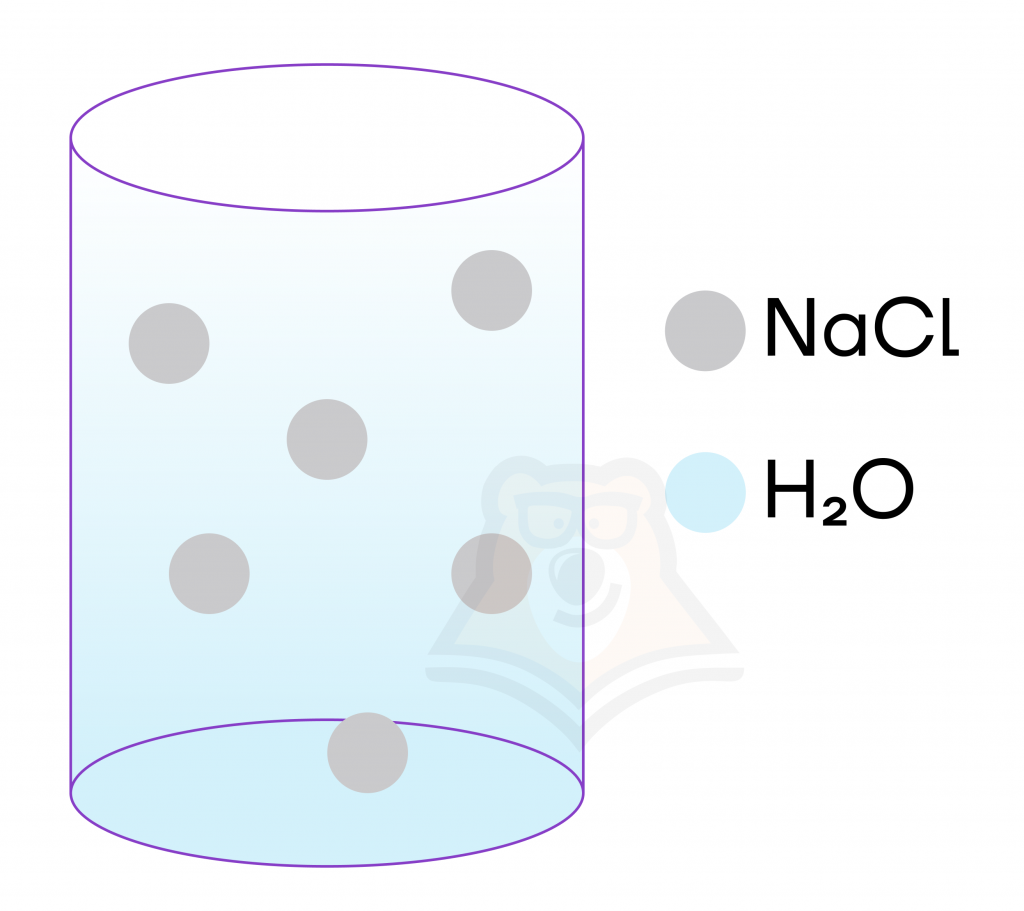
Образование заряженных частиц в растворах происходит также при разрушении кристаллической решетки, но уже не из-за воздействия высокой температуры, а из-за воздействия молекул воды.
Рассмотрим механизм образования ионов подробнее на примере растворения поваренной соли, хлорида натрия NaCl, в воде. Данная соль состоит из катиона натрия Na+ и аниона хлора Cl—. Вода в свою очередь является диполем, поэтому она частично положительно заряжена за счет атомов водорода, а отрицательный заряд сконцентрирован на атоме кислорода.
В кристаллическом виде ионы соли удерживаются между собой силами электростатического притяжения, однако при попадании соли в воду молекулы воды окружают ее. Катионы натрия начинают двигаться к отрицательно заряженной части молекулы воды, а анионы хлора — к положительной. Связь между катионом натрия и анионом хлора ослабевает, происходит растворение и диссоциация поваренной соли.
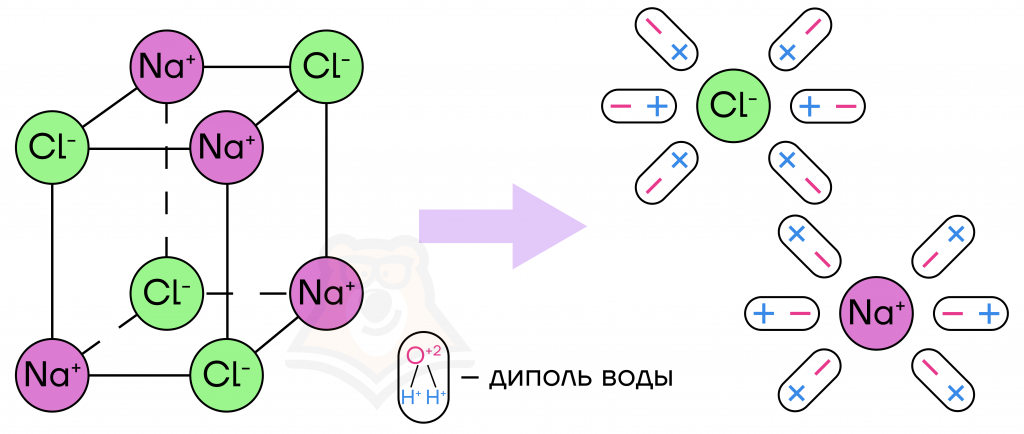
Для того, чтобы получить раствор, нам нужно добавить некоторое растворимое вещество в растворитель. Процесс образования раствора будет называться растворением.
Растворение — физико-химический процесс, при котором происходит диссоциация вещества и взаимодействие образовавшихся частиц с молекулами растворителя.
Важно отметить, что вещество, которое преобладает в растворе — это растворитель.
Чаще всего в роли растворителя используется вода.
| Существует ли универсальный растворитель? Изначально древнегреческие философы и ученые называли все растворы водой, однако в дальнейшем было определено, что вода может растворить далеко не все соединения. В Средние века на роль универсального растворителя была предложена щелочь, однако по мере открытия новых соединений и она оказалась непригодной. В нынешнее время есть несколько претендентов на роль универсального растворителя: — Царская водка, названная так за счет того, что способна растворять царский металл — золото — способна растворить практически все, за исключением керамики. — Тетрагидрофуран способен растворять множество веществ, в том числе резину, но растворяет он также далеко не все. На данный момент вода все еще является самым универсальным растворителем, способным растворять как органические, так и неорганические вещества! |

Теперь, когда мы уже разобрались в причинах появления заряженных частиц в растворах и расплавах электролитов, перейдем к непосредственному рассмотрению электролитической диссоциации в водных растворах, именно она чаще всего встречается на экзамене.
Диссоциация в водных растворах, классификация электролитов
Как мы уже узнали, все вещества можно разделить на электролиты и неэлектролиты. Но и внутри группы электролитов есть своя классификация. В ее основе лежит способность веществ распадаться на ионы, чаще всего мы рассматриваем этот процесс в растворах. В данной классификации мы можем разделить все электролиты на слабые и сильные.
Сильный электролит — вещество, которое в растворе практически полностью диссоциирует на ионы.
Слабый электролит — вещество, которое почти не диссоциирует на ионы в растворе.
Качественной характеристикой, по которой мы определяем силу электролита является степень диссоциации.
Степень диссоциации (α) показывает, на какое количество молекул (n) распалось соединение при растворении по отношению к количеству растворенных молекул (N).
α = n/N
Важно учитывать, что N показывает не просто количество молекул в растворе, а именно количество растворенного вещества. В чем же отличия? Давайте разберемся на примере нерастворимых соединений.
При погружении в воду хлорида серебра(I) (AgCl) большая часть соли так и останется в виде осадка, однако малая часть вещества растворится. Так как хлорид серебра(I) относится к классу солей, то та небольшая растворенная часть продиссоциирует полностью, поэтому хлорид серебра(I) мы можем отнести к сильным электролитам. Однако хлорид серебра(I) в химических реакциях мы на ионы не расписываем.
В рамках экзамена данный вопрос не рассматривается.
В этом электролиты похожи на спортсменов: один за минуту может отжаться больше 50 раз (распасться на много ионов), а другой едва десятку выжимает (почти никаких ионов). Люди быстро определят первого как сильного, а второго, увы, как слабого.

Вернемся к нашей схеме основных классов веществ, являющихся электролитам, и обозначим на ней, какие вещества будут относиться к сильным электролитам.
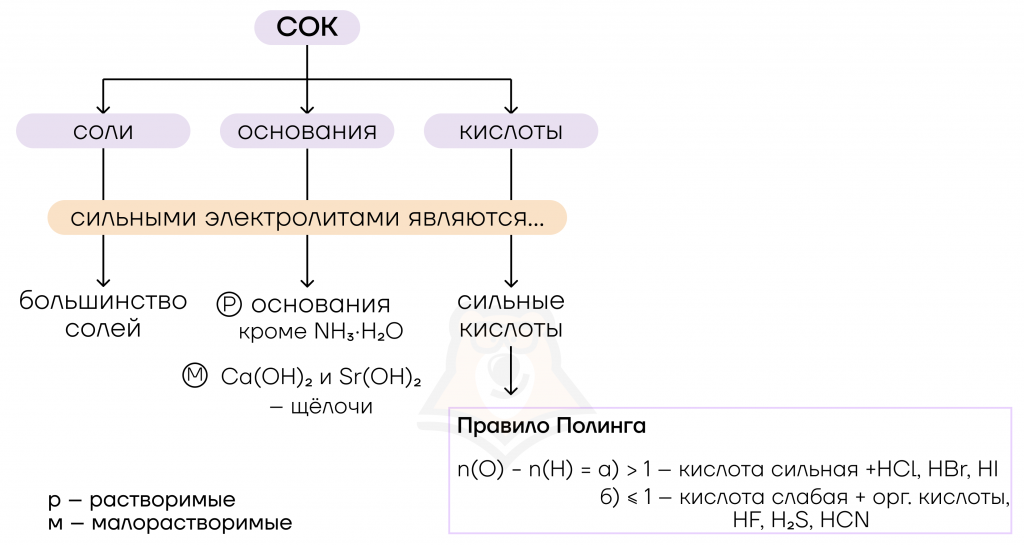
То есть к сильным электролитам будет относиться большинство солей, сильные основания и сильные кислоты.
К сильным основаниям относятся все растворимые основания (за исключением NH3·H2O) и малорастворимые Ca(OH)2 и Sr(OH)2.
Для определения силы кислоты используется правило Полинга, которое гласит:
«Кислота является сильной, если разница между числом атомов кислорода и водорода больше единицы».

| Кто связал между собой физику, химию и биологию? Лайнус Полинг изначально был больше физиком, чем химиком: он исследовал структуру кристаллов при помощи рентгеновских лучей, интересовался квантовой физикой. После открытия дифракции электронов (процесс рассеяния электронов) Полинг применил эту технику на многие химические соединения. Эти опыты помогли ему создать шкалу электроотрицательности, благодаря которой можно определить, насколько элемент склонен принимать электроны. Электроотрицательность лежит в основе как ковалентной химической связи — связи между двумя атомами неметаллов, так и ионной — связи между металлом и неметаллом. Когда Альберта Эйнштейна спросили, что он думает о работе Полинга, он, пожав плечами, ответил: «Для меня это было слишком сложно». За исследование химических связей Лайнус Полинг в 1954 году получил Нобелевскую премию по химии. Открытия Полинга затронули не только общую и неорганическую, но и органическую химию — гибридизация также является его идеей. Внимание Полинга было приковано в том числе к биологии: в военное время Полинг разработал искусственный заменитель сыворотки крови и датчики кислорода. Также Полинг занимался изучением структуры молекул белков и ДНК, без его идей невозможно было бы открытие двуспирального строения ДНК. Изучение Полингом серповидноклеточной анемии породило еще одно новое направление в науке — молекулярную биологию. После Второй мировой войны Полинг активно выступал за запрет ядерного оружия, изложив все последствия ядерной войны в книге «Нет больше войны!». Именно его усилия привели к заключению Договора о запрещении испытаний ядерного оружия, за что Полинг был награжден Нобелевской премией мира. В последние годы жизни Полинг не оставил науку: он занимался изучением аскорбиновой кислоты (витамина С) и ее влияния на иммунитет. К сожалению, за великими открытиями последовало и великое падение — влияние витамина С на иммунитет не было доказано, а идея Полинга породила миф, который негативно сказался на дальнейшем лечении простудных заболеваний по всему миру. |
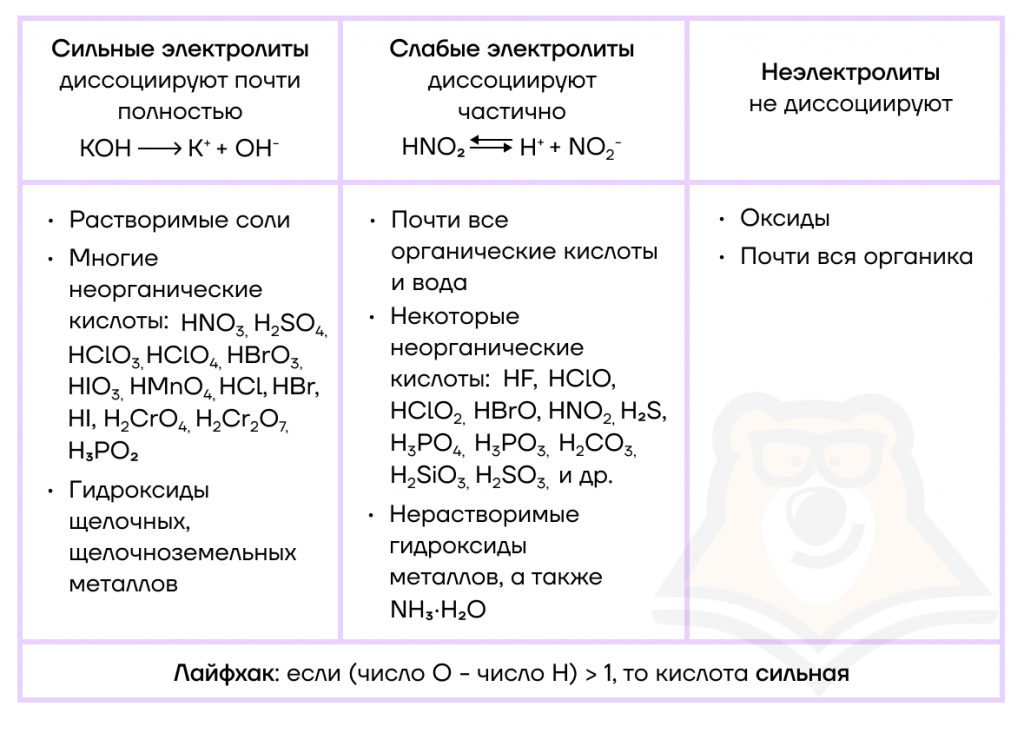
Разобравшись с электролитической диссоциацией в растворах, можем перейти к записи уравнения данного процесса.
Уравнения электролитической диссоциации
Разные классы химических соединений диссоциируют на разные катионы и анионы, и мы даже можем определить класс вещества с помощью уравнения электролитической диссоциации.
Кислоты — вещества, диссоциирующие в растворе на катион водорода (H+) и анион кислотного остатка.
Схема диссоциации кислот выглядит следующим образом:
HnA = nH+ + An-, где n- — заряд аниона A
К примеру, схема диссоциации соляной кислоты будет выглядеть таким образом:
HCl = H+ + Сl—
Если кислота многоосновная, то в ходе диссоциации от нее несколько раз отщепляется катион водорода. Такой вид электролитической диссоциации называют ступенчатым.
Посмотрим, что происходит при растворении ортофосфорной кислоты в воде.
I ступень: H3PO4 = H+ + H2PO4—
Молекула ортофосфорной кислоты диссоциирует на катион водорода и дигидрофосфат-анион.
II ступень: H2PO4— = H+ + HPO42-
Дигидрофосфат-анион все еще может отщеплять катион водорода, чем он и занимается!
III ступень: HPO42- = H+ + PO43-
Вы уже догадываетесь, что от образовавшегося гидрофосфат-аниона может отщепляться катион водорода, — это финальная стадия электролитической диссоциации ортофосфорной кислоты.
Основания — вещества, диссоциирующие в растворе на катион металла или аммония (NH4+) и гидроксид-анионы (ОН—).
Изобразим схему диссоциации оснований:
K(OH)n = Kn+ + nOH—, где n+ — заряд катиона K
А вот и пример — диссоциация гидроксида натрия!
NaOH = Na+ + OH—
Если основание содержит более одной гидроксильной группы, то оно диссоциирует ступенчато. На каждой ступени от основания отщепляется гидроксильная группа.
I ступень: Fe(OH)2 = FeOH+ + OH—
Гидроксильная группа отщепляется первый раз, а вместе с тем образуется гидроксо-катион.
II ступень: FeOH+ = Fe2+ + OH—
От гидроксо-катиона отщепляется гидроксильная группа, образуется катион железа. Отщепляться больше нечему, диссоциация окончена.
Соли – вещества, диссоциирующие в растворе на катион металла или аммония (NH4+) и анион кислотного остатка.
Соли делятся на множество видов, но схема диссоциации для всех общая:
KxAy = xMey+ + yAx-, где y+ — заряд катиона K, а x- — заряд аниона A.
Разберемся на примере диссоциации карбоната натрия.
Na2CO3 = 2Na+ + CO32-
Для комплексных солей механизм диссоциации будет аналогичен средним солям.
K[Al(OH)4] = K+ + [Al(OH)4]–
Диссоциация кислых солей протекает ступенчато.
I ступень: NaHCO3 = Na+ + HCO3—
II ступень: HCO3— = H+ + CO32-
Основные соли в большинстве своем являются нерастворимыми, диссоциация для них происходит в незначительной степени и на экзамене мы ее не расписываем.
CaOHCl = CaOH+ + Cl—
CaOH+ = Ca2+ + OH—
Обобщим полученную информацию в виде таблицы.
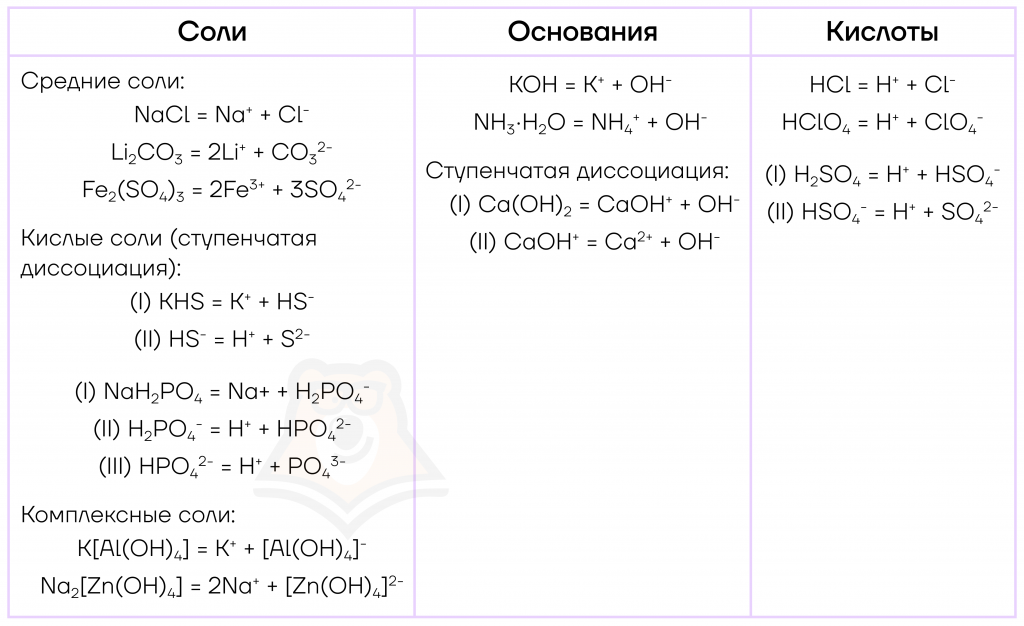
Для закрепления знаний об уравнении электролитической диссоциации попрактикуемся.
Разберем еще один пример задания 13 из ОГЭ по химии, на этот раз нам потребуются знания по уравнению электролитической диссоциации.
Задание. Выберите вещества, при диссоциации 1 моль которых получается 3 моль ионов.
1. NaCl;
2. H2SO4;
3. HBr;
4. Ba(OH)2;
5. LiNO3.
Решение: Напишем уравнение диссоциации каждого вещества.
1. Хлорид натрия (NaCl) — средняя соль, диссоциирует на катион металла и анион кислотного остатка:
NaCl = Na+ + Cl—
Мы видим, что из 1 моль хлорида натрия мы получим 1 моль катионов натрия и 1 моль хлорид-анионов, значит всего получим 2 моль ионов.
2. Серная кислота (H2SO4) — сильная многоосновная кислота, диссоциирует на катионы водорода и анион кислотного остатка:
H2SO4 = 2H+ + SO42-
Из 1 моль серной кислоты мы получили 2 моль катионов водорода и 1 моль сульфат-анионов, всего 3 моль ионов.
3. Бромоводород (HBr) — сильная одноосновная кислота, диссоциирует на катион водорода и бромид-анион:
HBr = H+ + Br—
Из 1 моль бромоводорода получили 1 моль катионов водорода и 1 моль бромид-анионов, всего 2 моль ионов.
4. Гидроксид бария (Ba(OH)2) — сильное основание, диссоциирует на гидроксид-анионы и катион бария:
Ba(OH)2 = Ba2+ + 2OH—
При диссоциации 1 моль гидроксида бария мы получили 2 моль гидроксид-анионов и 1 моль катионов бария, всего 3 моль ионов.
5. Нитрат лития (LiNO3) будет диссоциировать на катионы металла и нитрат-анион:
LiNO3 = Li+ + NO3—
При диссоциации 1 моль нитрата лития мы получим 1 моль катионов лития и 1 моль нитрат-анионов, всего 2 моль ионов.
Таким образом, нам подойдут варианты ответа под цифрами 2 и 4.
Ответ: 24
Сегодня мы узнали, что «зарядить» воду может каждый, для этого не требуется быть волшебником, достаточно просто разбираться в химии.

Электролитическая диссоциация является важным процессом, определяющим поведение многих веществ в растворах, мы наблюдаем ее каждый день, а теперь сможем и описывать это явление. Для того, чтобы разобраться во влиянии электролитической диссоциации на взаимодействие веществ и научиться применять все полученные знания на практике, рекомендуем вам прочитать статью «Реакции ионного обмена».
Термины
Диполь — это частица, которая с одной стороны имеет положительный заряд, а с другой — отрицательный.
Кислые соли — соли, в состав которых входят атомы водорода, которые могут быть замещены на металл или катион аммония NH4+.
Комплексные соли — соли сложного строения, состоящие из иона металла-комплексообразователя и нейтральных молекул и других ионов.
Основные соли — соли, в составе которых присутствует OH-группа.
Фактчек
- Все вещества можно разделить на электролиты — вещества, проводящие ток, и неэлектролиты — вещества, которые не проводят электрический ток. К электролитам относят три класса веществ: соли, основания и кислоты (СОК)
- Электролитическая диссоциация — процесс, в результате которого электролит распадается на положительно заряженные частицы (катионы) и частицы, заряженные отрицательно (анионы).
- Электролитическая диссоциация может проходить как в растворах, так и в расплавах.
- Благодаря уравнению электролитической диссоциации мы можем определить класс вещества.
Проверь себя
Задание 1.
Какое из веществ является сильным электролитом?
- NaCl
- H2S
- Fe(OH)3
- SO2
Задание 2.
Какая из перечисленных смесей не относится к растворам?
- Чай с сахаром
- Соленая вода
- Суп
- Все указанные смеси относятся к растворам
Задание 3.
Какое вещество является слабым электролитом?
- HCN
- KOH
- HCl
- NaCl
Задание 4.
Какое вещество диссоциируют по двум ступеням?
- HNO3
- KCl
- H2SO4
- Na2SO3
Ответы: 1. – 1; 2. – 3; 3. – 1; 4. – 3.


 к списку статей
к списку статей




