Реакции ионного обмена
На этой странице вы узнаете
- Кто такие диполи, и зачем они окружают молекулы?
- Какой стишок позволит вам запомнить пятерку сульфидов нерастворимых в кислотах?
- Можно ли приготовить кашу из известкового молока?
В детстве многие из нас обменивались фантиками, наклейками, фигурками и другими приятными мелочами. Оказывается, в химии вещества тоже любят чем-то обмениваться. Давайте разберемся, как это происходит!
Как и почему вещества растворяются в растворителе?
Чтобы лучше разобраться в этой теме, нужно вспомнить, что же такое растворение.
Растворение — физико-химический процесс, при котором происходит диссоциация (распад) вещества и взаимодействие образовавшихся частиц с молекулами растворителя.
Растворение связано также с такими понятием, как электролитическая диссоциация.
Электролитическая диссоциация — это процесс распада вещества на ионы, то есть заряженные частицы, в растворе или расплаве.
Мы уже узнали, что в ходе электролитической диссоциации образуются ионы. Но как понять, на какие ионы разложится вещество? Для этого посмотрим в таблице растворимости, какие анионы и катионы составляют указанное соединение. В строчке сверху записаны катионы (обозначены в таблице голубым цветом), а в столбце слева — анионы (обозначены розовым цветом).

А подробнее изучить данную тему можно с помощью другой нашей статьи «Электролитическая диссоциация».
Электролитическая диссоциация является важным процессом, изучая который мы можем описывать и предсказывать течение реакций ионного обмена.
Реакции ионного обмена (РИО) — это реакции, которые протекают между ионами в растворе электролитов.
С процессами растворения мы сталкиваемся в обычной жизни постоянно. Например, чтобы сварить пельмени, мы прежде растворяем соль в воде. А задумывались ли вы, что же происходит с молекулой поваренной соли (NaCl) в воде? Куда она «исчезает»?
В молекуле хлорида натрия ионный тип химической связи, то есть атомы притягиваются друг к другу за счет разных по знаку зарядов. Если вы забыли, какие существуют типы связей, то о них можно прочесть в статье «Химическая связь». Атом натрия отдает свой электрон хлору, заряжаясь положительно, соответственно, атом хлора становится отрицательно заряженным. Растворяемый в воде хлорид натрия оказывается в среде полярного растворителя, иначе говоря, мы «обогащаем» жидкость заряженными частицами, а именно: катионами натрия (Na+) и анионами хлора (Cl—).
Полярный растворитель — это жидкое при нормальных условиях (н. у.) вещество, в молекуле которого присутствует атом очень электроотрицательного элемента (F, O, N, Cl, Br).
Полярными растворителями являются, например, вода, метанол, уксусная кислота и т.д. Их молекулы можно представить в виде диполей.
| Кто такие диполи, и зачем они окружают молекулы? Диполь — это частица, которая с одной стороны имеет положительный заряд, а с другой — отрицательный. Так как диполь воды, например, имеет два противоположных заряда, то он окружает другие заряженные частицы (катионы и анионы), притягиваясь к ним. |
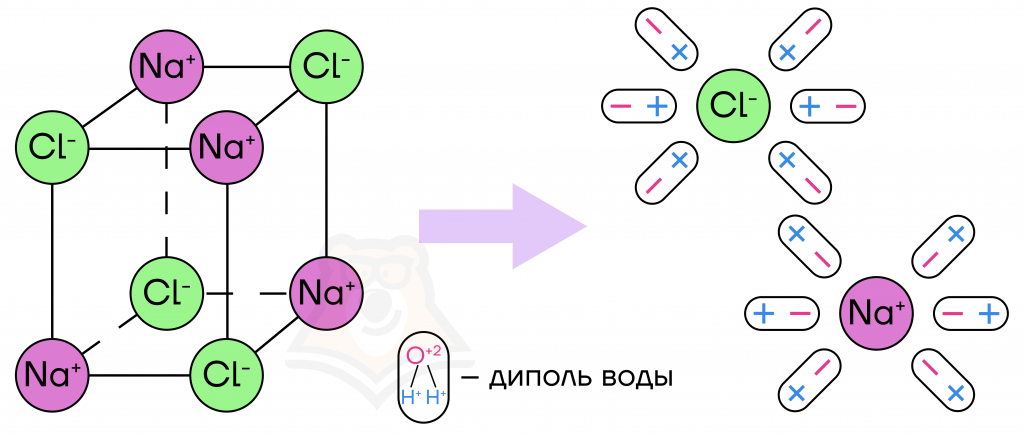
Анион хлора окружает себя молекулами воды, которые повернуты к нему своим положительным зарядом. Натрий, в свою очередь, притягивает к себе диполи воды их отрицательно заряженной частью. Так и происходит процесс растворения соли в воде.

Мы познакомились с сутью процесса растворения, который всегда сопровождает любую реакцию ионного обмена. Теперь необходимо выяснить, когда эта реакция может протекать, а когда нет.
Условия протекания РИО
Не все вещества способны реагировать друг с другом и вступать в РИО. Для протекания реакции должны выполняться определенные условия как для реагентов, так и для продуктов.
I. Условия для реагентов
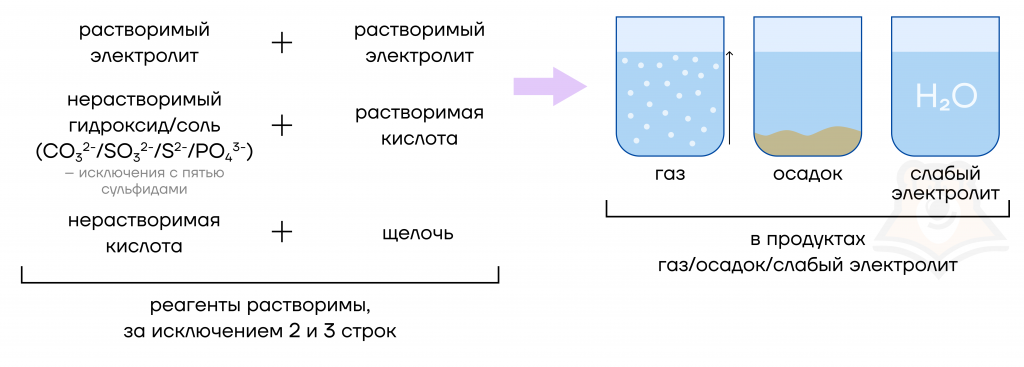
Давайте сначала познакомимся с основным условием для реагентов: реагенты в большинстве случаев должны быть растворимы (Р + Р).
Запомнить это условие протекания реакции нам поможет рычание тигрицы (длинный угрожающий звук «ррр»).

Традиционно правило не обошлось без исключений.
В мире есть люди, которые любят нарушать правила и все делать наоборот. Вот и в химии есть одна бунтарская компания, которая не хочет следовать этим правилам.

Исключения:
- Кислоты способны вступать в реакцию с малорастворимыми и с некоторыми нерастворимыми солями, кроме пятерки сульфидов: Ag2S, PbS, CuS, CdS, HgS.
Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3
FeS + 2HCl → FeCl2 + H2S↑
CuS + H2SO4 → реакция не идет
Но и на это правило нашлось исключение: соли все той же пятерки металлов (меди, серебра, ртути, кадмия и свинца) способны реагировать со слабой сероводородной кислотой.
Почему? В результате таких реакций образуется нерастворимая соль, которая не реагирует с образовавшейся кислотой.
Cu(NO3)2 + H2S → CuS↓ + 2HNO3
Fe(NO3)2 + H2S → реакция не идет, так как образующийся
сульфид железа(II) реагирует с образующейся азотной кислотой.
Такая вот вышла «матрешка» исключений.

| Какой стишок позволит вам запомнить пятерку сульфидов, нерастворимых в кислотах? Чтобы было легче запоминать эту пятерку исключений, существует стишок: «Серебро, свинец и медь — все мечтают почернеть,Тут и кадмий, тут и ртуть, H2S готов нагнуть». |
- Кислота должна быть растворимой, а гидроксид (не кислотный) может быть любым.
Cu(OH)2 + 2HCl → CuCl2 + H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Cu(OH)2 + H2SiO3 → реакция не протекает
- Если кислота нерастворима, то она может реагировать только со щелочами.
H2SiO3 + 2KOH → K2SiO3 + 2H2O
II. Условия для продуктов
Мы рассмотрели условия для реагентов, теперь рассмотрим условия для продуктов реакции.
- Выделяется газ или образуется неустойчивое вещество, которое разлагается с образованием газа (H2CO3 = H2O + CO2↑, H2SO3 = H2O + SO2↑, NH3·H2O = NH3↑ + H2O).
ZnS + H2SO4 → ZnSO4 + H2S↑
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
- Выпадает осадок или образуется неустойчивое вещество, которое разлагается с образованием осадка (2AgOH = Ag2O↓ + H2O, Hg(OH)2 = HgO↓ + H2O).
AgNО3 + КВr → АgВr↓ + КNО3
2AgF + 2KOH → 2KF + Ag2O↓ + H2O
- Образуется вода или слабая кислота.
NaHCO3 + NaOH → Na2CO3 + H2O
В принципе, ничего сложного, осталось только запомнить. Чтобы было проще это сделать, взглянем на обобщенную схему условий протекания РИО для реагентов и продуктов:
Мы научились определять, из каких ионов состоят вещества, а также изучили условия протекания РИО. Приступаем к самому интересному — к составлению ионных уравнений.
Молекулярное и ионные уравнения
Для начала давайте познакомимся с новыми понятиями.
Молекулярное уравнение — уравнение, включающее в себя незаряженные атомы и/или молекулы:
HCl + NaOH → NaCl + H2O.
Полное ионное уравнение — уравнение, включающее в себя заряженные ионы, которые образовались при диссоциации:
H+ + Cl– + Na+ + OH– → Na+ + Cl– + H2O.
Сокращенное ионное уравнение — уравнение, которое получается путем сокращения одинаковых ионов в правой и левой частях полного ионного уравнения:
H+ + OH– → H2O.
С помощью ионных уравнений на примере реакции соляной кислоты с гидроксидом натрия мы можем увидеть, что катионы натрия (Na+) и анионы хлора (Cl–) не участвуют в химической реакции, а, растворяясь, просто «плавают» в воде.
При составлении полного и сокращенного ионных уравнений на ионы мы расписываем сильные кислоты, растворимые соли и растворимые основания (кроме NH3·H2O). Вспомнить написание уравнений реакций диссоциации вы можете в нашей статье «Электролитическая диссоциация».

Обратите внимание, что малорастворимые соединения, такие как Ca(OH)2 и Sr(OH)2, в левой части уравнения мы расписываем, а в правой части не расписываем:
Sr2+ + 2OH– → Sr(OH)2
Ca2+ + 2OH– → Ca(OH)2
| Можно ли приготовить кашу из известкового молока? Известковое молоко внешне выглядит как суспензия белого порошка. А это по цвету очень напоминает привычное нам молоко. Однако прилагательное «известковое» дает нам понять, что этот раствор содержит соединение кальция. Речь не о какой-нибудь соли, а о малорастворимом гидроксиде кальция (Ca(OH)2), который проявляет щелочные свойства. При растворении его в воде действительно образуется жидкость белого цвета, однако она чаще всего применяется для побелки поверхностей. Так что ни о какой каше речи быть не может, ведь с этим веществом можно работать только в перчатках. |

Чтобы структурировать все полученные знания, давайте составим план, по которому мы будем выполнять задание второй части ЕГЭ на тему «Реакции ионного обмена»:
- В списке веществ находим два вещества, между которыми будет протекать реакция ионного обмена, описанная в задании.
Не забывайте про исключения!
- Записываем уравнение реакции в молекулярном виде.
Не забывайте уравнивать реакцию! Вспомнить, как уравниваются реакции, можно в нашей статье «Химическая реакция».
- Записываем полное ионное уравнение, расписывая на ионы все вещества, которые диссоциируют.
Не забывайте писать над ионами заряды (Ca2+), а не степени окисления (Ca+2)!
- Записываем сокращенное ионное уравнение, подчеркивая и убирая все одинаковые ионы из левой и правой частей полного ионного уравнения.
Не забывайте сокращать коэффициенты!
Предлагаем решить аналог задания №30 ЕГЭ по химии по этому плану.
Задание. Из предложенного перечня веществ выберите соль и вещество, между которыми протекает реакция ионного обмена без выпадения осадка. Запишите молекулярное, полное и сокращенное ионные уравнения реакции с использованием выбранных веществ.
Для выполнения задания используйте следующий перечень веществ: серная кислота, сульфит натрия, хлорид бария, гидросульфат лития, иод. Допустимо использование водных растворов веществ.
Решение:
Серная кислота, сульфит натрия, хлорид бария, гидросульфат лития — электролиты; иод — не электролит. Переберем возможные вариантыреакций.
— Серная кислота реагирует с сульфитом натрия, при этом выпадение осадка не наблюдается. Эта реакция удовлетворяет условию.
H2SO4 + Na2SO3 → H2O + SO2↑ + Na2SO4
— Серная кислота реагирует с хлоридом бария с образованием осадка, что не удовлетворяет условию.
H2SO4 + BaCl2 → 2HCl + BaSO4↓
— Серная кислота не реагирует с гидросульфатом лития, так как не образуется газ, осадок или слабый электролит.
— Сульфит натрия реагирует с хлоридом бария с образованием осадка, что не удовлетворяет условию.
Na2SO3 + BaCl2 → BaSO3↓ + 2NaCl
— Сульфит натрия не реагирует с гидросульфитом лития, так как не образуется газ, осадок или слабый электролит.
— Хлорид бария не реагирует с гидросульфатом лития, так как не образуется газ, осадок или слабый электролит.
Ответ:
Молекулярное уравнение: H2SO4 + Na2SO3 → H2O + SO2 +Na2SO4
Полное ионное уравнение: 2H+ + SO42– + 2Na+ + SO32– → H2O + SO2 + 2Na+ + SO42–
Сокращенное ионное уравнение: 2H+ + SO32– → H2O + SO2
Реакции ионного обмена можно не только расписывать на ионы, но и наоборот восстанавливать с помощью ионных уравнений.
Подбор реагентов для возможного уравнения реакции можно сравнить с работой детектива, который, опираясь на улики (а в нашем случае это будут ионы), делает свои выводы и по крупицам воссоздает момент преступления (реакцию ионного обмена).

Попробуем восстановить реакцию ионного обмена по следующему сокращенному ионному уравнению:
3Ca2+ + 2PO43– → Ca3(PO4)2
Наличие катиона кальция и фосфат-аниона в левой части уравнения говорит о том, что в качестве реагентов у нас два растворимых соединения. Обратившись к таблице растворимости, мы видим, что выбрать в качестве реагентов мы можем несколько веществ.
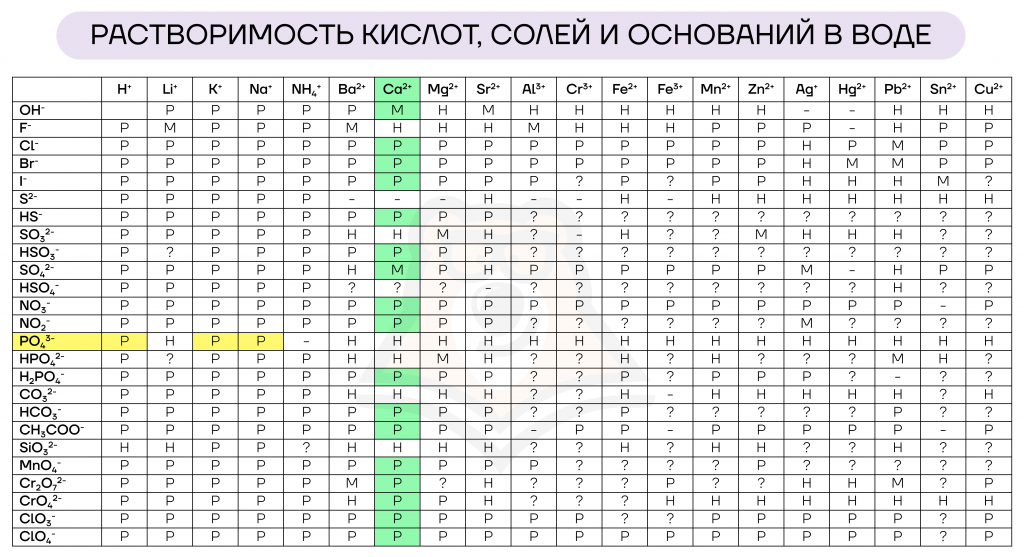
Возьмем, например, в качестве реагентов хлорид кальция и фосфат калия.
3CaCl2 + 2K3PO4 → Ca3(PO4)2↓ + 6KCl
3Ca2+ + 6Cl– + 6K+ + 2PO43– → Ca3(PO4)2↓ + 6K+ + 6Cl–
3Ca2+ + 2PO43– → Ca3(PO4)2↓
Ура! Мы верно выполнили задание. Обратите внимание, что взять гидроксид кальция и фосфорную кислоту мы не можем, так как в таком случае в ионном уравнении будут вода и слабая фосфорная кислота:
3Ca(OH)2 + 2H3PO4 → Ca3(PO4)2↓ + 6H2O
3Ca2+ + 6OH– + 2H3PO4 → Ca3(PO4)2↓ + 6H2O
Вариантов решения этого задания много, поэтому выбор веществ должен быть ограниченным.
Предлагаем решить пример задания №14 ОГЭ по химии.
Задание. Выберите два исходных вещества, взаимодействию которых соответствует сокращенное ионное уравнение реакции.
Ca2+ + CO32– → CaCO3
1) хлорид кальция и карбонат натрия
2) фосфат кальция и угольная кислота
3) оксид кальция и оксид углерода
4) хлорид кальция и карбонат бария
5) бромид кальция и карбонат лития
6) карбонат кальция и угольная кислота
Решение:
1) Этот вариант ответа подходит.
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Ca2+ + 2Cl– + 2Na+ + CO32– → CaCO3↓ + 2Na+ + 2Cl–
Ca2+ + CO32– → CaCO3↓
2) Реакция не протекает, так как фосфат кальция является осадком и может растворяться только в сильных кислотах.
3) Этот вариант ответа не подходит, так как оксиды не являются электролитами и не расписываются на ионы.
CaO + CO2 → CaCO3↓
4) Реакция не протекает, так как карбонат бария является осадком и может растворяться только в сильных кислотах.
5) Этот вариант ответа подходит.
CaBr2 + Li2CO3 → CaCO3↓ + 2LiBr
Ca2+ + 2Br– + 2Li+ + CO32– → CaCO3↓ + 2Li+ + 2Br–
Ca2+ + CO32– → CaCO3↓
6) Сокращенное ионное уравнение не соответствует заданию.
CaCO3 + CO2 + H2O → Ca(HCO3)2
CaCO3 + CO2 + H2O → Ca2+ + 2HCO3–
CaCO3 + CO2 + H2O → Ca2+ + 2HCO3–
Ответ: 15.
Тема «Реакции ионного обмена» является очень важной для понимания протекания многих процессов в химии. Безусловно, мы разобрали много фундаментальных понятий, без которых не стоит приступать к изучению химических свойств различных классов неорганических соединений. Поэтому, если вам удалось разобраться в этой теме, вы смело можете отнести себя к химику из мема ниже, а также прочесть следующую немаловажную статью о реакциях, противоположных реакциям ионного обмена: «Окислительно-восстановительные реакции».

Термины
Ионы — положительно или отрицательно заряженные частицы, образованные из атомов путем присоединения или отдачи электронов.
Степень окисления — это условный заряд атома элемента, вычисленный на основе предположения, что все связи в данном соединении являются ионными (показывает, сколько электронов атом «притянул» или, наоборот, «отдал» при образовании химической связи).
Фактчек
- Реакции ионного обмена — это реакции, которые протекают между ионами в растворе электролитов без изменения степеней окисления.
- При электролитической диссоциации на ионы расписываются только сильные кислоты, растворимые соли и растворимые основания (кроме NH3·H2O).
- Для протекания РИО реагенты должны быть растворимы (кроме нескольких исключений), а в продуктах должен быть газ, осадок, вода или слабая кислота.
- Ионные уравнения нам нужны для того, чтобы понимать, какие ионы взаимодействуют друг с другом, а какие просто присутствуют в растворе и не расходуются в химической реакции.
- В ионных уравнениях необходимо указывать заряд иона (сначала число, затем знак), а не степень окисления (сначала знак, затем число).
Проверь себя
Задание 1.
Какое утверждение о реакциях ионного обмена неверно?
- Реакции ионного обмена можно записать в виде ионных уравнений.
- Реакции ионного обмена не могут протекать между простыми веществами.
- Реакции ионного обмена являются окислительно-восстановительными.
- Реакции ионного обмена могут протекать не только между растворимыми в воде веществами.
Задание 2.
Взаимодействию каких веществ соответствует сокращенное ионное уравнение
H+ + OH– → H2O?
- соляная кислота и гидроксид железа(II)
- хлорная кислота и гидроксид калия
- кремниевая кислота и гидроксид натрия
- сероводород и гидроксид меди(II)
Задание 3.
В каком из вариантов ответа представлены ионы, образующиеся при диссоциации сульфата железа(III)?
- SO42–, Fe2+
- SO32–, Fe3+
- SO4–, Fe3+
- SO42–, Fe3+
Задание 4.
Между какими веществами протекает реакция ионного обмена?
- карбонат бария и сульфат натрия
- кремниевая кислота и гидроксид бериллия
- гидроксид меди(II) и соляная кислота
- сульфид серебра(I) и хлороводород
Ответы: 1. — 3; 2. — 2; 3. — 4; 4. — 3.


 к списку статей
к списку статей





