Расчеты по химическим формулам и уравнениям реакций. Часть 1
На этой странице вы узнаете:
- Кто и как отмечает день моля?
- Какая привычка может помочь сделать научное открытие?
- Как решить задачу, если вообще не знаешь, что делать и с чего начинать?
Какие ассоциации вызывает у вас слово «расчеты»? Вспоминаются уроки математики, расчет стоимости туристической путевки или, вообще, брак по расчету? А слово «формула» наталкивает вас на мысли о знаменитых гонках и неведомой «формуле любви»? Но сейчас мы с вами заинтересованы химией, поэтому и расчеты, формулы и уравнения сегодня будем изучать химические.
Основные расчетные формулы
Для чего вообще мы решаем химические задачи? Решение расчетных задач помогает нам лучше понять ранее изученный материал, развивает умение логически мыслить, предполагать исход тех или иных реакций, проводить необходимые вычисления в ходе исследований, лабораторных работ, а также в производстве.
Чтобы решать эти самые задачи, нам нужно обязательно знать несколько величин и формул:
- n — количество вещества (моль)
Все химические вещества обладают разными массой, плотностью и объемом. Кусочек, например, бария весит намного больше, чем абсолютно такой же по размеру кусочек серы.
Моль — универсальная единица измерения количества для всех химических веществ.
- NA — число Авогадро (6,02 · 1023 частиц/моль)
Сколько атомов содержится в грифеле карандаша? Невероятно много. Использовать числа с десятками нулей неудобно, поэтому химики пришли к договоренности, что в 1 моле любого вещества содержится 6,02 · 1023 частиц (атомов, молекул, ионов).
| Кто и как отмечает день моля? День моля — это праздник, который отмечается химиками в Америке 23 октября с 6:02 утра до 6:02 вечера. Время и дата связаны с числом Авогадро, которое равно 6,02 · 1023 и представляет собой количество частиц в одном моле любого вещества. В этот день во многих школах проходят конкурсы, игры, викторины на химические темы, например, некоторые школьники составляют список бытовых предметов, используя только химические названия. |
- M — молярная масса (г/моль)
Это масса в граммах одного моля вещества. Массу конкретного элемента можно узнать из таблицы Менделеева (ниже мы рассмотрим, как это правильно сделать).
- m — масса (г)
Просто масса вещества в привычных нам граммах.
- V — объем (л)
Объем жидкости или газа в литрах.
- Vm — молярный объем (22,4 л/моль)
Это количество литров, которое занимает один моль любого газа. Это число взялось из закона Авогадро:
«В равных объемах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул».
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объем Vm = 22,413 996(39) л.
| Какая привычка может помочь сделать научное открытие? Ни один учебник физики или химии не обходится без такого понятия, как закон Авогадро. Амедео Авогадро действительно внес огромный вклад в науку. Он определил формулы водорода, кислорода, азота, аммиака, изучал электрохимические явления, но, конечно, наибольшего признания достиг в сфере молекулярной физики, сформулировав закон Авогадро. А еще у него была интересная привычка. Изучая научную литературу, он выписывал себе особенно интересные для него сведения, в результате объем его выписок составил 75 томов по 900 страниц каждый. Может и нам стоит выписывать интересную информацию из книг, и тогда мы приблизимся к новому научному открытию? |
- N — число частиц
Число структурных частиц (атомов, молекул, ионов) в каком-либо веществе.
- С — концентрация (моль/л)
Показывает количество компонента, содержащегося в одном литре смеси.
- ωв-ва — массовая доля вещества (%)
Показывает долю компонента в общей массе смеси.
- φгаза — объемная доля (%)
Доля газа в общем объеме смеси.
- ρ — плотность (г/см3)
Отношение массы вещества к занимаемому им объему.
Кроме вышеупомянутого закона Авогадро, есть несколько законов, которые пригодятся нам при решении задач.
- Закон объемных отношений
Объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа. Например, при взаимодействии трех объемов водорода и одного объема азота образуются два объема аммиака:
3Н2 + N2 = 2NH3
- Объединенный газовый закон
При постоянной массе газа и его неизменной молярной массе отношение произведения давления на объем к его абсолютной температуре остается величиной постоянной.
P1V1T1 = P2V2T2,
где P1 — давление, V1 — объем, Т1 — температура в начальный момент времени, а P2, V2, Т2 — в конечный момент времени
Теперь рассмотрим формулы, в которых используются вышеизложенные величины:
- Количество вещества
n = mM = VVm = NNa = cV
Количество вещества (моль) можно найти как отношение массы вещества к его молярной массе, объема к молярному объему, числа частиц к числу Авогадро или произведение концентрации вещества на его объем.
- Массовая доля вещества
ωв-ва = m в-ваm р-ра * 100%
Массовая доля вещества находится как отношение массы вещества (mв-ва) к массе всего раствора (mр-ра). При делении двух этих величин мы получим десятичную дробь в промежутке от 0 до 1, чтобы перевести это число в проценты, нужно просто умножить его на 100.
- Объемная доля
φгаза = V газаV газ. смеси * 100%
Объемная доля газа находится аналогично массовой доле вещества: делим объем газа (Vгаза) на объем всей газовой смеси (Vгаз. смеси) и умножаем на 100, чтобы получить процентную долю.
- Масса раствора
mр-ра = ρV
Масса раствора находится как произведение плотности раствора и объема этого раствора.
- Растворимость
Растворимость показывает, какая масса (или объем для газов) растворенного вещества (mв-ва) может максимально раствориться в 100 г растворителя (mр-ля).
χ = m в-ваm р-ля *100%

Как мы видим, формул довольно много, но не все они применяются в каждой задаче. Исходя из данной нам информации, нужно уметь выбирать нужную конкретно в этой задаче формулу и производить по ней расчеты. Например, поиск количества вещества, который встречается почти в каждой задаче. Эту величину можно считать разными способами в зависимости от того, что нам известно: масса вещества, объем или количество частиц.
Также нужно помнить, что формулы можно и нужно подстраивать под себя. Как вы уже могли заметить, абсолютно все формулы являются обычными математическими действиями — делением и умножением, а значит мы можем выводить формулы нужных нам величин. Например, из формулы массы раствора можно вывести формулу объема этого раствора: массу раствора разделить на плотность.

Не забывайте, что число Авогадро и молярный объем — постоянные величины. Их значения не меняются!
А теперь вперед! Будем рассматривать примеры конкретных задач и применять изученные формулы.
Расчеты массы вещества или объема газа по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
Этот тип задач, пожалуй, самый простой в химии. Разобравшись в механизме расчетов, вы будете щелкать такие задачи как орешки.
Задача 1.
Какой объем кислорода необходим для полного окисления диоксида серы массой 32 г?
Первым делом для каждой задачи мы должны определить, что нам известно, а что нужно найти. Для этого внимательно читаем условие и записываем:
Дано:
m(SO2) = 32 г
Найти:
V(O2)
Теперь переходим к решению. В каждой задаче обязательно нужно составить уравнение химической реакции, которая описывается в условии.
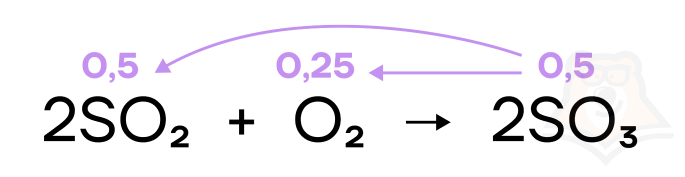
По молям реагента можно искать моли других веществ, только если реагент взят в недостатке (полностью расходуется в реакции). Если вещества по условию задачи дано больше, чем необходимо для протекания реакции, то такое вещество будет в избытке. По молям продукта можно искать моли других веществ без сомнений.
Отношение коэффициентов перед веществами в химической реакции равно отношению количеств (в молях) этих веществ в реакции. То есть, из уравнения выше мы видим, что вещества будут соотноситься как 2:1:2.
Перейдем к расчетам. При решении любых задач в большинстве случаев все известные величины вроде массы, объема, количества частиц нужно смело переводить в универсальную единицу измерения количества вещества — моль. Как это сделать? Очень просто, воспользуемся формулой нахождения количества вещества:
n = mM = VVm = NNa = СV
В условии нам сказано, что масса (m) диоксида серы равна 32 г. Значит, чтобы найти количество (n) диоксида серы нужно его массу разделить на его молярную массу (M). Молярная масса для диоксида серы будет равна:
M(SO2) = 32 + 16 + 16 = 64 г/моль
(Прописывать это в бланке ответов на экзамене при решении задач не обязательно, можно посчитать в уме).
Как мы это посчитали? Мы сложили относительные атомные массы элементов, которые указаны у каждого элемента в таблице Менделеева.
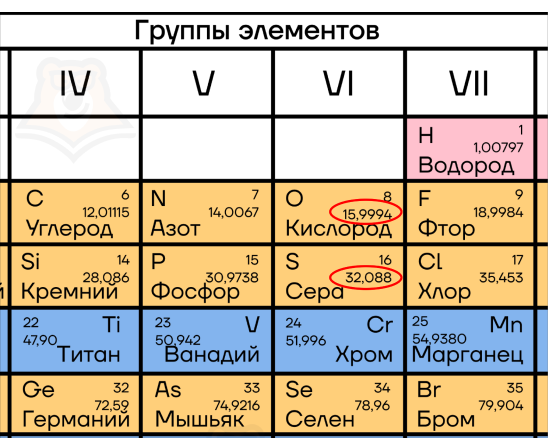
В случае с диоксидом серы SO2 это масса атома серы — 32 и масса двух атомов кислорода — 16 + 16.
Находим теперь количество диоксида серы:
n(SO2) = m(SO2)/M(SO2) = 32 г/64 г/моль = 0,5 моль
Вернемся к соотношению количеств. Из уравнения химической реакции следует, что вещества будут реагировать в соотношении 2:1. То есть, диоксида серы в два раза больше, чем кислорода или же количество диоксида серы равно удвоенному количеству кислорода. Отсюда легко найдем количество кислорода, разделив количество SO2 на 2.
Из УХР (уравнения химической реакции) следует, что n(SO2) = 2n(O2) (Не забывайте обязательно прописывать эту строчку, чтобы тому, кто проверяет ваше решение было понятно, откуда взялось это соотношение).
n(O2) = n(SO2)/2 = 0,5 моль/2 = 0,25 моль
В условии нас просили вычислить объем кислорода, при этом нам уже известно его количество. Значит, мы можем вывести формулу объема из формулы количества:
n = mM = VVm = NNa = cV
V = n*Vm
Подставляем известные нам значения (помним, что молярный объем –- это величина постоянная, она всегда равна 22,4 л/моль).
V(O2) = n(O2)*Vm = 0,25 моль*22,4 л/моль = 5,6 л
Ответ: 5,6 л
Вот и все, задача решена! Суть заключалась в:
- нахождении количества вещества по известной массе;
- установлении соотношения количеств веществ, участвующих в реакции;
- нахождении искомого количества вещества на основе полученных соотношений;
- вычислении объема по найденному количеству вещества.

Важный момент: при решении задач мы обязательно сначала прописываем формулу, по которой собираемся произвести расчет, в скобках при этом указывая формулу вещества, величиной которого мы оперируем. Обязательно нужно указывать единицы измерения в конце каждого действия: граммы, литры, г/моль и т.д.
Расчеты с использованием объемных отношений газов при химических реакциях
Разберем, каким образом проводятся расчеты объемных отношений газов при химических реакциях.
Задача 2.
Определите, какой объем кислорода образуется при переходе 8 л озона в кислород.
Дано:
V(O3) = 8 л
Найти:
V(O2)
Для решения этой задачи необходимо записать уравнение реакции:
2O3 = 3O2
По закону объемных отношений объем вступающего в реакцию озона относится к объему образующегося кислорода как небольшие целые числа.
V(O3)/V(O2) = 2/3, отсюда V(O2) = V(O3)*3/2 = 8*3/2= 12 л
Ответ: 12 л
Как видите, знание закона объемных отношений сильно упрощает решение задачи и сводит его буквально до одного действия.
Расчеты с использованием понятия «примеси»
В состав навески (количества вещества, отобранного для реакции) входит не только чистое вещество, но и примеси. Разберемся, что это такое.
Примеси — это различные дополнительные компоненты, доля которых относительно невелика.
Чистое вещество — вещество, не содержащее примесей и при этом состоящее из частиц одного вида.
Решение задач на нахождение массовой доли примесей аналогично решению задач на нахождение массовой доли в растворе, но вместо массы соли у нас будет масса чистого вещества (или примесей), а вместо массы раствора — масса навески: m(примеси)m(навески)*100%

Важно помнить, что массовая доля примесей и чистого вещества суммарно составляет 100%, поэтому при известной массовой доли примесей Х% мы можем найти массовую долю чистого вещества как (100 — Х)%.
Задача 3.
При прокаливании натриевой селитры (NaNO3), содержащей примеси, получили 33,6 л кислорода. Какова масса чистого вещества соли в селитре?
Дано:
m(NaNO3) = 400 г
V(O2) = 33,6 л
Найти:
m(чистого NaNO3)
Решение. Запишем уравнение реакции:
2NaNO3 = 2NaNO2 + O2↑
Найдем количество выделившегося кислорода.
n(O2) = V(O2)/Vm = 33,6 л/22,4 л/моль= 1,5 моль
Теперь найдем количество нитрата натрия, которая вступила в реакцию.
Из УХР следует, что n(NaNO3) = 2n(O2).
n(NaNO3) = 1,5 моль*2 = 3 моль
Ищем массу чистого вещества селитры.
m(NaNO3) = n(NaNO3)*M(NaNO3) = 3 моль*85 г/моль = 255 г
Ответ: 255 г
Данный тип задач встречается в №28 ЕГЭ. В случае получения верного ответа за него можно получить один балл.
Так как первая часть проверяется компьютером, очень важно дать верный числовой ответ. Для этого нужно учитывать, о чистом веществе или примесях нас спрашивают, в каких единицах измерения и с какой точностью нас просят дать ответ.
Расчеты теплового эффекта реакции
Многие химические реакции протекают с поглощением или выделением теплоты.
Тепловой эффект химической реакции (Q) — количество теплоты, которое выделяется или поглощается в ходе протекания химической реакции.
По тепловому эффекту реакции делятся на:
- Экзотермические (+Q) — химические реакции, в результате которых будет выделяться теплота.
- Эндотермические (-Q) — химические реакции, в результате которых теплота будет поглощаться.
Подробнее про тепловой эффект можно прочитать в статье: «Химическая реакция по тепловому эффекту».
Пример термохимического уравнения реакции:
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж
Теплота реакции измеряется в кДж и указывается со знаком «+ »для экзотермических и «-» для эндотермических реакций.
Задача 4.
Дано термохимическое уравнение сгорания меди 2Cu + O2 = 2CuO + 310 кДж. Сколько теплоты выделится при сгорании порции меди массой 16 г?
Дано:
Q1 = 310 кДж
m(Cu) = 16 г
Найти:
Q2
Решение.
Найдем количество меди.
n(Cu) = m(Cu)/M(Cu) = 16 г/ 64 г/моль = 0,25 моль
Теперь внимательно посмотрим на уравнение реакции. Исходя из коэффициентов мы видим, что медь взята в количестве 2 моль, при этом выделяется 310 кДж теплоты. Чтобы узнать, сколько выделится теплоты при сгорании 0,25 моль меди, составим пропорцию:
2 моль – 310 кДж
0,25 моль – x кДж
Отсюда:
x = 0,25 моль*310 кДж/2 моль = 38,75 кДж
Ответ: 38,75 кДж
Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
Все мы знаем, что химические реакции протекают не всегда так, как задумывалось. На это влияют внешние условия, количество примесей в реагентах.
Практический выход (η) — это отклонение массы (объема) продукта от теоретически возможного, которое используется только для продуктов реакции.
Теоретически возможное количество вещества — такое количество вещества продукта реакции, которые мы можем найти непосредственно по уравнению реакции. Теоретическое количество можем найти, поделив практическое количество на практический выход.
Задача 5.
Определите объем кислорода, который можно получить при разложении бертолетовой соли (KClO3) массой 24,5 г, если выход кислорода составляет 90% от теоретически возможного.
Дано:
m(KClO3) = 24,5 г
η(O2) = 90%
Найти:
V(O2)
Решение.
Составляем уравнение реакции.
2KClO3 = 2KCl + 3O2
Найдем количество бертолетовой соли.
n(KClO3) = m(KClO3)/M(KClO3) = 24,5/122,5 = 0,2 моль
Найдем теоретический объем кислорода, то есть тот, который мог бы выделиться при разложении 24,5 г соли, если бы выход реакции был 100%.
Из УХР следует, что n(O2) = 3/2n(KClO3)
n(O2) = 0,2 моль * 3/2 = 0,3 моль
Vтеор(O2) = n(O2)*Vm = 0,3 моль * 22,4 л/моль = 6,72 л
И теперь находим практический объем выделившегося кислорода.
Vпр(O2) = η(O2)*Vтеор(O2) = 0,9*6,72 л = 6,048 л
Ответ: 6,048 л
Установление молекулярной и структурной формулы вещества
Этот тип задач встречается только в органической химии. Здесь нам нужно попытаться исходя из информации, которая дана в условии, определить, какое именно вещество описывается и установить его молекулярную и структурную формулы.
Что здесь нужно знать?
Нужно знать такие понятия, как:
- Молекулярная (истинная) формула вещества — это формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества. Например, для пропилена такой формулой будет C3H6.
- Простейшая (эмпирическая) формула показывает соотношение атомов в веществе. В молекуле пропилена атомы C и H находятся в соотношении 1:2, соответственно, простейшая формула пропилена CH2.
- Относительная плотность газа X по газу Y — Dпо Y (Х). Относительная плотность газа обозначается буквой D и показывает, во сколько раз газ X тяжелее газа Y. Рассчитывается она как отношение молярной массы газа X к молярной массе газа Y.
Например, относительная плотность метана по водороду будет равняться:
Dпо H2(CH4) = M(CH4)/M(H2) = 16/2 = 8

Важно запомнить: молярная масса воздуха равна 29.
Задача 6.
Относительная плотность паров органического соединения А по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у.) и 12,6 г воды. Выведите молекулярную и структурную формулу органического соединения, если известно, что оно может вступать в реакции как заместительного, так и присоединительного галогенирования.
Любое органическое вещество состоит из атомов C и H. Возможно также присутствие атомов кислорода, но нам про него ничего не сказано, значит, наличие кислорода будем проверять расчетом. Если содержатся другие элементы, например, азот, то об этом будет обязательно сказано в условии (при сжигании азотсодержащего вещества…), в этой задаче ничего такого нет.
В общем виде уравнение реакции горения выглядит так:
СxНyОz + О2 → CO2 + H2O
Атомы углерода из исходного вещества переходят в углекислый газ, водорода — в воду. То есть, всегда будет действовать следующее правило: количество (в моль) атомов углерода в веществе = количество CO2, количество атомов водорода в веществе = удвоенное количество H2O (так как в молекуле воды два атома водорода).
Переходим к расчетам. Мы можем найти количество CO2 и H2O — смело это делаем.
n(CO2) = V(CO2)/Vm = 15,68 л/22,4 л/моль = 0,7 моль
Это количество равно количеству атомов C в веществе, формулу которого мы ищем.
n(C) = n(CO2) = 0,7 моль
n(Н2О) = m(H2O)/M(H2O) = 12,6 г/18 г/моль = 0,7 моль
n(H) = 2n(H2O) = 1,4 моль
Проверим наличие в веществе кислорода. Для этого посчитаем массы элементов и вычтем их из массы всего вещества.
m(C) = 0,7 моль * 12 г/моль = 8,4 г
m(H) = 1,4 моль * 1 г/моль = 1,4 г
m(O) = 9,8 г — 8,4 г — 1,4 г = 0 г
Кислорода в веществе нет.
Составляем соотношение количеств атомов в веществе.
n(C):n(H) = 0,7:1,4 = 1:2
Из этого соотношения мы видим, что простейшая формула вещества — CH2.
Ищем теперь истинную формулу. В условии написано, что относительная плотность паров по азоту равна 2. Используем эту информацию для нахождения молярной массы искомого вещества.
M(CxHyOz) = Dпо N2* M(N2) = 2*28 = 56 г/моль
Найдем теперь молярную массу простейшей формулы вещества.
M(CH2) = 12 + 1 +1 = 14 г/моль
Находим, во сколько раз молярная масса истинной формулы больше молярной массы простейшей.
56/14 = 4
И умножаем индексы элементов в простейшей формуле на это число, получаем искомую истинную (молекулярную) формулу вещества.
C4H8
Дело за малым, найти структурную формулу вещества. Для этого в условии задачи всегда описываются свойства вещества. Читаем: «может вступать в реакции как заместительного, так и присоединительного галогенирования». Запомним эту информацию.
Какие вообще вещества соответствуют формуле C4H8?
Это бутен-1 или бутен-2:
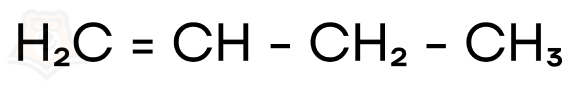
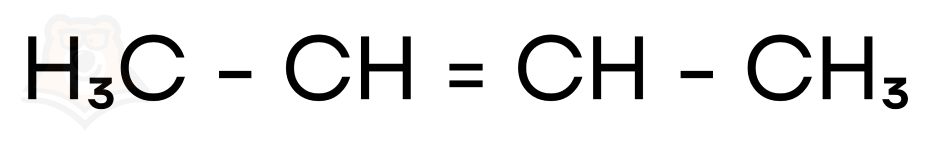
Или же циклобутан:
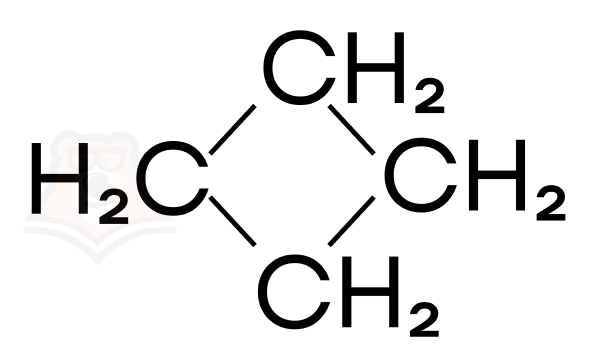
Вспоминаем химические свойства этих соединений, это можно сделать, прочитав статьи «Алкены». Ни бутен-1, ни бутен-2 не вступают в реакции заместительного галогенирования. А вот циклобутан прекрасно справляется и с заместительным, и с присоединительным галогенированием.
Делаем вывод: искомое вещество — циклобутан.
Задача 7.
Вещество А содержит 92,3% углерода и 7,7% водорода по массе. Известно, что вещество А может взаимодействовать с избытком гидроксида диамминсеребра(I). Установите молекулярную и структурную формулу вещества А. Напишите уравнение реакции взаимодействия вещества А и гидроксида диамминсеребра(I).
Для решения этой задачи нам нужно представить, что нам дано 100 г вещества, тогда по формуле массовой доли найдем массу углерода:
ωв-ва = m элементаm в-ва * 100%
92,3 = m(С)/100, отсюда масса углерода равна 92,3 г.
Аналогично получим массу водорода:
7,7 = m(H)/100, отсюда масса водорода равна 7,7 г.
Найдем количества веществ элементов:
n(C) = 92,3/12=7,7 моль
n(H) = 7,7/1=7,7 моль
Получим соотношение элементов 7,7:7,7=1:1, тогда простейшая формула СН, но вещества с такой формулой не существует. Удвоим количество атомов водорода и углерода и получим истинную молекулярную формулу — С2Н2, ацетилен. Действительно, он может реагировать с комплексом серебра, значит, мы все сделали верно.
Искомое вещество — ацетилен (СН≡СН).
Данный тип задач встречается в №33 ЕГЭ. Разберем критерии данного задания и попробуем понять, как заработать максимальное количество баллов за данный номер.
Первый балл: правильно произведены вычисления, необходимые для установления молекулярной формулы вещества, и записана молекулярная формула вещества.
Для получения первого балла важно полностью прописать все расчеты, даже если они простые и осуществляется в одно действие. Проверьте, для всех ли элементов вы записали расчеты, не забыли ли про массу кислорода.
Молекулярная формула считается корректной, если она соответствует условию задачи. Если вы получили соотношение элементов, которое сложно привести к целым числам, попробуйте умножить его на 10 (если оно меньше единицы) или последовательно умножать на два. Допускается округление, если ваше число очень близко к целому (6,98 можно округлить до 7).
Помните, что ваша молекулярная формула должна соответствовать формуле заданного класса веществ, а также не содержит логических ошибок:

Второй балл: записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания.
В №33 все последовательно, поэтому второй балл можно получить только после первого.
Составьте структурную формулу, однозначно отражающую строение вещества, распишите радикалы подробно, если они могут существовать в различных формах (например, -С3Н7 может быть в виде изопропила и пропила).
Перепроверьте, подходит ли ваша формула под условия задачи, нет ли более корректной формулы: если сказано, что радикалы максимально удалены друг от друга, то подразумевается пара-положение, а не орто- или мета-.
Третий балл: с использованием структурной формулы органического вещества записано уравнение реакции, на которую дается указание в условии задания.
Когда вещество определено и записана его структурная формула, остается только написать уравнение реакции.
Лучше всего повторить все органические реакции, но на самом экзамене достаточно перепроверить катализаторы и условия, например, спиртовой или водный раствор щелочи нам дан.
Расчеты величин при заданной растворимости
На первый взгляд может показаться, что эти задачи страшные и их сложно решить, но подробно разобравшись в механизме решения, применяя уже полученные знания, нам все по силам! Давайте разберемся, как решать задачи, когда нам дана растворимость вещества.
Растворимость — характеристика раствора, которая показывает, какая масса (или объем для газов) растворенного вещества (mв-ва) может максимально раствориться в 100 г растворителя (mр-ля).
χ = m в-ваm р-ля *100%
Задача 8.
Растворимость карбоната аммония при некоторой температуре равна 90 г на 100 г воды. Какая масса (в г) данной соли потребуется для приготовления ее насыщенного раствора массой 570 г?
Для решения этой задачи нам потребуется определение насыщенного раствора.
Насыщенный раствор — раствор, в котором растворено максимально возможное количество вещества при данных условиях: если попытаться растворить больше, чем можно, то «излишек» выпадет в осадок.
Дано:
χ = 90 г соли/100 г воды
m(р-ра) = 570 г
Найти:
m(соли)
ω(соли)
Решение.
Сначала найдем массу насыщенного раствора при растворении соли в 100 г воды:
m(р-ра1) = m(соли) + m(воды) = 90 + 100 = 190 г.
Массовую долю соли в насыщенном растворе найдем по формуле:
ω = m(соли)/m(р-ра) = 90/190 *100% = 47%
Составим пропорцию, отражающую, какая масса соли содержится в растворе при заданной массе:
В 190 граммах насыщенного раствора содержится 90 грамм соли, тогда в 570 граммах раствора будет Х г соли.
190 — 90
570 — Х
Отсюда Х = 570*90/190 = 270 г.
Ответ: ω(соли) = 47%; m(соли) = 270 г
Задача 9.
Растворимость хлорида магния в воде составляет 54,6 г на 100 г воды. Приготовили насыщенный раствор массой 134,5 г. К полученному раствору добавили избыток щелочи. Осадок, образовавшийся в ходе реакции, нагрели до полного разложения. Определить массу осадка, полученного в ходе второй реакции.
Дано:
χ = 54,6 г соли/100 г воды
m(р-ра) = 134,5 г
Найти:
m(осадка)
Решение.
Начало решения будет аналогично тому, что мы уже разобрали выше: найдем массу насыщенного раствора на 100 г воды, составим пропорцию.
m(р-ра1) = m(соли) + m(воды) = 54,6 + 100 = 154,6 г
В 154,6 г раствора содержится 54,6 г соли, тогда в 134,5 — Х г
Составляем пропорцию:
154,6 — 54,6
134,5 — Х
Решив, получим, что Х = 47,5 г.
Переходим к уравнению реакции взаимодействия хлорида магния и щелочи:
MgCl2 +2NaOH = Mg(OH)2 + 2NaCl
Посчитаем количество вещества хлорида магния:
n(MgCl2) = m/M = 47,5/95 = 0,5 моль
По коэффициентам видим, что количество осадка равно количеству хлорида магния, то есть n(Mg(OH)2) = 0,5 моль.
В задаче сказано, что полученный осадок подвергли термическому разложению, запишем уравнение:
Mg(OH)2 (t) = MgO + H2O
По коэффициентам видим, что количество осадка в данной реакции равно количеству гидроксида магния, то есть n(MgO) = 0,5 моль
По формуле массы вещества найдем массу осадка:
m(MgO) = n(MgO)*M = 0,5*40 = 20 г
Ответ: 20 г
Задача 10.
Растворимость бромоводорода составляет 224 л на 1 л воды. Растворимость аммиака 280 л на 1 л воды. Приготовили раствор бромоводорода, содержащий 100 мл воды, а также раствор аммиака с массой воды, равной 80 мл. Смешали насыщенные растворы аммиака и бромоводорода, все вещества прореагировали полностью. К полученному раствору добавили раствор нитрата серебра. Вычислите массу полученного осадка.
Решение.
Растворимость газов практически ничем не отличается от растворимости твердых веществ, только вместо массы мы рассматриваем отношение объема газа к объему растворителя. Запишем формулу растворимости для данной задачи:
χ = V газаV воды *100%
По условию задачи взаимодействие протекает между бромоводородом и аммиаком, запишем уравнение реакции:
NH3 + HBr = NH4Br
Рассчитаем количество вещества бромоводорода в насыщенном растворе, для этого составим пропорцию.
В 1 литре воды — 224 л бромоводорода
В 100 мл воды (0,1 л) — Х, отсюда
Х = 250*0,1/1 = 22,4 л
n(HBr) = V/Vm = 22,4/22,4 = 1 моль
Аналогичные действия проводим для аммиака.
В 1 литре воды — 280 л аммиака
В 80 мл воды (0,08 л) — Х, отсюда
Х = 280*0,08/1 = 22,4 л
n(NH3) = V/Vm = 22,4/22,4 = 1 моль
По уравнению реакции количество бромида аммония равно количеству вещества аммиака или бромоводорода, поэтому n(NH4Br) = 1 моль.
Запишем уравнение реакции взаимодействия бромида аммония с нитратом серебра:
NH4Br + AgNO3 = AgBr↓ + NH4NO3
Количество вещества осадка бромида серебра равно количеству вещества бромида аммония: n(AgBr) = n(NH4Br) = 1 моль.
Найдем массу осадка:
m(AgBr) = n(AgBr)*M(AgBr) = 1*188 = 188 г
Ответ: 188 г
Задачи на атомистику
В типе задач на атомистику дано некоторое соотношение атомов, именно поэтому она так названа. Для решения этого типа задач необходимо уметь составлять уравнения реакций, находить количество вещества и массу, знать формулу массовой доли и некоторые другие. Но давайте лучше разберемся на примере задачи.
Задача 11.
Смесь оксида и сульфата бария, в которой соотношение атомов бария к атомам кислорода равно 3:9, полностью растворили в холодной разбавленной серной кислоте. При этом кислота прореагировала без остатка. В результате реакции образовалось 233 г сульфата бария. Определите массовую долю атомов бария в исходной смеси.
Решение. Сульфат бария не растворим в кислоте, поэтому реакция пойдет только с оксидом:
BaO + H2SO4 = BaSO4 + H2О
Мы уже знаем, что образовалось 233 г сульфата бария, найдем его количество:
n(BaSO4) = 233/233 = 1 моль
Количество оксида бария будет равно количеству сульфата по коэффициентам в реакции:
n(BaO) = 1 моль
Теперь настало время перейти к самой интересной части данного типа задач, к соотношению атомов.
Примем количество сульфата бария за Х, тогда количество бария в нем будет равно 2Х, а количество кислорода — 4Х. Как мы это нашли? Для ответа на вопрос нужно внимательно посмотреть на формулу сульфата, как мы видим, в одной молекуле сульфата один атом бария и четыре атома кислорода.
n(Ba) = n(BaSO4) = Х моль
n(O) = 4n(BaSO4) = 4Х моль
И наоборот, количество вещества сульфата бария в 4 раза меньше количества вещества атомов кислорода в соли:
n(BaSO4) = ¼ n(O) = ¼ * 4X = X моль
Аналогично можно было бы найти количества ионов в соли: в сульфате бария один ион Ba2+ и один SO42-, значит
n(Ba2+) = n(SO42-) = n(BaSO4)
И наоборот, количество вещества сульфата бария будет равно количеству ионов Ba2+ или SO42-.
В оксиде бария у нас один атом бария и один атом кислорода, поэтому количество бария будет равно количеству кислорода и все это будет равно количеству вещества:
n(Ba) = n(O) = n(BaO) = 1 моль.
Найдем общее количество бария и общее количество кислорода.
n(Ba) = X + 1 моль
n(O) = 4X + 1 моль
Перейдем к данному нам в задании соотношению.
n(Ba)/n(O)=(X + 1)/(4X + 1)
(X + 1)/(4X + 1) = 3/9
Решим пропорцию и получим Х = 2, это будет количество сульфата бария.
Найдем массу смеси:
m(BaSO4) = n(BaSO4)*M = 2*233 = 466 г
m(BaO) = n(BaO)*M = 1*153 = 153 г
m(смеси) = m(BaSO4) + m(BaO) = 466 + 153 = 619 г
Найдем массу бария:
n(Ba) = 2 + 1 = 3 моль
m(Ba) = 3*137 = 411 г
Тогда массовая доля атомов бария в смеси будет равна
𝜔 = m(Ва)/m(смеси) = 411/619 * 100% = 66,4%
Ответ: 66,4 %
Задача 12.
К 525,6 г раствора хлорида натрия, в котором массовая доля всех протонов составляет 54,7%, добавили нитрат серебра. Определите массу осадка
Решение. Запишем уравнение реакции:
NaCl + AgNO3 = NaNO3 + AgCl↓
Найдем состав исходного раствора хлорида натрия, а для этого обозначим массу соли и воды через переменные:
n(NaCl) = х моль
n(H2O) = y моль
Тогда масса соли будет равна:
m(NaCl) = 58,5x г
m(H2O) = 18y г
Натрий содержит 11 протонов массой 1 г/моль, а хлор — 17 протонов, общая масса протонов в хлориде натрия равна (11+17)*х = 28х г.
В воде два атома водорода, каждый из которых содержит по одному протону, и один атом кислорода, который содержит 8 протонов, итого в воде (2*1+8)*у = 10у г.
По формуле массовой доли найдем массу протонов в растворе.
m(протонов) = ω*m(р-ра) = 525.6*0.547 = 288 г
Составим систему уравнений, в которой первое будет касаться массы раствора, а второе — массы протонов.
58,5x + 18y = 525.6
28х + 10y = 288
При решении системы получим:
х = n(NaCl) = 1 моль
y = n(H2O) = 26 моль
А теперь вернемся к уравнению реакции. Количество вещества осадка хлорида серебра равно количеству вещества хлорида натрия: n(AgCl) = n(NaCl) = 1 моль.
Найдем массу осадка.
m(AgCl) = n(AgCl)*M(AgCl) = 1*143,5 = 143,5 г
Ответ: 143,5 г
| Как решать задачу, если вообще не знаешь, что делать и с чего начинать? Сейчас будет несколько лайфхаков для решения любой задачи! 1. В любой задаче вам точно дают какие-то данные. Формула вещества — это уже данные. Зная ее, можно найти молярную массу вещества, узнать, сколько атомов и какие атомы входят в состав веществ. 2. Если данных в задаче не хватает для решения, вводите переменные. За переменную лучше всего брать количество вещества, так вам будет легче ориентироваться в уравнениях. 3. Выпишите формулы, которые знаете, постарайтесь их применить. |
Наша статья подходит к концу, а значит, пора подводить итоги. Мы проделали огромную работу и узнали самую важную информацию по задачам в химии, что принесет нам баллы как в первой, так и во второй части! Но не время останавливаться на достигнутом — для лучшего понимания различных типов задач советуем прочитать вторую часть этой статьи — «Расчеты по химическим формулам и уравнениям реакций. Часть 2».
Фактчек
- Для решения задач различных типов достаточно знать всего лишь пару формул.
- Закон объемных отношений позволяет сильно упростить решение задачи, в которой даны объемы.
- Чтобы решать задачи, очень важно уметь считать количество вещества, ведь оно встречается практически в каждой задаче.
- Для определения того, какая доля вещества от теоретически возможного образовалась в ходе реакции, используется понятие практического выхода.
- Для органических веществ возможно установить молекулярную и структурную формулу по заданным условиям.
- Для решения задач на атомистику необходимо использовать заданное соотношение атомов химических элементов.
Проверь себя
Задание 1.
При решении задач на нахождение смеси газов как мы находим общий объем?
- Перемножаем количества газов
- Вычитаем из большего объема меньший
- Складываем объемы
- Делим меньший объем на больший
Задание 2.
Чему равна масса воды в растворе поваренной соли?
- Массе соли
- Массе растворителя
- Массе раствора
- Объему раствора
Задание 3.
Как находится массовая доля вещества в растворе?
- Делением массы раствора на массу вещества
- Умножением массы раствора на массу вещества
- Делением массы вещества на массу раствора
- Сложением массы раствора и массы вещества
Задание 4.
Как мы можем использовать заданную растворимость?
- Для нахождения массовой доли соли в растворе
- Для нахождения массы соли в порции раствора
- Для нахождения массы раствора
- Все ответ верны
Задание 5.
Какой вариант ответа верно описывает число Авогадро?
- Одинаково для каждого газа
- Постоянная величина
- У одних веществ постоянная величина, у других искомая
- Зависит от условий задания
Ответы: 1. – 3; 2. – 2; 3. – 3; 4. – 4; 5. – 2.


 к списку статей
к списку статей






