Химическая связь
На этой странице вы узнаете
- Как и благодаря чему атомы соединяются в молекулы?
- Можно ли увидеть химическую связь?
- Химический «коннекшн» — какие химические связи бывают?
Человеческая жизнь невозможна без связей между людьми. Также и молекулы невозможны без химических связей между атомами. Непреодолимая связь между людьми приводит к образованию семьи, а связь между атомами — к образованию молекул.
Химическая связь
Перед тем, как мы перейдем непосредственно к изучению химической связи, вспомним основные понятия.
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
При соединении нескольких атомов образуются молекулы.
Молекула — это мельчайшая частица, которая состоят из атомов. Она является химически делимой.
| Как и благодаря чему атомы соединяются в молекулы? Чаще всего атомы химических элементов не существуют сами по себе, а объединяются в химические соединения, в которых они удерживаются рядом друг с другом с помощью химических связей. Например, при образовании молекулы H2O свободные электроны двух атомов водорода занимают пустые орбитали кислорода. |
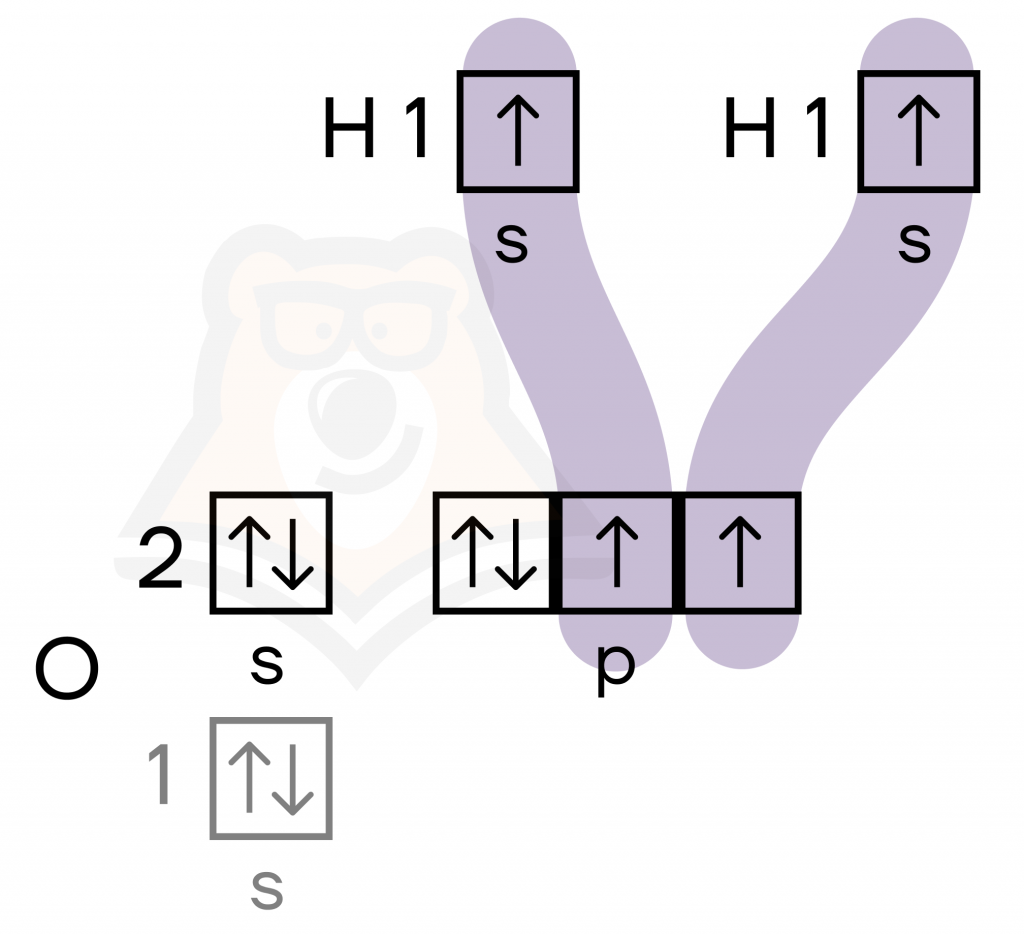
Многие атомы стремятся соединиться с другими атомами, образуя более сложные химические частицы. Но зачем все это нужно? Причина кроется в выигрыше энергии в результате такого соединения.
Это как скинуться с другом и купить несколько лотерейных билетов вместо того, чтобы купить один билет самому. В первом случае вероятность выигрыша в лотерее больше.
Атомы стремятся приобрести устойчивую конфигурацию, то есть полностью заполненный энергетический подуровень.
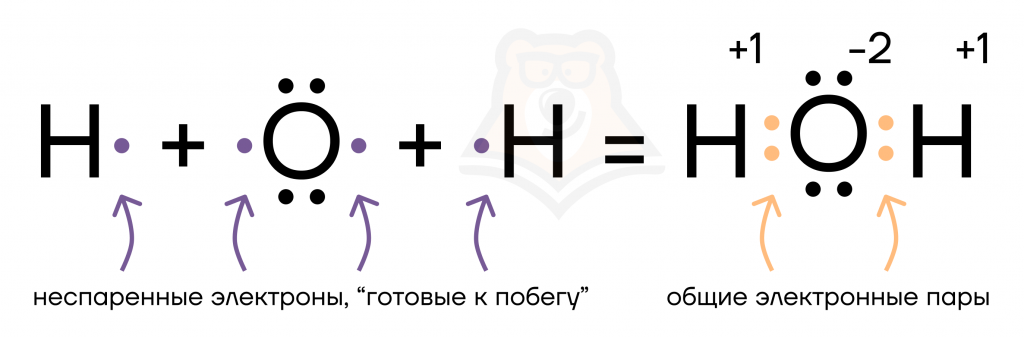
Так, объединив свои электроны, водород и кислород приобрели электронные конфигурации благородных газов, к чему стремятся атомы всех химических элементов.
Таким образом, химическая связь — это:
— сила, удерживающая атомы в молекуле;
— сила, возникающая благодаря перекрытию орбиталей и созданию тем самым общих электронных пар.

Почему образуются химические связи?
На это есть две причины (мы их уже упоминали):
- Каждый атом стремится приобрести конфигурацию инертного (благородного) газа, то есть иметь на внешнем уровне 8 электронов (или 2, как для элементов первого периода). Это называется правилом октета.
- Внутренняя энергия более сложных структур (например, молекул) меньше, чем суммарная энергия атомов, из которых состоит эта структура. А поскольку любая система стремится к меньшей энергии и большей стабильности, создавать химические связи энергетически выгодно для атомов.
Итог: атомам выгоднее и легче с точки зрения энергии быть вместе.
| Можно ли увидеть химическую связь? Недавно ученые из Японии и Швейцарии с помощью особого микроскопа смогли увидеть химические связи в молекулах угарного газа и других органических веществ. Были проведены наблюдения за формированием связей и их обрывом в зависимости от различных условий, а также измерена их сила. Эти исследования наглядно подтвердили известные нам данные о химических связях. |
Механизмы образования связей
Механизмы есть везде: в часах, в машинах, на производствах. Так и химические связи образуются по определенным правилам.
Сколько механизмов образования связей существует?
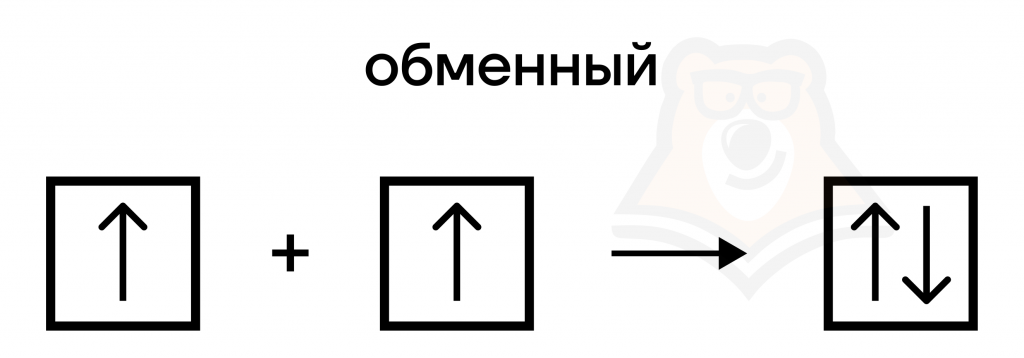
- Обменный механизм.
При образовании химической связи атомы выделяют по одному электрону на внешнем электронном уровне. Образуется общая электронная пара. По такому механизму образуются почти все химические связи.
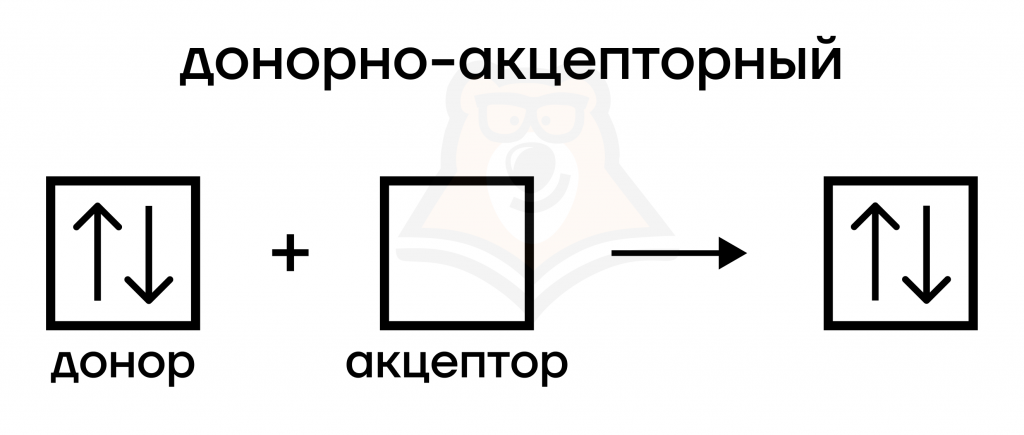
- Донорно-акцепторный механизм.
Такой вариант уже не равноценен для атомов: один предоставляет свободное место (вакантную орбиталь), а другой — свободную пару электронов. По такому механизму образуются связи в NH4+ (не NH3), PH4+, O3, CO, HNO3, N2O5, комплексы, соли аминов.
Давайте рассмотрим подробнее образование химических связей на примере катиона аммония NH4+.
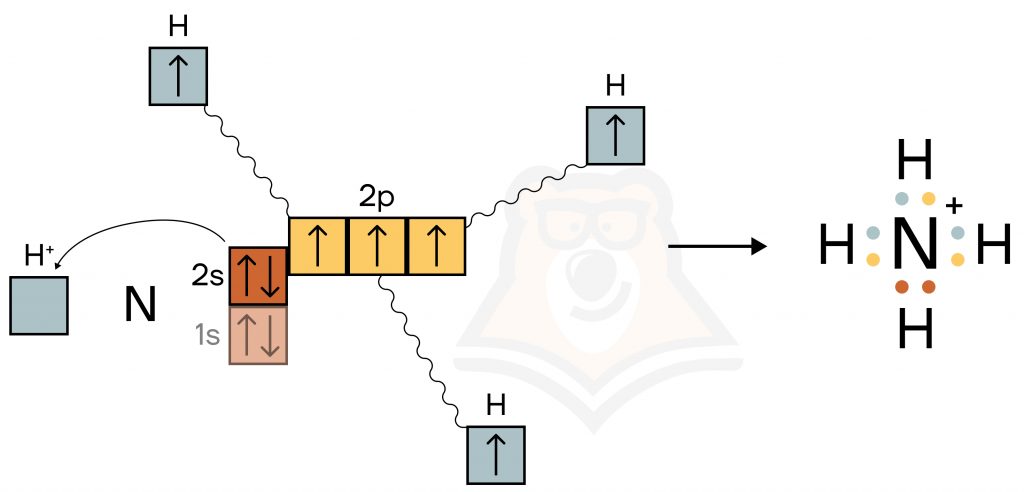
Сначала образуется молекула аммиака NH3. Три неспаренных электрона атома азота объединяются с неспаренными электронами от трех атомов водорода → образуются три связи по обменному механизму.
Далее к уже образовавшейся молекуле аммиака NH3 «прибегает» водород, у которого «украли» 1 электрон — H⁺. Так как электрона у него больше нет, по сути, он представляет собой пустую орбиталь.
Затем между NH3 и H⁺ возникает химическая связь по донорно-акцепторному механизму. Азот является донором электронов, так как у него есть спаренные электроны на 2s-подуровне, а водород акцептором — у него есть пустая орбиталь, куда можно «заселить» эти электроны.
Таким образом, образуется катион аммония NH4⁺, где три связи образованы по обменному механизму, а четвертая по донорно-акцепторному. В молекуле аммиака NH3, в отличие от этой частицы, есть только три связи, образованные по обменному механизму.
Разновидности химических связей
Ковалентная связь
Ковалентная НЕполярная:
- образуется между атомами одинаковых неметаллов;
- из-за одинаковых значений электроотрицательности их общая(-ие) электронная(-ые) пара(-ы) не смещает(ют)ся к какому-либо атому.
Примеры: Cl2, I2, H2, S, P, F2, N2, O2, C, H2O2, C3H8, CaC2, FeS2.

У атомов хлора в молекуле хлора одинаковая электроотрицательность (ЭО), так как это атомы одного и того же элемента. Поэтому никто из них на себя электроны не перетягивает.
Ковалентная полярная:
- образуется между атомами разных неметаллов;
- из-за разных значений электроотрицательности их общая(-ие) электронная(-ые) пара(-ы) смещает(ют)ся к более электроотрицательному атому.
Примеры: HCl, CO, N2O, CO2, HNO2, Cl2O5, H2SO4.
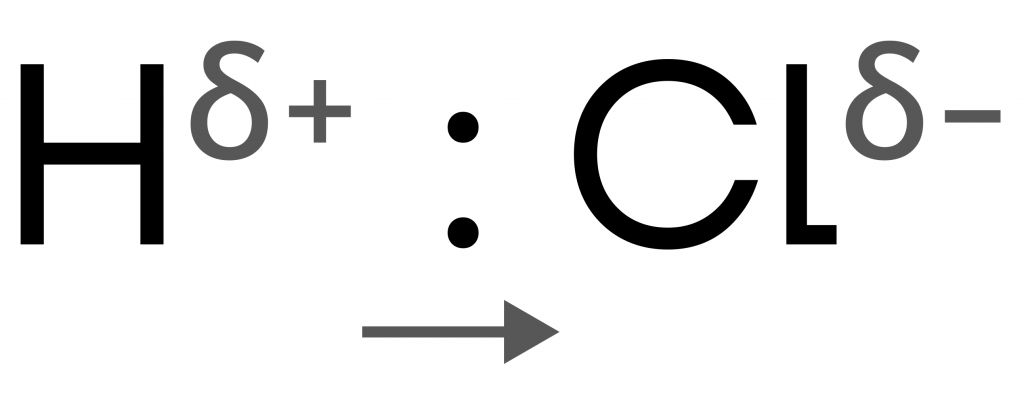
У хлора в молекуле соляной кислоты ЭО выше, чем у водорода, поэтому он перетягивает электроны на себя → на нем создается заряд σ-, а на водороде σ+.
Ионная связь:
- связь образуется между атомами металла и неметалла;
- из-за разных значений ЭО их общую(ие) электронную(ые) пару(ы) почти забирает себе более электроотрицательный атом.
При ионной связи атомы переходят в ионы.
Ионы — положительно или отрицательно заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединении электронов.
Примеры: соли, основания, оксиды металлов — NaCl, NH4NO3, K2O, Fe(OH)2.
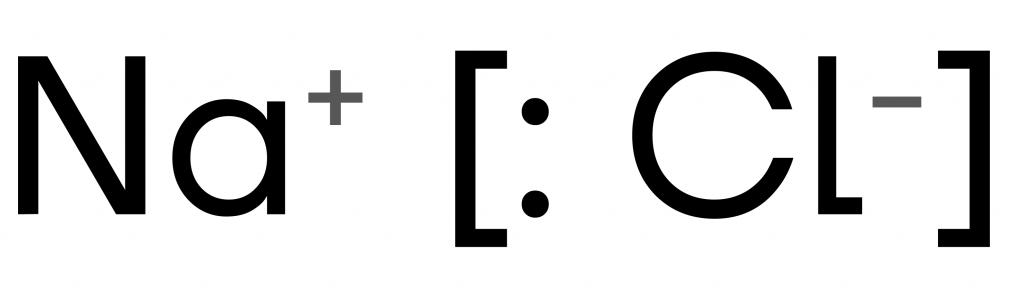
У хлора в соли NaCl ЭО намного больше, чем у натрия, поэтому хлор не просто стягивает на себя электроны, а отбирает их у металла → хлор приобретает заряд «–» и становится заряженной частицей — анионом, а натрий — «+» и становится катионом.
Металлическая связь
В этом виде связи между электронами происходит постоянная «тусовка».
Сущность: электроны отрываются от атомов Ме, превращая их тем самым в катионы Меn+. При этом, летая, они присоединяются к другим катионам, превращая их в атомы:
Ме0 – ne = Меn+
Меn+ + ne = Ме0
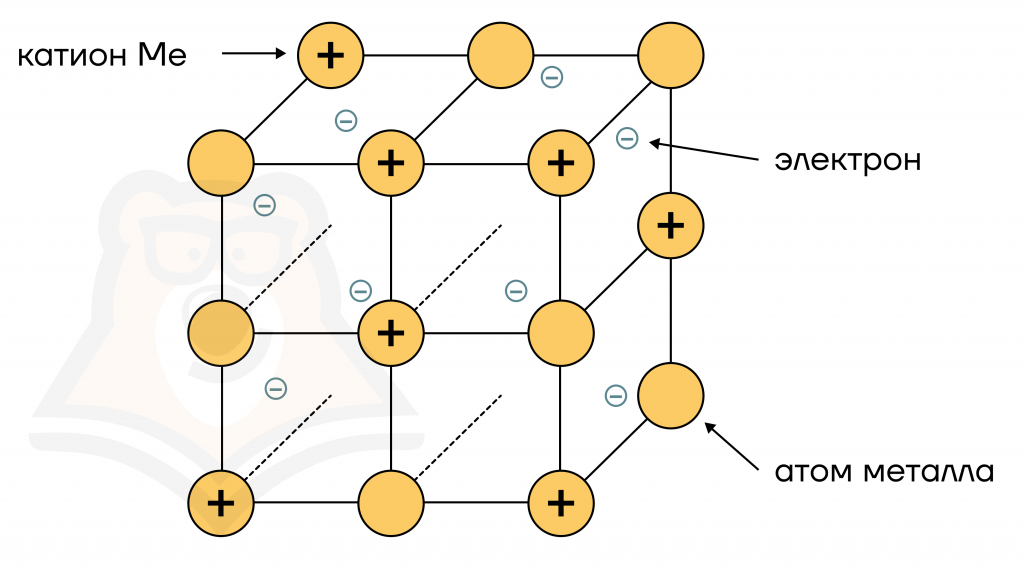
Для интересующихся темой:
- «электронный ветер» — носящиеся и перебегающие от одного атома к другому в кристалле Ме электроны (то есть сам процесс);
- «электронный газ» — совокупность всех этих электронов.
Водородная связь
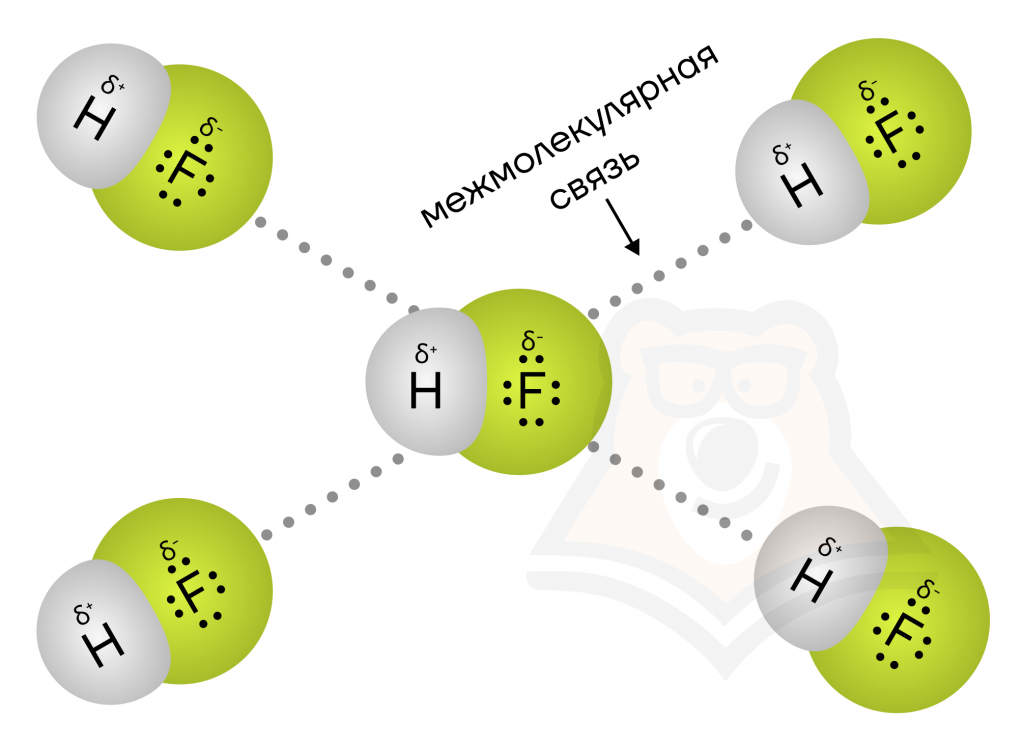
В молекулах некоторых веществ возникает особая водородная связь. Для начала давайте рассмотрим молекулу фтороводорода HF.
Фтор очень электроотрицателен. Поэтому он притягивает к себе общую электронную пару и, так как электроны заряжены отрицательно, на нем создается мощный частично отрицательный заряд, а на атоме водорода — частично положительный.
В итоге между молекулами (между плюсом и минусом) возникает электростатическое притяжение. Это и называется водородной связью.
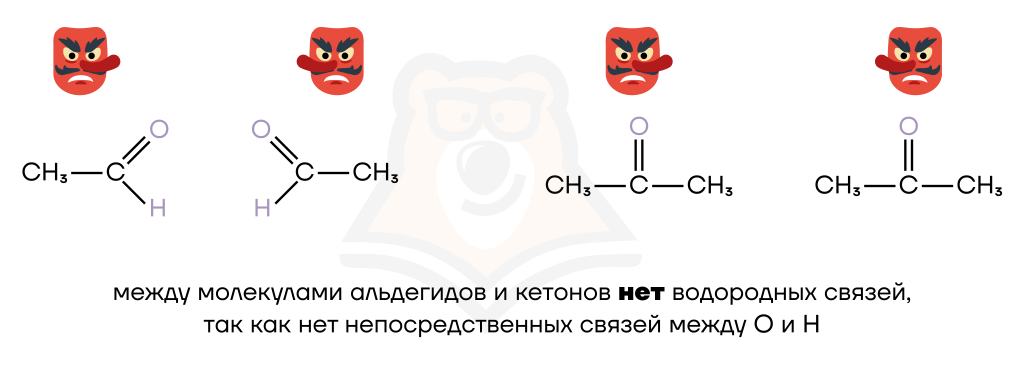
Примеры: H2O, растворы NH3, HF, спирты (CH3OH), фенолы (C6H5OH), карбоновые кислоты (CH3COOH), первичные (CH3NH2) и вторичные (CH3–NH–CH3) амины, аминокислоты (H2N–CH2COOH).
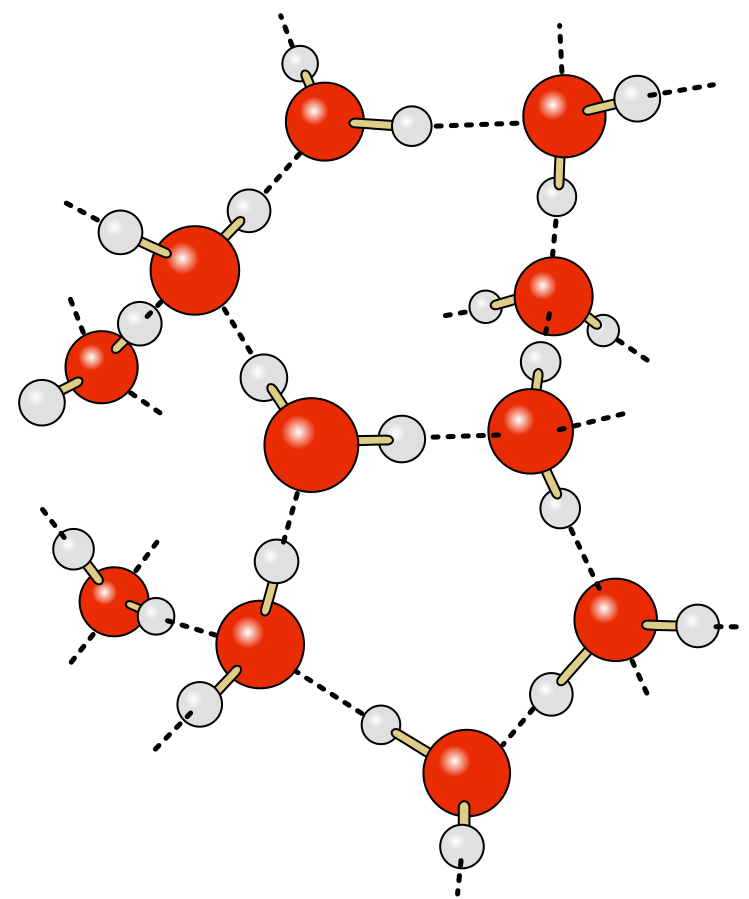
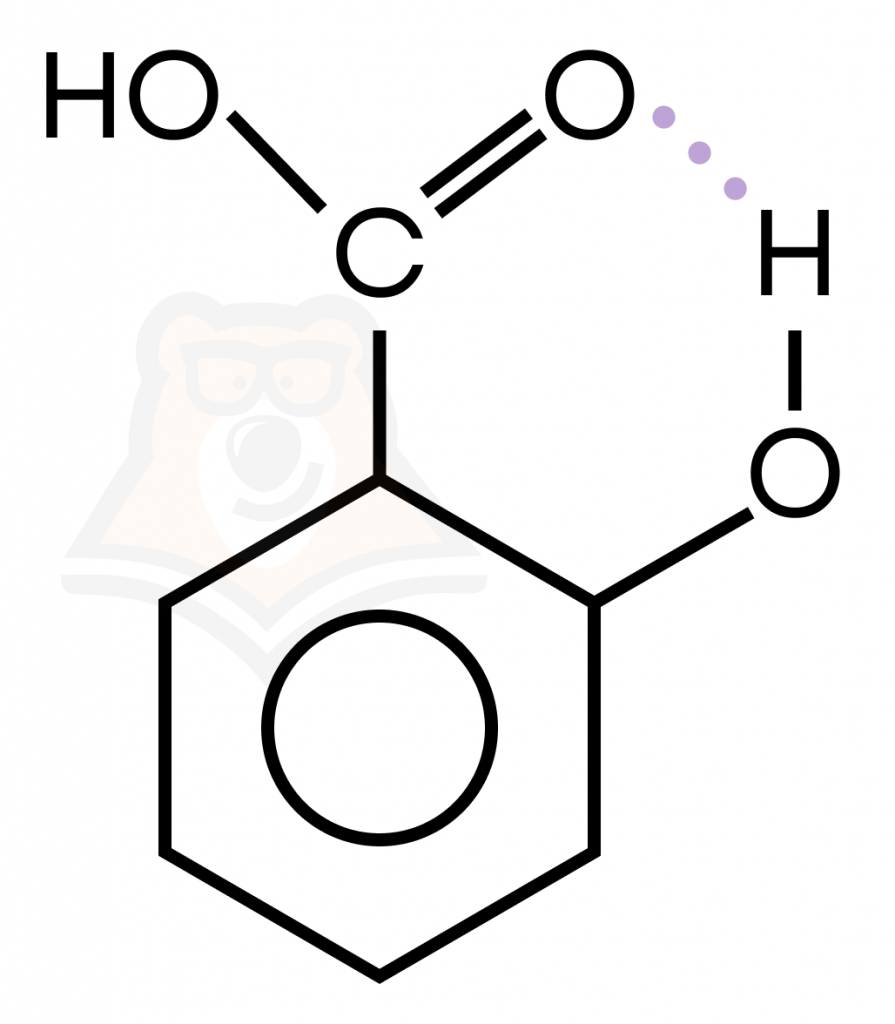
| Важно: Водородная связь может быть как межмолекулярной (между молекулами воды), так и внутримолекулярной (в молекуле салициловой кислоты). |
Характеристики связи
Химическую связь можно описать целым рядом параметров. Начнем по порядку:
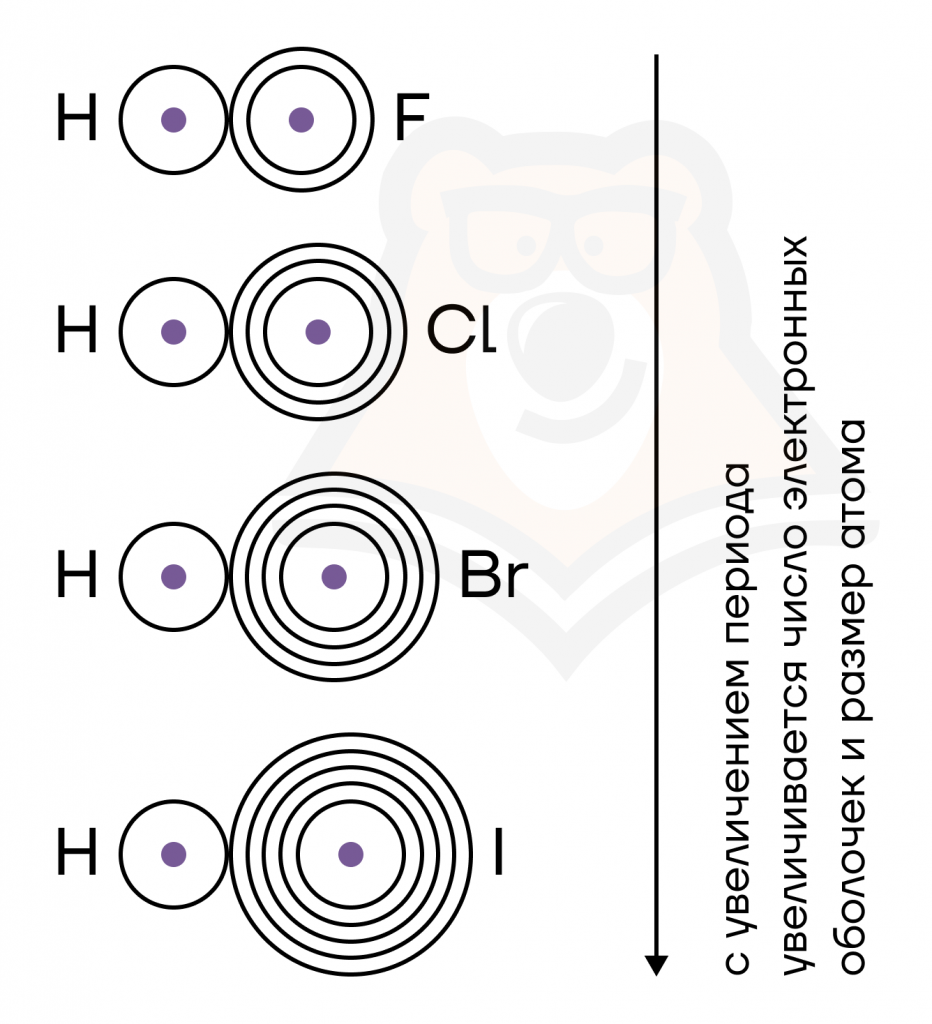
- Длина связи — это расстояние между ядрами атомов.
Чем больше атомы, тем больше расстояние между их ядрами и тем больше длина связи.
Длина связи влияет на ее прочность — с уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
- Прочность связи отображает то, какую энергию нужно приложить, чтобы разрушить связь.
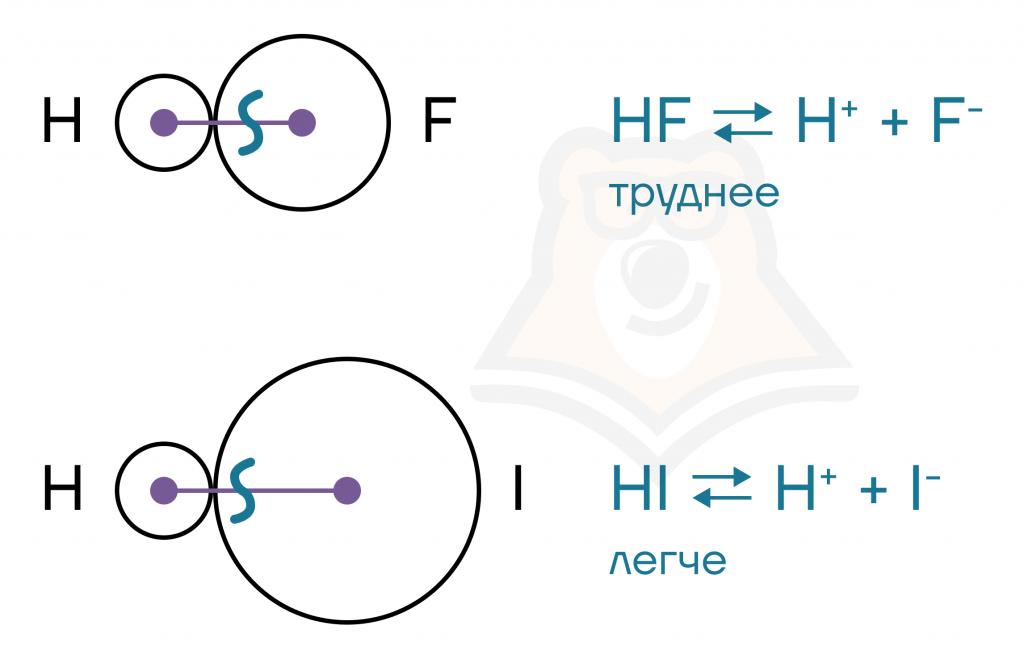
Чем длиннее связь, тем проще ее разрушить. Чем меньше кратность связи, тем проще ее разорвать.
Вспоминаем аналогию с Дженгой: чем выше Дженга, тем «легче» ей упасть.

- Кратность связи — это количество химических связей между атомами.
Кстати, количество связей, которое может образовать атом в молекуле, является еще и его валентностью.
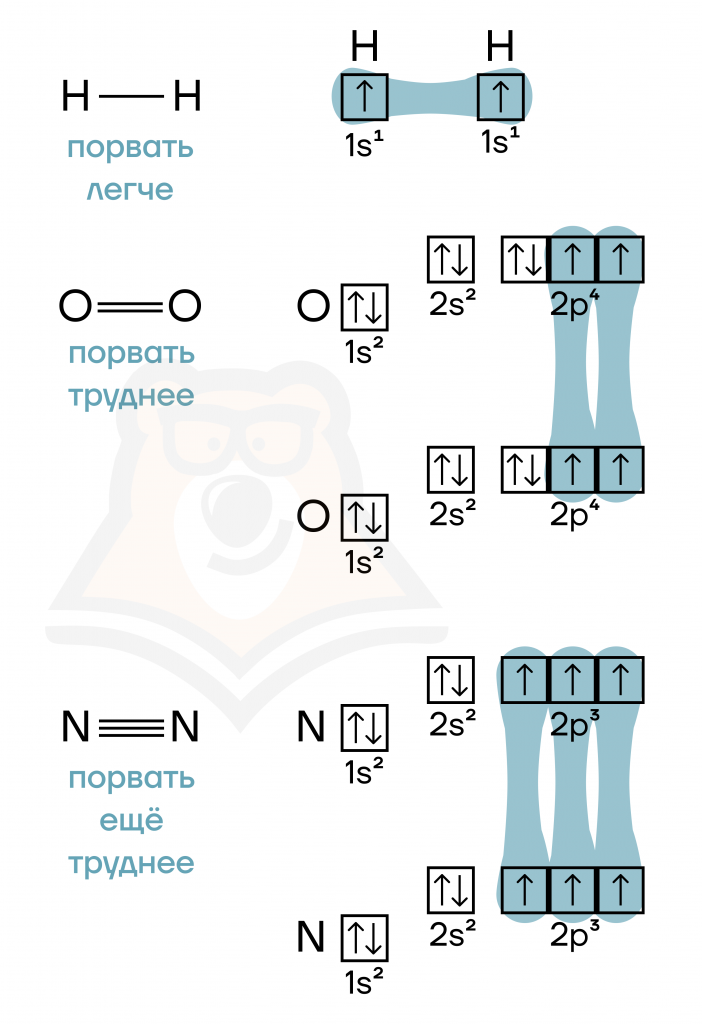
Чем больше кратность связи, тем сложнее ее разрушить.

- Полярность связи — отображает то, насколько велика разница электроотрицательностей атомов элементов.
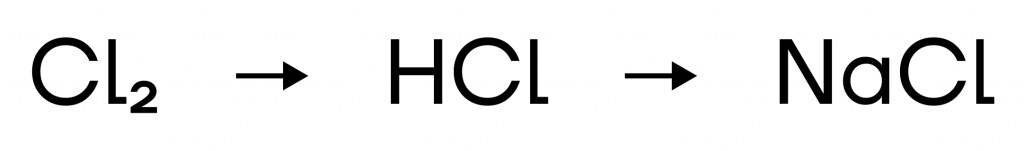
Чем больше разница ЭО, тем больше полярность.
Ковалентная неполярная связь → ковалентная полярная связь → ионная связь.
(в ряду полярность увеличивается)
В реальной жизни не все так однозначно. Химические связи очень чутко реагируют на окружающие их условия. Во время химических реакций и процессов на крошечные доли секунд могут образовываться гибридные и переходные связи. Некоторые из них обладают прочностью намного выше, чем у известных нам ковалентной, металлической и водородной связей. Изучение таких явлений является предметом для исследований современных ученых.
Фактчек
- Атомы в молекулах удерживаются определенными силами, которые называются химическими связями.
- Химическая связь обусловлена перекрытием орбиталей и созданием общих электронных пар. Атом старается приобрести электронную конфигурацию благородного газа (правило октета), так как это энергетически выгодно.
- Существует два механизма образования химической связи: обменный и донорно-акцепторный механизмы. В одной молекуле могут сочетаться оба этих механизма.
- Химическая связь бывает нескольких видов: ковалентная связь, ионная связь, металлическая связь, водородная связь.
- Химическая связь характеризуется длиной, прочностью, кратностью, полярностью.
Проверь себя
Задание 1.
По какому механизму образована молекула аммиака NH3?
- обменный механизм
- донорно-акцепторный механизм
- комбинация двух механизмов.
Задание 2.
В каком веществе присутствуют только ионные связи?
- Na2SiO3
- HF
- BaI2
- SO2
Задание 3.
В каком веществе присутствует три типа химических связей?
- CH3Cl
- CH3COONa
- BaSO4
- KCl
Задание 4.
В какой молекуле длина связи наибольшая?
- HF
- HCl
- HBr
- HI
Ответы: 1. — 1; 2. — 3; 3. — 2; 4. — 4.


 к списку статей
к списку статей





