Общие представления о промышленных способах получения важнейших неорганических веществ. Часть 1
На этой странице вы узнаете
- Как космос подарил нам железо?
- В отношениях парней и девушек есть романтические истории знакомства. А есть какая-то история у азота и водорода?
Химическая промышленность — вещь серьезная. Огромные заводы каждый день производят сырье как для бытовых предметов, так и для химического синтеза, строительства, приборостроения. В этой статье мы с вами узнаем все тонкости получения металлов, серной кислоты, аммиака в промышленности.
Металлургия
Металлургия — это наука о промышленных способах получения металлов.
Различают черную и цветную металлургию. К черной металлургии относят железо и его сплавы, а к цветной — все остальные металлы и их сплавы. Наиболее важны в металлургии именно сплавы металлов.
Основные сплавы железа — это:
- Чугун — сплав железа, содержащий 2—4% углерода. Производство чугуна было налажено еще в VI веке до нашей эры в Китае. Чугун применяют в машиностроении, делая детали для двигателей. Также из него изготавливают перила, лестницы, ворота, ограждения.
В Санкт-Петербурге есть целые мосты, сделанные из чугуна. Например, Зеленый мост — первый в Петербурге чугунный мост, а еще из чугуна делают кухонную утварь.

- Сталь — сплав железа, содержащий 0,3—2% углерода. Сталь обладает таким свойством, как упругость. Благодаря этому, сталь нашла свое применение в машино- и приборостроении.
Например, ее применяют для изготовления силовых пружин. Это свойство стали можно наглядно увидеть на примере Эйфелевой башни в Париже. Сделанная из 7300 тонн стали, башня под воздействием разных температур воздуха может изменяться в длине до 15 см.

- Легированные стали — сплавы железа с другими металлами, например, с никелем, хромом, кобальтом, титаном и другими. Добавление металлов придает стали различные свойства. Так, хром отвечает за устойчивость к коррозии, а никель за пластичность.
| Как космос подарил нам железо? Железо занимает четвертое место по распространенности на Земле среди всех химических элементов. Но как появились залежи этого металла? Дело было еще 4 миллиарда лет назад, когда наша Земля только зарождалась. На планету обрушился сильный метеоритный дождь. При высочайших температурах расплавленное железо достигло центра Земли и образовало земное ядро. А затем еще один аномальный метеоритный дождь принес в земную кору такие металлы, как железо, золото, кобальт, марганец. |

Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей).
- Получение металла или его сплава.
- Механическая обработка металла.
Почти все металлы находятся в природе в виде соединений. Активные металлы — в виде солей, средней активности — в виде оксидов и сульфидов, малоактивные — в виде простых веществ.
Получают металлы в промышленности следующими способами:
- Щелочные и щелочноземельные металлы.
Такие металлы из-за своей активности довольно сложно получить в чистом виде, ведь они стремятся прореагировать с другими веществами. Поэтому их получают электролизом расплава солей:
2LiCl = 2Li + Cl2
2NaCl = 2Na + Cl2
MgCl2 = Mg + Cl2
Калий получают взаимодействием паров натрия и расплава хлорида калия при нагревании. Натрий, как более активный металл, вытесняет калий из его соли:
KCl + Na = K + NaCl
Алюминий получают электролизом оксида алюминия в расплаве криолита:
2Al2O3 = 4Al + 3O2
Из всех металлов именно алюминий принято получать из расплава криолита. Это наиболее удобный и выгодный способ, так как алюминий — металл средней активности.
- Восстановление оксидов металлов средней активности углеродом и угарным газом.
2Fe2O3 + 6C = 2Fe + 6CO
ZnO + C = Zn + CO
2Fe2O3 + 6CО = 4Fe + 6CO2
Углерод и угарный газ способны реагировать с оксидами металлов средней активности. Они забирают себе кислород и образуют оксид, а металл выделяется в свободном виде.
Если металл находится в составе сульфида, то сульфид сначала обжигают, а потом уже восстанавливают полученный оксид.
2ZnS + 3O2 → 2ZnO + 2SO2
- Восстановление металлов из оксидов и солей другими металлами.
Важно отметить, что более активный металл вытесняет из оксидов или солей менее активный металл.
3CuO + 2Al = Al2O3 + 3Cu
CuO + Mg = Cu + MgO
2Fe2O3 + 4Al = 4Fe + 2Al2O3
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
CuSO4 + Fe = FeSO4 + Cu
Pb(NO3)2 + Zn = Pb + Zn (NO3)2
Общие научные принципы химического производства аммиака, серной кислоты и метанола
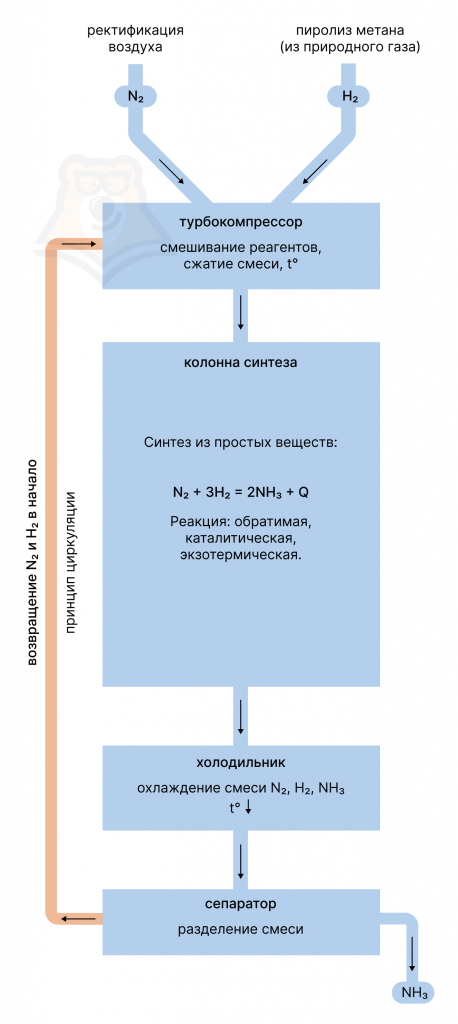
- Аммиак синтезируется из простых веществ — азота и водорода.
Азот получают перегонкой жидкого воздуха, а водород — паровой конверсией угля либо же метана:
C + H2O = CO + H2
CH4 + H2O = CO + 3H2
Сначала азот и водород смешивают друг с другом. Полученную смесь сжимают и нагревают в турбокомпрессоре (так как повышение давления и температуры повышает скорость реакции и выход продукта).
Далее происходит непосредственно синтез аммиака из азота и водорода в колонне синтеза.
Реакция обратимая, экзотермическая и каталитическая: в качестве катализатора используется платина или губчатое железо (как железный Губка Боб).
Далее в холодильнике производят охлаждение образовавшейся смеси, состоящей из аммиака и непрореагировавших азота и водорода, и ее разделение в сепараторе. После чего азот и водород возвращают в начало по принципу циркуляции.
Чтобы лучше понять, как весь этот процесс происходит и чтобы его запомнить, можно обратиться к рисунку выше.
Процесс получения аммиака непрерывный, для оптимизации производства используются принципы циркуляции и теплообмена.
| В отношениях парней и девушек есть романтические истории знакомства. А есть какая-то история у азота и водорода? Реакция между азотом и водородом N2 + 3H2 = 2NH3 имеет весьма примечательную историю. Многие ученые на протяжении всего XIX в. пытались осуществить эту реакцию, используя все методы, которыми владели тогда химики. Они нагревали исходные вещества, пропускали через их смесь электрические искры, пытались ускорить реакцию, подыскивая для нее катализаторы. Однако все эти усилия не приводили к сколько-нибудь заметному успеху. Это сейчас легко объяснить, зная, что молекулы азота очень прочны. Лишь в начале XX в., после того как получила развитие теоретическая химия, удалось выяснить условия протекания этой реакции: давление и нагревание. |
Аммиак служит сырьем для производства многих химических веществ. Например, с помощью аммиака в промышленных масштабах получают соду. Другое важное вещество, получаемое с помощью аммиака, — азотная кислота. Ее используют в производстве лекарств (например, в синтезе сердечных препаратов), в качестве окислителя ракетного топлива, для травления типографских форм в станковой графике и много где еще. Именно поэтому его так важно получать в больших количествах.
- Получение серной кислоты:
Серная кислота промышленно может быть получена в три этапа (стадии). Разберем их подробнее.
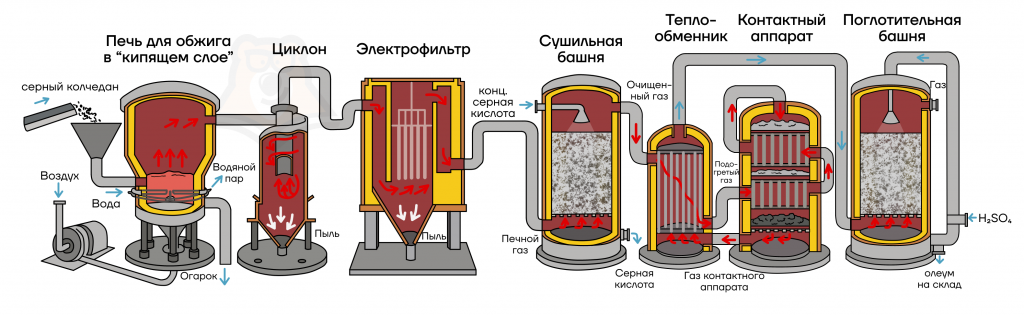
Стадия 1.
Сырье: FeS2, H2S, S и некоторые сульфиды.
Первая стадия включает в себя несколько этапов:
1) Обжиг пирита (FeS2) в печи для обжига (методом кипящего слоя):
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Метод кипящего слоя. В процессе обжига используют так называемый метод кипящего слоя — частицы измельченного пирита подаются в печь сверху, а воздух — снизу. В результате этого раскаленные частицы пирита оказываются подвешенными в токе воздуха, внешне напоминая кипящую жидкость.
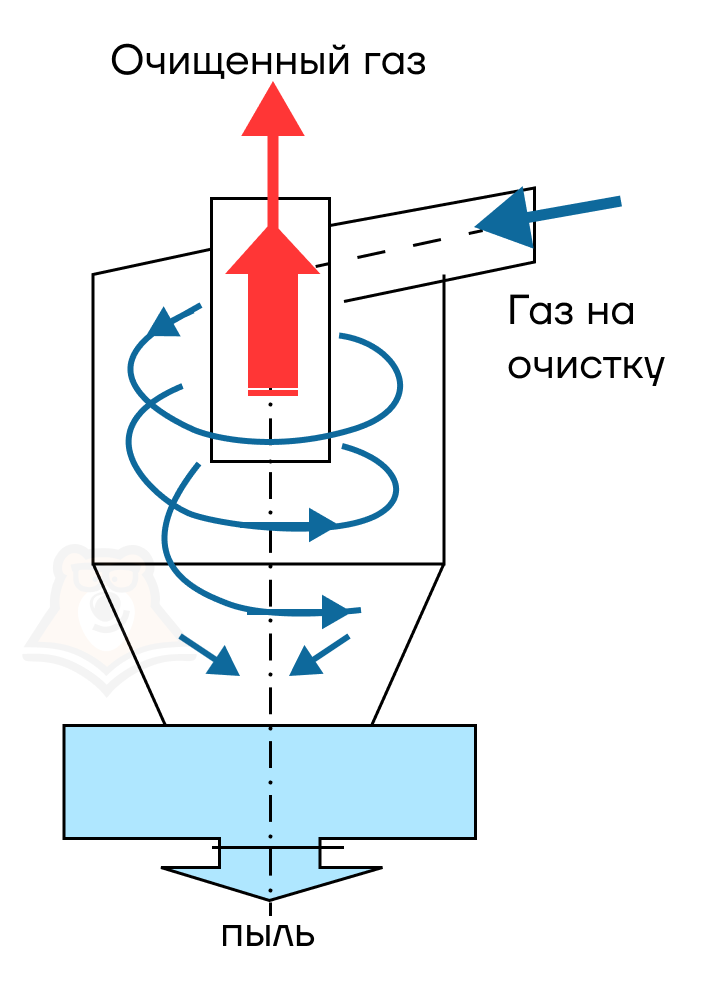
2) Очистка SO2 от Fe2O3 в циклоне и электрофильтре.
Циклон очищает газ путем закручивания потока загрязненного газа в цилиндрической части: под действием центробежной силы и силы притяжения твердые частички спускаются вниз.
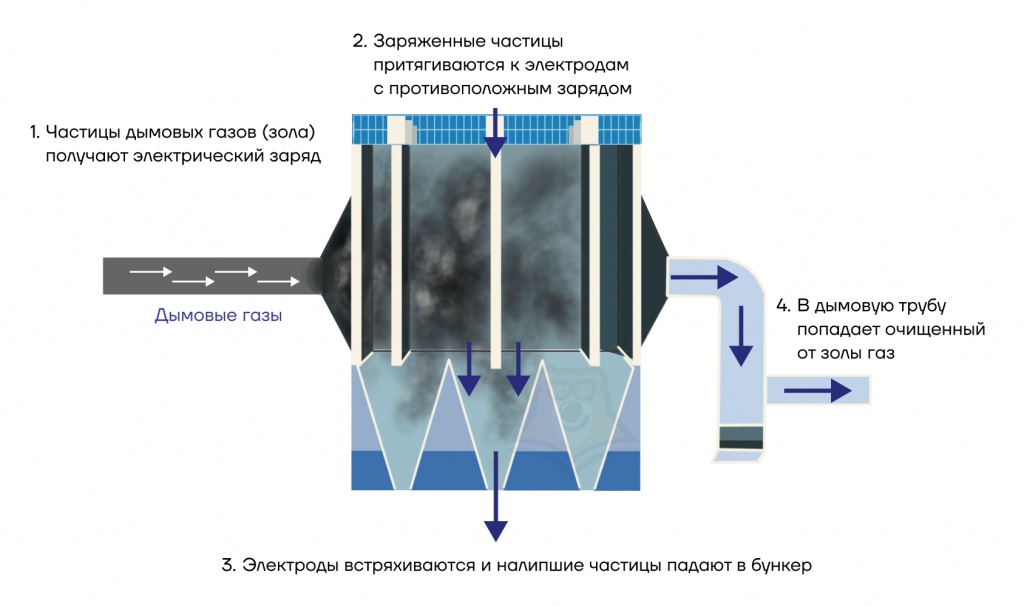
В электрофильтре частицам сообщается заряд, твердые частицы движутся по направлению к электроду и осаждаются на нем.
3) Осушка SO2 («очистка» от воды) в сушильной башне (принцип противотока). В качестве осушителя используется конц. H2SO4.
В сушильной башне снизу вверх поднимается газ, а сверху вниз льется концентрированная серная кислота, которая осушает газ за счет водоотнимающих свойств.
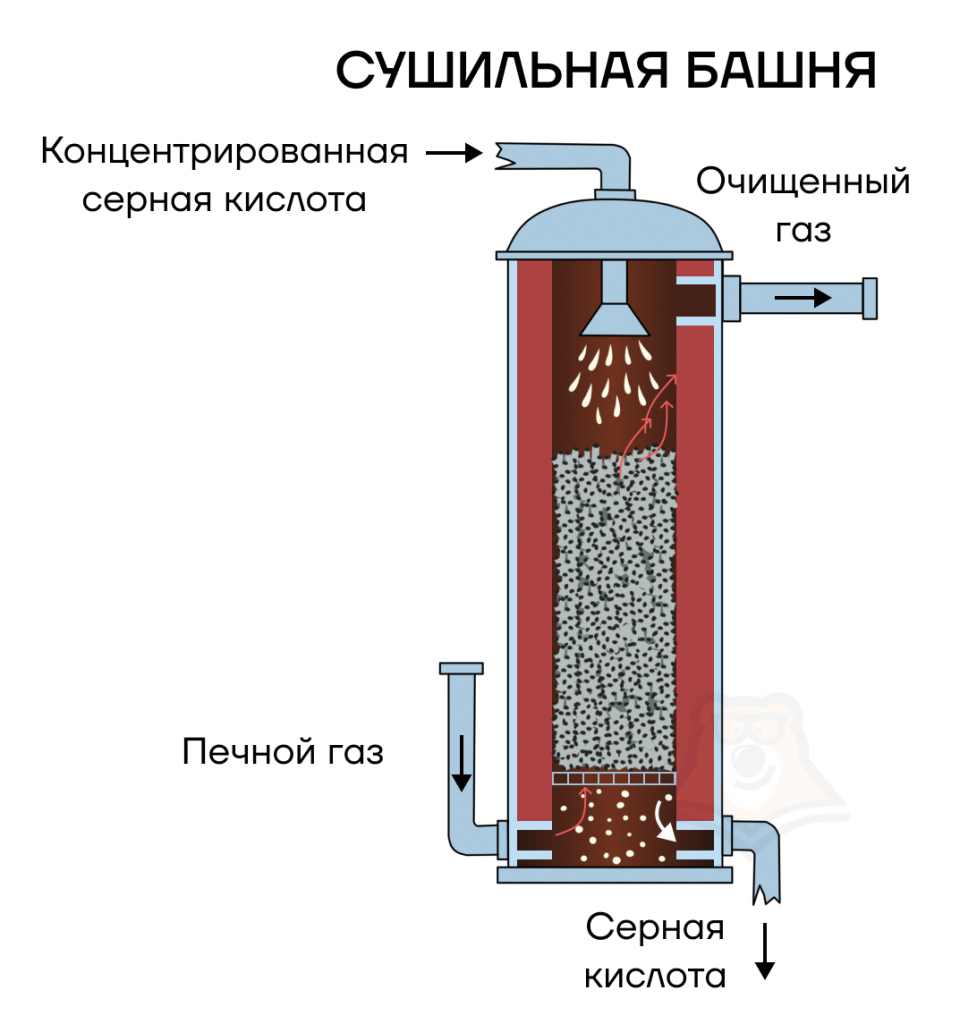
Стадия 2.
Окисление SO2 кислородом в контактном аппарате под действием катализатора V2O5:
2SO2 + O2 = 2SO3
Стадия 3.
Получившийся SO3 поглощают в поглотительной башне концентрированной серной кислотой с образованием олеума:
nSO3 + H2SO4 = H2SO4 + nSO3
Вы можете подумать, почему бы сразу не поглотить SO3 водой и получить серную кислоту? Дело в том, что при взаимодействии серного ангидрида и воды образуется большое количество теплоты, возрастает давление, и в результате образуется трудноуловимый сернокислотный туман. При поглощении же серного ангидрида концентрированной серной кислотой образуется олеум — раствор SO3 в безводной серной кислоте.
Этот олеум собирают в металлические емкости и отправляют на хранение.
Чтобы получить серную кислоту, необходимо к олеуму просто добавить воду, избыток SO3 превращается в H2SO4:
SO3 + H2O = H2SO4
Серная кислота применяется в самых различных сферах и промышленных отраслях:
- Производство минеральных удобрений.
- В качестве электролита свинцовых аккумуляторов.
- Источник для генерации минеральных кислот и солей.
- В нефтяной отрасли.
- В кожевенной и текстильной промышленностях.
- Создание фильтров для получения дистиллированной воды.
- В пищевой промышленности, как основа эмульгатора E513.
- Как важный элемент органического синтеза.
- Получение метанола.
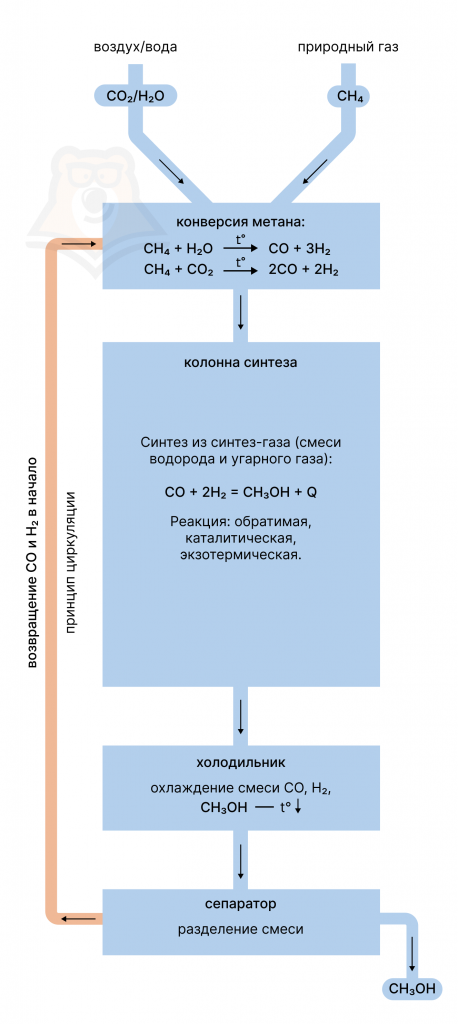
Производство метанола крайне напоминает производство аммиака: синтез осуществляется в одну реакцию (в той же колонне синтеза), также с использованием принципов циркуляции и теплообмена.
Производство начинается с конверсии метана углекислым газом или водяным паром. В результате образуется нужный нам синтез газ — смесь угарного газа CO и водорода H2, из которой мы непосредственно и будем получать метанол.
Далее полученная смесь CO и H2 направляется в колонну синтеза, где при высоких давлении и температуре и протекает реакция образования метанола:
CO2 + 2H2 = CH3OH
Как и в случае синтеза аммиака, эта реакция обратимая, экзотермическая и каталитическая: в качестве катализатора может выступать оксид цинка или медь.
Зачем при этом используются высокие давление и температура? Для повышения скорости и выхода реакции, конечно же.
Далее полученная смесь из CO, H2 и CH3OH охлаждается в холодильнике и подвергается разделению в сепараторе. Метанол направляется на склад, а непрореагировавшие угарный газ и водород по принципу циркуляции возвращаются в начало, чтобы реагировать до победного конца.
Химическое загрязнение окружающей среды и его последствия
К сожалению, наши любимые химические реакции в промышленных масштабах оказывают негативное влияние на окружающую среду. Например, при получении серной кислоты обжиг пирита проходит с выделением Fe2O3, который в виде мельчайших частиц попадает в атмосферу. Подобное явление называют металлизацией атмосферы.
Технологические процессы несовершенны. Поэтому часто происходят выбросы серного ангидрида в атмосферу, который с капельками воды образует серную кислоту. Это приводит к кислотным дождям, нарушающим жизнедеятельность водных экосистем, наносят вред здоровью человека и животных.

На металлургических предприятиях постоянно происходят выбросы огромного количества газов (CO, SO3), угольной, железной, алюминиевой пыли, частиц тяжелых металлов (свинец). Все эти металлы накапливаются в воздухе, почве, воде, атмосфере на радиусе от 20 до 50 км от производства. Загрязненный такой пылью воздух приводит к развитию у людей легочных, онкологических заболеваний.
Цветная металлургия использует огромные количества воды, а сточные воды, сбрасываемые в природные водоемы, содержат в себе ионы металлов, мышьяк, ртуть, фтор. Это также пагубно влияет на природу вокруг.
Применение изученных неорганических и органических веществ
Сейчас мы обобщим все знания о применениях. Пройдя органическую и неорганическую химию, вы все это очень подробно изучали. Вспомним самые важные моменты.
- Неорганика:
- перекись водорода и йод — хорошие дезинфектанты;
- поваренная соль — используется в консервации;
- алюминий — машиностроение, так как это очень легкий металл;
- раствор аммиака — в медицине;
- кислород и хлор — очистка воды.
- Органика:
- глицерин — парфюмерия;
- углеводороды — топливо;
- анилин — производство красителей;
- лимонная кислота — удаление накипи;
- алкадиены — вулканизация каучука.
Вот мы и разобрали все основные процессы, которые проходят в промышленности при получении и производстве важнейших химических соединений и простых веществ.
Фактчек
- Металлургия — это наука о промышленных способах получения металлов.
- Основные стадии металлургических процессов:
- обогащение природной руды (очистка, удаление примесей);
- получение металла или его сплава;
- механическая обработка металла.
- Аммиак синтезируется из простых веществ — азота и водорода.
- Получение серной кислоты в промышленности — сложный трехстадийный процесс.
- Производство метанола крайне напоминает производство аммиака: синтез осуществляется в одну реакцию (в той же колонне синтеза), также с использованием принципов циркуляции и теплообмена.
Проверь себя
Задание 1.
Анилин используется для производства…
- удобрений
- красителей
- лекарств
Задание 2.
Обжиг пирита — какая стадия производства серной кислоты?
- третья
- первая
- вторая
Задание 3.
Этиленгликоль используют в производстве…
- стекла
- линз
- антифриза
Задание 4.
Лимонную кислоту используют для…
- снятия накипи
- дезинфекции
- машиностроения
Ответы: 1. — 2; 2. — 2; 3. — 3; 4. — 1.


 к списку статей
к списку статей






