Алкены
На этой странице вы узнаете
- Лайфхак для фруктов: как ускорить созревание зеленых бананов?
- Как алкены помогают нашим котлетам не пригорать?
Алкены — следующий за алканами класс углеводородов, общая формула которых CnH2n. Их отличие заключается не только в одной гласной букве, а еще в том, что появляется кратная двойная связь, которая сильно расширяет возможные реакции алкенов. В статье мы узнаем, как алкены применяются в нашей обычной жизни, что из них делают на производстве и даже один лайфхак.
Строение молекулы этилена
Рассмотрим основные характеристики молекулы первого представителя класса алкенов — этилена, бесцветного газа со слабым сладковатым запахом:

- гибридизация атомов C=С: sp2;
- связи: двойная (σ + π) и одинарные (σ);
- форма молекул (участок С=С): плоская;
- валентный угол: 120°;
- длина связи: 0,134 нм.
Химическая формула этилена C2H4 указывает на два атома углерода с двойной связью между ними. Она сформирована σ- (между атомами H и C) и π-связью (между атомами C).
Для этилена характерно линейное строение, но его гомологи — например, пропилен — имеют уже пространственное строение из-за наличия CH3 групп в форме тетраэдра.
| Лайфхак для фруктов: как ускорить созревание зеленых бананов? Этилен обладает свойством ускорять созревание фруктовых плодов, поэтому часто для лучшей сохранности фрукты перевозят неспелыми, а затем хранят в помещениях, куда вводят этилен. Обычные яблоки при этом сами по себе выделяют немного этилена при хранении. Поэтому, если так случилось, что вы купили, например, зеленые бананы, можно положить их рядом с яблоками, и процесс дозревания ускорится. |

Общая формула гомологического ряда алкенов CnH2n. Гомологический ряд алкенов выглядит следующим образом:

| Имена для алкенов мы формируем по следующему алгоритму: 1. Выбираем самую длинную углеродную цепь, содержащую двойную связь (= главная цепь). 2. Нумеруем ее с того конца, где ближе двойная связь. 3. Называем вещество по схеме: «местоположение заместителя + название заместителя + число атомов углерода в главной цепи + -ЕН- + местоположение двойной связи (после какого атома С она находится)». |

Физические и химические свойства алкенов
Алкены, по сравнению с соответствующими алканами, имеют более низкие температуры плавления и кипения, которые увеличиваются с длиной углеродной цепи. Они почти не растворяются в воде, но хорошо растворяются в неполярных растворителях (C6H6, CCl4).

Рассмотрим теперь химические свойства алкенов. Входящая в состав двойной связи у алкенов π-связь довольно слабая, поэтому алкены вступают в реакции присоединения с разрывом π-связи. Но для них также характерны интересные реакции окисления, полимеризации.
- Реакции присоединения:
- Галогенирование.
Галогенирование алкенов проходит при комнатной температуре в растворе, в присутствии полярных растворителей по ионному механизму.

При взаимодействии алкенов с бромной водой, имеющей красно-бурую окраску, раствор обесцвечивается. Это является качественной реакцией на алкены.
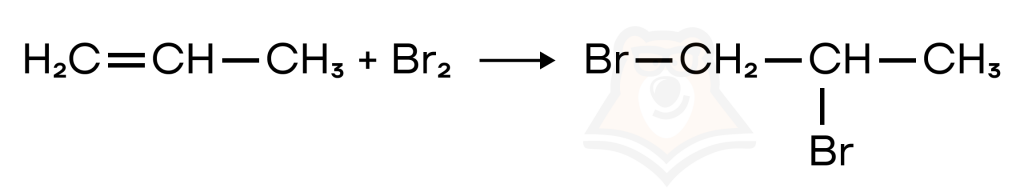

Если над стрелочкой стоит температура: нам намекают на то, что мы должны проводить аномальное галогенирование (не у атома углерода, стоящего рядом с двойной связью). Это «алкановское» замещение: оно происходит у sp³-гибридного атома углерода при одинарных связях по радикальному механизму.
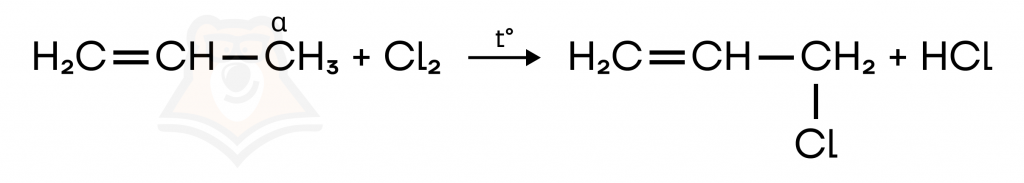
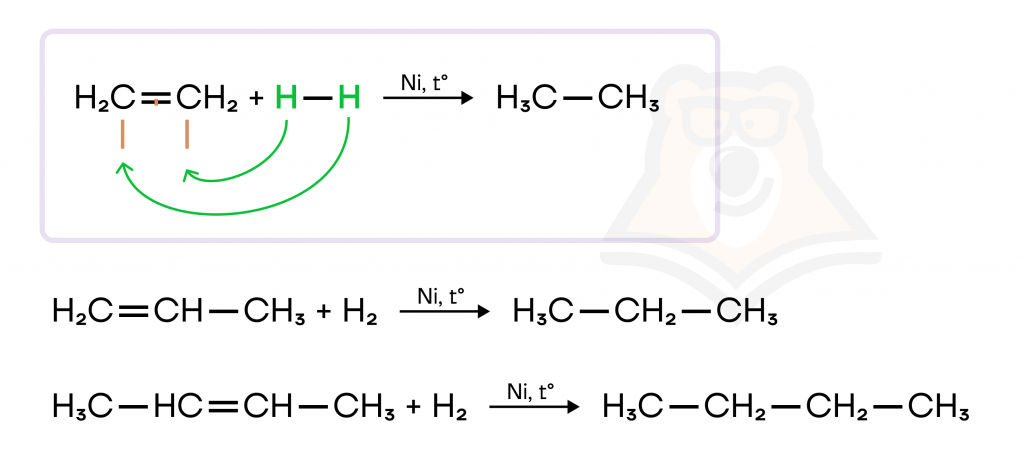
- Гидрирование.
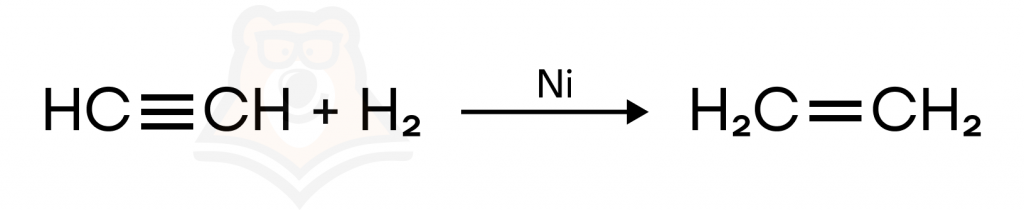
Алкены реагируют с водородом с разрывом двойной связи с использованием металлов-катализаторов — например, никеля.
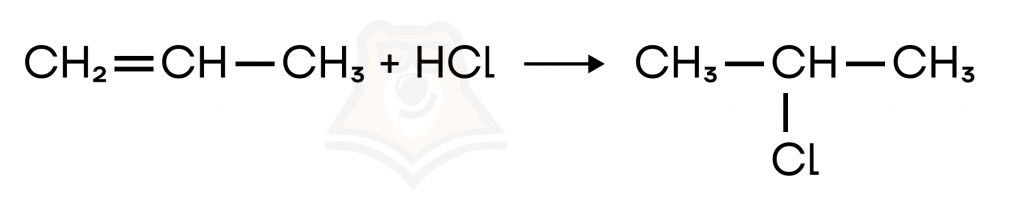
- Гидрогалогенирование.
При присоединении галогеноводородов образуется галогеналкан.

При присоединении к несимметричным алкенам применяется правило Марковникова.
Правило Марковникова: при взаимодействии галогеноводородов с несимметричными алкенами водород преимущественно присоединяется к наиболее гидрогенизированному (у которого больше H) атому углерода при двойной связи.
- Гидратация.
Гидратация проходит аналогично гидрогалогенированию, тоже с использованием правила Марковникова, только вместо галогена у нас OH-группа, а образуются спирты.

- Реакции полимеризации.
Полимеризация — процесс, при котором двойная связь в молекуле алкена как бы раскрывается. Полученные частицы называются полимерами, они могут соединяться между собой в длинные цепи.
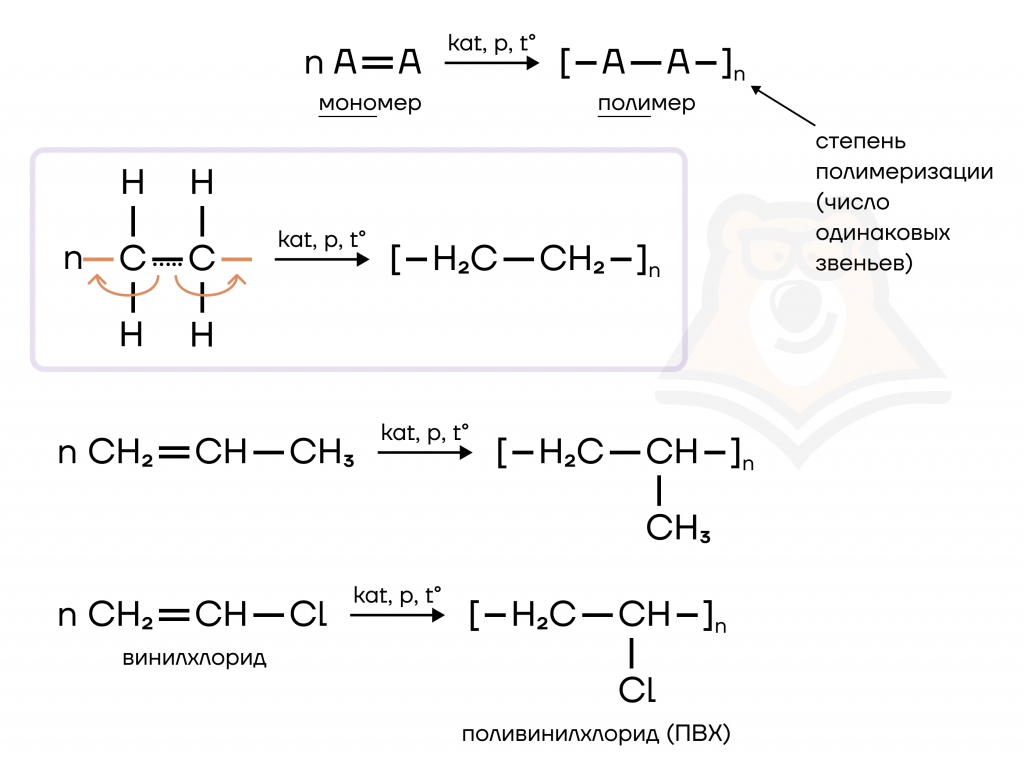
Процесс полимеризации невероятно важен для промышленности. Полимеры окружают нас повсюду — это всем нам хорошо известная полиэтиленовая пленка, пластмасса, каучук, резина, искусственная кожа, синтетические ткани, клей, органическое стекло и множество других изделий.
Реакцией полимеризации получают в том числе вещество под названием тефлон. Это его запатентованное название. На самом деле это полимер тетрафторэтилена (ПТФЭ).
nCF2 = CF2 → (–CF₂ –CF₂ –)n
| Как алкены помогают нашим котлетам не пригорать? Политетрафторэтилен был случайно открыт в апреле 1938 года 27-летним ученым-химиком Роем Планкеттом во время работы над созданием альтернативных хладагентов, в частности — тетрафторэтилена, который представляет из себя бесцветный газ. Полученное вещество хранилось в небольших баллонах. Однажды, после открытия одного из них, газ не выходил, хотя, судя по весу баллона, его содержимое все еще находилось внутри. Заинтересовавшись произошедшим, Планкетт решил разрезать баллон и проверить, что случилось с газом. Выяснилось, что тетрафторэтилен, ранее находившийся в баллоне, полимеризовался в воскообразную белую субстанцию, политетрафторэтилен. Данное вещество обладает удивительными свойствами: — оно чрезвычайно скользкое (одно из самых скользких веществ, известных человеку); — не подвергается коррозии; — политетрафторэтилен химически стабилен; — температура плавления политетрафторэтилена чрезвычайно высокая. В быту это вещество получило широкое распространение как антипригарное покрытие для посуды. Масла и загрязнения не прилипают к нему, поэтому жарить котлеты на тефлоновой сковородке — одно удовольствие. |
Рекламный постер сковороды с антипригарным покрытием (1960-е)
- Реакции окисления. Здесь различают несколько типов окисления:
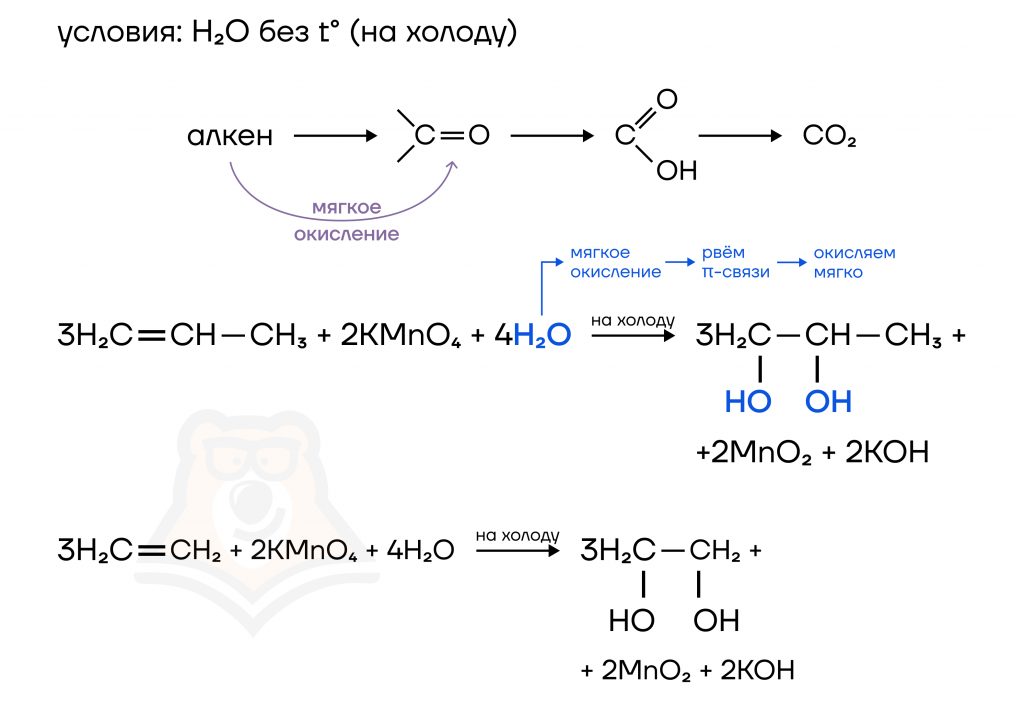
- Мягкое окисление.
При мягком окислении алкенов (в нейтральной среде — H2O) происходит разрыв ТОЛЬКО слабых π-связей. При этом атомы углерода при «порванной» связи окисляются совсем немного — до спиртов (так как окисление мягкое!).
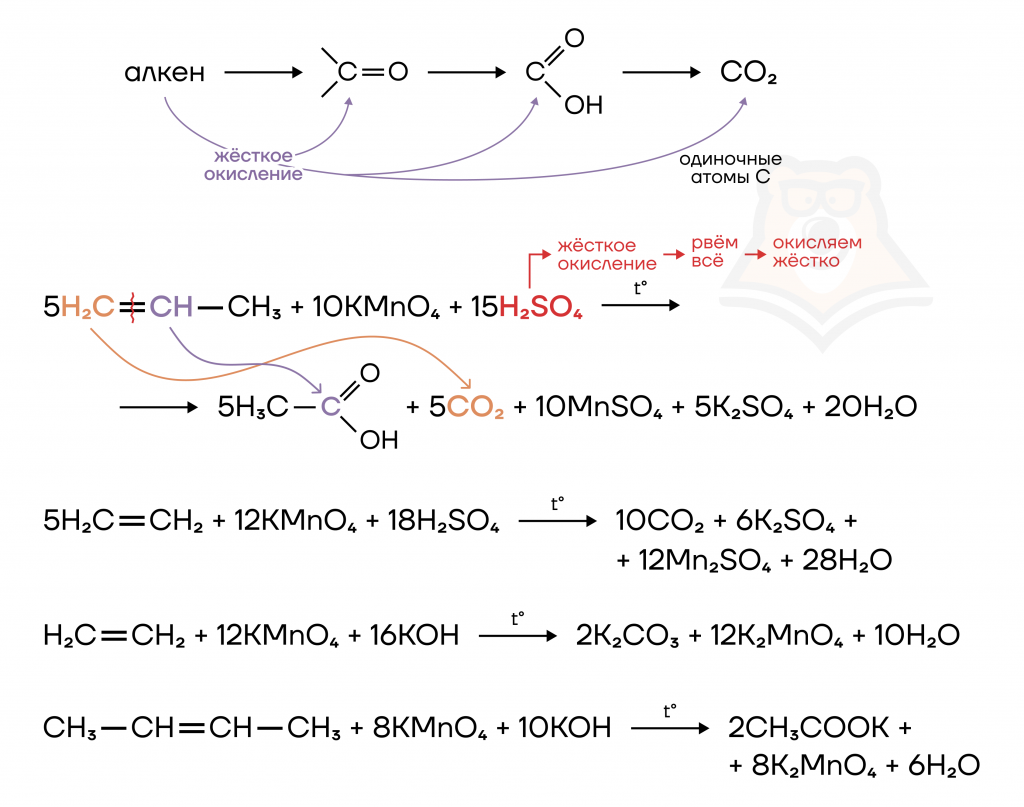
- Жесткое окисление.
При жестком окислении (в кислой или щелочной среде — H⁺/OH⁻) происходит разрыв ВСЕЙ кратной связи (как σ-, так и π-). При этом атомы углерода при «порванной» связи окисляются сильно — до карбоновых кислот (или их солей в щелочной среде) или даже до CO2 (если атом углерода «одиночный»):
- Каталитическое окисление.
Взаимодействие этилена с кислородом в присутствии солей меди или палладия приводит к образованию этаналя (уксусного альдегида).

Получение алкенов
В отличие от алканов, алкены в природе содержатся в малом количестве, поэтому их получают с помощью химических реакций. В промышленности алкены получают следующими способами:
- Дегидрирование алканов.
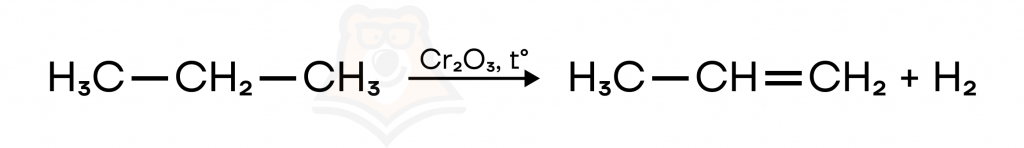
- Крекинг алканов.
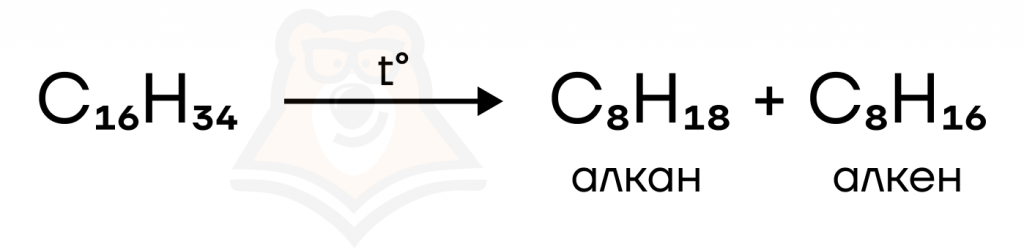
- Гидрирование алкинов, алкадиенов.
В лаборатории:
- Дегалогенирование дигалогенпроизводных.
Галогены при этом должны находиться у соседних атомов углерода, чтобы двойная связь замкнулась.

- Межмолекулярная дегидратация спиртов.
Дегидратация спиртов проходит по правилу Зайцева.
Правило Зайцева: отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
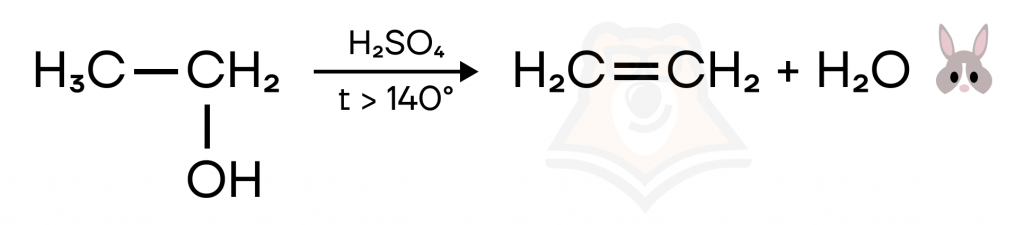
- Дегидрогалогенирование моногалогенпроизводных.

Применение алкенов
Пожалуй, основное применение алкенов — производство полимеров. Выше мы уже говорили о том, как полимеры повсеместно используются в нашей жизни: это и упаковочные материалы, и материалы для изготовления одежды и обуви — в общем, основа легкой промышленности.
Галогенпроизводные этилена — хлорэтан и дихлорэтан — используются как анестезирующее вещество и растворитель.
Из этилена получают этиловый спирт, уксусный альдегид, стирол.
На складах фрукты хранят в атмосфере этилена, чтобы они быстрее стали спелыми.
Фактчек
- Алкены — углеводороды, в которых присутствуют кратные двойные связи.
- Общая формула алканов CnH2n.
- Алкены могут быть в жидком, твердом и газообразном состояниях.
- Для алкенов, в отличие от алканов, характерны реакции присоединения.
Проверь себя
Задание 1.
Общая формула алкенов:
- CnH2n+2
- CnH2n
- CnH2n-2
- CnHn
Задание 2.
По какому механизму идут реакции галогенирования при нагревании?
- по радикальному
- по ионному
Задание 3.
При мягком окислении этилена в качестве органического продукта образуется:
- уксусная кислота
- углекислый газ
- этиленгликоль
- пропановая кислота
Задание 4.
Какие связи присутствуют в алкенах?
- двойная и одинарные
- только одинарные
- тройная и двойная
- тройная и одинарная
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 1.


 к списку статей
к списку статей






