Общая характеристика оксидов
На этой странице вы узнаете
- Зачем оксиды используют в ювелирном деле?
- Как создать радугу из оксидов и гидроксидов?
- Какое влияние на организм могут оказывать оксиды?
Оксиды похожи на некое промежуточное звено эволюции: сами они не слишком сложные, но без них невозможно понимание других классов веществ. Сегодня мы узнаем, как оксиды формируют более сложные соединения и какие есть «тупиковые ветви развития» среди этого класса.
Характеристика оксидов
Для того, чтобы дать характеристику оксидам, нам для начала необходимо узнать, что же такое оксиды. Подсказка о том, что это за класс, кроется уже в названии: «окси» — это кислород, значит, в оксидах точно должен быть кислород.
Оксиды — соединения кислорода в степени окисления -2 с другими элементами.
Практически все элементы таблицы Менделеева способны образовывать оксиды, а некоторые элементы могут образовывать даже несколько. От того, с каким элементом образован оксид, зависят свойства полученного соединения. Разберемся подробнее, какие бывают оксиды.

Начнем с того, что все оксиды можно разделить на солеобразующие и несолеобразующие. Солеобразующие при взаимодействии с кислотами или основаниями образуют соль и воду, а несолеобразующие в реакции солеобразования не вступают.
Металлы в степенях окисления +1 и +2 образуют основные оксиды, амфотерные оксиды — это оксиды металлов в степенях окисления +3 и +4 (а также ZnO, BeO, SnO, PbO), а оксиды металлов в степенях окисления +5, +6 и +7 — это кислотные оксиды.
Неметаллы способны образовывать кислотные и несолеобразующие оксиды. Большинство оксидов, образованных неметаллами, относятся к кислотным, а вот несолеобразующие оксиды являются исключениями и их необходимо выучить.
Кроме солеобразующих и несолеобразующих оксидов встречаются также двойные (солеобразные или смешанные) оксиды. К смешанным относят оксиды, которые содержат элемент с различными показателями валентности и степени окисления, зачастую обе степени окисления промежуточные. Такими оксидами будут Pb2O3, Mn3O4, Fe3O4.
Названы данные оксиды двойными, так как они состоят из двух оксидов:
Fe3O4 = FeO•Fe2O3
Mn3O4 = MnO•Mn2O3
Pb2O3 = PbO•PbO2
Давайте потренируемся различать группы оксидов.
Закрепим полученные знания, решив пример задания №5 ЕГЭ.
Задание. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) несолеобразующего оксида; Б) амфотерного оксида; В) кислотного оксида.

Решение. Для начала определим, какие вещества из предложенного перечня относятся к оксидам. К веществам, состоящим из кислорода в степени окисления -2 и другого элемента, относятся K2O, S2O, MnO2, CO2 и CuO.
Оксиды калия и меди(II) относятся к основным, так как содержат металл в степени окисления +1 и +2.
Оксид серы(I) относится к несолеобразующим, следовательно, под А подходит вариант ответа номер 3.
Оксид углерода(IV) как оксид неметалла будет относиться к кислотным, для В подойдет ответ под номером 6.
А вот оксид марганца(IV) за счет степени окисления металла +4 будет амфотерным, поэтому для Б подойдет номер 5.
Ответ: 356
Теперь, когда у нас есть базовые представления об оксидах, можем изучить, каким образом мы называем оксиды и как по названию оксида можно составить его формулу.
Номенклатура оксидов
Чтобы всегда правильно определять состав оксида, нужно знать систематическую (официальную) номенклатуру оксидов.
Для начала разберем, как нам назвать оксид, если дана его формула. Рассмотрим на примере N2O5.
Название любого оксида записывается в виде «оксид элемента (степень окисления римскими цифрами без знака)».
Наш оксид состоит из кислорода в степени окисления -2, а также азота в степени окисления +5.
Подставляем в общее название азот и его степень окисления и получаем, что N2O5 — это оксид азота(V).
Если нам дан элемент с постоянной степенью окисления в составе оксида (например, Na+ в составе Na2O), то степень окисления не указывается, пишем просто оксид натрия.
А теперь решим обратную задачу. Нам дан оксид марганца(IV), как составить для него формулу?
Помним, что в скобках указывается степень окисления, значит, марганец в оксиде имеет степень окисления +4. Так как в оксиде степень окисления кислорода всегда -2, то формула будет выглядеть как MnO2.
Кроме систематической номенклатуры, некоторые оксиды имеют и тривиальные (распространенные в быту) названия:
CaO — негашеная известь;
N2O — веселящий газ;
NO2 — бурый газ, лисий хвост;
Fe3O4 — железная окалина;
SiO2 — кремнезем, кварц, песок, горный хрусталь, силикагель;
SO2 — сернистый газ, сернистый ангидрид, диоксид серы;
SO3 — серный ангидрид, триоксид серы;
СО2 — углекислый газ;
СО — угарный газ;
MnO2 — пиролюзит;
Al2O3 — корунд, глинозем;
SO3 в H2SO4 — олеум.
Оксидов существует великое множество, так как же мы можем их получить?
Физические свойства и способы получения оксидов
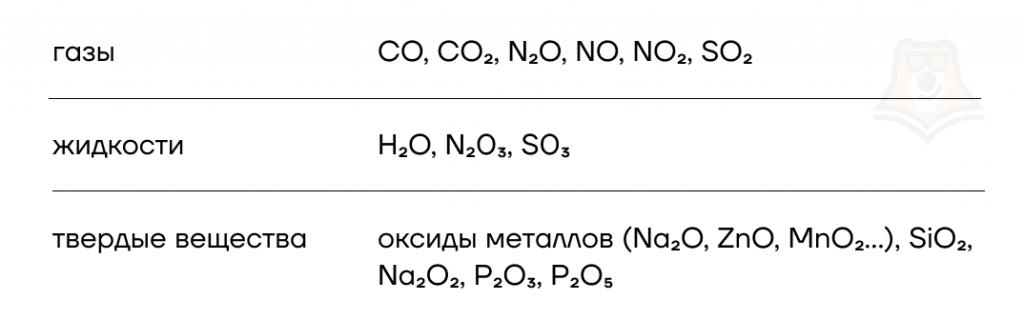
Для начала кратко разберем агрегатные состояния оксидов. Большинство из них являются твердыми веществами, но есть и газы, и жидкости.
Оксиды могут быть получены при взаимодействии кислорода с простыми веществами.

Важно заметить, что галогены (кроме фтора) с кислородом не реагируют!
Если элемент имеет несколько оксидов, то продукт взаимодействия будет определяться соотношением кислорода и простого вещества: при недостатке кислорода образуется оксид с меньшей степенью окисления, а при избытке — с большей.
4Cu + O2 (нед.) = 2Cu2O
2Сu + O2 (изб.) = 2CuO
Некоторые элементы, например, алюминий, на воздухе самопроизвольно покрываются оксидной пленкой.
| Зачем оксиды используют в ювелирном деле? Для защиты ювелирных украшений от потускнения в ювелирной промышленности существует оксидирование. Сущность данного процесса заключается в нанесении на поверхность изделий оксидной пленки — химически стойкой защитной пленки, позволяющей повысить их декоративные качества и коррозионную стойкость. Также все драгоценные камни являются разновидностями оксидов. Например, рубин — это разновидность оксида алюминия, агат — оксида кремния. Поэтому для создания различных имитаций драгоценных камней используются оксиды. |

Но и у данного способа получения есть несколько исключений. Некоторые металлы при взаимодействии с кислородом образуют не оксиды, а пероксиды и надпероксиды.
2Na + O2 = Na2O2 (пероксид натрия)
Пероксиды — соединения кислорода в степени окисления -1 с другими элементами.
К + О2 = КО2 (надпероксид калия)
Cs + O2 = CsO2 (надпероксид цезия)
Rb + O2 = RbO2 (надпероксид рубидия)
Надпероксиды — соединения кислорода в степени окисления -½ с другими элементами.

Фтор, как самый электроотрицательный элемент, при взаимодействии с кислородом образует фторид кислорода O+2F2—, оксида фтора не существует.
Сера всегда сгорает до оксида серы(IV), получение оксида серы(VI) происходит путем воздействия кислорода на SO2:
S + O2 = SO2
SO2 + O2 (катализатор V2O5) = SO3
Аналогична ситуация с азотом: он может окислиться только до NO и то под воздействием высокой температуры и при электрическом разряде. Данная реакция как раз происходит во время грозы.
N2 + O2 = 2NO
Оксиды можно получить при взаимодействии кислорода не только с простыми веществами, но и с бинарными соединениями. Например, при взаимодействии пирита (FeS2) с кислородом образуются оксид железа(III) и оксид серы(IV).
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Получение оксидов возможно в реакциях разложения.
H2SiO3 = H2O + SiO2
Li2CO3 = CO2 + Li2O
Мы уже упомянули, что некоторые оксиды могут реагировать с кислородом с образованием новых оксидов, но это лишь малая часть химических свойств. Давайте подробнее разберемся, какие еще реакции возможны для данного класса веществ.
Химические свойства оксидов
I. Общие свойства оксидов
Многие оксиды способны реагировать с водой с образованием соответствующих гидроксидов, если оксиду соответствует растворимый гидроксид.
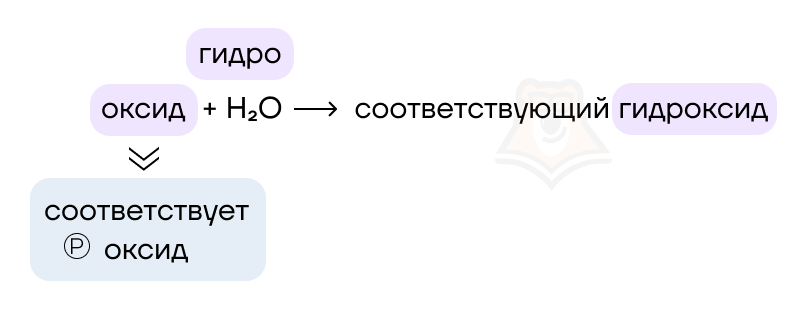
Na2O + H2O = 2NaOH
SO3 + H2O = H2SO4
Если оксиду соответствует нерастворимый гидроксид, то реакция не протекает.

Al2O3 + H2O ≠
Названия групп оксидов отражают их химические свойства, а также указывают на то, какие гидроксиды соответствуют оксидам:
| Основные оксиды | Основные гидроксиды (основания) |
| Амфотерные оксиды | Амфотерные гидроксиды (не основания!) |
| Кислотные оксиды | Кислотные гидроксиды (кислородсодержащие кислоты) |
| Несолеобразующие оксиды | Не образуют гидроксиды и не проявляют основных или кислотных свойств |

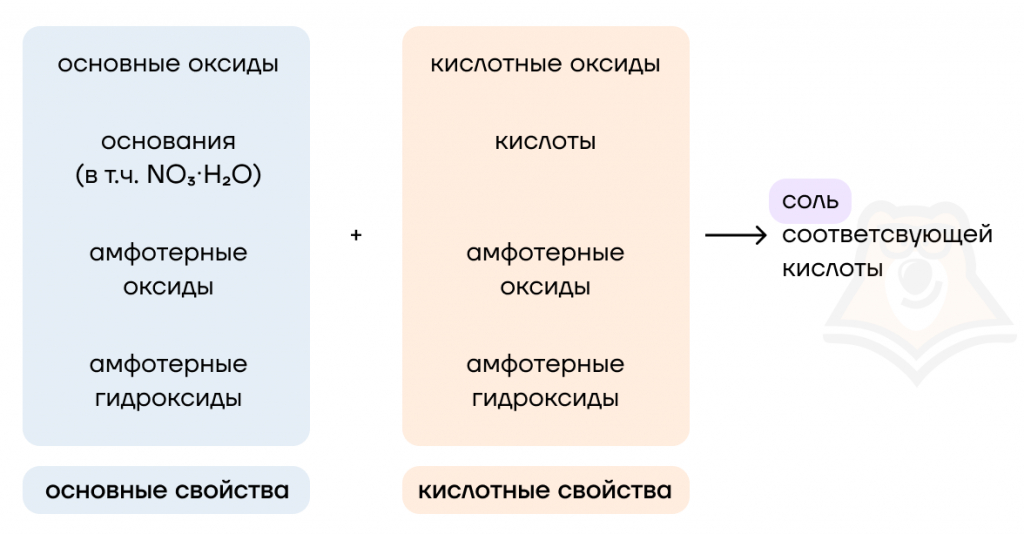
Кроме взаимодействия с водой, практически все оксиды вступают в основно-кислотное взаимодействие: основные соединения (основные оксиды и основания) реагируют с кислотными соединениями (кислотными оксидами и кислотами). Амфотерные соединения могут проявлять как основные, так и кислотные свойства.
Также большинству оксидов характерны окислительно-восстановительные реакции с повышением степени окисления. Оксид элемента не в высшей степени окисления можно перевести в оксид элемента в более высокой степени окисления добавлением кислорода.
2SO2 + O2 = 2SO3
2NO + O2 = 2NO2
Отдельного внимания заслуживают реакции вытеснения.
- Нелетучие оксиды вытесняют летучие оксиды из солей при сплавлении.
Нелетучие оксиды: P2O5, N2O5, SiO2 (и амфотерные оксиды)
Соли летучих кислот: MeCO3 (карбонаты), MeSO3 (сульфиты)
P2O5 + 3Na2CO3 = 2Na3PO4 + 3CO
- Более сильная кислота вытесняет более слабую из раствора.
Данное правило применимо для растворенного в воде оксида углерода (IV), который способен вытеснить более слабую кремниевую или фенол из солей:
K2SiO3 + H2O + CO2 = K2CO3 + H2SiO3
2C6Н5ОK + H2O + CO2 = K2CO3 + 2C6H5ОН
А теперь давайте подробнее изучим свойства конкретных групп оксидов.
II. Свойства основных оксидов
- Взаимодействие с водой
При взаимодействии с водой основные оксиды образуют основания: растворимые основания мы называем щелочами.
K2O + H2O = 2KOH
Реакции с образованием нерастворимых гидроксидов не идут, однако есть единственное исключение — оксид магния может прореагировать с водой при сильном нагревании, однако на экзамене этот материал не встречается.
- Взаимодействие с кислотами и кислотными оксидами
В ходе реакции образуется соль, если реакция идет с кислотой, то еще и вода.
BaO + H2SO4 = BaSO4 + H2O
CaO + SO2 = CaSO3
Разберем химические свойства основных оксидов подробнее, решив пример задания №6 ЕГЭ.
Задание. В пробирку с нерастворимым в воде оксидом Х добавили раствор Y. В результате реакции наблюдали растворение осадка.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) FeО
2) H2O
3) Na2O
4) HCl
5) KOH
Решение. В задании нам даны два оксида: оксид натрия (Na2O), который способен растворяться в воде, и нерастворимый оксид железа(II) (FeO). Именно с оксидом железа(II) и пойдет реакция.
Так как данный оксид нерастворим в воде и проявляет основные свойства, то с водой и щелочью реакция не пойдет, а вот при реакции с соляной кислотой (HCl) как раз будет наблюдаться растворение осадка:
CaO + 2HCl = CaCl2 + H2O
Значит, под X возьмем 1, а под Y — 4.
Ответ: 14
- Взаимодействие с амфотерными оксидами
Протекает также с образованием солей.
K2O + ZnO = K2ZnO2
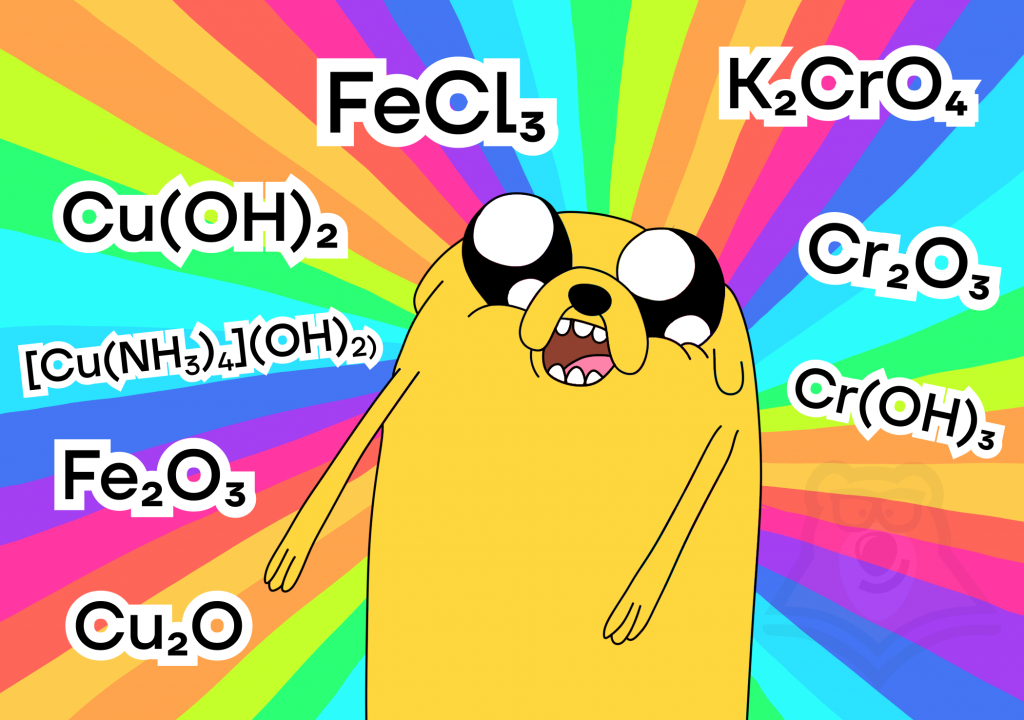
| Как создать радугу из оксидов и гидроксидов? Некоторые оксиды имеют цвета, которые мы можем сразу записать в нашу «радугу».Красный цвет имеет оксид меди(I) Cu2O и оксид железа(III) Fe2O3. Если мы растворим последний оксид в соляной кислоте, то получим желтый раствор хлорида железа(III): Fe2O3 + 6HCl = 2FeCl3 + 3H2O Если мы окислим оксид хрома(III) в щелочной среде, то получим желтый хромат, а если к полученному хромату добавим кислоту, то выйдет оранжевый дихромат. Cr2O3 + KClO3 + 4KOH = 2K2CrO4 + KCl + 2H2O 2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2О Кстати, сам оксид хрома(III) Cr2O3, как и его гидроксид Cr(OH)3 имеют зеленый цвет, включим в радугу. Голубой цвет имеет гидроксид меди(II) Сu(OH)2, а некоторые его соли (например, [Cu(NH3)4](OH)2) имеют синий оттенок. Для получения фиолетового цвета нам придется взять кислотный оксид марганца(VII) и с помощью воды превратить его в фиолетовый раствор кислоты HMnO4. |
После знакомства с основными оксидами можем перейти к их «второй половинке» — кислотным оксидам.
III. Свойства кислотных оксидов
- Взаимодействие с водой
При взаимодействии с водой кислотные оксиды образуют кислоты.

В данном случае также важно помнить, что реакция протекает только при условии соответствия оксиду растворимой кислоты. Если оксиду соответствует нерастворимая кислота, то реакция не протекает.
N2O5 + H2O = 2HNO3
SiO2 + H2O ≠
- Взаимодействие с кислотами и кислотными оксидами
В ходе реакции образуется соль, если реакция идет с основанием, то еще вода. В зависимости от того, какое вещество взято в избытке, продукты реакции могут быть разными: при избытке щелочи образуется средняя соль, а при недостатке — кислая соль.
СO2 + 2NaOH (изб.) = Na2CO3 + H2O
CO2 + NaOH (нед.) = NaHCO3
CO2 + CaO = CaCO3
- Взаимодействие с амфотерными оксидами
Протекает также с образованием солей.
SO3 + ZnO = ZnSO4
Но есть также класс, который объединяет в себе свойства предыдущих двух — амфотерные оксиды. Перейдем к их свойствам.
IV. Свойства амфотерных оксидов
- Взаимодействие с водой
Так как большинству амфотерных оксидов соответствуют нерастворимые гидроксиды, то реакция с водой не идет.
- Основно-кислотное взаимодействие
В основно-кислотные взаимодействия данные оксиды охотно вступают, при этом они способны реагировать как с основными соединениями, так и с кислотными.
Взаимодействовать амфотерные оксиды будут только с основными оксидами щелочных (IA группы) и щелочноземельных (IIA группы) металлов, а также только со щелочами.
Na2O + Al2O3 = 2NaAlO2
2KOH + Al2O3 + 3H2O = 2K[Al(OH)4]
Реакции с кислотными соединениями протекают только с кислотами и «сильными» кислотными оксидами — оксидами устойчивых кислот. Именно поэтому реакция с CO2 или SO2 не идет — Н2СО3 и Н2SO3 неустойчивы, то есть распадаются на воду и газ.
3SO3 + Al2O3 = Al2(SO4)3
ZnO + CO2 ≠
ZnO + 2HCl = ZnCl2 + H2O
- Реакции вытеснения
Амфотерные оксиды вытесняют летучие оксиды (SO2 и CO2) из солей при сплавлении — совместном нагревании твердых веществ.
ZnO + Na2SO3 = Na2ZnO2 + SO2
Al2O3 + CaCO3 = Ca(AlO2)2 + CO2
Осталось изучить только самые необычные оксиды — несолеобразующие. Не будем ждать и перейдем к изучению их свойств!
V. Свойства несолеобразующих оксидов
Несолеобразующие оксиды не реагируют с водой и не вступают в основно-кислотное взаимодействие. Зато они могут участвовать в ОВР.
N2O + H2 = H2O + N2 (восстановительные свойства)
2СО + О2 = 2СО2 (окислительные свойства)
Также есть несколько реакций с угарным газом, не поддающихся классификации, которые нужно запомнить.
CO + NaOH = HCOONa
CO + Cl2 = COCl2
| Какое влияние на организм могут оказывать оксиды? На самом деле некоторые несолеобразующие оксиды способны образовывать соединения с другими веществами. Например, угарный газ присоединяется к гемоглобину, что нарушает транспортировку кислорода и углекислого газа и вызывает отравление. N2O назван веселящим газом не просто так — при вдыхании данного оксида наступает опьянение с приступами смеха. Однако данный газ также может вызывать отравление организма. |

На сегодня наше изучение неорганической химии заканчивается, но впереди у нас много интересного. О том, какие классы веществ существуют в неорганической химии, можно прочитать в статье «Основные классы неорганических веществ».
Термины
Бинарные соединения — соединения, которые состоят из двух элементов: металла и неметалла или двух неметаллов.
Восстановители — соединения, отдающие электроны в окислительно-восстановительных реакциях, при этом повышающие свою степень окисления.
Кислые соли — соли, в состав которых входят атомы водорода, которые могут быть замещены на металл или катион аммония NH4+.
Металлы — вещества, обладающие металлическими свойствами, такими как высокие электро- и теплопроводность, высокая пластичность, ковкость и характерный металлический блеск. Они способны взаимодействовать с неметаллами, водой и некоторыми кислотами, а также могут вступать в окислительно-восстановительные реакции.
Неметаллы — вещества, не обладающие металлическими свойствами. Они способны взаимодействовать с металлами и некоторыми неметаллами, водой, щелочами и некоторыми кислотами, а также могут вступать в окислительно-восстановительные реакции.
Окислители — это соединения, охотно принимающие электроны в окислительно-восстановительных реакциях, при этом сами они понижают свою степень окисления.
Степень окисления — это условный заряд атома элемента, вычисленный на основе предположения, что все связи в данном соединении являются ионными (показывает, сколько электронов атом «притянул» или, наоборот, «отдал» при образовании химической связи).
Фактчек
- Оксиды состоят из кислорода в степени окисления -2 и другого элемента.
- Оксиды могут быть солеобразующими и несолеобразующими. Солеобразующие оксиды подразделяются на основные, амфотерные и кислотные.
- Название оксидов включает в себя указание на элемент в составе и его степень окисления, которую мы записываем в скобках римскими цифрами.
- Оксиды могут быть получены при взаимодействии кислорода с простыми веществами или бинарными соединениями.
- Оксиды способны реагировать с водой, вступать в основно-кислотные взаимодействия и в окислительно-восстановительные реакции.
Проверь себя
Задание 1.
К какой группе оксидов относится CrO3?
- Основный
- Амфотерный
- Кислотный
- Несолеобразующий
Задание 2.
Какое агрегатное состояние имеет N2O5?
- Газ
- Жидкость
- Смесь газа и жидкости
- Твердое вещество
Задание 3.
Какое оксид невозможно получить взаимодействием простого вещества с кислородом?
- CuO
- Li2O
- NO
- SO3
Задание 4.
Какой из оксидов не реагирует с водой?
- N2O
- SO3
- BaO
- Na2O
Задание 5.
С каким веществом не реагирует угарный газ?
- Гидроксид натрия
- Соляная кислота
- Кислород
- Хлор
Ответы: 1. – 3; 2. – 3; 3. – 4; 4. – 1; 5. – 2.


 к списку статей
к списку статей





