Качественные реакции
На этой странице вы узнаете
- Какую роль в химии играет Роберт Бойль?
- Кому пришло в голову жечь соль?
- Дым без огня — бывает?
У каждого предмета в окружающем мире есть свой определенный признак: форма, цвет, вкус, запах и т.д. Например, мы можем запросто отличить шар от куба или соль от сахара.
Но в химии не все так просто. Отличать по вкусу опасно, а по форме — проблематично. Встает вопрос: что тогда делать? На помощь нам приходят качественные реакции.
Качественный анализ
Качественный анализ — это совокупность различных методов, которые применяются для определения элементов, ионов, радикалов и веществ, входящих в состав раствора или смеси.
| Какую роль в химии играет Роберт Бойль? Именно Роберт Бойль ввел в химию такое понятие, как качественный анализ. Он первым начал определять серную кислоту по белому осадку при добавлении извести, соляную кислоту по осадку при добавлении нитрата серебра, а соли меди — по синему окрашиванию. Роберт Бойль подарил нам химические индикаторы из отваров лишайника, фиалок и других растений. Подробно о химических индикаторах мы говорили в статье «Экспериментальные основы химии». Все эти исследования привели к формированию такой отрасли химической науки, как аналитическая химия. Аналитическая химия занимается изучением точного состава веществ, от которого зависят и свойства этих веществ. Нас повсюду окружают изделия, которые изготовлены из искусственно синтезированных материалов. Именно химики-аналитики знают, как сделать эти материалы прочными, устойчивыми к воздействиям окружающей среды, безопасными для человека. |

Итак, для определения наличия тех или иных ионов используются качественные реакции. Это реакции, при проведении которых мы можем наблюдать различные признаки, помогающие нам обнаружить вещества (или ионы) в присутствии других веществ в смеси.
Существует целый ряд признаков, по которым мы можем узнать, какое перед нами соединение:
- образование осадков различных цветов;
- растворение веществ;
- выделение газов и изменение запаха;
- окрашивание пламени.
Многие вещества можно обнаружить физическими методами, без проведения химической реакции. Например, катионы металлов.
Какого цвета огонь?
Желто-оранжевого скажете вы, еще бывает синего — в газовой плите.
А вы знаете как можно раскрасить пламя?
Пирохимический анализ — это определение наличия катионов путем сжигания исследуемого на наличие катиона вещества.
Разные катионы дают разную окраску пламени почти всех цветов радуги:
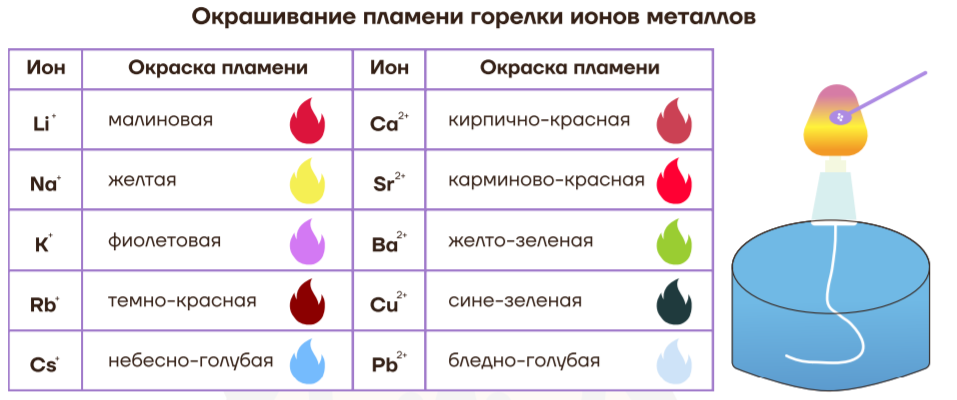
| Кому пришло в голову жечь соль? Немецкий химик Роберт Бунзен в 50-х годах 19 века изобрел свою собственную газовую горелку и принялся исследовать поведение различных химических веществ при нагревании и горении. Он сжигал металлы, соли, известь, уголь и вдруг обнаружил, что при горении поваренной соли NaCl, пламя пожелтело, а лаборатория наполнилась удушливым запахом хлора. Это было логично, ведь поваренная соль и состоит из хлора и натрия. Но что именно дало желтый цвет пламени: натрий или хлор? Бунзен решил взять соль натрия, которая уже не содержит хлор — пищевую соду, а затем и чистый металл натрий — в обоих случаях пламя горелки становилось желтым. Затем он начал исследовать соли других металлов: лития, калия и так далее. Все они давали разную окраску пламени. Бунзен систематизировал все полученные данные и открыл пирохимический анализ. |

Похожим образом могут быть определены некоторые газы, только вместо внесения вещества в огонь вносят тлеющую лучинку в газ. Тлеющая лучинка — это палочка или спичка, потушенные после горения и сохраняющие слабый огонек. При внесении ее в водород раздается глухой хлопок, а при внесении в кислород происходит вспыхивание и разгорание лучинки.
А теперь перейдем к определению ионов в растворе.
Качественные реакции в неорганике
Существуют отдельные способы распознавания катионов и анионов.
В таблице представлены основные качественные реакции на катионы.
| Катион | Реактив | Признак реакции (что наблюдаем) |
| Ba2+ | Ион SO42- | Выпадение белого осадка BaSO4 |
| Cu2+ | 1) Вода 2) Ионы ОН— | 1) Растворы солей меди имеют голубой цвет 2) Голубой осадок Cu(OH)2 |
| Pb2+ | Ион S2- | Выпадение черного осадка PbS |
| Ag+ | Ион Cl— | Выпадение белого творожистого осадка AgCl |
| Fe2+ | Красная кровяная соль, K3[Fe(CN)6] | Выпадение синего осадка KFe[Fe(CN)6] |
| Fe3+ | 1) Желтаякровяная соль, K4[Fe(CN)6] 2) Роданид-ион SCN— | 1) Выпадение синего осадка: KFe[Fe(CN)6] 2) Появление ярко-красного окрашивания |
| Al3+ | Щелочь (амфотерные свойства гидроксида) | Выпадение белого осадка гидроксида алюминия при добавлении первых порций щелочи и его растворение при дальнейшем добавлении в избытке щелочи. Поэтому при проведении реакций с солями алюминия очень важно добавлять щелочь по каплям и следить за осадком. |
| NH4+ | Щелочь при нагревании | Выделение NH3 — газа с резким неприятным запахом. |
| H+ | Индикаторы: лакмус, метилоранж | Красное окрашивание (кислая среда) |
Анионы можно определить следующими способами.
| Анион | Реактив | Признак реакции |
| SO42- | соли Ва2+ | Белый осадок BaSO4 |
| РО43- | ионы Ag+ | Светло-желтый осадок Аg3РO4 |
| СrO42- | ионы Ва2+ | Желтый осадок BaCrO4 |
| S2- | ионы Рb2+ | Черный осадок PbS |
| СО32- | ионы Са2+ | Белый осадок СаСО3 |
| SO32- | ионы Н+ | Выделение SO2 — газа с резким запахом |
| F— | ионы Са2+ | Белый осадок CaF2 |
| Cl— | ионы Аg+ | Белый творожистый осадок AgCl |
| Br— | ионы Аg+ | Светло-желтый осадок AgBr |
| I— | ионы Аg+ | Желтый осадок АgI |
| ОН— | индикаторы: а) лакмусб) фенолфталеин | Щелочная средаа) синее окрашиваниеб) малиновое окрашивание |
Качественные реакции в органике
В случае органических веществ мы уже определяем по признакам сами эти вещества, а не ионы или катионы:
| Органическое вещество | Реактив | Признак реакции |
| Алкены, алкины, алкадиены | а) Бромная вода Br2 (р-р) б) Перманганат калия KMnO4 | а) Обесцвечивание раствора б) Обесцвечивание раствора, выпадение осадка MnO2 |
| Алкины с тройной связью на конце цепи | Аммиачный раствор оксида серебра(I) [Ag(NH3)2]OH | Выпадение осадка соли серебра |
| Многоатомные спирты | Свежеосажденный гидроксид меди(II) Сu(OH)2 | Образование ярко-синего раствора |
| Фенолы | а) Бромная вода, Br2 (р-р) б) Раствор хлорида железа(III) FeCl3 | а) Выпадение белого осадка б) Образование фиолетового раствора |
| Альдегиды, муравьиная кислота, глюкоза | а) Свежеосажденный гидроксид меди(II) Сu(OH)2 при нагревании б) Аммиачный раствор оксида серебра(I), [Ag(NH3)2]OH при нагревании | а) Образование красного осадка Cu2O б) Выпадение осадка металлического серебра (реакция серебряного зеркала) |
| Карбоновые кислоты | а) Гидрокарбонат натрия (сода) NaHCO3 б) Лакмус | а) Выделение бесцветного газа СО2 б) Красное окрашивание |
| Белки | а) Азотная кислота, HNO3 б) Свежеосажденный гидроксид меди(II) Сu(OH)2 | а) Желтое окрашивание (ксантопротеиновая реакция) б) Образование фиолетового раствора (биуретовая реакция) |
| Крахмал | Раствор иода, I2 (р-р) | Синее окрашивание |
| Гомологи бензола | а) Раствор перманганата калия (KMnO4) в различных средах б) Раствор дихромата калия (K2Cr2O7) | а) В кислой среде обесцвечивание фиолетового раствора. В щелочной среде изменение окраски с фиолетовой на зеленую. В нейтральной среде обесцвечивание фиолетового раствора и выпадение бурого осадка MnO2. Для стирола и гомологов с метильными радикалами также выделение газа. б) Изменение окраски с оранжевой на сине-зеленую. Для стирола и гомологов с метильными радикалами также выделение газа. |
| Глюкоза и углеводы с альдегидным радикалом | а) Свежеосажденный Cu(OH)2 б) Cu(OH)2 при нагревании в) Аммиачный раствор оксида серебра г) Раствор Br2 | а) Ярко-синяя окраска раствора б) Выпадение кирпично-красного осадка Cu2O в) Блестящий налет серебра на стенках сосуда г) Обесцвечивание желто-коричневого (желто-оранжевого) раствора |
| Крахмал и полисахариды | Раствор I2 | Синее окрашивание |
| Дым без огня — бывает? Газ фосген C(O)Cl2 активно используется в органическом синтезе для производства красителей и поликарбоната. Он очень токсичен для человека, вдыхание паров концентрацией 5 мг/л приводит к смерти за 2—3 секунды. Фосген определяется своего рода качественной реакцией с аммиаком: COCl2 + 4NH3 = (NH2)2CO + 2NH4Cl Эту реакцию используют для быстрого обнаружения утечек фосгена. Смоченный в растворе аммиака листочек бумаги или ватный тампон начинает в присутствии фосгена выделять белый дым, который состоит из кристаллов хлорида аммония. |
Фактчек
- Качественные реакции — это такие реакции, которые позволяют обнаружить определенные вещества (или ионы) в присутствии других веществ в смеси.
- Обычно признаками качественных реакций служат выпадение осадка или выделение газа, обесцвечивание раствора или появление новой окраски, возникновение резкого запаха.
- Органических и неорганических веществ очень много, как и качественных реакций на них.
Проверь себя
Задание 1.
Качественной реакцией на катионы серебра является реакция с…
- нитрат-ионами
- кислородом
- хлорид-ионами
- фторид-ионами
Задание 2.
Какое окрашивание приобретает пламя при внесении в него катионов калия?
- красное
- фиолетовое
- голубое
- желтое
Задание 3.
Какое окрашивание приобретает раствор лакмуса в кислой среде?
- красное
- синее
- фиолетовое
- желтое
Задание 4.
Какой класс веществ может вступать в реакцию «серебряного зеркала»?
- альдегиды
- спирты
- алкены
- арены
Ответы: 1. — 3; 2. — 2; 3. — 1; 4. — 1.


 к списку статей
к списку статей





