Переходные элементы: медь, серебро, ртуть
На этой странице вы узнаете
- За что ценилась ртуть в Средневековье?
- Исчезла ли медь в конце Медного века?
- Почему серебро считается благородным?
За всю свою историю существования данные металлы, словно герои блокбастеров, прошли как взлеты: популярность, ценность и повсеместное использование, — так и падения. О том, какая судьба была уготована героям нашей статьи и как они существуют в современном мире, мы с вами сейчас и узнаем.
Общая характеристика
Что необходимо каждому человеку, где то место, в котором мы можем чувствовать себя уютно и комфортно? Конечно же речь идет про дом. Перед тем, как построить дом, необходимо заложить фундамент. Так и для того, чтобы построить картину физических и химических свойств тех или иных веществ, мы должны заложить фундамент, в случае химии металлов этот фундамент — знание их основных характеристик.
Медь — металл IB группы четвертого периода. Как и в случае других элементов побочных подгрупп, особенностью для нее является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях. У меди в электронной конфигурации наблюдается провал электрона.
Провал (проскок) электрона — переход электрона с внешнего энергетического уровня на предвнешний (нижележащий).
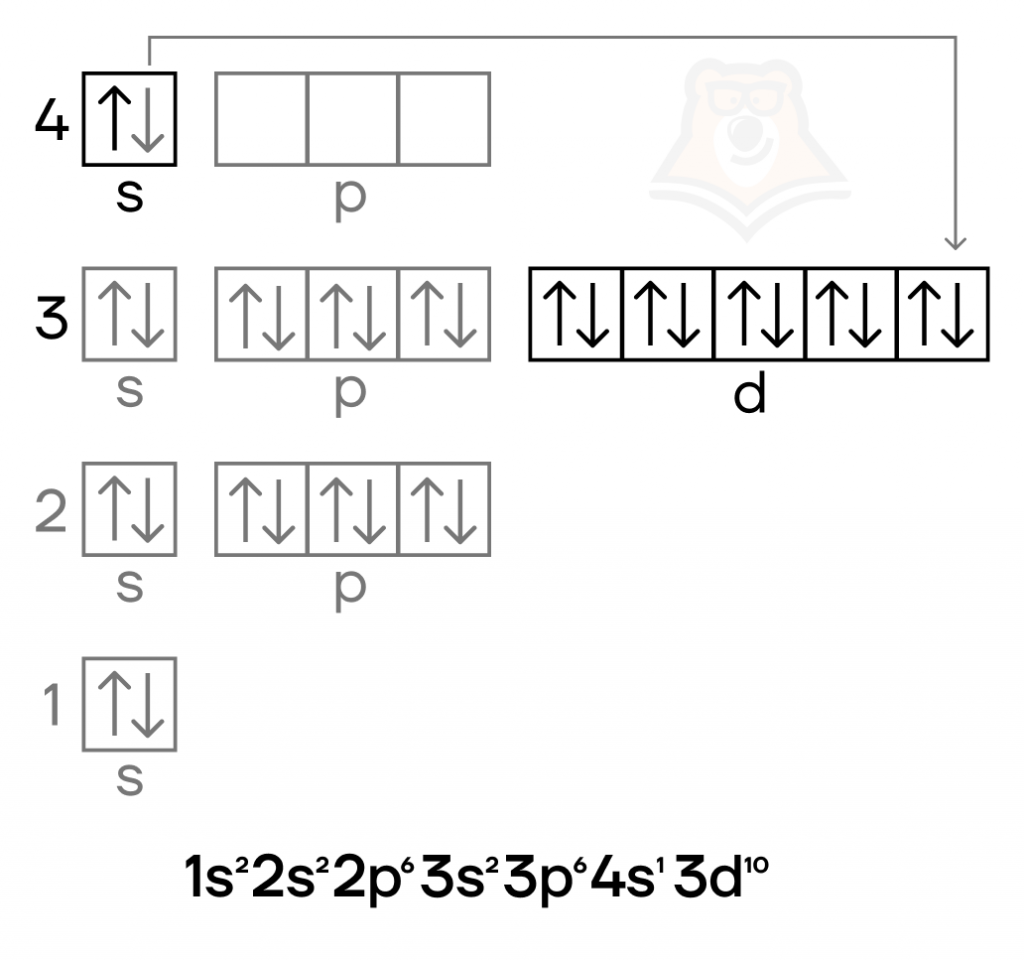
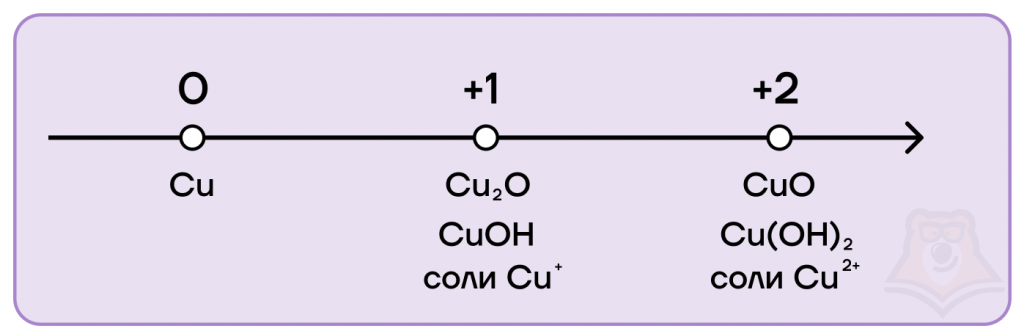
Степени окисления меди следующие:
- низшая степень окисления равна 0, как и у всех металлов;
- высшая равна +2;
- промежуточная равна +1.
Серебро — металл IB группы пятого периода. Валентные электроны у него располагаются как на внешнем (5s), так и на предвнешнем (4d) подуровнях, поэтому элемент располагается в побочной подгруппе. Как и у меди, в электронной конфигурации наблюдается провал электрона.
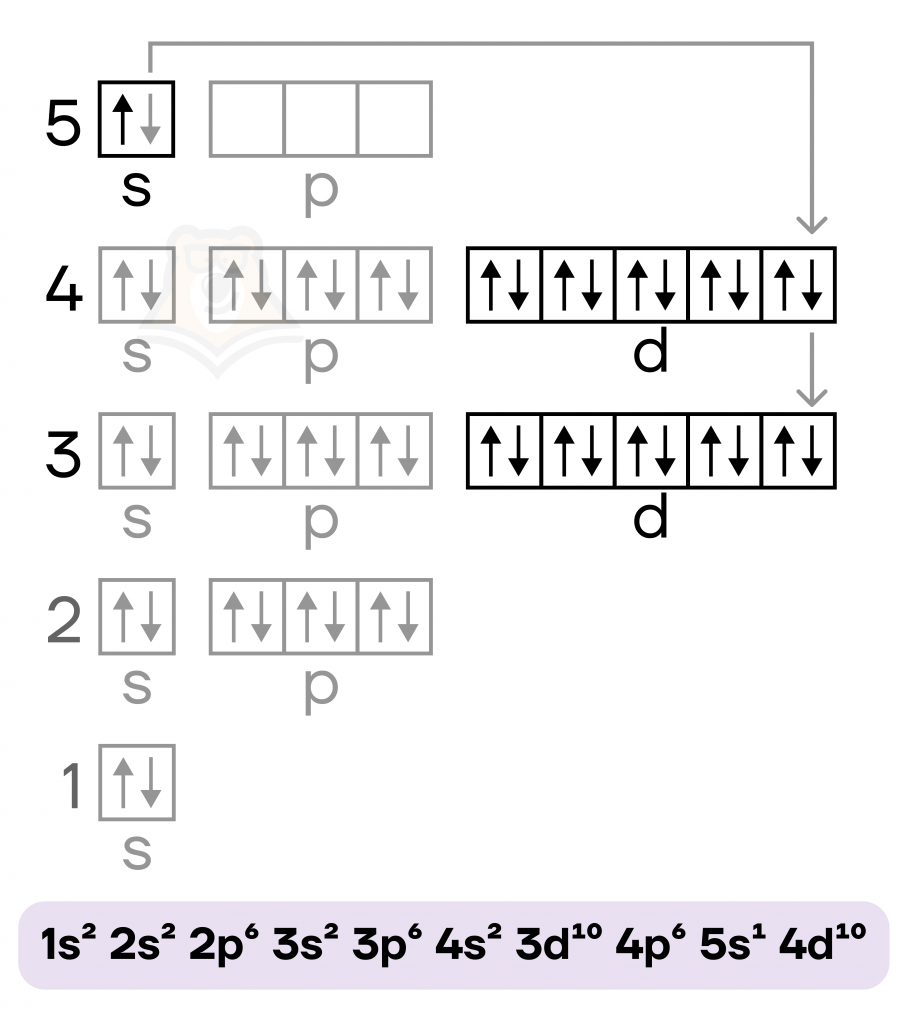
В соединениях серебро может иметь степени окисления 0 (в виде простого вещества) и +1. Возможны и другие степени окисления (+2 и +3), но в рамках школьной программы они не рассматриваются.
Ртуть — металл IIB группы шестого периода. Валентные электроны располагаются как на внешнем (6s), так и на предвнешнем (5d) подуровнях.
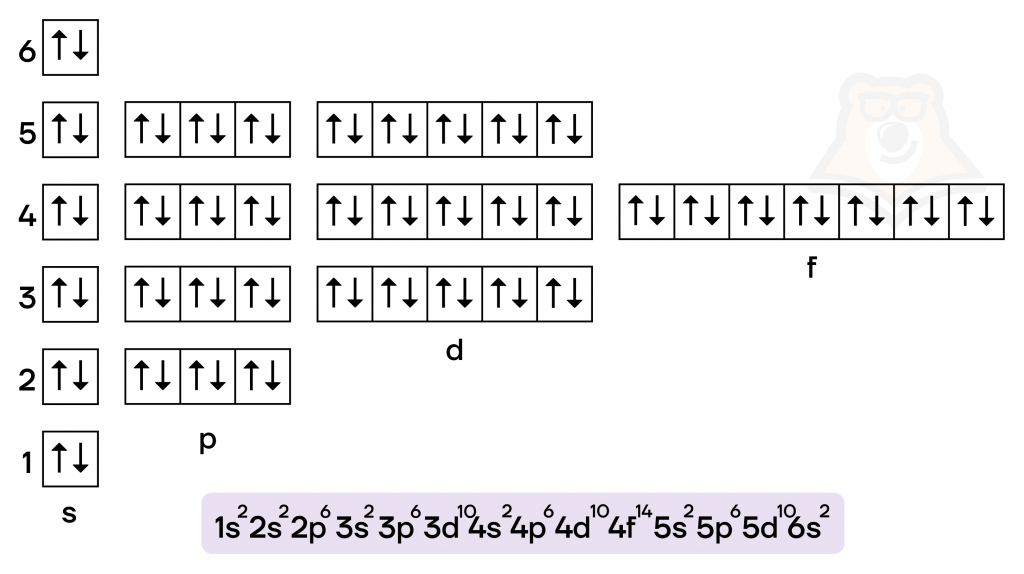
К степеням окисления ртути относятся степень окисления 0 (в виде простого вещества) и +2. Образование степени окисления +2 происходит путем перехода в возбужденное состояние, в таком состоянии один электрон с 6s- переходит на 6р-орбиталь, что дает ртути два неспаренных электрона.
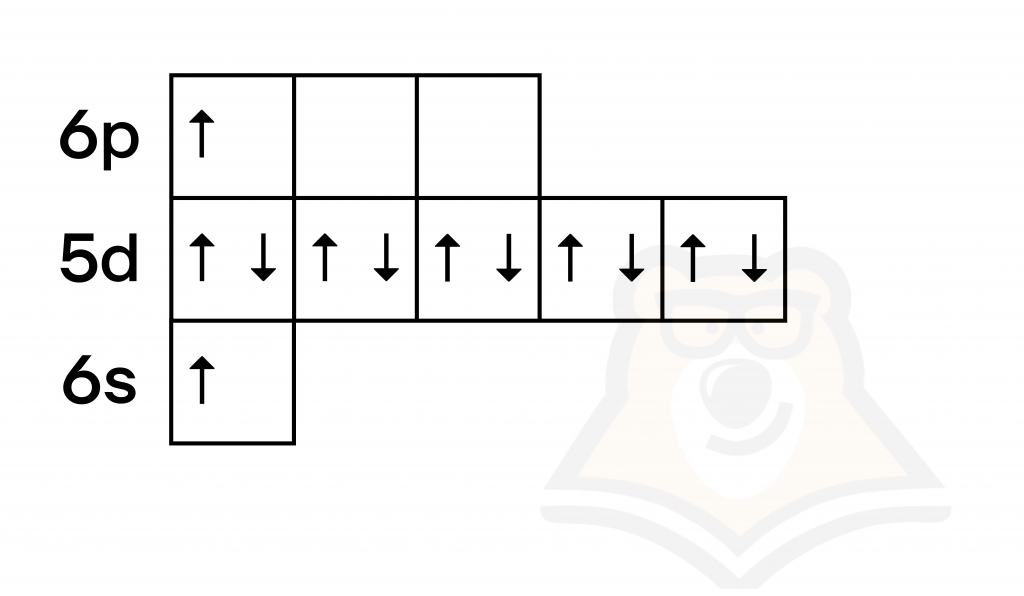
Подробнее о возбужденном состоянии в статье «Строение атома и электронные конфигурации».
Теперь, когда фундамент наших знаний заложен, можем перейти к строительству самого «здания»: разберем подробнее физические свойства и способы получения серебра, ртути и меди.
Физические свойства и способы получения металлов
По физическим свойствам медь, серебро и ртуть — довольно необычные металлы.
Ртуть — металл серебристо-серого цвета.

При нормальных условиях это единственный жидкий металл.
| За что ценилась ртуть в Средневековье? В настоящее время благодаря своему жидкому агрегатному состоянию и способности расширяться при воздействии температуры ртуть повсеместно используется в быту, а именно как часть ртутных термометров. Однако в Средние века взгляд на эту отличительную способность металла немного отличался: если ртуть жидкая, значит, ее можно пить. И не просто можно, а нужно! Данному металлу приписывалась способность лечить язвы, ее использовали вместо антибиотиков, которых тогда не было. На этом чудодейственные свойства не заканчивались. Красавицы Средневековья делали себе ртутные маски для блеска и гладкости кожи, а алхимики тем временем пытались получить из ртути золото. Безусловно, Средние века — лучшее время в «жизни» ртути. Но все в жизни меняется, так и представления о ценности данного металла подверглись изменениям. Сейчас мы знаем, что ртуть — крайне токсичное вещество, его попадание в организм вызывает отравление и может привести к смерти. Именно поэтому очень важно правильно действовать в случае повреждения ртутных термометров: — первым делом необходимо проветрить помещение, чтобы снизить концентрацию отравляющих паров; — при возможности необходимо надеть респиратор или медицинскую маску, при отсутствии данных средств защиты можно сделать их из бинта или марли; — надев перчатки, собираем осколки термометра, мелкие капли ртути можно поддеть листом бумаги, кисточкой, также можно попробовать собрать ртуть шприцом или медицинской грушей. Собранную ртуть нужно поместить в банку с холодной водой; — для ликвидации отходов нужно позвонить в 112 или привезти банку в МЧС. Главное помнить, что с ртутным термометром необходимо обращаться осторожно, чтобы подобные ситуации не возникли. |

Медь — металл красного цвета, это один из немногих металлов, имеющих яркую «окраску».

Серебро — серебристо-серый металл.

Данные металлы добываются в шахтах из различных минералов и руд. Например, ртуть добывается из такого красивого минерала, как киноварь, которая также использовалась в Средние века в качестве косметики и также приводила к отравлениям нарумяненных красавиц.

Медь и серебро добываются в медных и серебряных рудниках соответственно.
| Исчезла ли медь в конце Медного века? В далекие времена медь была настолько востребованным и необходимым металлом, что в честь нее впоследствии назвали целую историческую эпоху. Но в чем именно заключалась ценность меди, как люди обнаружили ее и почему ее век закончился? Впервые человечество познакомилось с медью через самородки — медные минералы, практически полностью состоящие из металла. И не обратить на эти самородки внимание было невозможно, потому что они были буквально повсюду. Люди создавали печи, растапливыемые углем и мхом, температура в которых достигала 1200оС и была достаточной для плавления меди. Расплавленную медь заливали в глиняные формы, делали из нее орудия труда, оружие, монеты — да вообще все, что было нужно для жизни. Но прогресс не стоит на месте: медь была слишком мягким металлом для использования во время войн и в мирное время, поэтому человечеству пришлось думать над тем, как сделать металл прочнее. История Медного века закончилась вместе с открытием сплавов меди с другими металлами, но это послужило началом новой эпохи — века Бронзового, в котором медь все так же была важна и необходима человечеству. Постепенно ресурсы земли уменьшались, за металлы, используемые в сплавах, разгорались войны. Новый металлический кризис привел к новому прорыву — открытию и использованию железа, началу Железного века. Сложно представить, что в современном мире страны воевали бы за медь или бронзу, но хоть этот металл уже не так необходим человечеству для существования, он все еще очень востребован. К основным сферам применения меди относятся электроэнергетика, производство труб и оружия. Вот так металл, за который раньше велись войны, стал оружием войн. |
Однако добычей минерала или руды все не ограничивается, в лабораторных условиях мы можем получить данные металлы путем электролиза — пропускания тока через раствор или расплав электролита.
Так как медь, серебро и ртуть относятся к неактивным металлам, мы можем их получить путем электролиза растворов солей. О том, почему это возможно, подробнее в статье «Электролиз расплавов и растворов (солей, щелочей, кислот)».
Безусловно, получение путем электролиза расплава также возможно, однако это более трудоемкий процесс, требующий большего количества сил и средств. Именно поэтому в рамках экзамена в тестовых заданиях мы выбираем электролиз растворов, а не расплавов солей.
4AgNO3 + 2H2O (эл-з) = 4Ag + O2 + 4HNO3
Ag+ + e = Ag0
Мы с вами разобрали физические свойства и способы получения металлов, наш дом знаний построен, в нем можно жить. Настало время знакомиться с соседями, а точнее изучить, как взаимодействуют ртуть, серебро и медь с другими и веществами.
Химические свойства металлов
В нашем доме сегодня собрались все самые известные классы веществ: простые вещества, кислоты, соли и некоторые другие. Как же пройдет знакомство наших металлов с ними: с кем получится подружиться, а с кем общение не пойдет? Сейчас узнаем.
- Взаимодействие с простыми веществами
Медь способна окисляться до разных степеней окисления в зависимости от силы окислителя или его количества (избытка/недостатка), степень окисления серебра и ртути остается постоянной.
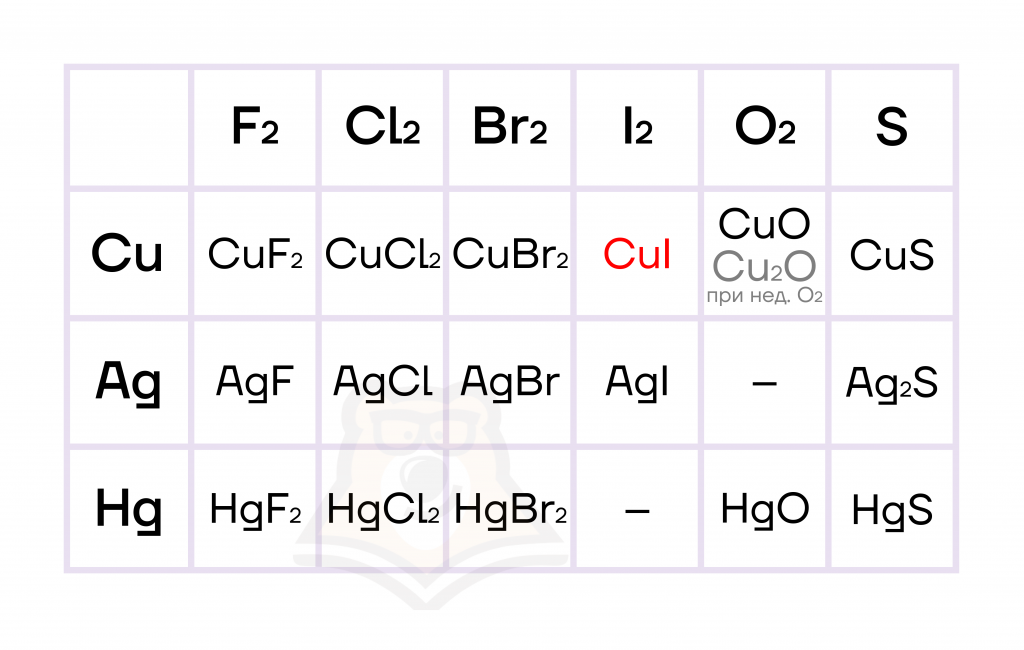
Ртуть не окисляется иодом, а серебро как типичный благородный металл не окисляется кислородом.
| Почему серебро считается благородным? В русском языке существует выражение «тридцать сребреников», которое обозначает цену предательства. Пока что звучит как-то неблагородно, да? К счастью, в химии понятие благородства относится не к каким-то моральным качествам, а к высокой химической стойкости: слабой подверженности коррозии (разрушению) и окислению. Благодаря этим свойствам серебро повсеместно используется в ювелирной промышленности, электротехнике, из него делают катализаторы и чеканят монеты. Также серебро находит свое применение в экономике не только в виде монет, но и в виде банковского вклада, то есть данный металл считается вариантом инвестиции. За много веков серебро прошло путь от металла, ассоциирующегося с предательством, до всеобще любимого материала, применяемого в разных сферах, а также гаранта финансовой стабильности. Ну и еще чеканной монетой можно заплатить Ведьмаку. |

- Реакция с водой
Медь, серебро и ртуть находятся в ряду активности после водорода, следовательно, они «слабее» водорода и не способны вытеснить такого сильного соперника.
Cu + H2O ≠
Ag + H2O ≠
Hg + H2O ≠

- Реакция с кислотами-неокислителями
Так же, как и в случае с водой, ртуть, медь и серебро не могут вытеснить «качка»-водорода из таких кислот.
Cu + HCl ≠
Ag + HBr ≠
Hg + H2SO4 (разб.) ≠
- Реакция с солями
Медь может вытеснять менее активные металлы из растворов их солей. Реакции вытеснения металлов из солей серебром и ртутью на экзамене практически не встречаются.
Cu + Ag2SO4 = CuSO4 + 2Ag
Cu + FeCl2 ≠
- Реакции с окислителями
Из-за низких значений электроотрицательности ртуть, серебро и медь являются типичными восстановителями, следовательно, они способны реагировать с окислителями.
Cu + 2H2SO4 (конц.) = CuSO4 + 2H2O + SO2
Cu + 2FeCl3= CuCl2 + FeCl2
Сu + N2O = CuO + N2
4Сu + 2NO2 = 4CuO + N2
2Ag + 2H2SO4 (конц.) = 2Ag2S + 2H2O, признак реакции — черный осадок Ag2S.
Для лучшего запоминания химических свойств переходных металлов решим вариант задания №7 ОГЭ, попрактикуемся на свойствах серебра.
Задание. Из предложенного перечня выберите два вещества, с которыми реагирует серебро.
1) H2O;
2) O2;
3) Cl2;
4) HCl;
5) H2SO4 (конц).
Решение. С водой (H2O) и кислотами-неокислителями (в данном случае с соляной кислотой HCl) серебро, как неактивный металл, не реагирует.
Серебро способно реагировать с неметаллами, однако реакция с кислородом не идет (помним, что серебро относится к благородным металлам). Берем в ответ только взаимодействие с хлором:
2Ag + Cl2 = 2AgCl
Реакция с кислотами-неокислителями не протекает, зато с окислителями спокойно идет:
2Ag + 2H2SO4 (конц.) = 2Ag2S + 2H2O.
Таким образом, нам подойдут варианты ответа 3 и 5.
Ответ: 35
Знакомство окончено, не со всеми веществами оно прошло гладко, однако, кажется, у наших металлов появился друг — это кислород. Теперь он живет вместе с металлами и их дружба «не разлей вода» (в прямом и переносном смысле). Давайте изучим эту компанию подробнее.
Оксиды и гидроксиды серебра, меди и ртути
При взаимодействии с кислородом серебро образует оксид серебра(I), а медь — оксид меди(I) и оксид меди(II). Данным оксидам соответствуют гидроксид серебра(I), гидроксид меди(I) и гидроксид меди(II).
Гидроксид меди(I) — крайне неустойчивый. Как и другие нерастворимые гидроксиды, при небольшом нагревании он способен разлагаться на соответствующий оксид и воду.
CuOH = Cu2O + H2O
Оксид меди(I) — красный, не растворимый в воде оксид.
За счет низкой степени окисления соединения меди(I) проявляют выраженные восстановительные свойства, повышая в ОВР степень окисления до единственной возможной +2.
2Cu2O + O2 = 4CuO
Сu2S + 2O2 = 2CuO + SO2
3Cu2O + 14HNO3(разб) = 6Cu(NO3)2 + 2NO + 7H2O
Cu2O + 6HNO3(конц) = 2Сu(NO3)2 + 2NO2 + 3H2O
По физическим свойствам оксиды меди(II) и серебра(I) — черные, не растворимые в воде вещества («серебро, свинец и медь: все мечтают почернеть…»), а гидроксид меди(II) — твердое нерастворимое вещество голубого цвета.
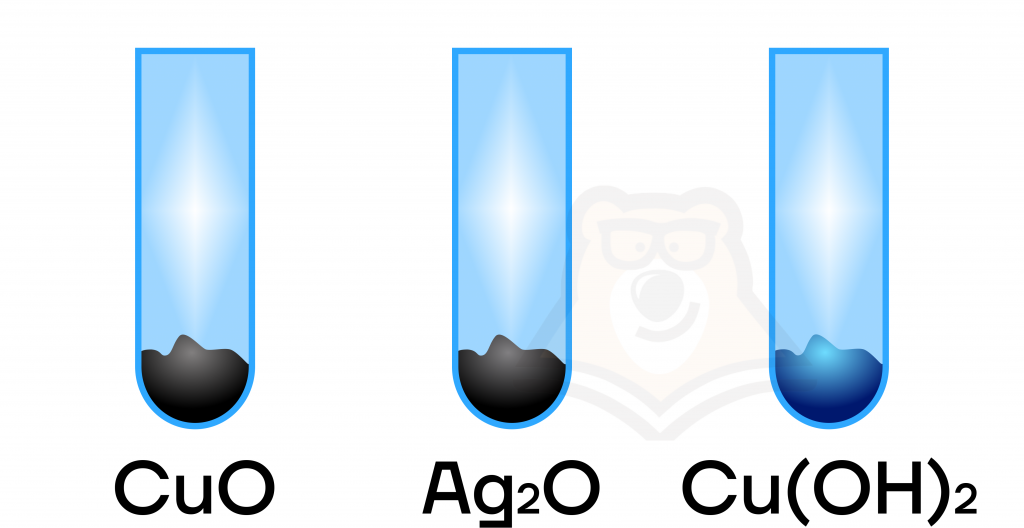
По химическим свойствам они представляют собой типичные основные оксиды и основания, а следовательно, способны вступать в основно-кислотные взаимодействия с кислотами и кислотными оксидами с образованием солей. Для гидроксидов этих металлов ввиду их нерастворимости также характерно термическое разложение.
- Взаимодействие с водой
Оксидам меди(II) и серебра соответствуют нерастворимые гидроксиды, поэтому взаимодействие с водой не идет:
CuO + H2O ≠
Ag2O + H2O ≠
- Реакции с кислотами и кислотными оксидами
Как типичные основные оксиды способны реагировать с кислотами и кислотными оксидами:
CuO + SO3 = CuSO4
Ag2O + 2HCl = 2AgCl + H2O
СuO + H2SO4 (разб.) = CuSO4 + H2O
- Окислительно-восстановительные реакции
В окислительно-восстановительных реакциях (ОВР) выступают в роли окислителя, так как чем дальше металл находится в ряду активности, тем более выражены окислительные свойства его катиона. Поэтому реагирует с восстановителями.
Ag2O + H2 = 2Ag + H2O
CuO + СО = Cu + СО2
- Комплексообразование
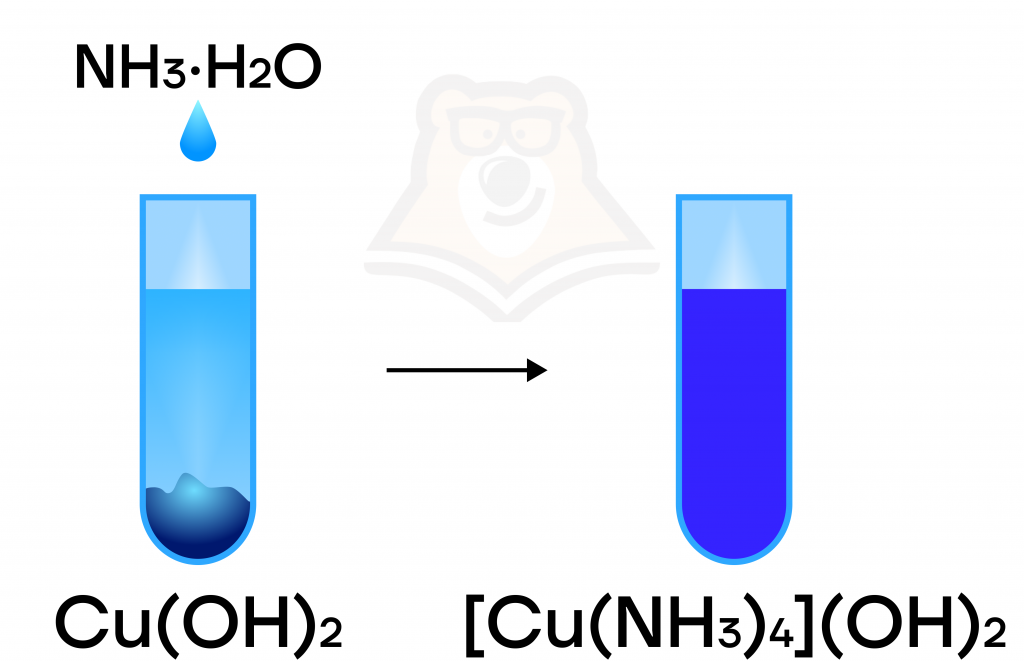
Оксид серебра(I), как и гидроксид меди(II), способен реагировать с раствором аммиака с образованием комплексной соли. При этом наблюдается растворение голубого осадка и образование ярко-синего раствора.
Ag2O + 4NH₃·H₂O = 2[Ag(NH3)2]OH
Cu(OH)2 + 4NH₃·H₂O = [Cu(NH3)4](OH)2 + 4H2O
- Термическое разложение
Гидроксид меди(II), а также оксиды серебра и ртути при нагревании разлагаются с образованием чистого серебра и кислорода.
Cu(OH)2 (t) = CuO + H2O
2Ag2O (t) = 4Ag + O2
HgO (t) = 2Hg + O2
Гидроксид серебра(I), как и гидроксид ртути(II), являются очень неустойчивыми соединениями и при комнатной температуре разлагаются до оксида и воды.
2AgOH = Ag2O + H2O
Hg(OH)2 = HgO + H2O
Если гидроксид образуется в реакции ионного обмена, он также мгновенно распадается.
2NaOH + 2AgNO3 = 2NaNO3 + Ag2O + H2O
2NaOH + Hg(NO3)2 = 2NaNO3 + HgO + H2O

Важно запомнить, что хоть гидроксид серебра(I) и неустойчив, соли, образованные им будут считаться солями, образованными сильным основанием. Звучит странно, да? На самом деле тот непродолжительный миг, что гидроксид существует до распада, он отлично диссоциирует в растворе, поэтому относится к сильным электролитам и сильным основаниям.
После изучения свойств соединений серебра, меди и ртути можем закрепить полученные знания, решив задание №9 ЕГЭ.
Задание. Задана следующая схема превращений веществ:AgNO3 + KOH ⟶ Х + Y ⟶ AgCl
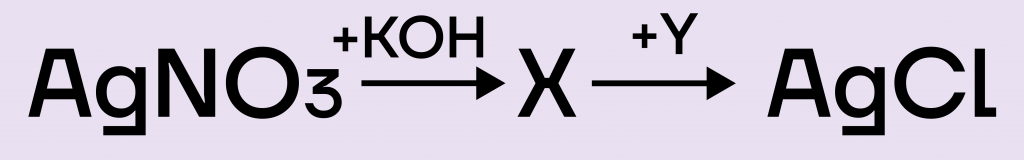
Определите, какие из указанных веществ являются веществами X и Y.
1) Ag(OH)2;
2) Cl2;
3) HCl;
4) Ag2O;
5) КCl.
Решение. Взаимодействие между нитратом серебра(I) и щелочью относится к реакциям ионного обмена (РИО).
AgNO3 + KOH =AgOH + KNO3
Вспомним, что гидроксид серебра(I) неустойчив и распадается на соответствующий оксид и воду.
2AgOH = Ag2O + H2O
Подставим продукты распада в исходную реакцию ионного обмена и получим:
2КOH + 2AgNO3 = 2КNO3 + Ag2O + H2O
Таким образом, вещество Х — это оксид серебра(I) Ag2O.
Хлор не способен вытолкнуть кислород из оксида, поэтому вариант ответа под цифрой 2 отметаем.
Оксид серебра(I) — соединение не растворяется в воде, поэтому оно не вступает в РИО, зато оно растворяется в кислотах.
Ag2O + 2HCl = 2AgCl + H2O
Под Y скрывалась соляная кислота.
Ответ: 43
Химические свойства переходных металлов и их соединений — очень важный и интересный раздел неорганической химии, знание которого может дать нам баллы как в первой, так и во второй частях экзамена. А для лучшего понимания свойств переходных металлов рекомендуем ознакомиться со статьей «Переходные металлы: хром, железо, марганец».
Термины
Восстановители — это соединения, отдающие электроны в окислительно-восстановительных реакциях, при этом сами они повышают свою степень окисления.
Окислители — это соединения, охотно принимающие электроны в окислительно-восстановительных реакциях, при этом сами они понижают свою степень окисления.
Степень окисления (СО) — это условный заряд атома элемента, вычисленный на основе предположения, что все связи в данном соединении являются ионными (показывает, сколько электронов атом «притянул» или, наоборот, «отдал» при образовании химической связи).
Фактчек
- Медь, серебро и ртуть относятся к переходным металлам, то есть таким, которые расположены в побочных подгруппах больших периодов. Возможные степени окисления меди: 0, +1, +2; серебра: 0, +1, ртути: 0, +2.
- Ртуть — единственный жидкий при нормальных условиях металл, а медь окрашена в красный цвет.
- Ртуть, серебро и медь способны реагировать с простыми веществами, солями и окислителями, взаимодействие с водой и кислотами-неокислителями не идет. В реакции с кислородом образуются оксиды.
- Оксиды и гидроксиды данных металлов способны реагировать с кислотами и вступать в ОВР.
Проверь себя
Задание 1.
У атома какого химического элемента не наблюдается «проскок» электрона?
- Серебро
- Медь
- Ртуть
- Все вышеперечисленные имеют «проскок»
Задание 2.
С какой солью будет реагировать медь?
- Хлорид натрия
- Сульфат ртути(II)
- Хлорид железа(II)
- Фосфат кальция
Задание 3.
Для какого металла характерна степень окисления только +2?
- Ртуть
- Медь
- Серебро
- Медь и серебро
Задание 4.
Какое вещество разлагается без нагревания?
- Оксид серебра(I)
- Гидроксид меди(II)
- Гидроксид ртути(II)
- Оксид ртути(II)
Ответы: 1. – 3; 2. – 2; 3. – 1; 4. – 3.


 к списку статей
к списку статей






