Однородные и неоднородные системы. Растворы
На этой странице вы узнаете
- Можем ли мы назвать суп раствором?
- Из-за чего вода в морях замерзает медленнее, чем в пресных водоемах?
- Какие системы можно встретить на кухне?
Однородные и неоднородные системы — это то, что окружает нас повсюду: от кухни до химической лаборатории. Сегодня мы подробнее изучим эти понятия и потренируемся находить и классифицировать разные системы вокруг нас.
Однородные и неоднородные системы
В повседневной жизни мы очень часто сталкиваемся с однородными и неоднородными системами. К примеру, кто-то каждое утро пьет однородную систему (кофе), а кто-то после учебы ходит поесть неоднородную систему (куриный супчик). Разберемся, что же такое однородные и неоднородные системы.
Однородная система — система, химический и физический состав которой во всех частях одинаков, при этом отсутствует видимая граница разделения компонентов системы.
Неоднородная система — система, химический и физический состав которой в разных частях неодинаков, при этом компоненты системы можно различить визуально.
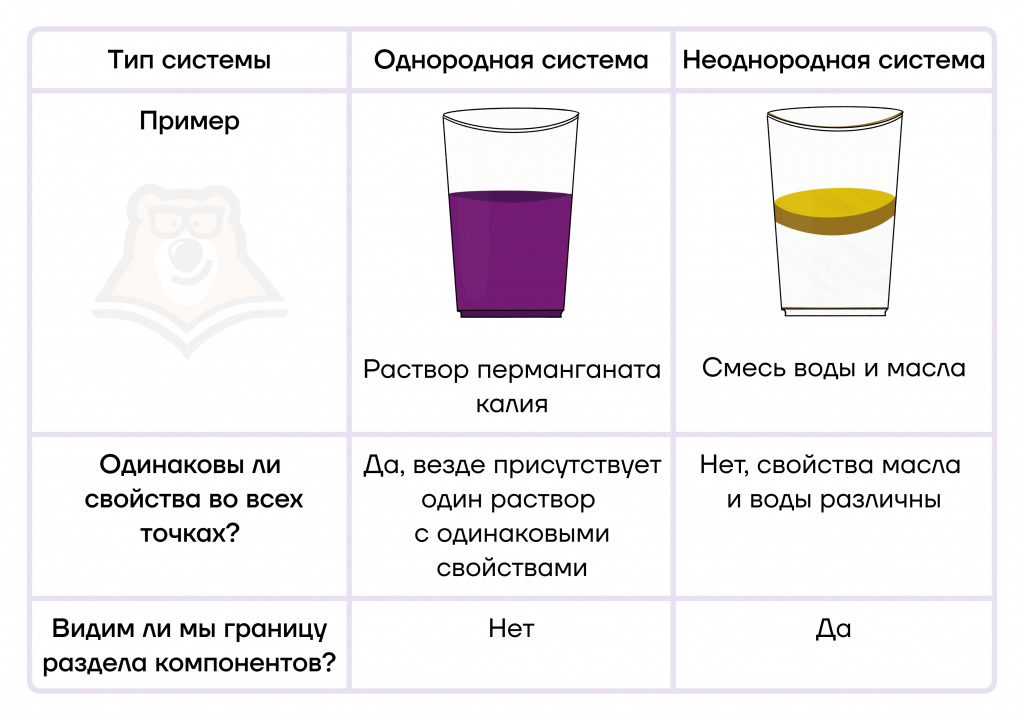
Граница разделения компонентов также называется поверхностью раздела фаз.
Фаза — совокупность всех частей системы, обладающих одинаковыми физическими и химическими свойствами во всех точках, и отделенная от других частей системы поверхностью (границей) раздела.
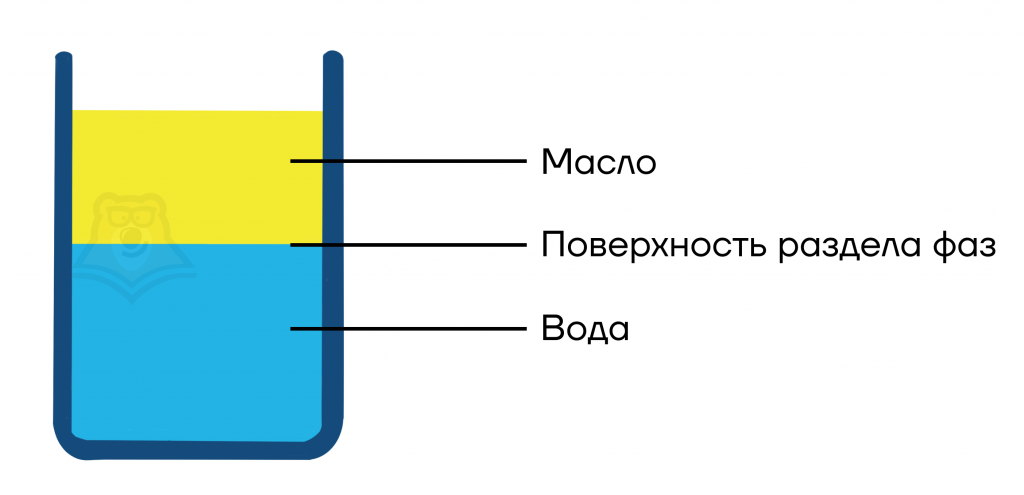
Из чего состоит однородная система только что проснувшегося человека? Кофе+сахар. Кофе — раствор, поэтому он сам по себе однородный. А вот сахар — твердое вещество. Но он полностью растворяется в кофе, поэтому в итоге мы получаем однородную систему — раствор.
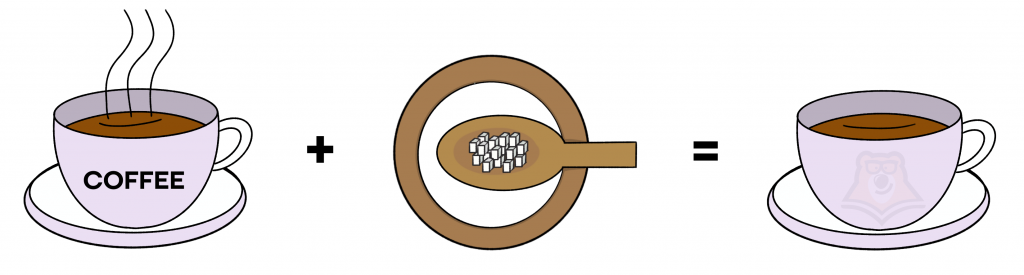
Из чего состоит неоднородная система, о которой мечтает голодный ученик? Бульон + курица + овощи. Получается неоднородная смесь, мы видим каждый ингредиент отдельно. Поэтому это и будет неоднородной системой.

Лайфхак для определения типа системы: если мы видим хотя бы один твердый реагент (вещество, вступающее в реакцию), то это точно неоднородная система.
Итог: в однородной системе все компоненты не различимы (сразу вспоминаем кофе с сахаром), а в неоднородной различимы (суп с овощами).
| Можем ли мы назвать суп раствором? Казалось бы, суп жидкий, в нем есть какие-то добавленные компоненты, а значит, он является раствором. Но тут все не так просто. Как уже было сказано, раствор — это однородная система, то есть мы не сможем визуально разделить компоненты этой смеси. Однородные системы также называются гомогенными. Если же мы посмотрим на суп, то увидим неоднородную систему из овощей, мяса и бульона. Бульон в свою очередь состоит из подсоленной воды и масла, через некоторое время он самостоятельно разделится на капельки масла и основной слой воды. То есть из-за своей неоднородности суп не может быть назван раствором. Неоднородные системы также называются гетерогенными. А если мы так хотим превратить суп в раствор, то для этого нам надо превратить его в однородную систему, то есть отобрать только жидкую часть. |

Однородные и неоднородные системы идут рука об руку с понятиями смесей и чистых веществ.
Чистые вещества — это вещества, состоящие из молекул или атомов одного типа.
Смесь — это система, состоящая из нескольких веществ, частицы которых разного типа.
Чистые вещества всегда однородны и, в отличие от большинства смесей, имеют определенный химический состав и постоянные физические свойства. Смеси же состоят из нескольких веществ и их свойства могут меняться в зависимости от различных параметров. Чистым веществом будет, например, поваренная соль, а вот смесью — раствор соли.

Решим аналог задания №16 ОГЭ по химии, так как при его решении может пригодиться информация об однородных и неоднородных системах, а также о чистых веществах и смесях.
Задание. Из перечисленных суждений о чистых веществах и смесях выберите одно или несколько верных.
1) Кофе является смесью веществ.
2) Прозрачный виноградный сок является чистым веществом.
3) Майонез является смесью веществ.
4) Суп является однородной смесью.
Запишите в поле ответа номера верных суждений.
Решение. Разберем последовательно каждое высказывание.
1) Кофе — смесь веществ, так как это раствор, состоящий из воды и растворенных кофейных зерен. Вариант ответа нам подходит.
2) Виноградный сок — смесь веществ, так как это раствор, состоящий из воды и сока винограда. Этот вариант ответа нам не подойдет.
3) Майонез — это смесь веществ, так как в его состав входят жир, яичный желток, соль, уксус и др. Верный вариант ответа.
4) Суп — это неоднородная смесь, так как мы видим ее компоненты. Ответ неверный.
Ответ: 13

А теперь перейдем к первому компоненту нашей темы — однородным системам, а точнее к растворам.
Однородные системы. Растворы
Растворы являются самым частым примером однородных систем. Что же это такое?
Раствор — однородная система, состоящая из нескольких веществ: растворенного вещества и растворителя (чаще всего воды).

Насыщенность раствора напрямую зависит от растворимости вещества.
Растворимость — характеристика раствора, которая показывает, какая масса (или объем для газов) растворенного вещества (mв-ва) может максимально раствориться в 100 г растворителя (mр-ля).
\(χ =\frac{m в-ва}{m р-ля} *100%\)
Важно отметить, что вещество, которое преобладает в растворе, — это растворитель.
Чаще всего в роли растворителя используется вода. Растворители можно разделить на полярные и неполярные, чаще всего мы встречаемся именно с полярными растворителями.
Полярный растворитель — это жидкое при нормальных условиях (н. у.) вещество, в молекуле которого присутствует атом очень электроотрицательного элемента (F, O, N, Cl, Br).
Полярными растворителями являются, например, вода, метанол, уксусная кислота и т.д.
Раствор обладает массой, которую мы можем найти по формуле mр-ра = ρV, то есть масса раствора находится как произведение плотности раствора и объема этого раствора.
Можем решить и обратную задачу: если нам дана масса и объем, то можем найти плотность.
Плотность — отношение массы (m) раствора к его объему (V).
\(ρ =\frac{m}{V}\) [г/мл]
Что еще важно знать о растворах? У них есть определенная концентрация, которая может быть выражена в нескольких формах.
Массовая доля вещества — отношение массы вещества (mв-ва) к массе всего раствора (mр-ра).
\(ωв-ва =\frac{m в-ва}{m р-ра} * 100%\) [безразмерная или в процентах]
При делении двух этих величин мы получим десятичную дробь в промежутке от 0 до 1, чтобы перевести это число в проценты, нужно просто умножить его на 100.
Концентрация раствора (молярная) — количество вещества (n), которое находится в единице объема раствора (Vр-ра).
\(C =\frac{n}{Vр-ра}\) [моль/л]
Концентрация раствора (моляльность) — количество вещества (n), которое находится в 1000 г (1 кг) растворителя.
\(Cm=\frac{n}{mр-ля}\) [моль/кг]
Титр — это отношение массы (mв-ва) вещества к объему раствора (Vр-ра).
\(Т =\frac{m в-ва}{V р-ра}\) [г/л]
| Из-за чего вода в морях замерзает медленнее, чем в пресных водоемах? Концентрация раствора влияет на некоторые его физические свойства, например, на температуру кипения (перехода в парообразное состояние) или температуру кристаллизации (перехода в твердое состояние). Чем выше концентрация растворенного вещества, тем ниже температура кристаллизации раствора. Воды океана имеют более высокую концентрацию соли, чем пресные воды, и потому замерзают при более низкой температуре. Мы знаем, что обычная вода замерзает при 0°C, а вот воды Мирового океана переходят в состояние льда при температуре около -1,8°C. Проверить данный факт мы можем и в домашних условиях, для этого нам потребуется бутылка с дистиллированной водой и бутылка с подсоленной водой. Оставив обе бутылки в морозилку, через некоторое время мы заметим, что дистиллированная вода замерзает быстрее. |

Теперь, когда мы уже поговорили об однородных системах, можем перейти к их противоположностям — неоднородным системам.
Неоднородные системы
Чаще всего среди неоднородных систем рассматриваются дисперсные системы и их подвид — коллоидные системы.
Дисперсная система — система, состоящая из двух или большего числа фаз, которые практически не смешиваются и не реагируют друг с другом химически.
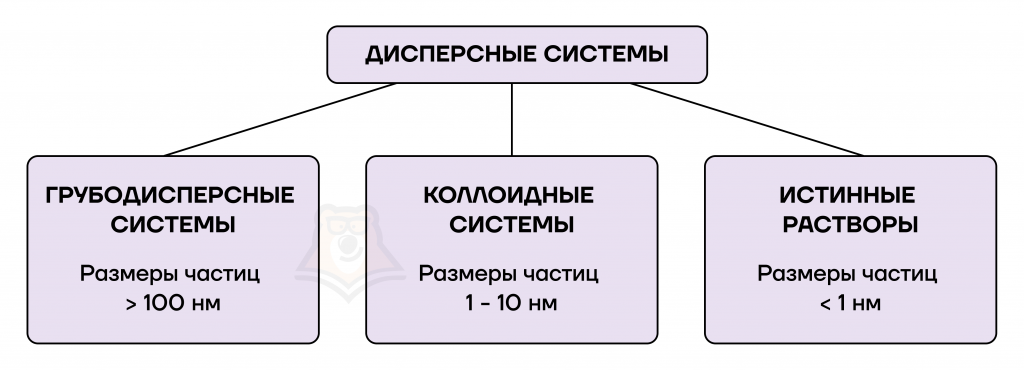
Коллоидные системы — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами, в которых частицы, капли или пузырьки дисперсной фазы имеют размер от 1 до 100 нм.
| Какие системы можно встретить на кухне? Молоко и сливки можно рассматривать как коллоидные системы, состоящие из дисперсной среды и дисперсной фазы. Белки находятся в среде молока как дисперсная фаза, а молочный жир присутствует в виде эмульсии. Майонез — пищевой продукт, представляющий собой дисперсную водно-жировую эмульсию типа «масло в воде», в которой в качестве дисперсной фазы распределено растительное масло, а в водной среде растворены вкусовые добавки. К коллоидным системам относят также гели: холодец, мармелад, агар-агар, желатин и др. |
Рассмотрим различные вариации дисперсных систем, фиолетовым цветом в тексте выделены коллоидные системы.
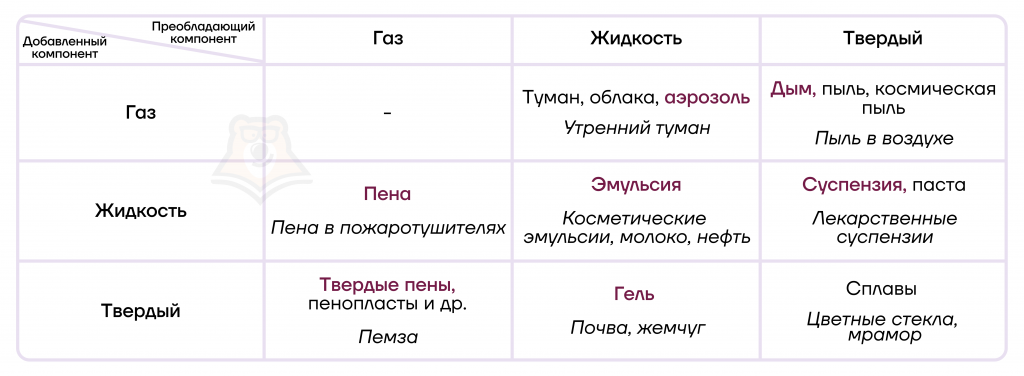
А теперь попрактикуемся!
Закрепим материал на практике, а для этого решим нетипичный аналог задания №6 ЕГЭ по химии.
Задание. В двух пробирках находился раствор соляной кислоты. В первую пробирку добавили раствор вещества Х, а во вторую — раствор вещества Y. В первой пробирке образовалась коллоидная система, а во второй сохранилась однородная система. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) KOH
2) Ba(NO3)2
3) AgNO3
4) AgI
5) BaSO4
Решение. Образование коллоидной системы в первой пробирке свидетельствует о выпадении осадка, соляная кислота при взаимодействии с растворимыми в кислотах солями серебра как раз даст нам осадок хлорида серебра (AgCl). Выберем нитрат серебра, так как иодид не растворяется в кислотах.
НСl + AgNO3 = AgCl + HNO3
Во второй пробирке сохранилась однородная система, то есть выпадения осадка или выделения газа не наблюдалось. Без подобных признаков протекает реакция со щелочью (КОН).
KOH + HCl = KCl + H2O
Таким образом, Х — это нитрат серебра, а Y — гидроксид калия.
Ответ: 31
Сегодня мы открыли для себя мир однородных и неоднородных систем, поближе познакомились с растворами и изучили коллоидные и дисперсные системы. Химия — очень интересная наука и многие ее аспекты важны не только в пределах лаборатории, но и в обычной жизни. А о том, как знания химии применяются в промышленности, можно прочитать в статье «Общие представления о промышленных способах получения важнейших неорганических веществ. Часть 1».
Фактчек
- Все химические системы можно разделить на однородные и неоднородные в зависимости от количества фаз, а также на чистые вещества и смеси.
- К однородным системам относятся растворы, основной характеристикой которых является концентрация в разных видах: молярная концентрация, массовая доля, моляльность и титр.
- Неоднородные системы включают в себя дисперсные системы и их подвид — коллоидные системы.
- Различные коллоидные системы окружают нас повсюду, в том числе в быту.
Проверь себя
Задание 1.
Что не является однородной системой?
- Раствор поваренной соли
- Кусочек сахара
- Воздух
- Туман
Задание 2.
Какое из веществ является смесью?
- Дистиллированная вода
- Поваренная соль
- Яблочный сок
- Глюкоза
Задание 3.
Что из перечисленного не относится к способам выражения концентрации?
- Моляльность
- Титра
- Массовая доля
- Плотность
Задание 4.
Какая из указанных дисперсных систем не является коллоидной?
- Паста
- Суспензия
- Эмульсия
- Гель
Ответы: 1. — 4; 2. — 3; 3. — 4; 4. — 1.


 к списку статей
к списку статей





