Особенности строения электронных оболочек атомов элементов
На этой странице вы узнаете:
- В атомах химических элементов есть свои уровни комфортности?
- Химические элементы делятся на семейства? Это что, биология какая-то?
- Как переходные металлы помогают нам жить?
Сейчас в обществе все больше набирает оборот модный тренд — минималистичный образ жизни. Как в фильме «Сто вещей и ничего лишнего». Главные герои — два закадычных друга — решили на спор отказаться от всех своих вещей (абсолютно всех, включая одежду и телефон). Спустя время, преодолев череду проблем, они поняли, что вещи — это не главное в жизни.

Видимо, по такому принципу «живет» хорошо нам знакомый товарищ — водород. У него всего один электрон, который почти всегда на своем месте. А как быть, например, с атомом хлора, у которого их аж 17, ведь их надо содержать в порядке? Сейчас мы с вами узнаем, как располагаются электроны в электронной оболочке атома и многое другое.
Строение электронной оболочки атома
Строение электронной оболочки атома напрямую зависит от положения элемента в Периодической системе.
Как нам поможет Периодическая таблица химических элементов Д.И. Менделеева при заполнении схемы строения электронных оболочек атомов?
- Число электронов в атоме химического элемента равно его порядковому номеру в Периодической системе Д. И. Менделеева.
- Количество уровней совпадает с номером периода, в котором располагается элемент: 1, 2, 3…
- Количество электронов на внешнем энергетическом уровне для элементов главных (A) подгрупп можно также легко узнать — в какой группе по номеру расположен химический элемент, столько электронов и будет находиться на его внешнем уровне.
- Для элементов побочных подгрупп количество электронов на внешнем энергетическом уровне равно двум, так как большая часть электронов расположена на предвнешнем уровне. Исключениями являются медь, серебро, хром, золото и некоторые другие элементы. Подробнее о том, почему так, поговорим ближе к концу статьи.
- Количество валентных электронов для элементов главных (A) подгрупп равно номеру группы, для элементов побочных подгрупп — числу электронов на внешнем энергетическом уровне и незаполненном предвнешнем d-подуровне.
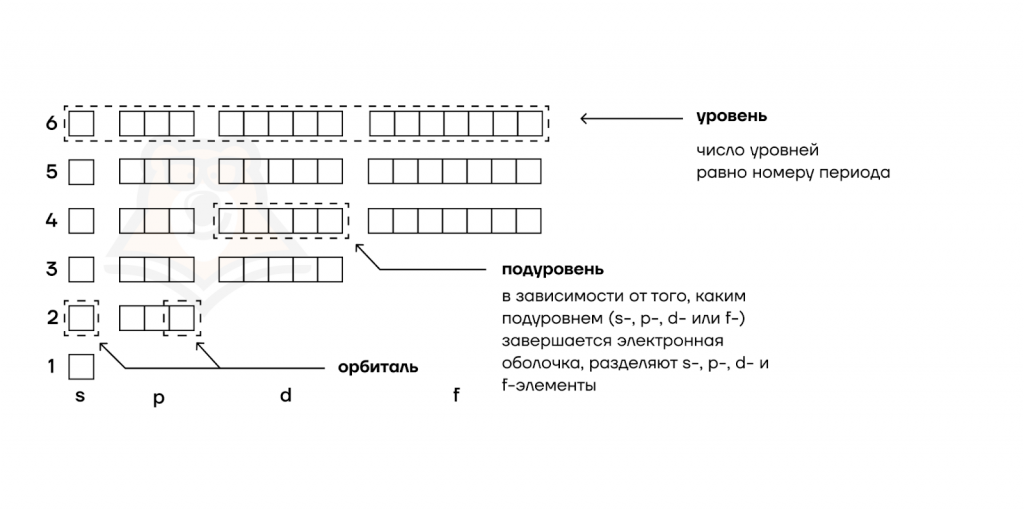
Это можно использовать для проверки своих действий при распределении электронов по уровням.
Уже сейчас, используя полученную информацию, мы можем решить задание №2 ОГЭ по химии.
Задание. На приведенном рисунке изображена модель атома химического элемента.
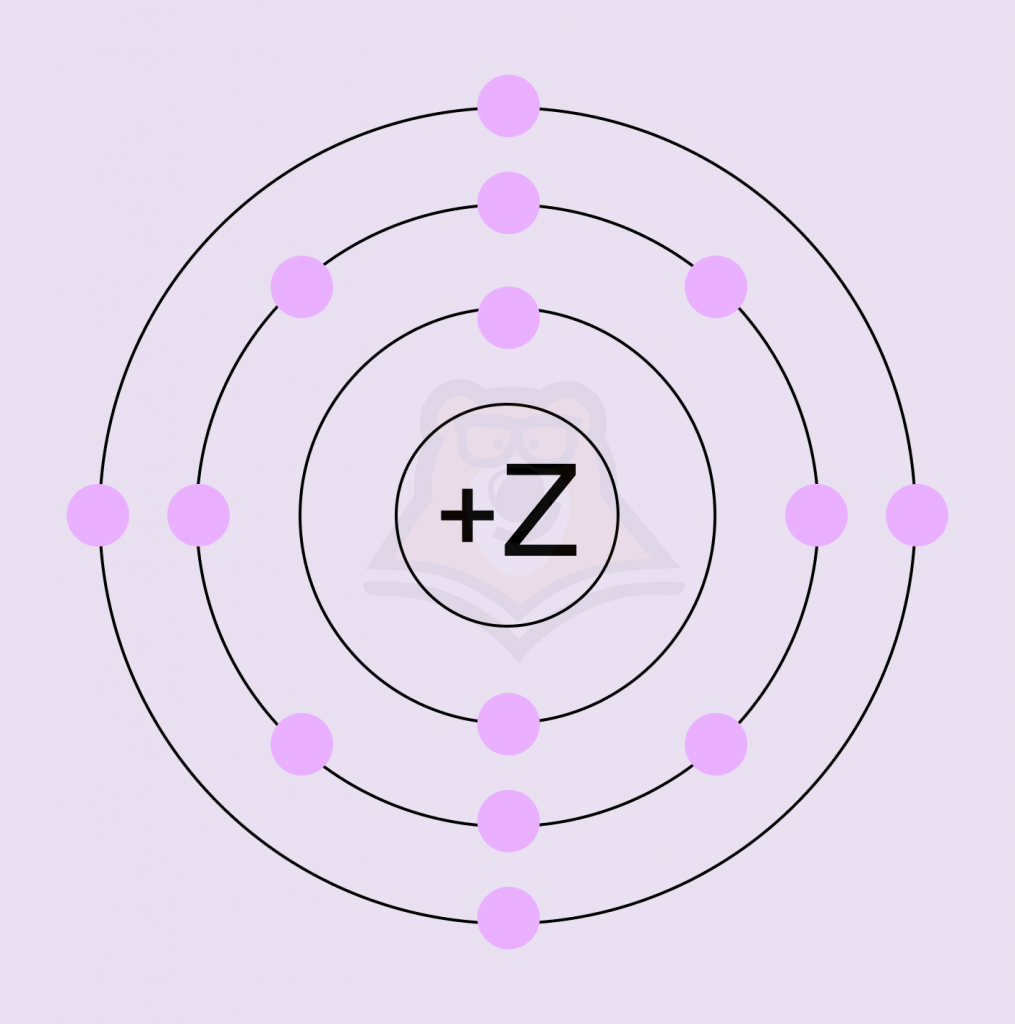
Запишите в таблицу порядковый номер в Периодической системе (Х) химического элемента, модель атома которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе.
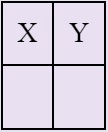
Решение:
1) Порядковый номер химического элемента в Периодической системе можно определить по числу электронов в атоме. Сосчитав все электроны, получаем, что их 14 штук, следовательно, X — 14.
2) Номер группы Периодической системы, в которой расположен химический элемент, можно узнать по числу электронов на его внешнем электронном уровне. Сосчитав их, получим, что их 4 штуки, следовательно, Y — 4.
Ответ: 144
Теперь, когда у нас есть общие представления о строении электронной оболочки, кратко разберем порядок заполнения электронных уровней, подуровней и оболочек.
Электронная конфигурация атома
Для изображения строения электронных слоев атома (электронной конфигурации) пользуются условной записью. Вспомнить о том, что такое электронная конфигурация и как она заполнятся, можно, прочитав статью «Строение атома и электронные конфигурации».
Удобно представлять атомные орбитали в виде ячеек, в которых располагаются два электрона, их обозначаем в виде двух стрелочек, первая направлена вверх, а вторая — вниз. В одной ячейке может быть не более двух электронов.

Разберем подробнее на примере.
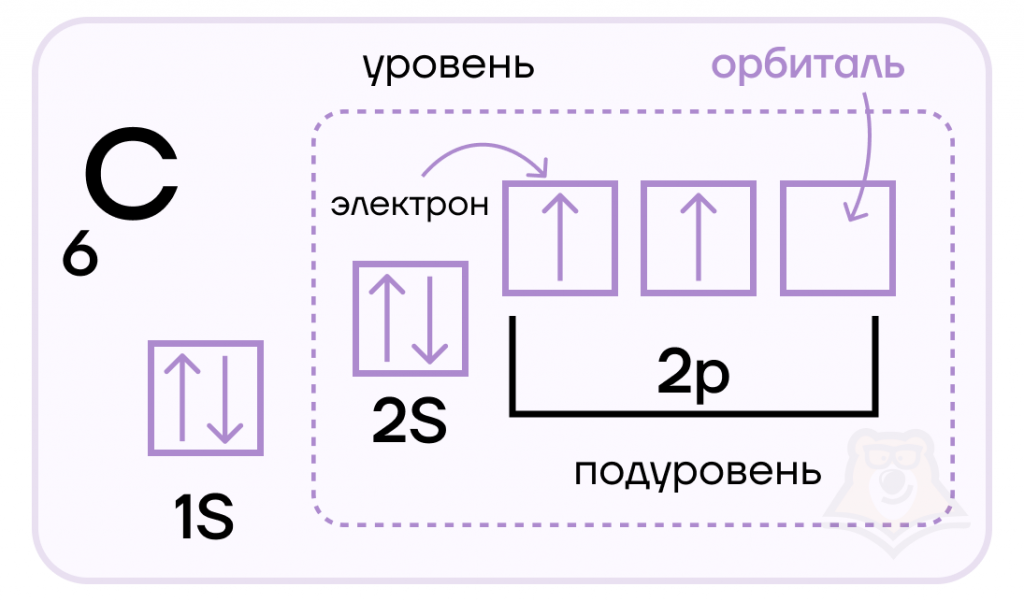
Например, на изображении представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы.
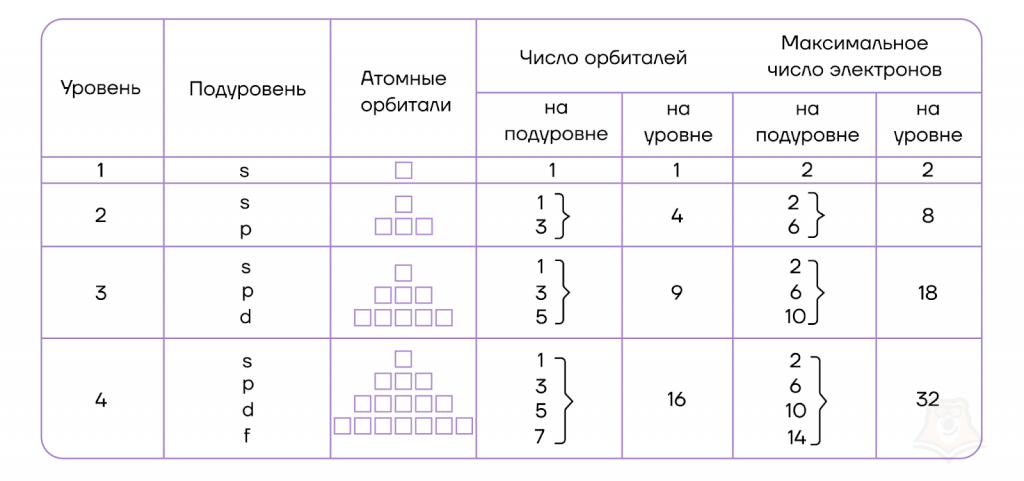
| В атомах химических элементов есть свои уровни комфортности? Да, проанализировав таблицу, мы увидим, что на s-подуровне может находиться не больше двух электронов, на p-подуровне — не больше шести электронов, на d-подуровне — не больше десяти электронов, на f-подуровне — не больше четырнадцати электронов. Электроны, как и люди, стремятся занять более комфортные места. Порядок заполнения подуровней в атомах химических элементов следующий: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.

Потренируемся в написании электронной конфигурации на примере атома титана.
Химический элемент титан располагается в IVB группе IV периода, имеет порядковый номер, равный 22. Исходя из этого, мы можем сказать, что в его атоме:
- четыре энергетических уровня (IV период), из которых первый и второй уровни полностью заполнены;
- четыре электрона на внешнем энергетическом уровне и предвнешнем подуровне;
- всего двадцать два электрона (порядковый номер).
В соответствии с порядком заполнения орбиталей распределим электроны:
22Ti 1s22s22p63s23p64s23d2 — как мы видим, сначала заполняется 4s-подуровень, а затем 3d-подуровень, это соответствует порядку заполнения орбиталей, описанному выше.
Проверим себя. В сумме все верхние цифры (обозначающие число электронов на подуровне), должны образовать ровно 22: 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22, следовательно, электронная конфигурация атома титана составлена верно.
| Химические элементы делятся на семейства? Это что, биология какая-то? К счастью, с биологией у атомов химических элементов мало общего, иначе, представьте, что в качестве домашнего питомца у вас был бы атом хлора, а в зоопарке бы показывали семью атомов золота. Что-то из области фантастики, не так ли? Однако, да, химические элементы разделяют на семейства по строению их электронных оболочек. |
В зависимости от положения «последнего электрона» бывают s-, p-, d-, f-элементы:
- s-элементы — это элементы IA и IIA групп, в их атомах последний электрон занимает место на s-подуровне внешнего энергетического уровня;
- p-элементы — это элементы IIIA-VIIA групп, в их атомах последний электрон занимает место на p-подуровне внешнего энергетического уровня;
- d-элементы — это элементы побочных подгрупп, в их атомах последний электрон занимает место на d-подуровне предвнешнего энергетического уровня;
- f-элементы — это лантаноиды и актиноиды, 4f- и 5f-элементы соответственно, в их атомах последний электрон занимает место на f-подуровне предпредвнешнего энергетического уровня.
У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Главные подгруппы таблицы Менделеева составляют s- и p-элементы, а между ними расположены переходные элементы.
К переходным элементам относятся элементы, которые расположены в побочных подгруппах больших периодов периодической системы Д.И. Менделеева. К ним принадлежат d- и f-элементы.
| Как переходные металлы помогают нам жить? Без переходных металлов наш организм существовать не может. — Железо — это центральный атом гемоглобина — белка, переносящего кислород по нашему организму. — Цинк участвует в выработке инсулина, гормона, регулирующего уровень сахара в крови. — Кобальт — центр витамина В12, дефицит которого приводит к анемии. — Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов. |

Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.

Переходные элементы очень бережливы в вопросе энергии, они любят расставлять все так, как хочется им. Как они это делают, мы сейчас и узнаем.
Проскок электрона
Одной из главных особенностей переходных элементов является проскок электрона. Для начала поймем, что же это такое?
Провал (проскок) электрона — переход электрона с внешнего энергетического уровня на предвнешний (нижележащий).
| Как умеет скакать электрон? Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней. Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация. Иметь такую конфигурацию более энергетически выгодно, поэтому происходит проскок (провал) электрона: электрон с верхнего «этажа» как будто проваливается на «этаж» ниже. |

Это явление характерно для элементов IB и VIB групп: хрома (Cr), меди (Cu), серебра (Ag), золота (Au). Также проскок имеется у ниобия (Nb), молибдена (Mo), рутения (Ru), платины (Pt) и палладия (Pd).
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон «перепрыгивает» на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s1

Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9.
Закрепим тему, а для этого решим аналог задания №1 ЕГЭ.
Задание. Определите, какие из указанных элементов в основном состоянии имеют на внешнем электронном уровне один неспаренный электрон. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
1) Cr
2) Ca
3) C
4) Ne
5) Cu
Решение:
Запишем электронные конфигурации элементов.
1) Конфигурация хрома с учетом проскока электрона: 1s2 2s2 2p6 3s2 3p6 4s1 3d5.
Внешним считается 4 электронный уровень, на нем у нас один неспаренный электрон (4s1), вариант ответа нам подойдет.
2) Конфигурация кальция: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s². Внешним будет 4 уровень, на нем два спаренных электрона (4s2).
3) Конфигурация углерода: 1s2 2s2 2p2. Внешним будет 2 уровень, на котором два спаренных электрона (2s2) и два неспаренных (2p2).
4) Конфигурация неона: 1s2 2s2 2p6. Благородные газы не имеют неспаренных электронов, их внешний уровень полностью заполнен.
5) Конфигурация меди с учетом проскока электрона: 1s2 2s2 2p6 3s2 3p6 4s1 3d10. Внешним считается 4 электронный уровень, на нем у нас один неспаренный электрон (4s1), вариант ответа нам также подойдет.
Ответ: 15
Сегодня мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома. Теперь для нас не составит труда описать строение атома любого химического элемента. А подробнее о переходных элементах можно прочитать в статье «Переходные элементы: хром, железо, марганец».
Термины
Валентные электроны — электроны, участвующие в образовании химической связи.
Фактчек
- Электроны располагаются на электронных уровнях, причем их число определяется положением элемента в Периодической системе (по номеру периода).
- Энергетические уровни, в свою очередь, состоят из подуровней.
- Энергетические подуровни состоят из атомных орбиталей, которые для удобства обозначаются ячейками.
- Химические элементы делятся на s-, p-, d- и f-семейства по тому, на какой подуровень пишем последний электрон при составлении электронной конфигурации атома.
- d- и f-элементы являются переходными.
- Переходным элементам характерно явление провала (проскока) электрона: перехода электрона с внешнего уровня на более комфортный предвнешний.
Проверь себя
Задание 1.
Сколько электронов может максимально располагаться на орбитали?
- 1 электрон;
- 2 электрона;
- 3 электрона;
- 4 электрона.
Задание 2.
Как атомные подуровни заполняются электронами?
- В порядке увеличения их энергии.
- В порядке уменьшения их энергии.
- В периодическом порядке.
- В порядке уменьшения порядкового номера.
Задание 3.
Какого семейства элементов не существует?
- s-элементы;
- p-элементы;
- r-элементы;
- d-элементы.
Задание 4.
Какому элементу не свойственен провал электрона?
- Железо
- Молибден
- Хром
- Медь
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 1.


 к списку статей
к списку статей





