Гидролиз солей
Может показаться, что изучать гидролиз солей сложно, но это не так. Его можно легко понять и запомнить, так как этот процесс происходит по такому же механизму, как и люди обмениваются опытом, знаниями или какими-то предметами.
На этой странице вы узнаете
- Есть ли какая-то связь между гидрой и гидролизом?
- Какие цели ставят себе гидролиз и среда раствора?
- Гидролиз любит слизывать воду?
Что такое гидролиз?
Гидролиз – это взаимодействие молекул воды с ионами растворённого вещества.
То есть вещество при диссоциации дает ионы: катион и анион, эти ионы будут реагировать с молекулами воды. Этот процесс называется гидролизом.
| Есть ли какая-то связь между гидрой и гидролизом? “Гидро” с греческого значит “вода”. И гидра, и гидролиз зависят от воды. Гидролиз не протекает без воды, а гидра не сможет выжить без воды. Вот такая далекая, но яркая связь. |
Чего хочет гидролиз
У каждого человека в жизни есть какая-то цель. Кто-то хочет зарабатывать очень много денег, кто-то хочет поступить в лучший вуз, а кто-то поехать летом на море. Удивительно, но у гидролиза тоже есть цель.
Давайте возьмём интервью у гидролиза!
- Добрый день, гидролиз!
- Здравствуйте!
- Скажи, пожалуйста, какая у тебя самая большая цель в жизни?
- Хммм… Тут всё очевидно! Я люблю искать слабые точки и бить по ним!
- Вот это да! А как ты определяешь слабые места?
- Часть соли, которая при взаимодействии с водой отдаёт слабый электролит, и будет слабым звеном!
- Кто же их тебе дарит?
- Их мне дарят слабые кислоты или основания.
- Здорово! Неужели у тебя всегда получается находить слабые места в веществах?
- К сожалению, нет. Есть настолько сильные вещества, с которыми я не могу справиться.
- Дорогой Гидролиз, ты из-за этого расстраиваешься?
- Нет! Потому что есть не только абсолютно сильные, но и полностью слабые вещества.
- Круто! Ну тогда я желаю тебе успехов! Уверена, у тебя всё получится!
- Большое спасибо!
Из этого интервью мы крепко запомним: нерастворимые соли гидролизу не подвергаются!
Давайте представим, что мы на пляже, рядом с нами вода, а в воде камни. Камень для нас – нерастворимая соль, которая с водой не способна никак взаимодействовать, потому что она не распадается на ионы. Теперь мы понимаем, почему нерастворимые соли не гидролизуются.
| Гидролиз любит слизывать воду? Нет, это не так! “Лиз” с греческого переводится “разложение”. Из этого и следует определение гидролиза, то есть разложение под действием воды. |
Среды растворов
Давайте теперь поговорим про среды растворов! Это необходимо для того, что понимать, какие ионы содержатся в растворе и в каком количестве. Выделяют три среды: кислую, нейтральную и щелочную.
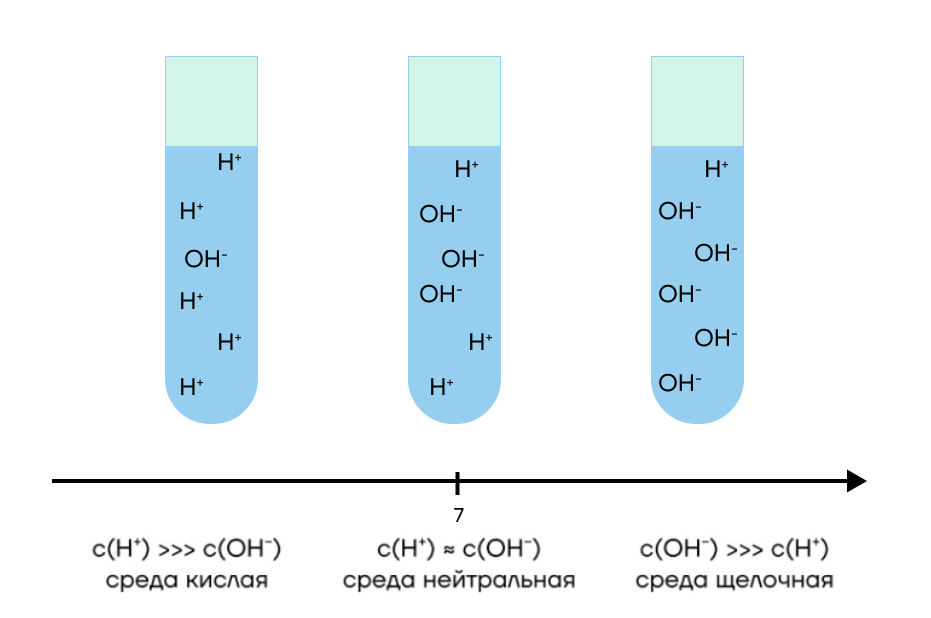
Здесь всё зависит от концентрации ионов водорода.
- Если ионов водорода больше, чем гидроксид-ионов, то среда кислая.
- Если ионов водорода и гидроксид-ионов примерно одинаковое число, то среда нейтральная.
- Если ионов водорода меньше, чем гидроксид-ионов, то среда щелочная.
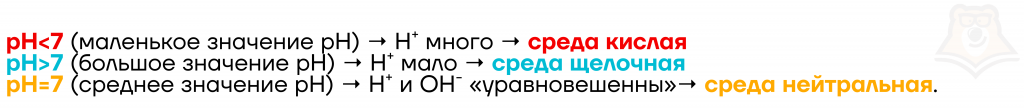
Концентрацию ионов водорода отражает такая величина, как pH. Ещё её называют водородным показателем. Она обратно пропорциональна концентрации водорода. То есть, чем больше ионов водорода, тем меньше значение pH.
Давайте теперь возьмём интервью у среды, простите, госпожи Среды!
- Привет, Среда!
- Приветик!
- Скажи, пожалуйста, какая у тебя самая большая цель в жизни?
- Хммм… Тут всё очевидно! Я люблю искать сильные точки и бить по ним!
- Вот это да! А как ты определяешь сильные места?
- Часть соли, которая при взаимодействии с водой отдаёт сильный электролит и будет сильным звеном!
- Кто же их тебе дарит?
- Их мне дарят сильные кислоты или основания.
- Здорово! Спасибо тебе за интервью! Удачи!
- Взаимно!
Поговорим теперь про все три среды: кислую, щелочную и нейтральную.
- Если соль образована сильной кислотой и слабым основанием — среда ее раствора кислая.
- Если соль образована слабой кислотой и сильным основанием — среда ее раствора щелочная.
- Если соль образована и сильной кислотой, и сильным основанием – среда ее раствора нейтральная.
- Если соль образована и слабой кислотой, и слабым основанием — среда ее раствора нейтральная.
- Если дана нерастворимая соль, гидролиз не протекает, а среда задается водой и будет нейтральной.
Из всего сказанного необходимо сделать один очень важный вывод!
Гидролиз ищет слабую часть, а среда – сильную!
Гидролиз и среда нам всё про себя рассказали. Настало время практики!
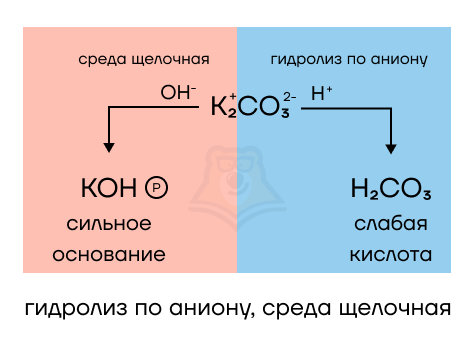
- K2CO3 образован сильным основанием (щелочью КОН) и слабой угольной кислотой (H2CO3) — среда определяется по сильному и будет щелочной, а вот гидролиз протекает по слабому аниону. Запишем уравнение гидролиза:
К2СО3 + 2Н2О = 2КОН + Н2О + СО2↑ (помним, что H2CO3 распадается на газ и воду)
Газ из раствора улетит, а воду мы можем сократить, тогда в растворе останется только щелочь, отсюда и щелочная среда. Почему мы говорим, что гидролиз идет по аниону? Именно продукт взаимодействия аниона с водой в данной реакции будет условием протекания реакции — выделяется газ, условия для реакции ионного обмена (РИО) соблюдаются. Вспомнить о том, какие еще есть условия для данного типа реакций, вы можете, прочитав статью «Реакции ионного обмена».
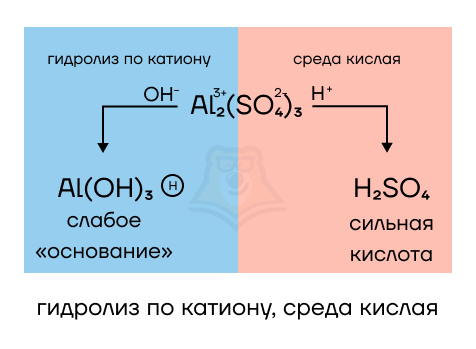
- Al2(SO4)3 образован слабым амфотерным гидроксидом алюминия (Al(OH)3) и сильной серной кислотой (H2SO4) — среда будет кислой, а гидролиз протекает по катиону. Запишем уравнение гидролиза:
Al2(SO4)3 + 6H2O = 2Al(OH)3↓ + 3H2SO4
Гидроксид алюминия выпадет в осадок, в растворе его уже не будет, останется только серная кислота, которая и создает нам кислую среду. Условием протекания РИО будет выпадение осадка, образованного при гидролизе катиона алюминия.
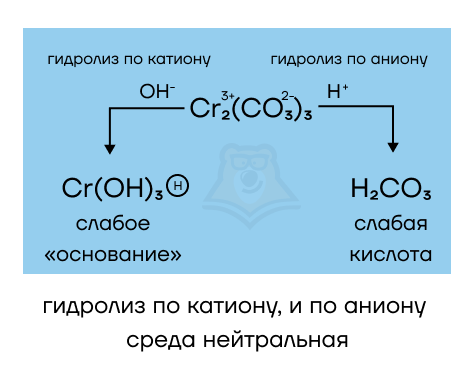
- Cr2(СO3)3 образован слабым амфотерным гидроксидом (Cr(OH)3) и слабой угольной кислотой (H2CO3) — среда раствора нейтральна, гидролиз идет и по катиону, и по аниону. Запишем уравнение гидролиза:
Сr2(CO3)3 + 6H2O = 2Cr(OH)3↓ + 3H2O + 3CO2
Гидроксид хрома(III) выпадает в осадок, в растворе его не будет, углекислый газ также уходит из раствора (улетает из него). Кто же тогда остается? Вода, которая и дает нам нейтральную среду. А так как и выпадение осадка, и выделение газа являются условиями для протекания РИО, то гидролиз будет протекать и благодаря катиону хрома, и благодаря карбонат-аниону.
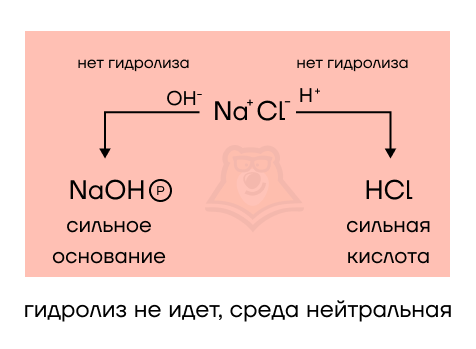
- NaCl образован сильным основанием (щелочью NaOH) и сильной соляной кислотой (HCl). Среда нейтральная, а гидролиз не протекает. Попробуем разобраться, почему так, записав теоретическое уравнение гидролиза:
NaCl + H2O = NaOH + HCl
Сила кислоты и щелочи сопоставима, невозможно «отдать кому-то победу» и «признается ничья» — нейтральная среда. Оба продукта растворимы, признаков протекания РИО нет, именно поэтому мы и не можем сказать, что гидролиз протекает.
Роль гидролиза в биологических процессах
- Полимеры (белки, жиры и полисахариды) во время переваривания пищи благодаря гидролизу превращаются в мономеры (аминокислоты, глюкозу и т.д.). То есть без гидролиза пища почти не может усваиваться.
- Многие лекарства, попадая в наш организм, подвергаются гидролизу. Значит, без гидролиза лекарства бы усваивались хуже.
Фактчек
- Гидролиз – это взаимодействие молекул воды с ионами растворённого вещества. Нерастворимые соли гидролизу не подвергаются!
- Выделяют три среды: кислую, нейтральную и щелочную. Если ионов водорода больше, чем гидроксид-ионов, то среда кислая. Если ионов водорода и гидроксид-ионов примерно одинаковое число, то среда нейтральная. Если ионов водорода меньше, чем гидроксид-ионов, то среда щелочная.
- Концентрацию ионов водорода отражает pH. Эта величина пропорциональна концентрации водорода. То есть, чем больше ионов водорода, тем меньше значение pH.
- Гидролиз ищет слабую часть, а среда – сильную!
Проверь себя
Задание 1.
Какая среда у следующей соли: KNO3
- Кислая
- Щелочная
- Нейтральная
Задание 2.
Какая среда у следующей соли: NaF
- Кислая
- Щелочная
- Нейтральная
Задание 3.
Сульфат бария гидролизуется
- По катиону
- По катиону и по аниону
- Не гидролизуется
Ответы: 1. — 3; 2. — 2; 3. — 3.


 к списку статей
к списку статей




