Элементы VIIА группы. Галогены 2.0
На этой странице вы узнаете
- Какая кислота способна растворить стекло?
- Пробовали ли вы галит на вкус?
- Почему галогены жизненно важны для нас?
Соединения галогенов имеют невероятно широкое применение в жизни. Даже самые известные и привычные нам в быту вещества могут быть связаны с галогенами. Например, обычная поваренная соль, галогеновые фары автомобилей, тефлоновое покрытие сковороды, хладагент в холодильнике, фотопечать. Этот список можно продолжать очень долго.
В этой статье мы познакомимся с соединениями галогенов, их свойствами и применением, и узнаем кое-что новенькое о простых, обыденных вещах.
Галогеноводороды
Галогеноводороды (HF, HCl, HBr, HI) представляют собой газы, хорошо растворимые в воде. Растворы этих газов в воде и являются кислотами: фтороводородной, хлороводородной и т.д.
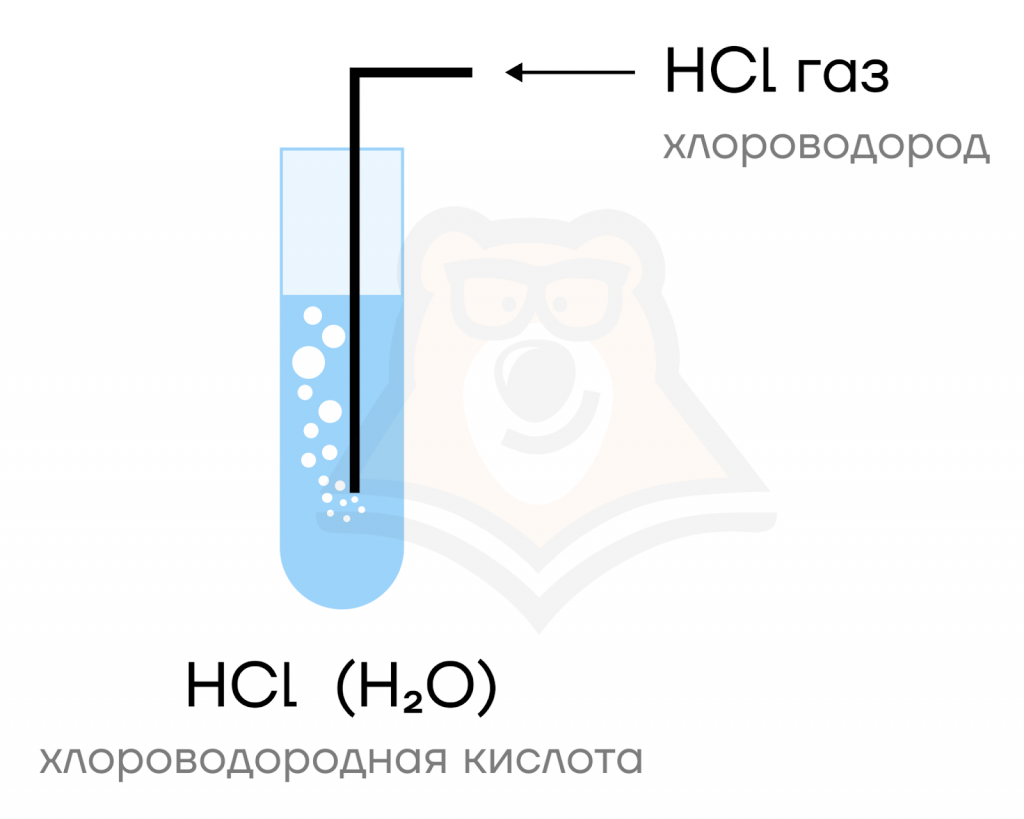
Повторим, как формируются названия галогеноводородов и их солей.
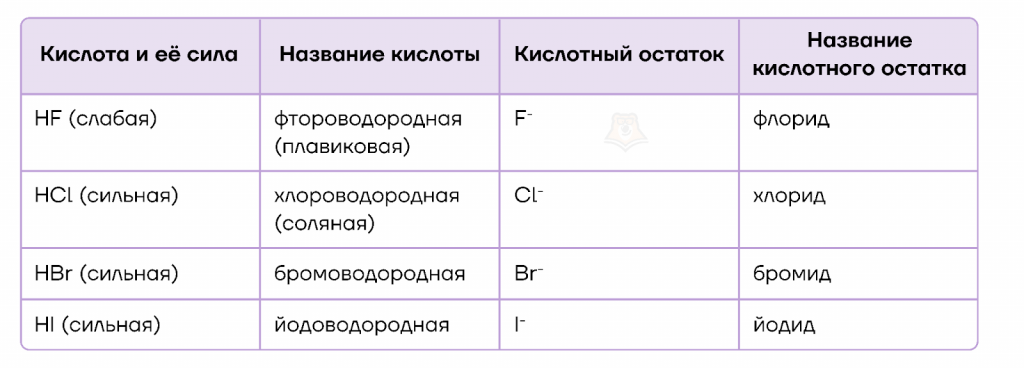
- Название водородных кислот строится из названия галогена (фтор, иод и т.д.) и водорода.
- Если нужен кислотный остаток, то к названию галогена просто добавляем суффикс -ид.
Сила галогеноводородных кислот возрастает в ряду HF→HCl→HBr→HI, так как с ростом радиуса атома галогена, отщепление иона водорода Н+ от молекулы облегчается. Таким образом, HI является самой сильной галогеноводородной кислотой и имеет наибольшую склонность отдавать протоны (ионы водорода).
Получение галогеноводородов
В промышленности основным способом получения галогеноводородов является синтез непосредственно водорода и галогена. В лаборатории — гидролиз бинарных соединений фосфора и кремния.
| Синтез из простых веществ. | H2 + Cl2 = 2HCl H2 + Br2 = 2HBr |
| Воздействие концентрированной серной кислоты на безводные хлориды и фториды. Для получения бромо- и иодоводорода подобный способ не используют из-за протекания ОВР. | H2SO4(конц.) + NaCl(тв.) = NaHSO4 + HCl↑ H2SO4(конц.) + NaF(тв.) = NaHSO4 + HF↑ |
| Гидролиз бинарных соединений фосфора и кремния. | PCl5 + 4H2O = H3PO4 + 5HCl SiCl4 + 3H2O = H2SiO3 + 4HCl |
Химические свойства галогеноводородов
Галогеноводороды (HF, HCl, HBr, HI) представляют собой газы, хорошо растворимые в воде. Растворы этих газов в воде и являются кислотами: фтороводородной, хлороводородной и т.д.
Поговорим про их химические свойства.
- Так как это кислоты, для них будут характерны типичные для большинства кислот реакции: основно-кислотные взаимодействия, реакции с металлами, реакции ионного обмена.
- Так как галоген находится в степени окисления (с.о.) –1, в окислительно-восстановительных реакциях (ОВР) галогеноводороды (кроме HF) выступают в роли восстановителей, повышая с.о. до устойчивого нуля.
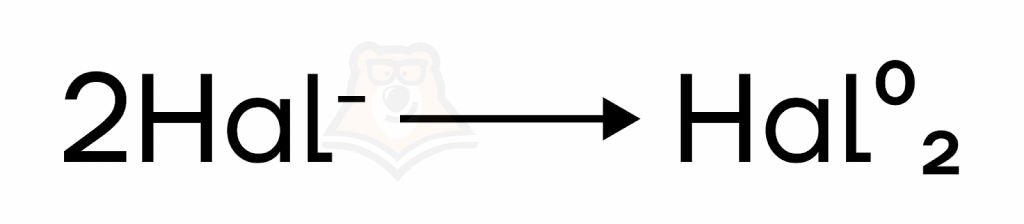
Причем восстановительная способность увеличивается к HI.
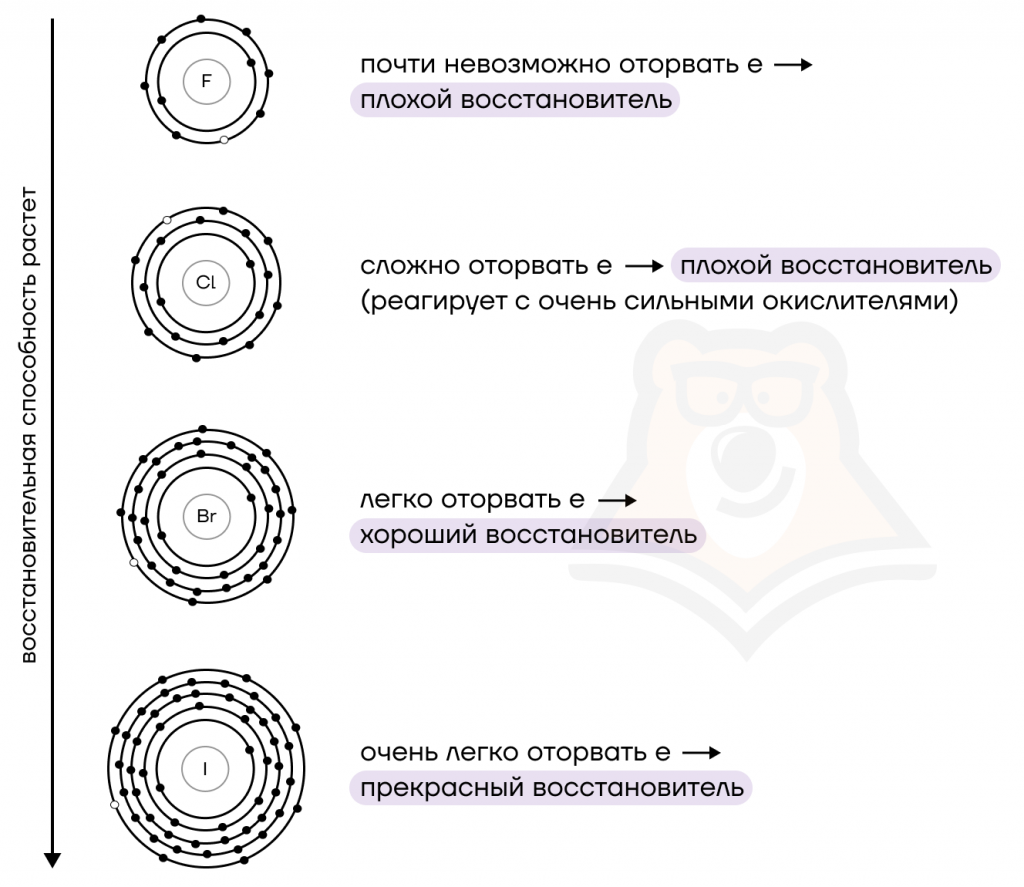
- Кислотные свойства (на примере HCl).
Водным растворам галогеноводородов свойственны все привычные нам взаимодействия кислот — основно-кислотное взаимодействие (ОКВ), реакции ионного обмена (РИО), реакции с металлами до водорода в ряду активности металлов (Ме).
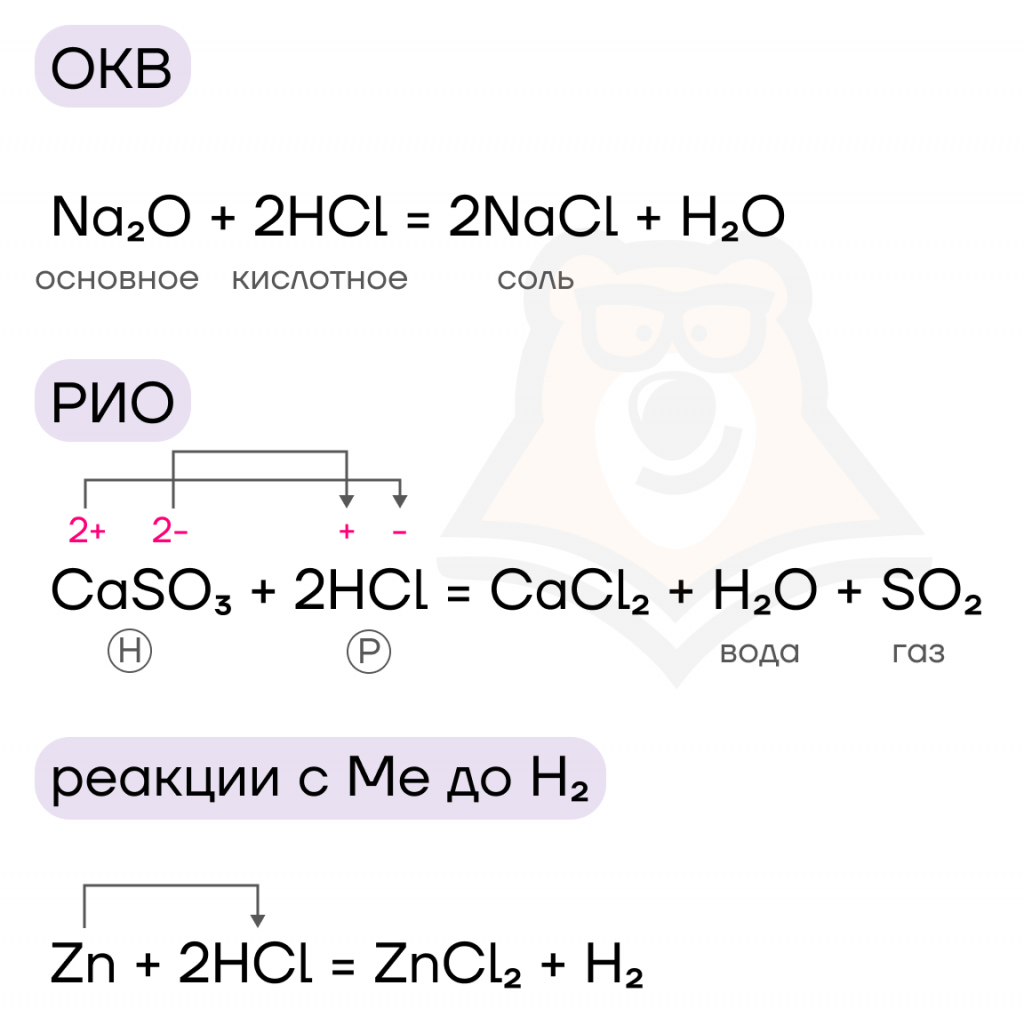
- Восстановительные свойства.
Здесь чаще всего встречаются реакции с соединениями металлов побочных подгрупп в высоких степенях окисления (Fe+3, Cr+3, Cu+2), а также с концентрированной серной кислотой.
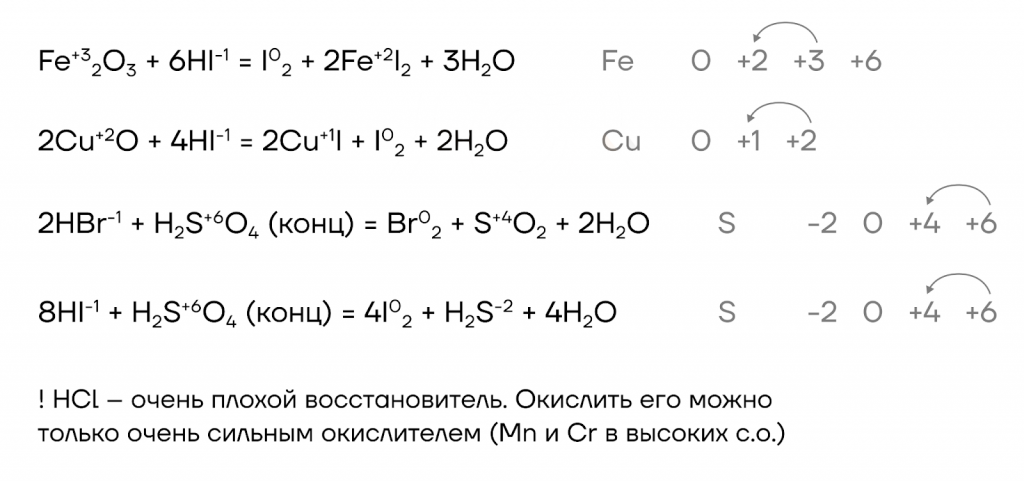
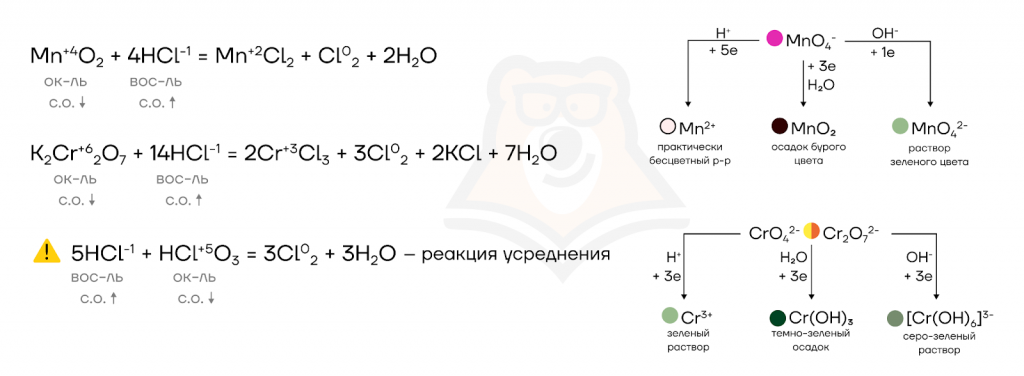
Мы можем закрепить полученные знания, решив задание №9 ЕГЭ.
Задание. Задана следующая схема превращений:
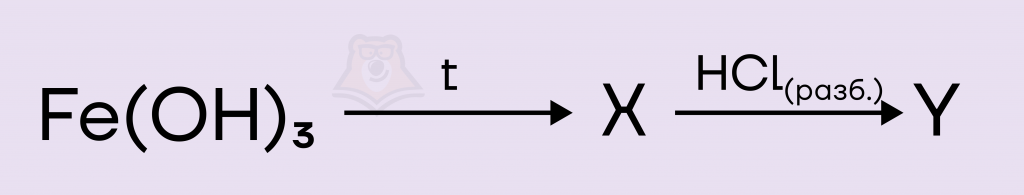
Определите какие из указанных веществ являются веществами X и Y
1) FeCl2
2) FeO
3) Fe(OH)2
4) FeCl3
5) Fe2O3
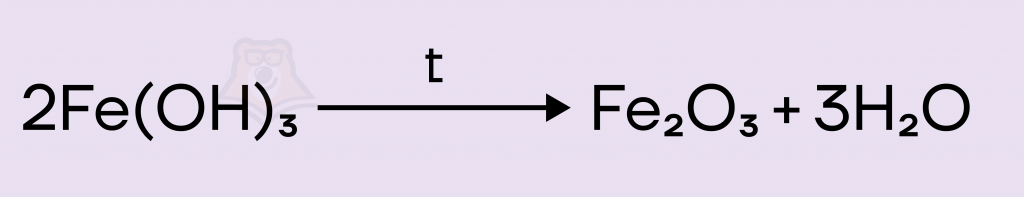
Решение. Запишем реакцию разложения гидроксида железа(III). В результате реакции образуются соответствующий оксид железа(III) и вода. Кстати, оксид железа(III) имеет несколько тривиальных названий — гематит, железный блеск, красный железняк.
Далее оксид железа(III) вступает в реакцию с разбавленной соляной кислотой. В результате реакции образуются соль хлорид железа(III) и вода.

Ответ: 45
| Какая кислота способна растворить стекло? Оксид кремния SiO2 в обычной жизни — стекло. Способность плавиковой кислоты растворять стекло активно используется в промышленности, например, для нанесения надписей и рисунков на стекло. Этот процесс называется «травление стекла». По этой же причине плавиковую кислоту хранят только в пластиковых емкостях. SiO2 + 4HF = SiF4 + 2H2O |
Соли галогеноводородных кислот
Как мы увидели выше, соли галогеноводородных кислот образуются в реакциях ионного обмена соответствующих кислот с солями и щелочами, а также в окислительно-восстановительных реакциях. Название солей галогеноводородных кислот формируется по принципу «название галогена + ид».
- Соли галогеноводородных кислот, как и сами кислоты, способны вступать в реакции ионного обмена.
NaCl + AgNO3 = AgCl + NaNO3

Важно запомнить, что галогениды серебра не растворяются в кислотах!
AgCl + HNO3 ≠
- Галогениды также способны вступать в окислительно-восстановительные реакции, в которых они проявляют свои восстановительные свойства.
6KI + 2KMnO4 + 4H2O = 3I2 + 2MnO2 + 8KOH
2KBr + 2H2SO4 (конц.) = Br2 + SO2 + K2SO4 + 2H2O
8KI + 5H2SO4 (конц.) = 4I2 + H2S + 4K2SO4 + 4H2O
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
- В твердом виде хлориды и фториды вступают в реакцию с концентрированной серной кислотой с образованием газа. В случае бромидов и иодидов будут протекать окислительно-восстановительные реакции, которые приведены выше в пункте 2.
NaF(тв) + H2SO4 (конц.) = NaHSO4 + HF↑
KCl(тв) + H2SO4 (конц.) = KHSO4 + HCl↑
- Фториды взаимодействуют с разбавленной серной кислотой в растворе, однако в этом случае выделение газа не наблюдается, образуется слабый электролит (слабая кислота HF).
NaF + H2SO4 = NaHSO4 + HF
Качественные реакции на галогенид-ионы
Качественными реакциями на все галогенид-ионы (кроме фтора) является взаимодействие с растворимыми солями серебра. В результате выпадают осадки белых и желтых цветов.

Кислородсодержащие кислоты и соли галогенов
Несмотря на то, что сами галогены (кроме фтора) не взаимодействуют с кислородом, они все равно имеют кислородсодержащие соединения.
Для начала на примере хлора, кислородсодержащие кислоты других галогенов очень неустойчивы. Для того, чтобы определить силу кислоты можно воспользоваться формулой, приведенной ниже.
n = x(O) — y(H),
где x(O) — количество атомов кислорода в кислоте,
y(H) — количество атомов водорода в кислоте.
Если n = 0;1 — кислота слабая (слабый электролит), n = 2;3 — кислота сильная (сильный электролит).
Рассмотрим хлорноватую кислоту HClO3. Количество атомов кислорода 3, атомов водорода 1. n = 3 — 1 = 2, значит кислота является сильным электролитом.
Эта формула позволяет сделать упрощенные расчеты. В университетских курсах неорганики ее не используют, но для школьной химии в рамках ЕГЭ она работает правильно.
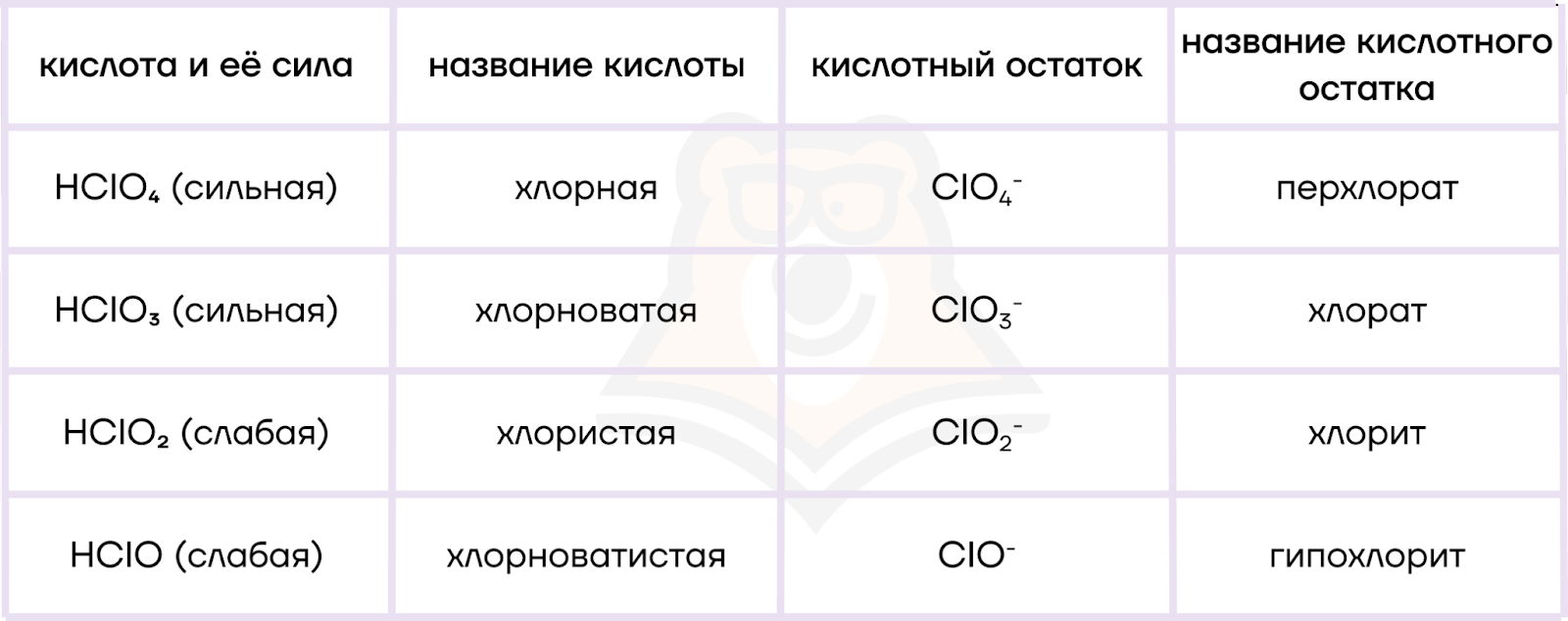
Вспомним, как называются кислоты и их соли в зависимости от степени окисления атома галогена, используя таблицу ниже.
Теперь давайте рассмотрим химические свойства кислородсодержащих кислот и солей галогенов.
Химические свойства кислородсодержащих кислот и солей галогенов
- Кислотные свойства.
Кислородсодержащие кислоты галогенов обладают типичными свойствами кислот: вступают в основно-кислотные взаимодействия, реакции ионного обмена, в реакции с металлами до водорода.
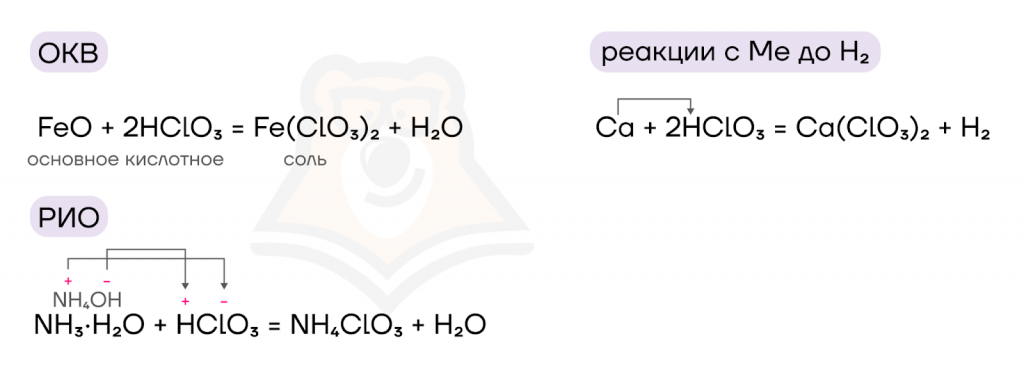
- Окислительные свойства.
За счет высоких степеней окисления и высоких значений электроотрицательности атомов галогенов, кислородсодержащие кислоты и их соли обладают выраженными окислительными свойствами, в реакциях они понижают с.о. до –1.
Определить, до какого вещества окислится галогенсодержащий реагент в таких реакциях, легко. Достаточно убрать кислород из галогенсодержащего реагента и записать получившееся вещество после знака «=».

- Термическое разложение.
Здесь нужно запомнить, как разлагается хлорат калия KClO3 в зависимости от условий:
- если KClO3 просто нагревают без посторонних веществ, тогда образуются две соли;
- если используется катализатор (обычно MnO2), то идет более глубокое разложение с образованием хлорида и кислорода.

Мы рассмотрели химические свойства кислородсодержащих кислот и солей галогенов. Далее мы рассмотрим, где встречаются в природе и применяются эти соединения.
Применение галогенов и их соединений, нахождение в природе
Ввиду своей высокой активности галогены повсеместно встречаются в природе в виде минералов.
Природный минерал — это твердое неорганическое вещество, естественным путем образующееся в земной коре.
Минералы обладают определенным химическим составом и кристаллической структурой.
Природные минералы фтора:
- флюорит CaF2;
- криолит Na3[AlF6];
- топаз Al2 [SiO4] (F, OH)2.
Все эти минералы нашли широкое применение в промышленности. Например, криолит известен нам благодаря электролитическому способу получения алюминия.
Электролитический способ получения алюминия из криолита — один из наиболее распространенных и эффективных методов производства алюминия. Криолит используется в качестве растворителя для электролиза.
Процесс производства алюминия основан на электролизе расплава, который состоит из криолита и оксида алюминия Al2O3. Расплав помещается в электролизер, который состоит из двух электродов: катода и анода. При подаче электрического тока через расплав происходит разложение криолита на ионы алюминия и фторида. Ионы алюминия перемещаются к катоду, где они редуцируются (восстанавливаются) до металлического алюминия. Фториды, в свою очередь, перемещаются к аноду, где они окисляются до фтора и образуют газообразные продукты.
Этот процесс является очень энергоемким, но при этом получается высококачественный алюминий с высокой степенью чистоты. Узнать подробнее об электролизе можно в статье «Электролиз расплавов и растворов (солей, щелочей, кислот)».
Флюорит и топаз, как полудрагоценные камни, используются при изготовлении ювелирных украшений, предметов интерьера.
Флюорит обладает очень красивой, зональной окраской. Его применяют в металлургии, химической, алюминиевой, стекольной промышленности, оптике. Фотографии Марса с советских космических кораблей были сделаны при помощи фотообъективов, линзы которых изготовлены с применением флюорита.
Топаз имеет широкую цветовую гамму. Однажды, один бесцветный топаз ошибочно приняли за алмаз. Принадлежащий королю Португалии камень имел массу в 328 г и долгое время считался самым крупным алмазом в мире. В 30-е годы XIX века этот топаз был бесследно утрачен.
Природные минералы хлора:
- галит (каменная соль) NaCl;
- сильвинит KCl·NaCl.
Сильвинит является важным источником калийных удобрений.
| Пробовали ли вы галит на вкус? Галит — природный минерал, который может быть разных цветов, включая белый, серый, розовый, красный, синий и зеленый, в зависимости от примесей, содержащихся в минерале. Он имеет кубическую структуру и может образовывать красивые кристаллы. Название минерала происходит от греческих слов «halos» — «соль» и «lithos» — «камень». Но все мы прекрасно с ним знакомы и употребляем в пищу ежедневно, потому что это основной источник поваренной соли. Галит — это тривиальное название, которое нужно запомнить для подготовки к экзамену. |
Бром и иод не образуют собственных минералов, но при этом их относят к так называемым рассеянным элементам в земной коре. Это значит, что их соли в очень малых количествах содержатся практически везде. Большое количество важного для нашего здоровья иода накапливается в морских водорослях.
Для закрепления пройденного материала решим задание, подобное №19 ЕГЭ.
Задание. Установите соответствие между реагентом и схемой превращения элемента хлора.
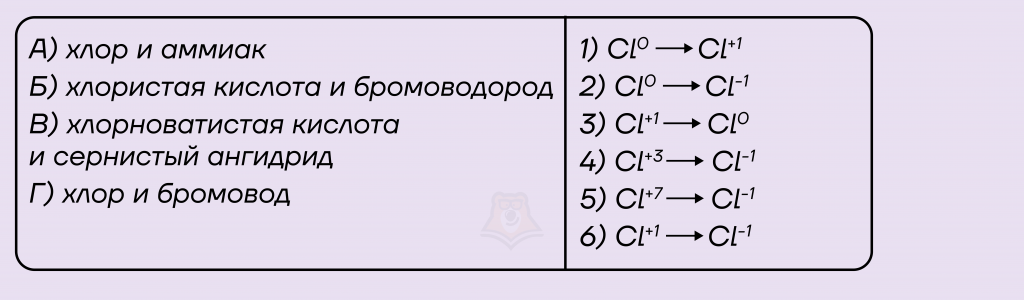
Решение.
Для решения этого задания нам помогут знания в определении степеней окисления в соединениях и умение составлять химические формулы соединений.
Для начала давайте запишем все варианты из левого столбца в виде химических формул и расставим степени окисления хлора в исходных соединениях.
А) Cl20 и NH3
Б) HCl+3O2 и HBr
В) HCl+1O и SO2
Г) Cl20 и HBr
Для варианта Б мы сразу же можем найти правильный ответ, потому что он единственный из предложенных — это вариант ответа №4.
Уравнение реакции:
HClO2 + 4HBr = HCl-1 + 2Br2 + 2H2O
Запишем остальные реакции и расставим степени окисления в продуктах, которые содержат атомы хлора.
А) 3Cl2 + 8NH3 = 6NH4Cl-1 + N2
В) HClO + SO2 + H2O= HCl-1 + H2SO4
Г) Cl2 + 2HBr = 2HCl-1 + Br2
Таким образом, нам подходят варианты ответа А) 2, Б) 4, В) 6 и Г) 2.
Ответ: 2462
| Почему галогены жизненно важны для нас? Хотя все галогены и являются ядовитыми веществами, они невероятно важны для человеческого организма. Без иода невозможна нормальная деятельность щитовидной железы, а отсутствие фтора вызывает разрушение зубной эмали и кариес. Бром участвует в деятельности нашей нервной системы. Галогены широко используются в различных областях: — хлор используется для очистки воды и бассейнов; — раствор иода для дезинфекции ран и устранения бактерий; — фтор используется в производстве антидепрессантов и антибиотиков; — галогены широко используются в промышленности для производства пластмасс, резиновых изделий, электроники; — соединения галогенов входят в состав ракетного топлива; — при добыче золота, бурении нефтяных скважин. |
В завершение можно сказать, что галогенсодержащие вещества имеют широкое применение в различных отраслях промышленности и медицине благодаря своим уникальным свойствам. Однако, при работе с такими веществами необходимо соблюдать все меры предосторожности и следовать инструкциям по их использованию, чтобы избежать возможных опасностей для здоровья. В целом, галогены являются важными элементами в нашей жизни, и их правильное использование может принести большую пользу для нашего здоровья и благополучия.
Хотите узнать больше о кислороде — элементе VIА группы и его важности для нашей жизни? Тогда мы приглашаем вас прочитать статью «Элементы VIА группы. Кислород». Не упустите возможность расширить свои знания и узнать что-то новое!
Термины
Окислительно-восстановительные реакции — реакции, протекающие с изменением степеней окисления атомов.
Реакции ионного обмена — это реакция между сложными веществами, в ходе которой они обмениваются своими составными частями.
Степень окисления — условный заряд элемента, рассчитанный исходя из условия, что все связи в соединении ионные.
Электролиз — это окислительно-восстановительная реакция (ОВР), протекающая на электродах при прохождении электрического тока через раствор или расплав электролита.
Электролит — вещество, раствор или расплав которого проводит электрический ток.
Электроотрицательность — свойство атомов одного элемента оттягивать на себя электроны от атомов другого элемента в соединениях.
Фактчек
- Галогеноводороды — газы, хорошо растворимые в воде, растворы которых и являются кислотами.
- Сила галогеноводородных кислот возрастает в ряду HF→HCl→HBr→HI.
- В ОВР галогеноводороды (кроме HF) выступают в роли восстановителей, повышая степень окисления до нуля.
- Качественным реактивом на галогенид-ионы (кроме фтора) является взаимодействие с растворимыми солями серебра.
- Кислородсодержащие кислоты галогенов и их соли проявляют окислительные свойства: в ОВР переходят в соответствующие галогеноводороды.
Проверь себя
Задание 1.
Какая из кислот является самым сильным восстановителем?
- HF
- HCl
- HBr
- HI
Задание 2.
Какая из кислот реагирует с диоксидом кремния?
- HF
- HCl
- HBr
- HI
Задание 3.
Как называется соль KClO2?
- гипохлорит калия
- хлорит калия
- хлорат калия
- перхлорат калия
Задание 4.
Какого цвета осадок выпадает при взаимодействии иодида натрия и нитрата серебра?
- черный осадок
- белый осадок
- зеленый осадок
- желтый осадок
Задание 5.
Какая молекулярная формула соответствует хлорной кислоте?
- HClO4
- HClO3
- HClO2
- HClO
Ответы: 1. — 4; 2. — 1; 3. — 2; 4. — 4; 5. – 1.


 к списку статей
к списку статей






