Химическое равновесие
На этой странице вы узнаете
- Что выбирает химия – равновесие или хаос?
- Какая связь между химическим равновесием и весами?
- Может ли “такси” сместить химическое равновесие?
Почти каждый человек хочет находиться в балансе и в равновесии, совмещать и работу, и отдых, проводить много времени и с друзьями, и с семьей. Не всегда это выходит, но мы к этому стремимся. Удивительно, но к равновесию стремится и химия. О том, как она к этому приходит, расскажем в статье.
Химическое равновесие и реакции
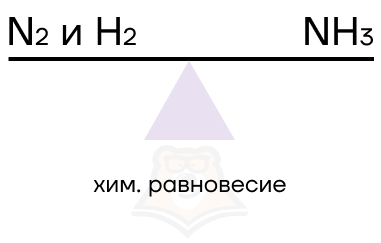
Химическое равновесие – это то состояние системы, когда она находится в балансе, то есть скорость её прямой и обратной реакции равны.
Теперь давайте разберемся, что такое прямая и обратная реакции. Эти два термина обозначают полностью противоположные явления.

Прямая реакция – реакция, которая направлена в сторону продуктов.
Обратная реакция – реакция, которая направлена в сторону реагентов.
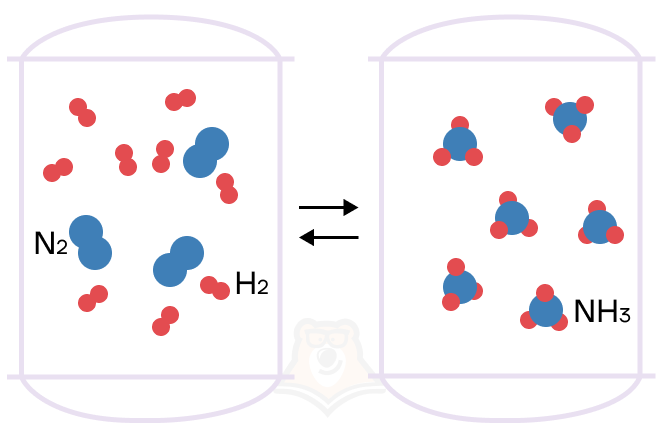
Если реакция протекает в обоих направлениях (и прямом, и обратном), то такая реакция называется обратимой. Примером такой реакции служит получение аммиака из азота и водорода, потому что из аммиака (продукта) можно получить реагенты (азот и водород).
При определении обратимости реакции мы должны задать себе вопрос: “Можно ли из продукта получить реагенты?” Если ответ положительный, тогда реакция обратима.
Важно понимать, что к обратимым реакциям относятся в основном реакции соединения.
Необратимая реакция – это реакция, которая протекает только в прямом направлении. Примером является следующая реакция: ZnS + 2HCl⇒ZnCl₂ + H₂S
Если мы возьмем продукты этой реакции и постараемся сделать так, чтобы они взаимодействовали, то ничего из этого не выйдет. Поэтому реакция и называю необратимой.
Идеальное равновесие
| Что выбирает химия – равновесие или хаос? На самом деле, химия не любит равновесие, баланс и порядок, она топит за хаос и смещение равновесия. Однако иногда возникает такая ситуация, когда в единицу времени (секунду/минуту) в единице объема или на единицу поверхности образуется одинаковое количество и продуктов, и реагентов. Запомним: когда продуктов и реагентов одинаковое количество, наступает химическое равновесие. |
Давайте ненадолго вернемся в окружающий нас мир. Наша человеческая природа тоже постоянно стремится к хаосу: нам проще оставить мытьё посуды на потом, чем помыть сразу, нам не хочется после учебы сразу пойти и постирать все вещи или сложить их аккуратно в шкаф. Они чаще всего либо валяются на диване, либо висят на стуле и так далее. Но иногда к нам домой приходят гости или друзья, мы не хотим, чтобы они увидели бардак и поэтому начинаем убираться. И на какое-то время мы говорим “стоп” хаосу и “привет” равновесию и порядку. Замечаете сходство? В химии точно так же!
| Какая связь между химическим равновесием и весами? Чтобы легче запомнить правило химического равновесия, возьмем образ весов. Если чаши наполнены продуктами и реагентами равномерно, весы будут идеально прямы. Так и визуализируйте, когда надо вспомнить. |

Влияние на равновесную систему
С химическим равновесием разобрались, теперь двигаемся дальше.
Что будет, если на нашу идеальную равновесную систему оказать какое-либо влияние?
Произойдет смещение, то есть сдвиг равновесия – нарушение химического равновесия за счет преобладания скорости прямой или обратной реакции.
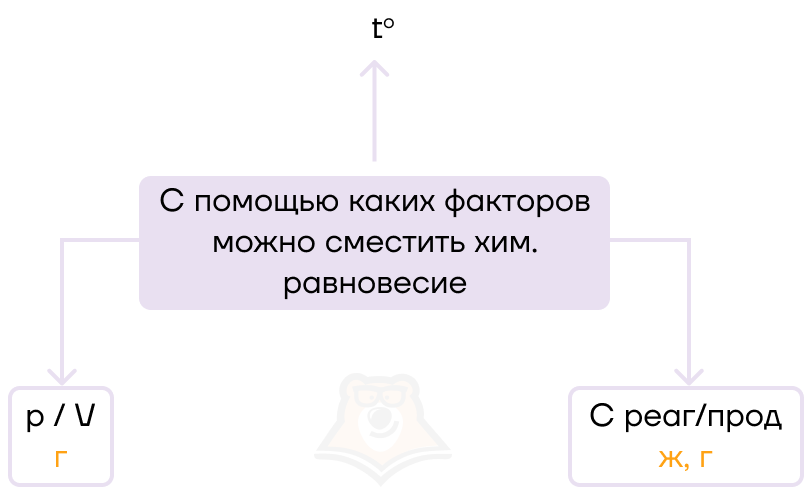
На химическое равновесие будет влиять несколько факторов:
- температура,
- давление и объем,
- концентрация реагента или продукта.
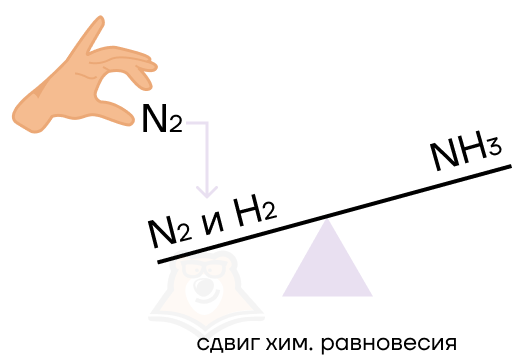
Как же определить, как именно какое-то воздействие повлияет на химическое равновесие? Здесь нам поможет волшебное правило Ле Шателье. Согласно ему при действии на систему, которая находится в равновесии, равновесие смещается в ту сторону, которая будет ослаблять воздействие.
То есть система, как капризный ребёнок, всё делает наоборот. Действие, которое будут оказывать на него, будет вызывать кучу криков и споров, то есть противодействие.
Теперь давайте углубимся в факторы, которые влияют на равновесие. Важно понимать, что может вывести систему из себя.
- Температура
Мы уже знаем, что по тепловому эффекту реакции делят на экзо- и эндотермические.
Подробнее об этом можно прочитать в следующей статье: «Электролитическая диссоциация электролитов в водных растворах».
Так как согласно правилу Ле Шателье система нам всегда противодействует, то:
- при повышении температуры (+) равновесие будет смещаться в сторону эндотермической реакции (-);
- при понижении температуры (-) – в сторону экзотермической реакции (+).
Подробнее про типы химических реакций можно прочитать в статье «Химические реакции по тепловому эффекту».
Рассмотрим теперь это на примере:
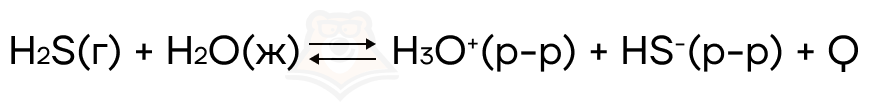
При увеличении температуры, равновесие такой реакции будет смещаться в сторону обратной реакции, так как именно в ту сторону будет идти эндотермическая реакция.
А при уменьшении температуры, равновесие сместится в сторону прямой реакции, так как там происходит экзотермическая реакция.
- Концентрация
Опять же вспоминаем, что система – вредный ребенок, который всё делает наоборот. Поэтому при добавлении какого-либо вещества (повышении концентрации) она старается поскорее его израсходовать, а при уменьшении концентрации (разбавлении) наоборот – экономить и забирать это вещество себе.
То есть при повышении концентрации реагентов и понижении концентрации продуктов происходит сдвиг равновесия в сторону продуктов, а при понижении концентрации реагентов и повышении концентрации продуктов равновесием смещается в сторону реагентов.
Рассмотрим теперь это на примере:
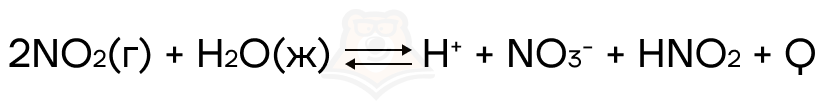
Что произойдет при увеличении концентрации азотистой кислоты?
Увеличится концентрация продукта, следовательно равновесие сместится в сторону реагентов.
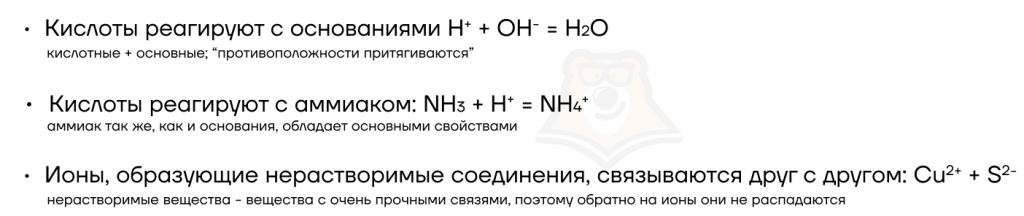
| Важно! Добавление твердых нерастворимых веществ не оказывает влияния на смещение равновесия. |
Однако при добавлении твердых растворимых веществ смещение может происходить, так как в воде растворимые вещества диссоциируют на ионы, то есть распадаются на заряженные частицы.
Например:
- Давление (только для газов)
Правило “сделай наоборот” работает и для этого фактора. При увеличении давления равновесие смещается в сторону меньших объемов газов, а при уменьшении давления – в сторону больших объемов газов.
Как посчитать эти объемы газов?
Легко! Просто считаем сколько всего моль газов и в продуктах и в реагентах, где количество вещества больше, там и объем больше!
Рассмотрим на примере:
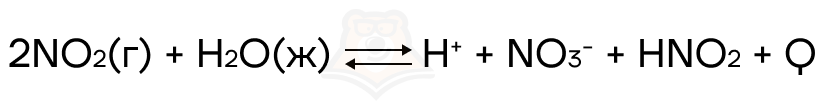
Что произойдёт при увеличении давления?
Считаем газы (в реагентах 2 моль, в продуктах 0 моль), поэтому равновесие сместится в сторону продуктов.
| Важно! Давление и объем обратно пропорциональны, поэтому увеличение давления = уменьшение объема, а уменьшение давления = увеличение объема. |
| Может ли “такси” сместить химическое равновесие? Какое такси? Мы говорим о катализаторе, который разгоняет скорость химической реакции. Он и является “такси” в химии. Подробнее про это можно почитать в статье: «Скорость химической реакции». Так вот, несмотря на то, что катализатор влияет на скорость реакции, на смещение равновесия он влиять не будет! Так что его “услуги” тут не будут работать. |
Фактчек
- Химическое равновесие – это то чувство системы, когда она находится в балансе, то есть когда скорость её прямой и обратной реакции равны.
- Прямая реакция – реакция, которая направлена в сторону продуктов.
- Обратная реакция – реакция, которая направлена в сторону реагентов.
- Если реакция протекает в обоих направлениях (и прямом, и обратном), то такая реакция называется обратимой.
- Правило Ле Шателье – при действии на систему, которая находится в равновесии, равновесие смещается в ту сторону, которая будет ослаблять воздействие.
- Факторы, которые влияют на равновесие системы: температура, концентрация, давление.
Проверь себя
Задание 1.
Куда сместится равновесие при добавлении соляной кислоты в реакции:
H2 + Cl2 = 2HCl
- В сторону продуктов
- В сторону реагентов
- Не сместится
Задание 2.
Куда сместится равновесие при уменьшении давления: N2 + 3H2 = 2NH3
- В сторону продуктов
- В сторону реагентов
- Не сместится
Задание 3.
Куда сместится равновесие при добавлении катализатора в реакции:
NaOH + HCl = NaCl + H2O
- В сторону продуктов
- В сторону реагентов
- Не сместится
Ответы: 1. — 2; 2. — 2; 3. — 3.


 к списку статей
к списку статей



