Количество теплоты и фазовые переходы
На этой странице вы узнаете
- Может ли жидкость не течь?
- Как из воды можно получить соль?
- Что будет, если очень сильно нагреть газ?
Представим, что меняется время года. После холодной зимы приходит теплая и солнечная весна. Лед в реке… Стойте, а где он? Почему здесь только вода? Оказывается, что лед растаял и стал водичкой.
А пусть теперь летний жаркий день. Вода в реке стала убывать, но куда? Оказывается, часть воды перешла в пар.
Да, сейчас мы с вами поговорим про агрегатные состояния вещества и как они переходят из одного вида в другой.
Агрегатные состояния веществ
В жизни мы с вами часто пользуемся водой. Именно на примере данного вещества мы и рассмотрим возможные агрегатные состояния тел в нашем мире.
Агрегатное состояние — физическое состояние вещества, зависящее от соответствующего сочетания температуры и давления.
По определению агрегатное состояние тела зависит от его температуры. И правда: если охладить воду до низкой температуры, то она заморозится и получится лед; если нагреть до высокой температуры — вода испарится.
В физике существует 3 агрегатных состояния тел, которые индивидуальны для каждого вещества.
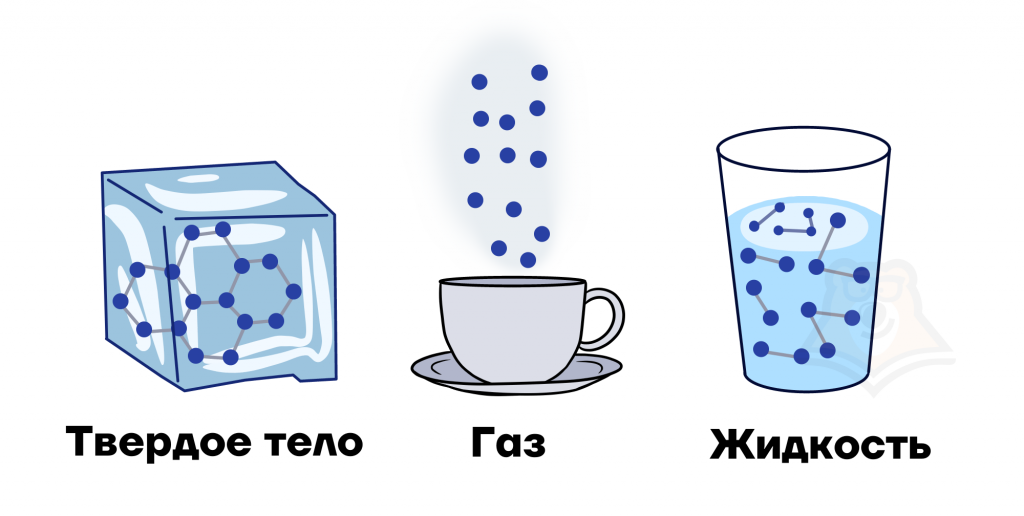
- Твердое состояние. Это практически любой предмет, который мы встречаем в жизни. Например, лед, стол, машина.
Твердое состояние тела характеризуется наличием кристаллической решетки.
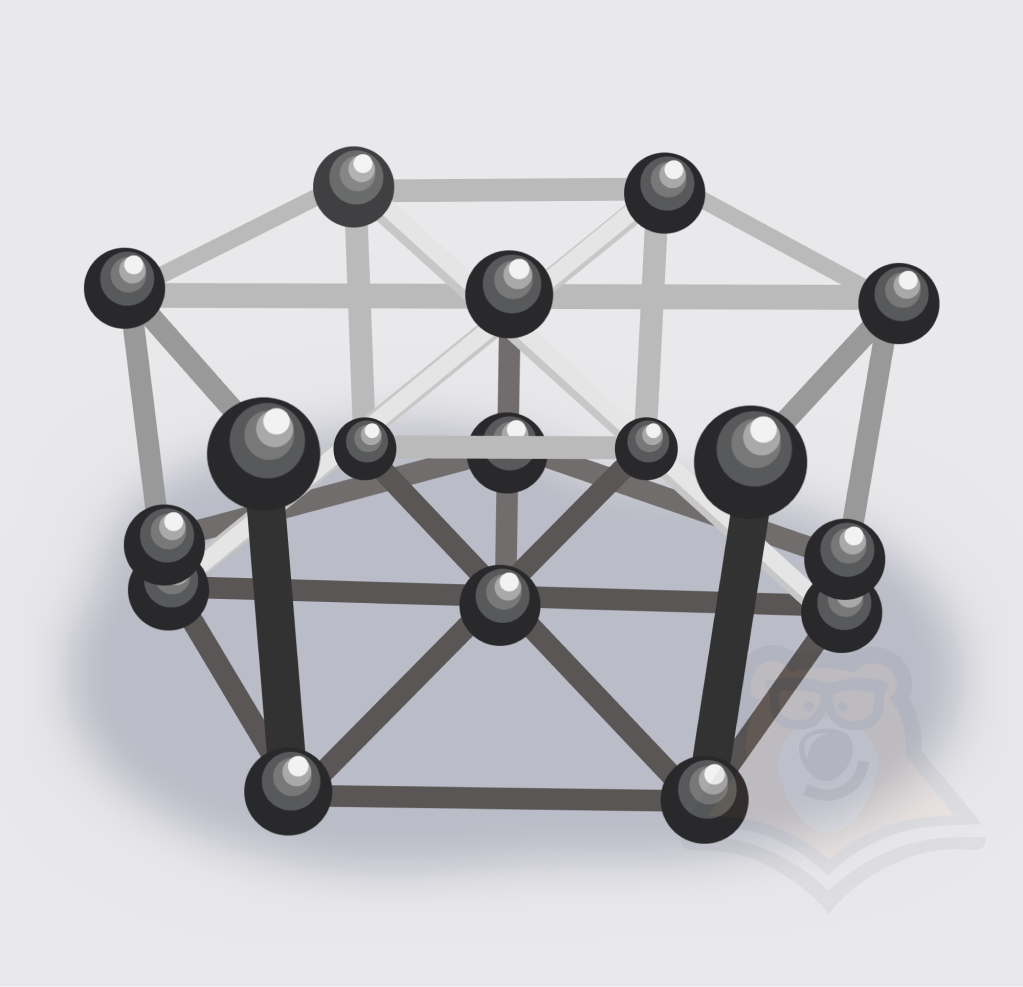
Кристаллическая решетка — пространственная структура вещества, где молекулы упорядочены и закреплены на своих местах.
Благодаря наличию кристаллической решетки, твердые тела обладают постоянной формой и объемом.
- Жидкое состояние. Например: вода, сок, духи.
Почему вода растекается? Вещества в жидком состоянии лишены кристаллической решетки, из-за чего молекулы могут свободно перемещаться по всему объему тела. При этом сохраняется объем тела, а форма изменяется.
Если мы перельем всю воду из бутылочки в стакан, она примет форму стакана, но объем воды останется тот же. Именно поэтому вода и растекается по поверхности — она как бы стремится занять весь объем.

| Может ли жидкость не течь? Оказывается, существуют такие жидкости, которые не могут течь в привычном понимании. Они занимают некоторое положение, которое можно изменить, только прикладывая внешнюю силу. Такие жидкости называются неньютоновские жидкости. Одним из отдаленных примеров является известный вам лизун (жвачка для рук, слайм). |

- Газообразное состояние. Например: пар, гелий в воздушных шариках, дым костра.
Почему мы чувствуем отдаленные запахи?
Запах — это газ. Газообразные вещества также лишены кристаллической решетки, при этом сам газ не сохраняет свои форму и объем: он постоянно перемещается в пространстве и занимает весь предоставленный ему объем.
Почему вода может превратиться в пар, так сильно отличающийся от нее по свойствам? Интутитивно понятно, что для этого воде нужно сообщить какую-то энергию. О том, что это за энергия, мы поговорим дальше.
Количество теплоты
Логичен факт: чтобы нагреть тело, надо передать ему тепло. Аналогично: чтобы охладить тело, оно должно отдать свое тепло. Например, мы нагреваем воду в чайнике с помощью нагревательного элемента, который и передает ему свое тепло. Такое тепло в физике называют количеством теплоты Q.
Количество теплоты — энергия, которую получает или отдает тело в процессе теплообмена с другими телами или окружающей средой.
Сколько нужно тепла для изменения температуры тела? Для ответа на этот вопрос на помощь приходит формула количества теплоты.
| Q = cm(t2 – t1), где Q — количество теплоты (Дж); c — удельная теплоемкость тела (Дж/(кг*oC)); m — масса тела (кг); t2 и t1 — конечная и начальная температуры тела (oC). |
Заметим, что тело может как нагреваться, так и охлаждаться. Тогда по формуле:
- при нагревании: t2 > t1: Q > 0, мы должны передать тепло телу;
- при охлаждении: t2 < t1: Q < 0, мы должны забрать тепло у тела.
В формуле появилась новая величина — удельная теплоемкость тела.
Удельная теплоемкость тела — количество теплоты, необходимое для нагревания 1 кг тела на 1 градус. \([c] = \frac{Дж}{кг*С⁰}\)
Стоит отметить, что эта величина индивидуальна для каждого вещества. Значение удельной теплоемкости веществ можно посмотреть в справочных материалах.

Мы дали определение энергии, которую нужно дать телу для его нагрева или охлаждения. Теперь давайте поговорим про количество теплоты, которое нужно передать телу, чтобы оно изменило свое агрегатное состояние.
Фазовые переходы
Как мы выяснили ранее, агрегатное состояние вещества зависит от температуры. Значит, при достижении определенной температуры тело способно изменить свое состояние. Такое явление называется фазовым переходом.
Фазовый переход — изменение агрегатного состояния вещества.
Существует 4 вида фазовых переходов, которые зависят от температуры тела:
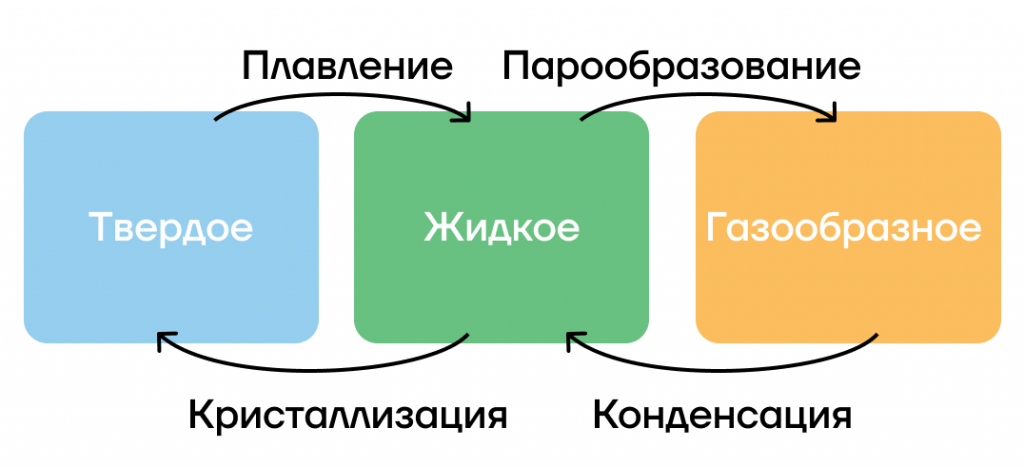
- Кристаллизация — переход из жидкого состояния в твердое. Например, вода превращается в лед при 0 градусов по шкале Цельсия.

| Как из воды можно получить соль? Если вы соскучились по красивым видам или вам захотелось попробовать необычной соли, то вам следует отправиться в Крым на оЕсли вы соскучились по красивым видам или вам захотелось попробовать необычной соли, то вам следует отправиться в Крым на озеро Сасык. В дни, когда на улице очень жарко, вода начинает сильнее испаряться. Из-за этого из воды начинают показываться кристаллы соли, а пигментация местных водорослей усиливается, что дает красивый красный цвет. |

- Плавление — переход из твердого состояния в жидкое. Например, таяние льда. Интересно, что железо имеет температуру плавления в 1549 ℃. А рекордсменами являются вольфрам с температурой плавления 3387 ℃ и ртуть с температурой плавления –37 ℃.
При плавлении происходит поглощение энергии, то есть к телу нужно неустанно подводить тепло. Это тепло переходит в кинетическую энергию молекул, которые начинают сильнее колебаться в узлах кристаллической решетки. Размах их колебаний увеличивается до такой степени, что кристаллы теряют свою форму. Так вещество плавится, переходя из твердого состояния в жидкое. При этом его внутренняя энергия увеличивается.
А вот при кристаллизации вещества выделяется такое же количество теплоты, которое поглощается при плавлении. Причем его внутренняя энергия уменьшается.
Чтобы вычислить количество теплоты, которое необходимо для плавления тела, ввели понятие удельной теплоты плавления.
Удельная теплота плавления — количество теплоты, которое необходимо передать телу массой 1 кг для его плавления, \([λ] = \frac{Дж}{кг}\)
| Q=λm, где Q — количество теплоты (Дж); λ — удельная теплота плавления (Дж/кг); m — масса тела (кг). |
- Конденсация — переход из газообразного состояния в жидкое. Например, запотевание окон в полном людей автобусе.
- Парообразование — переход из жидкого состояния в газообразное. Например, испарение воды из чайника при ее нагревании до 100 градусов Цельсия (кипении).

Для процесса парообразования, как и для плавления, характерна удельная теплота парообразования.
Удельная теплота парообразования — количество теплоты, которое необходимо передать телу массой 1 кг для его обращения в пар, \([L] = \frac{Дж}{кг}\)
| Q=Lm, где Q — количество теплоты (Дж); L — удельная теплота парообразования (Дж/кг); m — масса тела (кг). |
Парообразование всегда сопровождается поглощением энергии, то есть телу нужно постоянно сообщать тепло. Это тепло переходит в кинетическую энергию молекул вещества, они начинают обладать достаточной скоростью, чтобы вырваться с поверхности жидкости. Так получается пар. При этом внутренняя энергия тела увеличивается.
А вот для конденсации ситуация противоположная, ведь это процесс, обратный парообразованию. Переход вещества из газообразного состояния в жидкое сопровождается выделением энергии, то есть от тела отводят теплоту. При этом внутренняя энергия вещества уменьшается.
Также есть еще 1 немаловажный процесс — сгорание топлива. Оно характерно тем, что при сгорании некоторого вещества выделяется тепло. Часто этот процесс используется в двигателях, работа которых основана на внутреннем сгорании топлива.
Горение — выделение теплоты при горении твердых, жидких и газообразных веществ.
Удельная теплота сгорания топлива — количество теплоты, которое выделяется при полном сгорании 1 кг топлива. \([r] = \frac{Дж}{кг}\)
| Q=rm, где Q — количество теплоты (Дж); r — удельная теплота сгорания топлива (Дж/кг); m — масса тела (кг). |
Важно отметить, что во всех формулах отсутствует температура. Это значит, что во время фазовых переходов температура тела не меняется. Да, тело получает (или отдает) тепло, но это тепло уходит на смену агрегатного состояния.
Заметим, что процессы кристаллизации-плавления и конденсации-парообразования являются взаимно обратными. Это значит, что для расчета теплоты для каждой из пар этих процессов используются одинаковые формулы, но с разными знаками.
- При плавлении и парообразовании тело получает тепло: Q > 0.
- При кристаллизации и конденсации тело отдает тепло: Q < 0.
Умение считать количество теплоты плавления или парообразования пригодится для решения №23 ЕГЭ.
Задание. В начале процесса температура куска свинца массой 1 кг была равна 47 °С. Ему передали количество теплоты, равное 46,4 кДж. Температура плавления свинца равна 327 °С. Какова масса расплавившегося свинца? Тепловыми потерями пренебречь, ответ дать в кг.
Решение. Мы точно не знаем, весь свинец расплавился или только его часть, это нужно проверить расчетами.
Чтобы нагреть свинец до температуры плавления, нужна теплота:
Q = cm∆t = 130 1*(327 – 47) = 36400 (Дж) = 36,4 (кДж).
Чтобы полностью расплавить, нужна:
Q = λm = 2,5*104*1 = 25000 (Дж) = 25 (кДж).
В сумме надо затратить 36,4 + 25 = 61,4 (кДж).
Мы по условию даем меньше, значит, расплавится только часть свинца. Тогда:
Q = cm∆t + λm’, откуда
λm’ = Q – cm∆t,
масса расплавившегося свинца:
\(m’ =\frac{ Q — cm∆t}{λ}=\frac{46400-36400}{2,5*10^4}=0,4\) (кг)
Ответ: 0,4
Мы узнали, какими бывают фазовые переходы. Теперь давайте посмотрим на их график.
График фазовых переходов
Проанализируем, как выглядит график фазовых переходов на примере воды. Пусть в начальном состоянии «А» вода находится в твердом состоянии — лед.
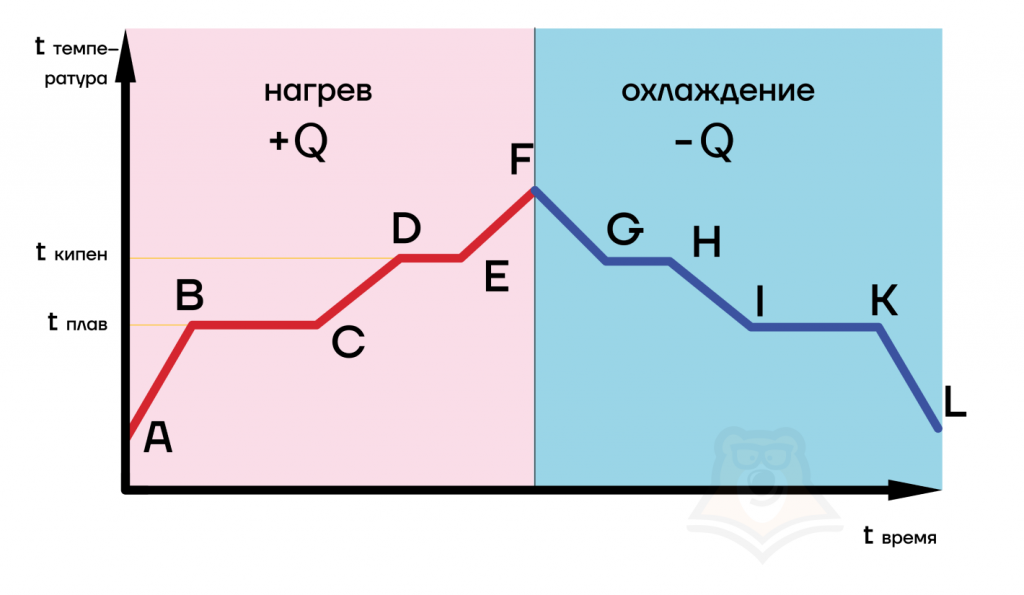
- AB — нагревание льда до температуры плавления 0 градусов Цельсия.
- BC — плавление льда при постоянной температуре. В точке B это еще лед, в промежуточной точке — вода со льдом, а в точке С лед уже полностью превратится в воду.
- CD — нагревание воды до температуры кипения 100 градусов Цельсия.
- DE — парообразование (кипение) воды. При постоянных 100 градусах вода превращается в пар.
- EF — нагревание пара.
Следующие процессы по времени и теплоте равны первым пяти, однако в первых процессах тело получает тепло (нагревание, плавление, парообразование), а потом отдает тепло (охлаждение FG, конденсация GH, кристаллизация IK).
А теперь давайте потренируемся и решим задачку №9 ЕГЭ.
Задание. В цилиндре под поршнем находится твердое вещество. Цилиндр поместили в печь. На рисунке дан график изменения температуры вещества по мере поглощения им количества теплоты Q. Выберите все утверждения, которые соответствуют результатам наблюдений.
1) Температура плавления вещества равна 40 °С.
2) В состоянии 2 у вещества максимальная внутренняя энергия.
3) Для того, чтобы полностью расплавить вещество, уже находящееся при температуре плавления, ему надо передать 40 Дж теплоты.
4) На участке 2—3 переход вещества в газообразное состояние.
5) Удельная теплоемкость вещества в жидком состоянии меньше, чем в твердом.
Решение. По графику видим, что сначала происходит процесс нагревания твердого вещества, затем плавление при постоянной температуре 40 °С. После — нагревание жидкого вещества, затем кипение при постоянной температуре 80 ºС.
Пункт 1 верный, пункт 2 нет, так как внутренняя энергия растет при нагревании жидкости, в состоянии 3 она будет еще больше.
Пункт 4 убираем, переход в газообразное состояние будет дальше состояния 3.
На процесс плавления по графику нужно потратить 80 – 40 = 40 (Дж), пункт 3 правильный.
Остался пункт 5, он неправильный. Чтобы это доказать, распишем теплоту нагревания твердого и жидкого вещества:
\(Q1 = c1m∆t1, Q2 = с2m∆t2\)
Отсюда удельные теплоемкости c1 = Q1 / m∆t1 и с2 = Q2 / m∆t2. Чтобы сравнить, поделим их друг на друга: \(\frac{c_1}{c_2}=\frac{Q_2m∆t_1}{Q_1m∆t_2}=\frac{Q_2∆t_1}{Q_1∆t_2}=\frac{80*30}{40*40}=1,5\). Видим, что с2 (в жидком состоянии) больше в 1,5 раза.
Ответ: 13
| Что будет, если очень сильно нагреть газ? На самом деле, мы пропускаем еще 1 процесс — переход из газообразного состояния в плазму. Он слишком сложен для школьной программы, но стоит знать, что газ — не окочательное состояние вещества. И даже сама плазма не является конечной остановкой смены агрегатных состояний веществ. Кстати говоря, Солнце целиком и полностью состоит из плазмы. |

Мы узнали много нового, например, что такое парообразование, по какой формуле можно рассчитать количество теплоты при данном фазовом переходе и как выглядит его график. Но вы никогда не задумывались, почему превращение жидкости в пар происходит при определенной температуре? Постоянна ли эта температура, или она может меняться в зависимости от каких-то условий? Давайте поговорим об этом далее.
Кипение
Кипение – это парообразование по всему объему жидкости, которое происходит при определенной температуре, называемой температурой кипения.

Температура кипения определяется несколькими факторами:
- родом жидкости;
- внешними условиями, в частности, атмосферным давлением или давлением газа внутри закрытого сосуда.
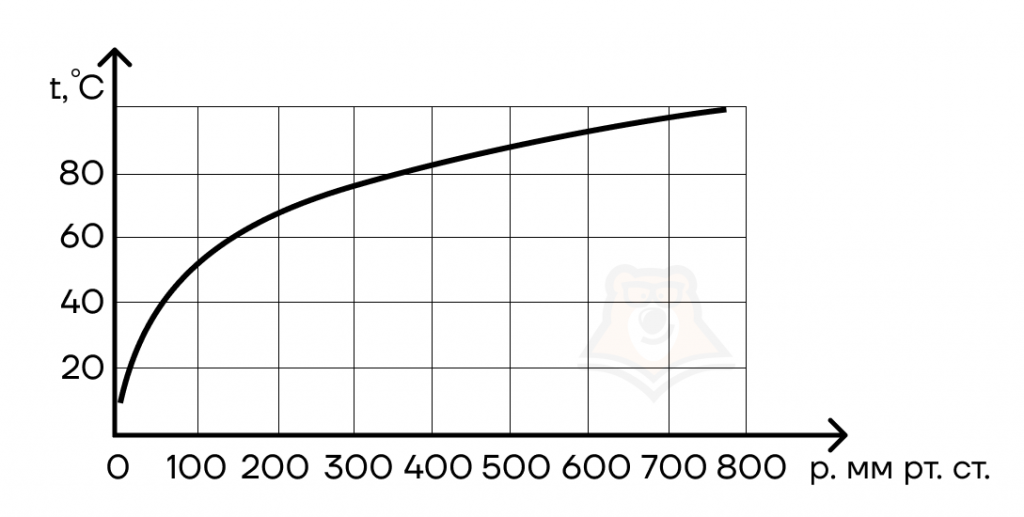
Чем больше внешнее давление, тем больше температура кипения. И наоборот, при уменьшении давления температура кипения также уменьшается. Эту закономерность мы можем видеть на картинке ниже, где изображена кривая зависимости температуры кипения от внешнего давления.
В этой статье мы заглянули в физику процессов, с которыми сталкиваемся каждый день – кипение воды в чайнике, таяние льда и снега, запотевание очков при входе в теплое помещение с холодной улицы. Но дальше – больше! В статье «Уравнение теплового баланса» вы узнаете, как находить количество теплоты для системы тел.
Фактчек
- Агрегатное состояние — физическое состояние вещества, зависящее от соответствующего сочетания температуры и давления.
- Существует три агрегатных состояния тел: твердое, жидкое и газообразное.
- Кристаллическая решетка — пространственная структура вещества, где молекулы упорядочены и закреплены на своих местах.
- Количество теплоты — энергия, которую получает или отдает тело при изменении его температуры.
- Фазовый переход — изменение агрегатного состояния вещества. Он делится на четыре вида: плавление, кристаллизация, конденсация и парообразование.
Проверь себя
Задание 1.
Благодаря чему твердые тела обладают постоянной формой и объемом?
- Твердости
- Кристаллической решетке
- Силе молекул
- Магия
Задание 2.
Почему вода растекается?
- Она жидкая.
- Ее кристаллическая решетка очень слабая.
- В ее структуре нет кристаллической решетки.
- Молекулы воды зафиксированы на месте.
Задание 3.
Почему мы чувствуем запахи?
- Газ занимает весь объем пространства.
- Молекулы воздуха очень сильные.
- Не всегда запах распространяется в пространстве.
- Газ имеет определенный объем.
Задание 4.
Что такое фазовый переход?
- Изменение температуры тела
- Изменение теплоты тела
- Изменение формы тела
- Изменение агрегатного состояния тела
Задание 5.
В каком из пунктов верно распределены пары фазовых переходов?
- Конденсация — охлаждение, парообразование — нагревание.
- Нагревание — охлаждение.
- Плавление — кристаллизация, парообразования — конденсация.
- Плавление — парообразование, кристаллизация — конденсация.
Ответы: 1. — 2; 2. — 3; 3. — 1; 4. — 4; 5. — 3.


 к списку статей
к списку статей





