Уравнение состояния идеального газа
На этой странице вы узнаете
- Чем Больцман выделяется на фоне всех других ученых?
- Какую ситуацию не может описать модель идеального газа?
- Ученых двое, а уравнение — одно. Как такое может быть?
Мы помним Менделеева как известного химика. Но на самом деле химия занимала всего около 10% его работ. Он занимался геологией, метеорологией, физикой и даже экономикой. Его таблица химических элементов является величайшим открытием в мире. Однако он изучал не только химические вещества, но и уравнения их состояния. Эти уравнения по сей день используются в науке. Давайте познакомимся с ними.
Уравнение состояния идеального газа
Вспомним основное уравнение МКТ \(p = \frac{1}{3}nm_0v^2\) и немного его преобразуем. Воспользуемся формулой кинетической энергии молекулы \(Е = \frac{m \bar{v^2}}{2} = \frac{3}{2}kT\), откуда \(m_0v^2 = 3kT\). Подставим это значение в самое первое уравнение:
\(p = \frac{1}{3}n * 3kT = nkT\).
Итак, мы вывели уравнение состояния идеального газа.
| p = nkT, где p — давление газа (Па); n — концентрация молекул (м-3); k — постоянная Больцмана (Дж/К); T — абсолютная температура (К). |
Уравнение состояния идеального газа связывает воедино макроскопические параметры, которые характерны видимым человеческому глазу объектам (давление и температура), и один микроскопический параметр (концентрацию молекул).
| Чем Больцман выделяется на фоне всех других ученых? Знали ли вы, что Больцман — единственный ученый, на чьей могиле выбита одна из самых важных формул в физике. Даже Эйнштейн не удостоился таких почестей. Дело в том, что Больцман слишком сильно опередил свое время. Он связал энергию молекулы и температуру с помощью постоянной k. Если присмотреться к фотографии, то можно заметить формулу: S = k * logW. Эта формула является статистическим определением энтропии. Но об этой формуле вы узнаете более подробно в ВУЗе. |

Какой газ принимать идеальным при расчетах? Любой газ считается идеальным,если соблюдаются следующие два условия:
- его давление составляет порядка одной атмосферы;
- его температура соответствует комнатной.

| Какую ситуацию не может описать модель идеального газа? К сожалению, модель идеального газа не всесильна. Есть ситуация, при которой данная модель не подходит. В случае, когда газ сжимают с такой силой, что он переходит в другое агрегатное состояние, невозможно применить модель идеального газа. К примеру, когда летом мы достаем из холодильника бутылку лимонада и на ней появляются запотевшие капли, то происходит процесс конденсации и газ переходит в жидкое состояние. В этом случае мы не сможем применить модель идеального газа для описания процесса. |

Для того чтобы связать концентрацию молекул газа, его температуру и давление, был разработан объединенный газовый закон, совмещающий в себе результаты работ многих ученых и приведенный в современный вид Д.И. Менделеевым. Математическое выражение этого закона получило название «уравнение Клапейрона-Менделеева».
Уравнение Клапейрона — Менделеева
Преобразуем уравнение состояния, используя величины, которые можно измерить без косвенных вычислений. Распишем концентрацию:
\(n = \frac{N}{V}\), где N — количество частиц, V — объем газа.
Получим:
\(p = \frac{N}{V}kT \Leftrightarrow pV = NkT\).
Подобные преобразования мы могли сделать самостоятельно, но ученые Менделеев и Клапейрон решили пойти дальше.
Учтем, что молярная масса газа (можно вывести из формул количества вещества):
\(M = m_0* N_A\).
Разделим правую часть нашего уравнения на M и умножим на \(m_0*N_A\):
\(pV = \frac{m_0 * N_A}{M}NkT\), где
\(m_0* N = m\) — масса газа,
\(kN_A= 8,31\) Дж / (Моль\(*К\)) \(= R\) — универсальная газовая постоянная.
Тогда:
\(pV = \frac{m}{M}RT\)
Данное уравнение и является уравнением Клапейрона — Менделеева.
Уравнение Клапейрона — Менделеева связывает три макроскопических параметра газа: давление, массу и температуру.
| \(pV = \frac{m}{M}RT\), где p — давление газа (Па); V — объем, занимаемый газом (м3); m — масса газа (кг); M — молярная масса (кг/моль); R — универсальная газовая постоянная (Дж/ (Моль*К)); T — абсолютная температура (К). |
Разберем некоторые примеры применения уравнения Клапейрона-Менделеева, которые встречаются во второй части ЕГЭ № 24.
Задание. В день включения отопления комната нагрелась с 10 до 25°C. При нормальном давлении объем комнаты составляет 40 м3. Необходимо вычислить, какая масса воздуха выйдет из комнаты, при изменении температуры. Ответ выразить в килограммах и округлить до сотых.
Решение. Для начала переведем все единицы измерения в систему СИ. Нормальное давление P будет равно \(10^5\) Па, \(R = 8, 31\) Дж/(моль*К), \(\mu=0,029\) кг/моль, \(T_1=10+273=283 К, T_2=25+273=298 К\).
Теперь выведем формулу изменения массы на основе уравнения Клапейрона-Менделеева:
\(pV=\frac{m_1}{\mu}RT_1\) \(pV=\frac{m_2}{\mu}RT_2\) \(\Rightarrow\)
\(\Delta m=m_1-m_2= \frac{pV\mu}{R}(\frac{1}{T_1}-\frac{1}{T_2})=\frac{10^5Па*40 м^3*0,029 кг/моль}{8,31 Дж/(мольК)}(\frac{1}{283}-\frac{1}{298})\approx 2,48 кг\)
Ответ: 2,48 кг
Из уравнения Клапейрона-Менделеева следует 3 закона, характеризующих изопроцессы, при которых один из параметров является постоянным, а другие определяются по пропорции.
Таким образом, мы можем убедиться в универсальности объединенного газового закона, который связывает параметры температуры, давления и объема, который, в свою очередь, можно выразить через массу и плотность. Такие закономерности позволяют говорить о важной роли изопроцессов в практическом применении законов.
Изопроцессы
Если мы посмотрим на формулу выше, то поймем, что в ней очень много переменных.
Представим выращивание арбузов. Их сладость зависит от грунта, климата, заботы о растении и так далее. Интересно, что если мы где-то уменьшим заботу о растении, но оно будет в более благоприятном климате, то его сладость останется неизменной.
В физике же исследователи анализируют поведение идеального газа, изменяя его макроскопические параметры, один из которых остается постоянным. Такие процессы, происходящие над газом, называют изопроцессами. Зачастую массу газа стараются сохранять постоянной. Тогда в уравнении остается лишь 3 переменных.
Изопроцесс — это процесс, в котором при неизменной массе вещества один из макроскопических параметров газа остается постоянным.
Существует 3 вида изопроцессов:
- изотермический, при котором постоянной остается температура T;
- изобарный, при котором постоянным остается давление p;
- изохорный, при котором постоянным остается объем V.
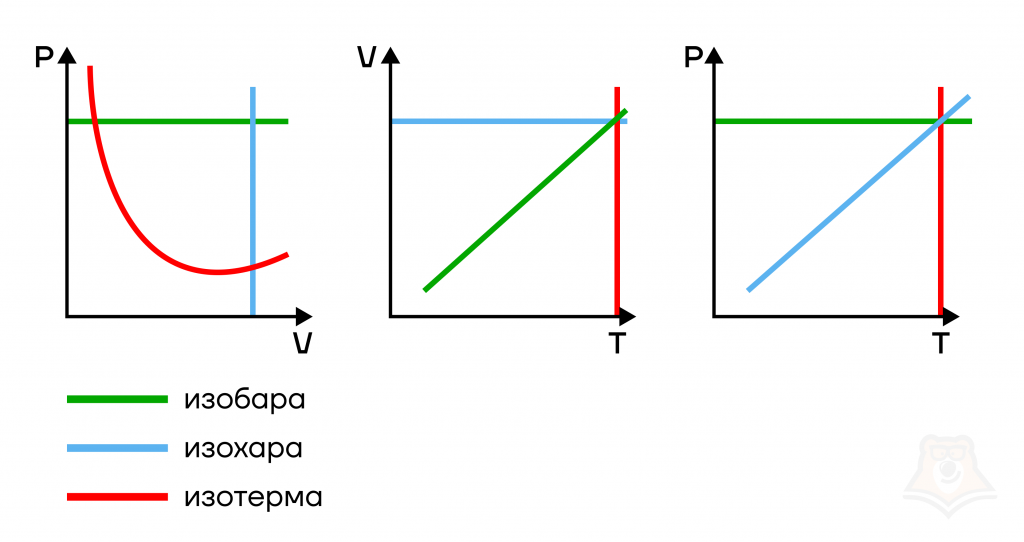
Зная графические зависимости давления, температуры и объема друг от друга, становится возможным определение характера одного из этих параметров, если он не известен по условию задачи.
Рассмотрим более подробно, как это можно сделать.
Изотермический процесс
Закон Бойля — Мариотта: для газа постоянной массы при постоянной температуре произведение давления газа на его объем постоянно.
| p1V1 = p2V2, где p1 — давление газа в состоянии 1 (Па); V1 — объем, занимаемый газом, в состоянии 1 (м3); p2 — давление газа в состоянии 2 (Па); V2 — объем, занимаемый газом, в состоянии 2 (м3). |
Этот закон можно записать следующим образом: pV = const.
Следствием данного закона является то, что при T = const и m = const увеличение значения одного из параметров (p или V) приведет к уменьшению другого.
К каждому процессу рисуется график зависимости одной величины от другой. При этом координаты зачастую представлены в осях, связанных с микропараметрами: pV, pT, VT. Изотермический процесс на графиках выглядит так: в осях p(V) — гипербола (изотерма), в осях p(T) и V(T) — прямые, параллельные оси p и V соответственно.
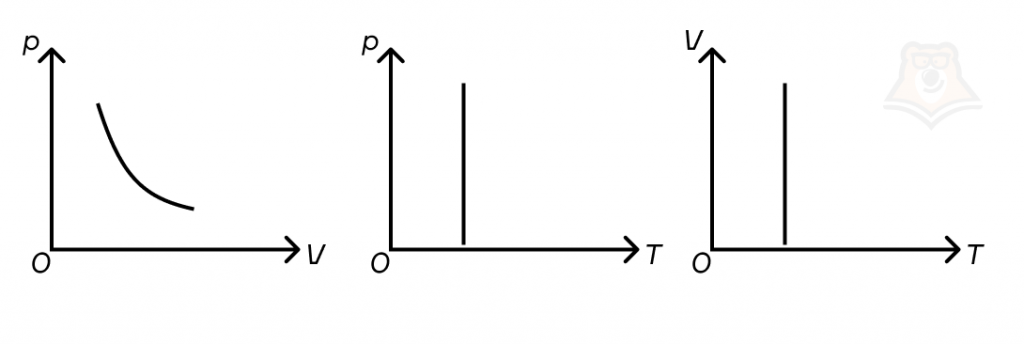
Из закона Клапейрона — Менделеева \(pV = \frac{m}{M}RT\) следует, что при m = const произведение pV прямо пропорционально зависит от температуры T: чем больше температура T, тем дальше от начала графика находится изотерма в осях p(V).
Если с законом Бойля-Мариотта нет вопросов, то с авторством следующих двух законов существует целое поле для дискуссий. Это связано с тем, что история открытий газовых законов не однозначна и происходила в один промежуток времени. Поэтому закон Гей-Люссака часто называют законом Шарля и наоборот. Попробуем разобраться, в чем отличие.
Изобарный процесс
Закон Гей-Люссака: для газа постоянной массы при постоянном давлении отношение объема газа к его температуре постоянно.
| \(\frac{V_1}{T_1} = \frac{V_2}{T_2}\), где V1 — объем, занимаемый газом в состоянии 1 (м3); T1 — температура газа в состоянии 1 (К); V2 — объем, занимаемый газом в состоянии 2 (м3); T2 — температура газа в состоянии 2 (К). |
Или кратко: \(\frac{V}{T} = const\).
Из этого закона следует, что увеличение значения одного из параметров (V или T) приводит к увеличению другого. График данного процесса в осях V(T) — прямая, выходящая из начала координат.
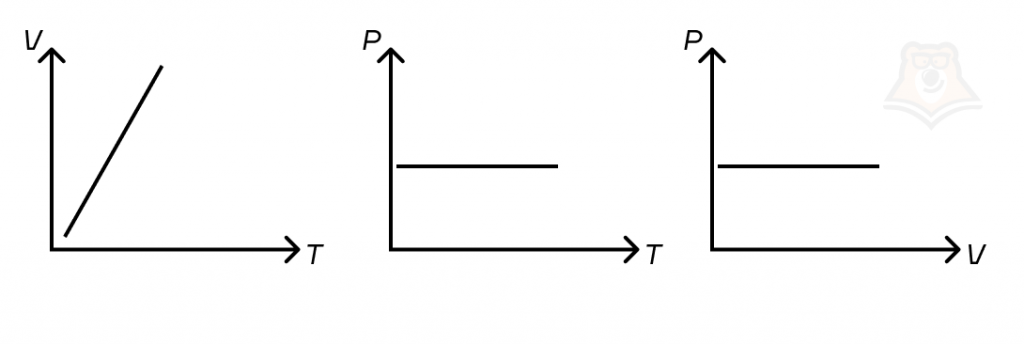
Определим, от чего зависит угол наклона графика в осях V(T). Из уравнения Клапейрона — Менделеева \(pV = \frac{m}{M}RT\) получим:
\(V = \frac{mRT}{Mp}\)
То есть при постоянной массе угол наклона графика обратно пропорционально зависит от давления p: чем больше давление, тем меньше угол наклона, и наоборот.
Графически эту закономерность можно представить в виде прямой в координатах P0T, которая будет называться изобарой и изображаться параллельно оси 0Т.
А какая закономерность может охарактеризовать газ с постоянной массой и объемом? Для этого необходимо применить закона Шарля, который также называют вторым законом Гей-Люссака.
Изохорный процесс
Закон Шарля: для газа постоянной массы при постоянном объеме отношение давления газа к его температуре постоянно.
| \(\frac{p_1}{T_1} = \frac{p_2}{T_2}\), где p1 — давление газа в состоянии 1 (Па); T1 — температура газа в состоянии 1 (К); p2 — давление газа в состоянии 2 (Па); T2 — температура газа в состоянии 2 (К). |
Или кратко: \(\frac{p}{T} = const\).
Из этого закона следует, что увеличение значения одного из параметров (p или T) приводит к увеличению другого.
График изохорного процесса (как и в предыдущем случае) в осях p(T) — прямая, выходящая из начала координат:
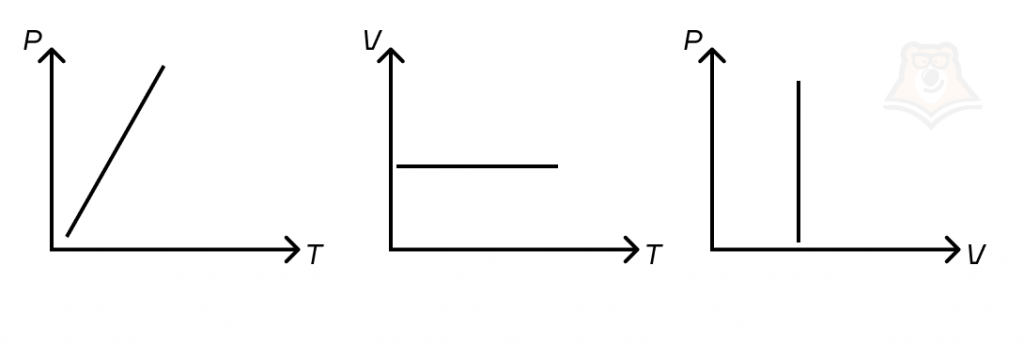
По аналогии с изобарным процессом угол наклона графика в осях p(T) обратно пропорционально зависит от объема V: чем больше давление, тем меньше угол наклона, и наоборот.
Рассмотрим другой пример применения уравнения Клапейрона-Менделеева для решения задания № 25 во второй части ЕГЭ.
Задание. В закрытом сосуде находится 5 моль кислорода. Объем сосуда – 15 л. Температура газа в нем равна 132 °C. Чему равно давление газа в сосуде? Ответ выразите в килопаскалях (кПа) и округлите до целых.
Решение. Для начала переведем все единицы измерения в систему СИ. \(R = 8,31 Дж/(моль*К), V=15*10^{-3}м^3, T = 132 + 273 = 405 К\).
Теперь выведем формулу давления на основе уравнения Клапейрона-Менделеева:
\(PV=RT \Rightarrow P=\frac{\upsilon RT}{V}=\frac{5*8,31*405}{15*10^{-3}}=1121,85 *10^3Па\approx 1122 кПа\)
Ответ: 1122 кПа

Замечание. В физике, как всегда, много схожих формул и графиков. Иногда их довольно сложно запомнить. Но если не запоминать графики, а научиться их выводить, то все станет на порядок легче.
Если мы запишем уравнение Клапейрона — Менделеева и будем выносить постоянное значение (p, V или T) в правую часть, то далее мы спокойно можем получить уравнение вида y = const * x и нарисовать необходимый график. Физику проще понять, чем вызубрить.
| Ученых двое, а уравнение — одно. Как такое может быть? Как и многие законы, уравнение состояния идеального газа \(pV = \frac{m}{M}RT\) было выведено общими усилиями нескольких физиков. Правильно говорить уравнение Клапейрона–Менделеева, так как именно Клапейрон объединил все газовые законы в 1 закономерность, а Менделеев вывел известную для вас формулу для 1 моля вещества. |

Бенуа Поль Эмиль Клапейрон 
Дмитрий Иванович Менделеев
Итак, мы с вами разобрались, какое состояние газа считается идеальным и как правильно применять эту информацию при решении задач. Познакомились с универсальным уравнением Клапейрона-Менделеева и научились находить неизвестные величины по графикам изопроцессов. А как эти знания пригодятся нам для определения количества теплоты и фазовых переходов, можно узнать в этой статье.
Термины
Макроскопические параметры – физические величины, характеризующие состояние тела без учета их молекулярного строения (V, P,T).
Микроскопические параметры – индивидуальные характеристики тела, описывающие поведение молекул, из которых оно образовано (концентрацию молекул).
Молярная масса – физическая величина, характеризующая 1 моль вещества.
Конденсация – физический процесс, при котором пар превращается в жидкость, выделяя определенную энергию.
Фактчек
- Уравнение состояния идеального газа связывает макроскопические и один микроскопический параметр газа.
- Уравнение Клапейрона — Менделеева связывает три макроскопических параметра газа.
- Изопроцесс — это процесс, при котором при неизменной массе вещества один из макроскопических параметров газа остается постоянным.
- Идеальный газ – это газ, соответствующий двум критериям: давление порядка одной атмосферы и комнатная температура.
- Из уравнения Клапейрона-Менделеева следует 3 закона, характеризующих изопроцессы: изобарный – закон Гей-Люссака, изотермический – закон Бойля-Мариотта и изохорный – закон Шарля.
- В случае, если один из параметров температуры, давления или объема неизвестен, возможно его найти, зная графики зависимостей изопроцессов.
Проверь себя
Задание 1.
Что показывает уравнение состояния идеального газа?
- Газ идеальный
- Газ неидеальный
- Связывает макро- и микроскопические параметры газа
- Показывает макроскопические параметры газа
Задание 2.
Что связывает уравнение Менделеева-Клайперона?
- Макроскопические параметры газа
- Макро- и микроскопические параметры газа
- Идеальный и неидеальный газы
- Три макроскопических параметра газа
Задание 3.
Какие параметры называются макроскопическими?
- Которые характеризуют тело, как единое целое
- Которые характеризуют тело, состоящее из мелких частиц
- Которые характеризуют частицы тела
- Параметры мельчайших частиц
Задание 4.
Что такое изопроцесс?
- Изменение двух параметров газа при неизменных массе и одном другом параметре
- Изменение всех параметров газа
- Увеличение значения параметра газа
- Изменение одного параметра газа
Задание 5.
Как называется изопроцесс, при котором увеличивается объем и давление газа?
- Изотермический
- Изохорный
- Изобарный
- Это не изопроцесс
Ответы: 1. – 3; 2. – 4; 3. – 1; 4. – 1; 5. – 4.


 к списку статей
к списку статей






