Основные понятия и положения МКТ
На этой странице вы узнаете
- Почему моль необязательно гнать из дома?
- Когда весь мир остановится?
Было ли вам когда-нибудь интересно, из чего мы состоим? Возможно, кто-то скажет кости да мясо. Но что если мы посмотрим под большим увеличением микроскопа? Тогда увидим, что все мы состоим из молекул. Более того, каждый в мире предмет состоит из молекул. При этом у молекул существуют свои законы, по которым они движутся. В этой статье мы обсудим мир, который в миллионы раз меньше нас.
Основные положения МКТ
Ранее мы изучали физические явления, основываясь на поведении тел, с которыми мы можем взаимодействовать тактильно, мы их видим. Сейчас же мы перейдем к изучению микромира.
Микромир — мир молекул, атомов и мельчайших частиц, которые невозможно увидеть невооруженным глазом.
Изучением микромира занимается раздел молекулярной физики. В основе изучения физики мельчайших частиц лежит учение молекулярно-кинетической теории (МКТ). На чем основана МКТ?
Молекулярно-кинетическая теория объясняет физические процессы макромира, используя данные его молекулярного строения. Теория основана на 3 фундаментальных положениях:
- Все вещества состоят из мельчайших частиц (молекул и атомов), между которыми есть промежутки.
- Частицы вещества находятся в непрерывном хаотическом движении.
- Частицы вещества постоянно взаимодействуют друг с другом.
Молекула — наименьшая частица вещества, которая сохраняет все его основные химические свойства.
Молекулы, в свою очередь, состоят из атомов.
Атом — мельчайшая химически неделимая частица вещества.
Размеры молекул и атомов настолько малы, что их невозможно различить без использования микроскопов.
Модель идеального газа
Основная часть изучения теоретической физики ведется на основе рассмотрения моделей — идеализированных систем, которые удобны для проведения математических расчетов. Микромир изучается с помощью модели идеального газа.
Идеальный газ — модель реального газа, в котором пренебрегают потенциальным взаимодействием (притяжением и отталкиванием) частиц на расстоянии друг от друга.
Идеальный газ удовлетворяет основным положениям МКТ, при этом выделяют следующие его свойства:
- Молекулы газа равномерно распределены по всему объему.
- Молекулы газа очень малы и представляют собой упругие шарики, которые можно считать материальными точками.
- Молекулы идеального газа находятся в непрерывном хаотическом движении.
- Взаимодействия молекул газа происходят только при соударениях, а сами соударения считают абсолютно упругими.
Для определения количественного состава молекул газа вводят величину. Она называется количеством вещества, единицей которого является моль.
Моль — это количество вещества, которое содержит в себе столько частиц, сколько содержится атомов в 0,012 кг углерода-12.
| Почему моль необязательно гнать из дома? Моль в данном понятии это вовсе не насекомое, а величина, которая позволяет измерять количество газа в пространстве. В молекуле углерода-12 содержится всего один атом, поэтому в одном моле одного и того же вещества содержится одно и то же количество частиц.  Данное количество частиц называется постоянной Авогадро: NA = 6,022 * 10²³ моль⁻¹. Иначе говоря, эта величина показывает, сколько частиц может уместиться в любом газе. |
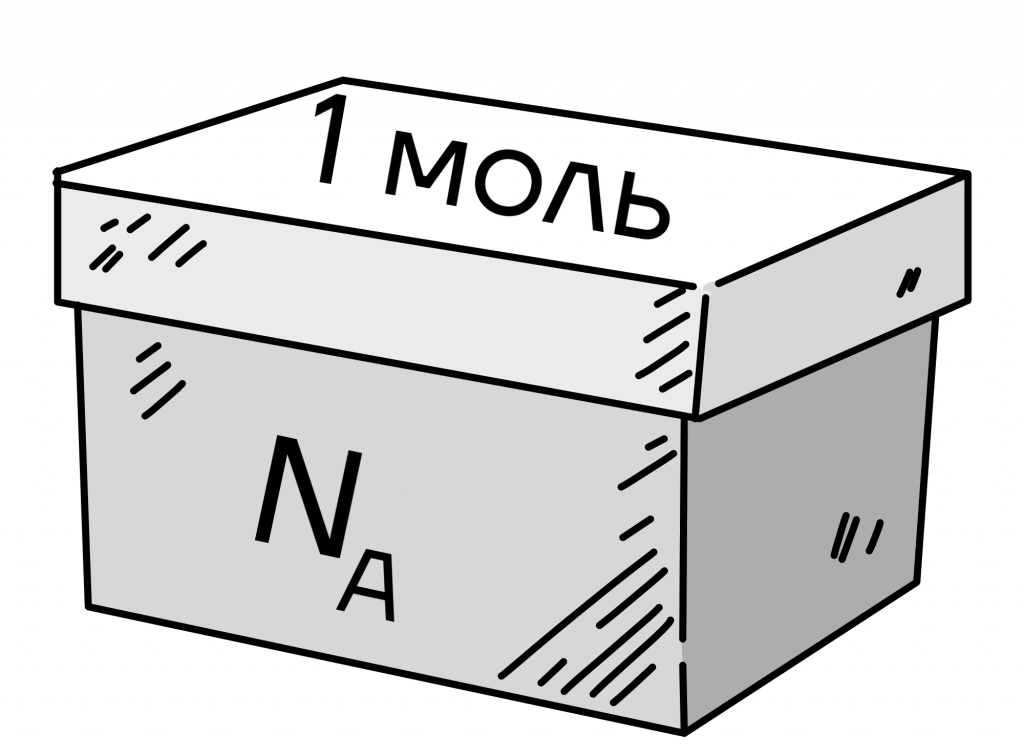
Данная величина является основополагающей для вычисления количества вещества (моль). Простыми словами, 1 моль вещества — это коробка, которая может уместить в себя такое количество частиц, которое равно числу Авогадро.
Как найти количество вещества? В газах содержится количество частиц, которое далеко не равно числу Авогадро (может быть как больше, так и меньше). Поэтому в общей сумме количество вещества вычисляется по формуле:
| \(\nu = \frac{N}{N_A}\), где \(\nu\) — количество вещества (моль); N — количество частиц, которое содержится в газе; NA — постоянная Авогадро (моль-1). |
Бывает, что не всегда возможно найти количество частиц, которое содержится в газе, поэтому вводят понятие молярной массы.
Молярная масса — масса одного моля вещества.
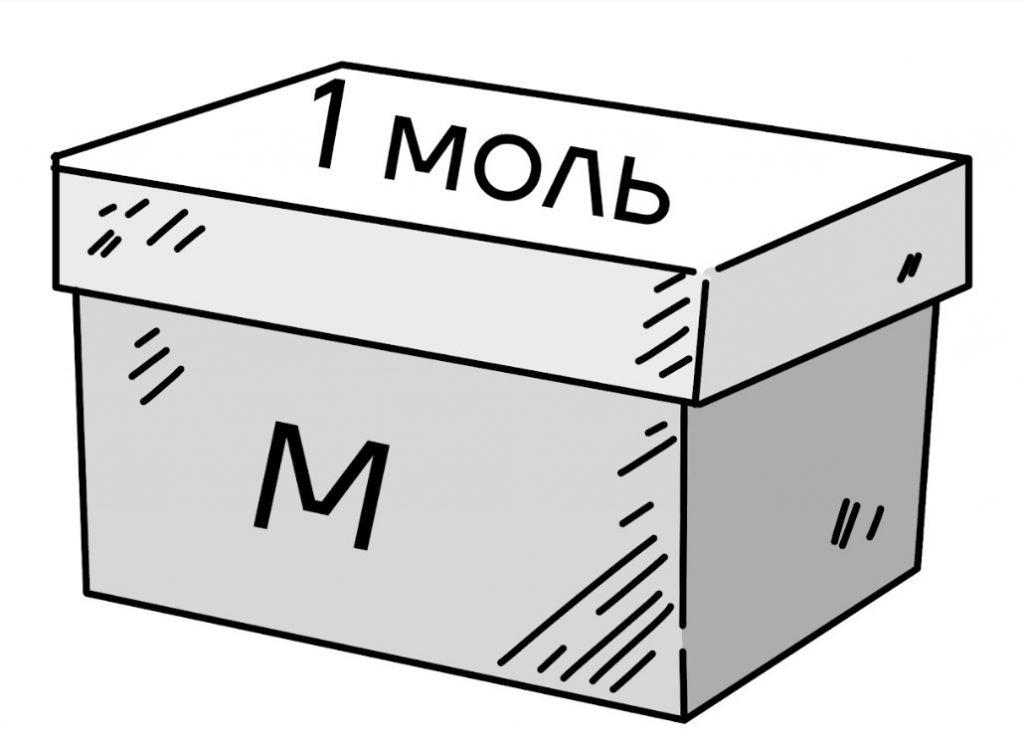
Вернемся к примеру с коробкой. Пусть теперь масса одной коробки с одним молем равная молярной массе. Таких коробок много, общая их масса равна массе вещества m. Количество таких коробок равно отношению массы всего вещества к массе одной коробки.
| \(\nu = \frac{m}{M}\), где \(\nu\) — количество вещества (моль); m — масса вещества (кг); M — молярная масса вещества (кг/моль). |
В механике для характеристики вещества мы использовали его плотность. Данное понятие применимо и для газов. В микромире важной составляющей веществ является количество частиц, из которого они состоят, поэтому вместе с плотностью вводят понятие концентрации.
Концентрация — количество частиц в единице объема вещества.
Концентрация помогает понять, насколько много частиц находится в объеме всего газа. Она находится по формуле:
| \(n = \frac{N}{V}\), где n — концентрация вещества (м-3); N — количество частиц; V — объем газа (м3). |
Температура
В процессе непрерывного взаимодействия частиц друг с другом в идеальной системе устанавливается состояние, при котором процессы происходят с определенной усредненной скоростью. Это значит, что газы в среднем обладают фиксированной кинетической энергией движения молекул.
Важной характеристикой этой энергии является температура системы.
Температура идеального газа — физическая величина, характеризующая среднюю кинетическую энергию хаотического движения его молекул.
В молекулярной физике температура измеряется по шкале Кельвина. Если по шкале Цельсия за нуль принята температура замерзания льда, то по шкале Кельвина нуль является абсолютным нулем.
Абсолютный нуль температур (0 К) — температура, при которой прекращается движения молекул.
| Когда весь мир остановится? Абсолютный нуль является теоретическим значением. На данный момент смогли лишь приблизиться к этому значению, но не достичь. При его достижении молекулы должны остановиться и занять стационарное положение. Иначе говоря, если когда-нибудь температура станет равной 0 К, то мир остановится полностью, так как остановятся даже молекулы. |

Шкала Цельсия связана со шкалой Кельвина по формуле:
| T = t + 273, где T — температура по шкале Кельвина (К); t — температура по шкале Цельсия (oС). |
Энергия молекул газа связана с его температурой по формуле:
| \(\frac{m_0v^2}{2} = \frac{3}{2}kT\), где m0 — масса одной молекулы газа (кг); v — средняя скорость движения молекулы (м/с); k — постоянная Больцмана (Дж/К); T — температура по шкале Кельвина (К). |
Из формулы энергии связи можно найти теоретическую среднюю скорость движения молекул: \(\bar{v} = \sqrt{\frac{3kT}{m_0}}\). Данную формулу можно запомнить, используя чтение по буквам: «Три ка тэ на эм».
Другими словами: «Три кота на мясо». В процессе запоминания ни один кот не пострадал.

Массу одной молекулы можно найти из формул количества вещества, где общая масса газа m = m0N. Тогда \(\nu = \frac{m}{M} = \frac{N}{N_A}\) \(\Leftrightarrow\) \(\frac{m_0N}{M} = \frac{N}{N_A}\) \(\Leftrightarrow\) \(\frac{m_0}{M} = \frac{1}{N_A}\). Отсюда \(m_0 = \frac{M}{N_A}\). Подставим в формулу скорости: \(\bar{v} = \sqrt{\frac{3kTN_A}{M}}\). В процессе изучения модели идеального газа в формулах часто встречался множитель kNA, поэтому эту величину заменили новым коэффициентом:
R = kNA = 8,31 Дж / (моль * К) — универсальная газовая постоянная.
Существует 2 формулы для вычисления средней скорости движения молекул, которые используются в зависимости от известных величин:
- \(\bar{v} = \sqrt{\frac{3kTN_A}{M}}\), когда известна масса одной молекулы;
- \(\bar{v} = \sqrt{\frac{3kTN_A}{M}}\), когда известна молярная масса вещества.
Основное уравнение молекулярно-кинетической теории
Как мы выяснили, молекулы идеального газа непрерывно двигаются и взаимодействуют друг с другом. Из механики мы помним, что каждое взаимодействие определяется силой.
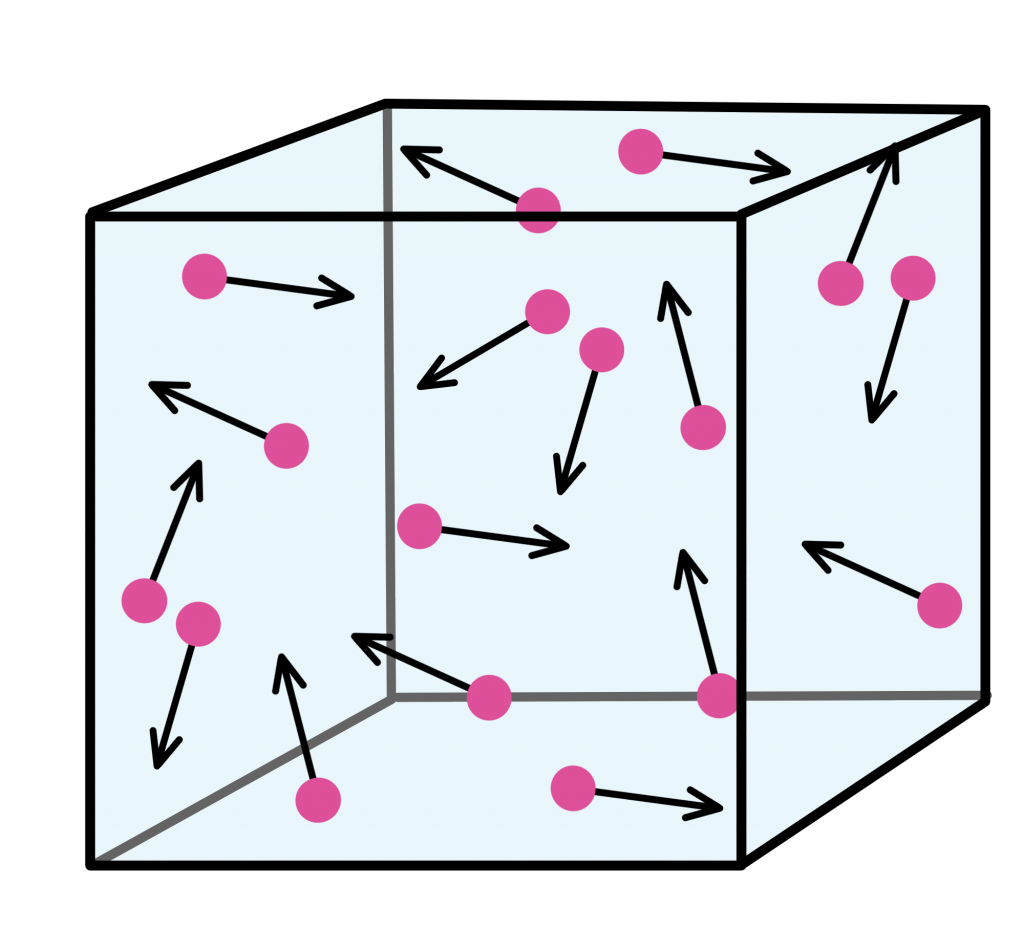
Представим, что большое количество частиц заперто в коробке. Тогда в каждый момент времени поток частиц, который равномерно распределен по объему, будет действовать на стенки коробки со средней силой. В данном случае поток частиц будет распределен по площади стены. Тогда на каждую стену будет оказываться давление потока частиц.
Давление частиц зависит следующих величин:
- Импульс частиц, который характеризует модуль силы действия на объекты.
- Количество частиц в пространстве, что показывает, сколько таких частиц будет взаимодействовать.
Основное уравнение МКТ выражает эту зависимость:
| \(p = \frac{1}{3}nm_0v^2\), где p — давление (Па); n — концентрация газа (м-3); m0 — масса одной молекулы газа (кг); \(\bar{v}\) — средняя скорость движения молекулы (м/с). |
Молекулы находятся в непрерывном движении. Тогда по формуле в каждый момент времени они давят на окружающие тела. Следовательно, на протяжении всей жизни мы находимся под постоянным давлением окружающей нас среды, которое мы не чувствуем, так как оно скомпенсировано другими факторами окружающей среды.
Мы понимаем, что в жизни практически невозможно встретиться с газом, у которого одинаковые частицы. В большинстве своем системы представлены смесями из нескольких газов.
Как найти давление смеси газов? В процессе поиска ответа на этот вопрос английский физик Дальтон вывел фундаментальный теоретический закон.
Закон Дальтона: давление смеси газов равно сумме парциальных давлений (их давления, если бы из смеси убрали остальные газы) всех газов смеси.
| p = p1 + p2 + … + pn, где pn — парциальное давление n-го газа в смеси (Па). |
Фактчек
- Молекулярная физика — раздел физики, в котором изучается микромир.
- Молекулы газа непрерывно двигаются в пространстве и взаимодействуют друг с другом.
- Модель идеального газа не учитывает потенциальное взаимодействие молекул.
- Моль — это такое количество вещества, которое содержит в себе столько частиц, сколько содержится атомов в 0,012 кг углерода-12.
- Температура идеального газа — физическая величина, характеризующая среднюю кинетическую энергию хаотического движения его молекул.
- Молекулы газа в любой момент времени давят на окружающие тела.
Проверь себя
Задание 1.
Что такое микромир?
- поле зрения микроскопа
- мир больших тел
- мир мельчайших частиц
- маленький мир
Задание 2.
Какая теория лежит в основе изучения молекулярной физики?
- кинетическая
- молекулярная
- тепловая
- молекулярно-кинетическая
Задание 3.
Чем пренебрегают при использовании модели идеального газа?
- столкновениями частиц
- движением частиц
- потенциальным взаимодействием частиц на расстоянии
- расстоянием между частицами
Задание 4.
Кто такая моль?
- насекомое
- ноль, только моль
- единица измерения массы газа
- количество вещества, которое содержит в себе столько частиц, сколько содержится атомов в 0,012 кг углерода-12
Задание 5.
Что такое парциальное давление?
- давление смеси газов
- внутреннее давление системы
- давление одного газа, если бы в смеси не было других
- давление 1 моля вещества
Ответы: 1. — 3; 2. — 4; 3. — 3; 4. — 4; 5. — 3.


 к списку статей
к списку статей





