Основы ядерной физики: строение ядра, ядерные силы
На этой странице вы узнаете
- Бывают ли у химических элементов братья?
- Почему врет таблица Менделеева?
- Как несколько граммов вещества могут уничтожить целый город?
Вы, возможно, могли заметить, что существует некоторая несостыковка в таблице Менделеева. Почему масса химического элемента меньше, чем должна быть? Как известная для вас формула Эйнштейна E = mc2 превратилась в оружие? Эти явления объясняются понятием дефекта масс. Сейчас мы более подробно во всем разберемся.
Строение ядра
Из статьи о «Планетарная модель атома и постулаты Бора» мы узнали, что атом состоит из ядра и электронов, которые вращаются по орбите. Однако мы лишь вскользь упомянули строение атомного ядра.
Атомное ядро — скопление протонов и нейтронов в центре атома. Именно в атомном ядре сконцентрирована основная масса атома.
Да, в ядре сконцентрированы все протоны и нейтроны. А если там сконцентрированы все протоны, следовательно, там будет сконцентрирован основной положительный заряд.

Поскольку атом электрически нейтрален, то суммарный положительный заряд протонов равен суммарному отрицательному заряду электронов.
Массовое число атома представляет собой суммарное число протонов и нейтронов, входящих в состав ядра.
| A = Z + N, где Z — количество протонов в ядре; N — количество нейтронов в ядре; A — количество нуклонов в ядре. |
Со строением ядра можно столкнуться в задании № 10 ОГЭ по физике.
Задание. В ядре нейтрального атома элемента, массовое число которого А = 65, содержится 32 нейтрона. Сколько электронов находится в электронной оболочке этого атома?
Решение.
Массовое число элемента представляет собой сумму числа протонов и нейтронов в ядре, значит, в ядре содержится 65 − 32 = 33 протона.
Электрически нейтральный атом представляет собой систему с равным числом электронов и протонов. Следовательно, в данном ядре содержится 33 электрона.
Ответ: 33
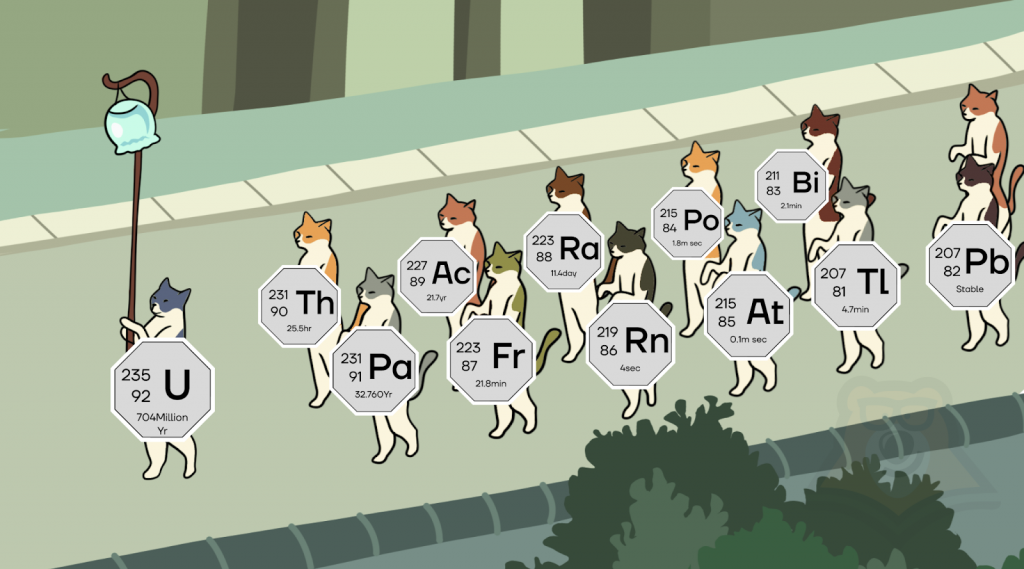
Однако некоторые атомные ядра одного и того же химического элемента могут иметь разную массу. С чем это связано? Такие химические элементы получили название изотопы.
Изотопы
Что это такое?
Изотопы — атомы, являющиеся одним и тем же химическим элементом, но отличающиеся массой. Следовательно, отличается только количество нейтронов в ядре. Заряд ядра всех изотопов одинаков.
Вот примеры изотопов кислорода:

Расшифровка: Фраза изотоп кислорода-17 означает, что дан атом кислорода, атомная масса которого равна 17, вместо 16.
Понятие изотопа может встретиться в задании № 10 ОГЭ по физике.
Задание. Сколько нейтронов содержит ядро изотопа углерода \(С_6^{14}\)?
Решение.
Зарядовое число равно числу протонов \(Z = 6\), массовое число равно числу нуклонов \(А = 14\). Число нейтронов равно \(N = 14 — 6 = 8\).
Ответ: 8
| Бывают ли у химических элементов братья? Изотопы — химические элементы, которые отличаются от своего «брата» лишь массовым числом. Некоторые иногда путаются, чем отличаются изотопы. Вот еще один способ понять их отличие: все элементы природы изначально электронейтральны (у всех одинаковый заряд). А изотоп отличается в одной характеристике. Он отличается массой. Будто бы это два брата-близнеца, просто один всегда больше кушал и занимался спортом. |

Также стоит отметить, что изотопы могут обладать как большей, так и меньшей массой, в отличие от исходного элемента. Все зависит от реакции, в которой образуется тот или иной изотоп. Так, у урана на данный момент известно более 20 изотопов. Вот некоторые из них:

Изотопы урана могут отличаться и иными свойствами. Например, уран-235, в отличие от иных его изотопов, способен принимать участие в цепной ядерной реакции с выделением значительной энергии.
Дефект массы и энергия связи
Как вы думаете, что будет, если сложить массы всех протонов и нейтронов, входящих в состав атома, и сравнить полученный результат с массой элемента? Они совпадут? На самом деле окажется, что масса нуклонов больше, чем масса самого ядра. Почему так? Электроны? Нет, их масса слишком незначительна по сравнению с массами протонов и нейтронов. Но что тогда?
Этому есть объяснение. Часть массы нуклонов уходит на создание энергии связи нуклонов между собой. Это энергия внутриядерных сил! Именно она и не входит в рамки классической физики, которая просто не может объяснить данное явление.
Как раз та самая часть массы нуклонов, которая уходит на создание внутриядерных сил, называется дефектом массы.
Дефект массы — часть массы нуклонов, которая уходит на создание внутриядерных сил.
Рассчитывается по следующей формуле:
| △m = Z * mp + (A – Z)* mn – mядра , где △m — дефект масс (кг); Z — количество протонов в ядре; mp — масса протона (кг); A — количество нуклонов в ядре; mn — масса нейтрона (кг); mядра — масса ядра (кг). |
При подсчете в атомных единицах массы (а.е.м.) очень важно прописывать все цифры после запятой, так как именно в тысячных долях и будет отличие.
| Почему врет таблица Менделеева? Если вы сложите массу протонов и нейтронов в ядре и сравните с самой массой ядра, то вы получите, что суммарная масса протонов и нейтронов больше массы ядра. Это объясняется дефектом масс. |

Рассмотрим на примере, как находить дефект массы.
Пример.
Найдите дефект массы изотопа лития-7, если известно, что масса ядра Li равна 7,01601 а.е.м.

Решение.
1) Для начала запишем массу протона и нейтрона в а.е.м. (они постоянны для всех веществ):
- mp = 1,007 а.е.м.
- mn = 1,008 а.е.м.
2) Теперь найдем количество протонов Z и нейтронов N = (A — Z):
- Заряд лития равен 3. Значит, Z = 3.
- Массовое число лития равно 7. Тогда количество нейтронов найдем по формуле: N = (A – Z) = 7 – 3 = 4.
3) Найдем дефект масс:
△m = Z * mp + N * mn – mядра
△m = 3*1,007 + 4*1,008 – 7,01601 = 0,03699 а.е.м.
Ответ: Дефект массы изотопа лития-7 равен 0,03699 а.е.м.
Энергия связи
Как мы уже сказали, дефект массы уходит на внутриядерные силы. Эти силы порождают энергию, которая удерживает ядро в целости. Эта энергия называется энергией связи.
Энергия связи — энергия, которая удерживает протоны и нейтроны в ядре и не дает ему распасться.
Она рассчитывается по следующей формуле:
| \(E_{св} =△m*c^2\), где \(E_{св}\) — энергия связи (Дж); \(△m\) — дефект масс (кг); \(с\) — скорость света (м/с). |
Это та самая формула Эйнштейна! Эта формула больше относится к специальной теории относительности, однако и в квантовой физике эта формула нашла свое применение.
Если затратить энергию, равную энергии связи, то можно будет расщепить атом на нуклоны. На этом явлении основано такое изобретение, как ядерная бомба. При расщеплении ядра будет высвобождена огромная энергия, которая удерживала протоны и нейтроны. Соответственно, чем больше масса ядра, тем сильнее будет взрыв. Именно поэтому в ядерных бомбах используют тяжелые элементы (элементы с большим зарядовым числом).
| Как несколько граммов элемента могут уничтожить целый город? Так, дефект масс в ядерной бомбе, сброшенной на Хиросиму во времена Второй Мировой войны, равнялся всего лишь 600 миллиграммам изотопа урана-235. Энергия связи была эквивалентна взрыву 13—18 тысяч тонн тротила. Люди, находящиеся вблизи эпицентра, мгновенно сгорели, как и птицы, которые в это время были в воздухе. Световое излучение было настолько сильным, что оно вжигало темную ткань в кожу, а на стенах оставляла человеческие силуэты. |

Деление атомного ядра на части, происходящее самопроизвольно, применяется в атомных реакторах. Но возможно ли раздробить нуклон? Что может получиться при его делении?
Элементарные частицы и их свойства
Наличие в атомном ядре частиц, его составляющих, может навести на мысль: что мы найдем, раздробив протон или нейтрон? Возможно ли это?
Экспериментальные исследования привели к открытию частиц, которые появляются при взаимодействии протонов, нейтронов и фотонов с веществом.
К элементарным частицам будем относить первичные, далее неразложимые частицы, из которых состоит материя.
Способность частиц появляться при взаимодействии с другими частицами является их неотъемлемым свойством. Строго говоря, заглянув «внутрь» нейтрона, который способен к распаду с появлением протона, электрона и антинейтрино (β-распад), мы не найдем там соответствующих частиц. Эти частицы возникают вследствие самопроизвольного распада нейтрона.
Более того, внутри атомного ядра происходит беспрерывное превращение протона в нейтрон и наоборот. Обменные взаимодействия в этом случае напоминают кипящий котел.
На данный момент известно более 350 элементарных частиц, свойства которых описаны. Столь широкий диапазон уже нуждается в классификации.
В основу разделения частиц на основные классы положена масса.
- В первую группу попадает фотон, масса покоя которого равна нулю. В покое эта частица просто не существует.
- Легкие частицы – лептоны – имеют минимальную массу и не принимают участия в сильных взаимодействиях в атомном ядре. Таких частиц всего 12: электроны, мюоны, таоны и соответствующие им антинейтрино и нейтрино.
- Частицы, осуществляющие сильные взаимодействия в ядре, отнесены к классу адронов.
Заметим, что многие частицы имеют античастицу, отличающуюся наличием противоположного заряда. Взаимодействие частицы и античастицы приводит к их аннигиляции. Фотон не имеет античастиц.
Особенности появления и взаимодействия элементарных частиц позволяют задавать им свойства: странность, очарование, красота. Например, странность частиц связана с особенностью их появления в результате реакций. Частицы появляются парами, но не являются частицей и античастицей. Очарование частиц связано с предполагаемым наличием в их структуре «очарованного» кварка. Красота частицы характеризует особенности сильного и слабого взаимодействий частиц и последствий этого взаимодействия.
Дискретными свойствами частиц являются: масса, спин, время жизни и электрический заряд.
Погружаясь в строение вещества, мы находим новые частицы. Насколько глубоко можно «копать»? Пока физики не достигли предела. Нас еще ждут новые открытия.

В статье «Радиоактивность, виды распадов» мы более подробно разберем явление радиации и почему до сих пор нельзя жить в Чернобыле.
Термины
Аннигиляция — реакция превращения частицы и античастицы при их столкновении в какие-либо иные частицы, отличные от исходных.
Атомный реактор — устройство, в котором происходит распад атомного ядра с выделением значительной энергии.
Цепная ядерная реакция — реакция распада ядер атомов вследствие захвата нейтронов, происходящая с выделением энергии.
Фактчек
- Изотопы — атомы, являющиеся одним и тем же химическим элементом, но отличающиеся массой. Следовательно, отличается лишь только количество нейтронов в ядре. Заряд ядра изотопов всегда одинаков.
- Дефект масс — часть массы нуклонов, которая уходит на создание внутриядерных сил.
- Энергия связи — энергия, которая удерживает ядро в целости. Рассчитывается по следующей формуле: \(Eсв =△m*c^2\).
- Элементарные частицы — неразложимые частицы, составляющие материю.
Проверь себя
Задание 1.
В чем отличие изотопа от оригинального элемента?
- в количестве протонов;
- в количестве электронов;
- в количестве нейтронов;
- нет отличий.
Задание 2.
У одного химического элемента не может быть больше 5 изотопов.
- Утверждение верно.
- Утверждение не верно.
Задание 3.
Определите количество нейтронов у изотопа кислорода-17.
- 8
- 9
- 16
- 17
Задание 4.
Найти дефект массы изотопа кислорода-16, если известно, что масса ядра кислорода составляет 16,01203 а.е.м.
- 0,10797
- 0,09865
- 0,112
- 0,11
Ответы: 1. — 3; 2. — 2; 3. — 2; 4. — 1.


 к списку статей
к списку статей





